Днк вакцины реферат иммунология
Обновлено: 30.06.2024
Мы все ждём развязки триллера по поиску вакцины от COVID-19. В её разработке участвуют тысячи специалистов из научных центров десятков стран. Но объединяет их одно – история борьбы с опасными болезнями с помощью прививок
Эффективно, но очень опасно.
Первые попытки защитить человека от опасных инфекций предпринимались ещё в средневековых Индии и Китае. Именно в этих странах заметили, что если намеренно заразить здорового человека небольшой дозой инфекции, в дальнейшем заболевание станет для него неопасным. Правда, сразу после искусственного заражения придётся переболеть в лёгкой, а иногда и тяжёлой форме. В середине 18 века метод, получивший название вариоляция, взяли на вооружение английские доктора для защиты от оспы. Узнав об этом, российская императрица Екатерина II пригласила к себе одного из преуспевших в вариоляции докторов – Томаса Димсдейла.
Первые вакцины относились к живым неослабленным. Они наиболее эффективные, но слишком опасные с точки зрения развития заболевания и осложнений, поэтому давно не используются.
Крайне неприличная смерть
Новый путь – опасность меньше
В 1801 году известный русский врач Яков Мудров по указу Александра I провёл публичную вакцинацию волонтёра Андрея Петрова, использовав на это раз опыт Дженнера и коровью оспу. Результат оказался положительным и император издал указ о проведении в России массовой вакцинации. Первыми были практически полностью вакцинированы военные. Считается, что именно это позволило защитить от вспышек оспы армию во время Отечественной войны 1812 года и полностью победить натуральную оспу в России.
Бешеный успех
Начав свой путь с бешенства, живые ослабленные вакцины получили широкое распространение в 50-х годах 20-го века. К ним относятся вакцины от кори, эпидемического паротита, краснухи, ветряной оспы.
В основе синтеза этой группы иммунобиологических препаратов лежит метод аттенуирования (сильного ослабления) вируса, которое достигается путём многочисленного повторного заражения вирусом лабораторных животных. С каждым новым циклом вирус всё больше приспосабливается к организму млекопитающего, и становится для человека практически безопасным. В то же время, сохраняет свою антигенную структуру и способность вызвать иммунитет.
Неактивный, но полезный
Вакцины, которые содержат незаразные вирусы называются инактивированными. При подготовке такой вакцины вирусную взвесь инактивируют с помощью высокой температуры, химикатов или ионизирующего излучения. В результате вирусные белки частично расплавляются (денатурируются), но сохраняют свои антигенные свойства и могут вызывать иммунный ответ. Однако он может оказаться не таким сильным, поэтому в инактивированных вакцинах используются своего рода усилители – адъюванты. Их задача помочь лимфоцитам выработать как можно больше противовирусных антител. Самый известный адъювант – соли алюминия. В последние десятилетия стали использоваться фосфолипидные наночастицы, полностью повторяющие строение вируса.
Наиболее известные вакцины из этой группы - от полиомиелита и коклюша. Они безопаснее ослабленных, но требуют длительной разработки качественного адъюванта, поэтому их внедрение нередко растягивается на годы. Через некоторое время, как правило, требуется ревакцинация.
Не повторить ошибок
В начале пятидесятых годов 20-го веках Джонас Солк создал инактивированную вакцину против полиомиелита. Для американцев это было событие равное окончанию войны. Однако эйфория продлилась недолго. Одна из компаний-производителей не смогла полностью дезактивировать вирус и изготовила некачественную вакцину. В результате 120 000 детей по трагической случайности были привиты вакциной, которая содержала потенциально смертельный полиовирус; 70 000 переболели полиомиелитом в легкой форме, 200 оказались необратимо и тяжело парализованы, десять умерли. Это была одна из самых страшных биологических катастроф в истории Америки, которая привела к беспрецедентному усилению контроля за производством вакцинных препаратов во всем мире.
Правильный вектор
Векторные или рекомбинантные вакцины как бы сочетают в себе положительные качества живых и инактивированных вакцин.
Развитие генной инженерии и полная расшифровка генома большинства живых существ позволила получить принципиально новое поколение – нуклеиновые вакцины (ДНК-вакцины и РНК-вакцины) Их основа – ДНК или РНК, первая нуклеиновая кислота является основой генома человека, вторая – многих вирусов. Суть ДНК-вакцины – встроить в наш геном новую информацию, после чего организм сам начнёт синтезировать вирусные белки. Вред они не нанесут, зато помогут сформировать устойчивый иммунитет. В случае использования вирусной РНК механизм немного другой – полноценного встраивания в геном не происходит, но РНК, взаимодействуя с клеткой, вызывает синтез части вирусных белков также, как это делает вирус. Результат от потенциального использования обеих нуклеиновых вакцин один: в ответ на синтез белков начинается выработка антител. Потенциально, потому что на данный момент ни одна из этих вакцин не одобрена к применению на людях. Единственная разрешённая ДНК-вакцина используется в ветеринарии для вакцинации лошадей от вируса Зика.
Ещё один продукт современной вакцинологии – так называемые белковые вакцины. В её основе – фрагменты вирусных белков, это те самые антигены, на которые реагирует наш иммунитет. У белковой вакцины много плюсов, например она не может вызвать заболевание и считается одной из самых безопасных, а, значит, процесс доклинических и клинических испытаний может быть максимально коротким. Но есть минусы, полностью перекрывающие даже такие значимые достоинства. Разработчикам трудно получить достаточное количество вирусных белков для необходимого количества вакцины. Кроме того, иммунитет после вакцинации временный и нестойкий, через некоторое время потребуется ревакцинация.
Вакцина от пневмонии.
Когда ждать вакцину от COVID-19?
Два китайских разработчика делают успехи в создании инактивированной вакцины: на начало мая они провели первую фазу клинических испытаний и даже получили положительный результат в виде стойкого повышение антител к 10 вариантам штамма SARS-CoV-2 у грызунов.
Наибольшего прорыва удалось добиться в создании векторных вакцин, китайский и английский разработчики в мае приступили к испытанию на добровольцах. Как и в нашей стране – тестирование на добровольцах векторной вакцины, совместно разработанной специалистами НИИ эпидемиологии и микробиологии им. Н. Гамалеи и Вирусологического центра Минобороны, стартовало в начале июня.
Цель – коллективный иммунитет
Именно создание устойчивого популяционного иммунитета является одной из основных задач массовой вакцинации от любого заболевания, в том числе и от COVID-19. Kогда количество имеющих иммунитет становится подавляющим, прерываются пути распространения инфекции, снижается её заразность. Ждать, пока коллективный иммунитет от новой инфекции сформируется самостоятельно можно далеко не всегда: так, при коронавирусе нового типа это может привести к неоправданно большим жертвам. Кроме того, не ясно, насколько устойчивым окажется натуральный иммунитет. Поэтому врачи всего мира возлагают на скорейшее появление вакцины большие надежды.
Американский разработчик создаёт нуклеиновую ДНК-вакцину от COVID-19. Первые результаты клинических испытаний должны появиться в конце июня.
Участвующих в испытании вакцины волонтёров на несколько месяцев полностью изолируют от общества, чтобы не было риска заразиться и заразить.

Обзор
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).

ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].

Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
Но. всё хорошее имеет свои недостатки
- более низкая по сравнению с живыми вакцинами эффективность, особенно по отношению к крупным млекопитающим и человеку, и потому необходимость многократной иммунизации;
- отсутствие эффективной доставки в антигенпрезентирующие клетки;
- формирование иммунитета только в отношении протеиновых компонентов болезнетворных микроорганизмов, поскольку целевые гены кодируют белки. ДНК-вакцины не могут заменить препараты, действие которых основано на использовании антигенных молекул другой природы, например капсульных антигенов, представленных полисахаридами (полисахаридные пневмококковые, менингококковые, брюшнотифозные вакцины и др.);
- вероятность атипического процессинга и биохимических изменений (например, гликозилирования) антигенов в эукариотических клетках;
- возможность ослабления иммунного ответа на целевой антиген из-за иммуногенности вирусных компонентов (при использовании вирусных систем доставки);
- отсутствие данных о безопасности таких вакцин, т.к. не изучены последствия, к которым приводит длительная экспрессия в макроорганизме чужеродной генетической информации;
- возможность развития нежелательных иммунологических реакций в виде хронических воспалительных процессов или генерализованной иммуносупрессии из-за пролонгированной экспрессии антигена в макроорганизме.
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора

Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
- Структуры, обеспечивающие репликацию плазмиды (используются ori pUC19, pMB1), и сайты рестрикции.
- Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам) [5].
- СpG-мотивы бактерий, которые из-за отсутствия метилирования способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины [7]. — консенсусная последовательность, окружающая старт-кодон (GCC(A/G)CCAUGG), которая играет важную роль в инициации трансляции у эукариот.
- Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса (часто вместе с интроном А), промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 — в кератиноцитах, альбуминовый — в гепатоцитах). Применение промотора и системы синтеза бактериофага Т7 позволяет осуществлять экспрессию целевого гена без участия транскрипционной системы клеток макроорганизма и, соответственно, без перемещения вектора в ядро [8].
- Целевой ген, кодирующий белок патогена. Он также может содержать дополнительные нуклеотидные последовательности, кодирующие лиганды для рецепторов антигенпредставляющих клеток. Такими последовательностями могут выступать гены маркерного белка CD40, внеклеточного домена Fms-подобной тирозинкиназы-3 или антигена-4 Т-киллеров. Облегчение деградации антигена в протеасоме или лизосоме также будет стимулировать иммунную реакцию. Поэтому для усиления протеолитического расщепления антигена в его последовательность встраивают сигнал убиквитинирования [9, 10].
- После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β-глобина кролика или гормона роста быка.
- Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.

Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Генно-инженерные ( рекомбинантные ) вакцины. Векторные вакцины. Синтетические вакцины.
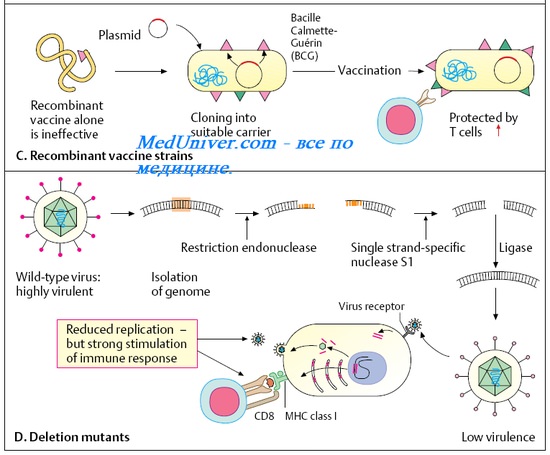
Генно-инженерные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета (более подробно см. главу 7). Возможны несколько вариантов создания генно-инженерных вакцин.
• Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы.
• Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением Аг и его использованием в качестве иммуногена.
• Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин.
Ряд современных противовирусных вакцин сконструирован путём введения генов, кодируюших основные Аг патогенных вирусов и бактерий в геном вируса осповакцины (HBsAg вируса гепатита В) и непатогенных для человека сальмонелл (HBsAg вируса гепатита В и Аг токсина столбнячной палочки). Другим примером служит введение генов возбудителя туберкулёза в вакцинный штамм БЦЖ, что придаёт ему большую активность в качестве дивергентной вакцины. Такие препараты известны как векторные вакцины.
Для активной иммунопрофилактики гепатита В также предложена вакцина, представляющая собой HBsAg вируса. Его получают из дрожжевых клеток, в которые введён вирусный ген (в форме плазмиды), кодирующий синтез HBsAg. Препарат очищают от дрожжевых белков и используют для иммунизации. В качестве метода более быстрой и дешёвой наработки бактериальных экзотоксинов в настоящее время разработаны методы их получения при помощи неприхотливых микроорганизмов, в геном которых искусственно внесены гены токсинообразования (например, в виде плазмид).
Селективное удаление генов вирулентности открывает широкие перспективы для получения стойко аттенуированных штаммов шигелл, токсигенных кишечных палочек, возбудителей брюшного тифа, холеры и других диареегенных бактерий. Возникает возможность создания поливалентных вакцин для профилактики кишечных инфекций, вводимых внутрь. Другим важным . направлением выступает возможность получения аттенуированных штаммов возбудителя туберкулёза человека и их использования в качестве вакцин.
Синтетические вакцины
Принцип конструирования вакцин включает синтез или выделение нуклеиновых кислот или полипептидных последовательностей, образующих Aг-детерминанты, распознаваемых нейтрализующими AT. Непременные компоненты таких вакцин — сам Аг, высокомолекулярный носитель (винилпирролидон или декстран) и адъювант (повышающий иммуногенность вакцин). Подобные препараты наиболее безопасны в плане возможных поствакцинальных осложнений, но их разработке мешают две проблемы. Во-первых, не всегда имеется информация об идентичности синтетических эпитопов естественным Аг. Во-вторых, низкомолекулярные синтетические пептиды обладают низкой иммуногенностью, что приводит к необходимости подбора соответствующих адъювантов.
С другой стороны, введение синтетических вакцин в комбинации с адъювантами и иммуномодуляторами перспективно у лиц с нарушениями иммунного статуса. Особые перспективы имеет использование нуклеиновых кислот для иммунопрофилактики инфекций, вызываемых внутриклеточными паразитами. В эксперименте показано, что иммунизация организма РНК и ДНК многих вирусов, малярийного плазмодия или возбудителя туберкулёза приводит к развитию стойкой невосприимчивости к заражению.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

ДНК-вакцина (генная вакцина, вакцина на основе нуклеиновых кислот) - это генно-инженерная конструкция, которая после введения в клетку обеспечивает выработку белков патогенов или опухолевых антигенов и вызывает иммунную реакцию. Введение ДНК-вакцин в организм называют генетической иммунизацией. ДНК-вакцинация имеет ряд преимуществ по сравнению с обычными вакцинами. В частности показано, что такие вакцины обеспечивают не только выработку антител (гуморальный иммунитет), но и специфический цитотоксический ответ (клеточный иммунитет), что ранее было достижимым только с помощью живых вакцин. Сегодня ДНК-вакцины не применяют для лечения человека, однако прогнозируется, что генетическая иммунизация поможет преодолеть целый ряд заболеваний [1].
Используемые сегодня вакцины можно разделить в зависимости от методов их получения на следующие типы:
• живые аттенуированные вакцины;
• вакцины, содержащие очищенные компоненты микроорганизмов (протеины или полисахариды);
• рекомбинантные вакцины, содержащие компоненты микроорганизмов, полученные методом генной инженерии.
Технологию рекомбинантной ДНК применяют также для создания живых ослабленных вакцин нового типа, достигая аттенуации путем направленных мутаций генов, кодирующих вирулентные протеины возбудителя заболевания. Эту же технологию используют и для получения живых рекомбинантных вакцин, встраивая гены, кодирующие иммуногенные протеины, в живые непатогенные вирусы или бактерии (векторы), которые и вводят человеку [2].
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E.coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин - pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток.
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции - до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации - Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [3].
Библиографический список
Попов, Ю.А. Генетические (ДНК) вакцины. Проблемы особо опасных инфекций. [Текст] : / Ю.А. Попов, Н. И. Микшис – М. : 2010. - 105с.
Читайте также:

