Днк технологии в медицинской генетике реферат
Обновлено: 08.07.2024
Современная медицина находится на стадии преобразования, обусловленного слиянием двух основных направлений технологического прогресса. Речь идёт о значительных достижениях в области информационных технологий, с одной стороны, и в быстро развивающейся генетике — с другой. Возможным итогом этого слияния может стать появление в недалёком будущем нового вида медицины — индивидуализированной медицины, целью которой будет персональный подход к каждому пациенту.
В настоящее время для оценки той или иной патологии, а также для выбора наиболее подходящей методики лечения врачи изучают семейный анамнез больного и проводят генетические исследования. Определение причины заболевания на молекулярном уровне позволяет сделать правильное заключение при неоднозначной симптоматике. Кроме того, некоторые патологии, например артериальная гипертензия (повышенное артериальное давление), имеют различный патогенез, а следовательно, необходимы и разные подходы к лечению.
Благодаря точному определению причины заболевания врачи назначают больному индивидуальную терапию наиболее подходящими препаратами, это помогает избежать возникновения нежелательных или побочных эффектов. Данное направление медицины до недавнего времени развивалось не так быстро, как ожидали, однако сейчас в некоторых областях отмечен значительный прогресс.
Фармакогенетика изучает характерную реакцию организма на введение тех или иных биохимических веществ. Различия в геноме каждого человека могут приводить к гиперчувствительности или, наоборот, недостаточной эффективности стандартной дозы препарата. В этом случае генетические исследования помогают врачу выбрать правильную дозировку, а благодаря открытиям в области генетики в других отраслях, стало возможным появление новых видов лекарственных средств.
Так, в фармакогеномике для производства препаратов используют генную инженерию. Например, человеческие гены, кодирующие инсулин или интерферон, встраивают в геном микроорганизмов, полевых культур или сельскохозяйственных животных, в результате чего они начинают производить белки человека.
В организациях, занимающихся исследованием заболеваний человека, моделируют нарушения у животных путём делеции определённых генов. При помощи данной методики можно создать модели множества заболеваний, таких, как, например, муковисцидоз или нейрофиброматоз (НФ, болезнь Реклингхаузена).

Несмотря на то что генетика в основном занимается проблемами передачи из поколения в поколение генов, отвечающих за наследственные заболевания, она также охватывает и многие другие вопросы. Именно поэтому в в статьях на сайте будут представлены основы клеточной и молекулярной биологии и биологии развития, изучение которых необходимо для понимания последующего материала.
Клетка. Каждая клетка человека содержит полный набор пар генов его организма, экспрессия которых контролируется на молекулярном уровне на каждой стадии её развития. В зависимости от локализации в организме клетки во время эмбриональной стадии развития под действием определённых факторов приобретают различные свойства путём экспрессии различных комбинаций из 20 000—25 000 пар генов. Тем не менее большинство клеток имеют сходное строение и состав.
Генетический материал. Катализаторы большинства биохимических реакций в организме человека — ферменты, последовательность аминокислот которых зависит от генов. Ген — материальный носитель, кодирующий наследственную информацию и входящий в состав длинной молекулы, называемой ДНК (дезоксирибоклеиновая кислота). Молекула ДНК имеет форму суперрученной спирали, которая может быть в растущих тканях сплетена (отрицательное суперскручивание) или свёрнута (положительное суперскручивание).
ДНК упакована в 23 пары гомологичных хромосом. При этом у нормальной женщины две из них — это большие X-хромосомы. Нормальный мужчина имеет также 46 хромосом, но вместо X у него присутствует более мелкая Y-xpoмосома. Она несёт в себе небольшое количество наследственной информации, в том числе гены, обусловливающие развитие мужского пола.
Генотип и фенотип. Генотип — этот термин генетики используют для обозначения всей генетической информации, передаваемой человеку по наследству. Фенотип — совокупность всех анатомических, физиологических и психологических признаков, распознаваемых у человека.
Практически любой аспект фенотипа зависит и от генетической составляющей, и от воздействия окружающей среды. Данное правило необходимо помнить при определении возможной причины заболевания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных.
Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
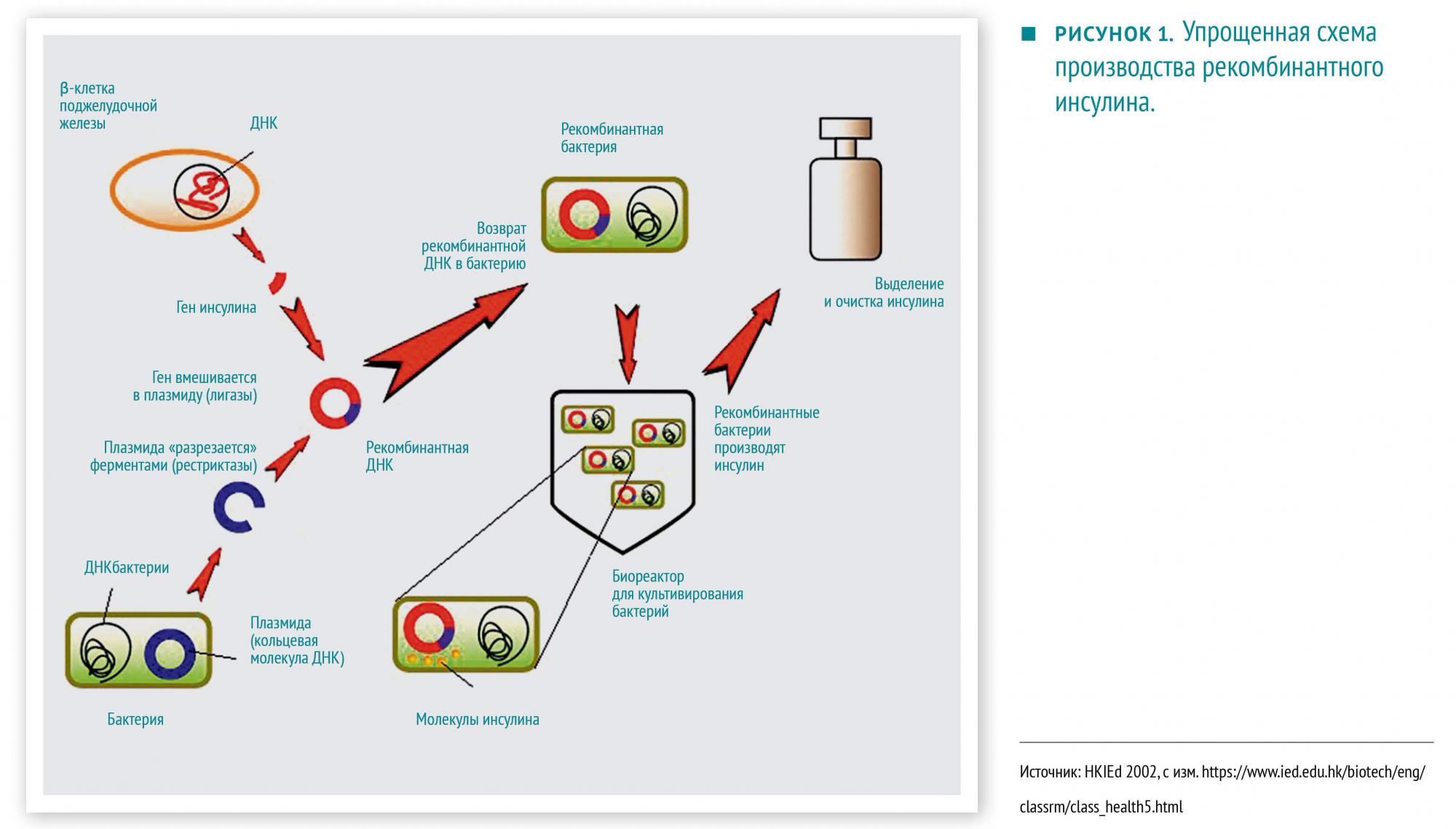
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
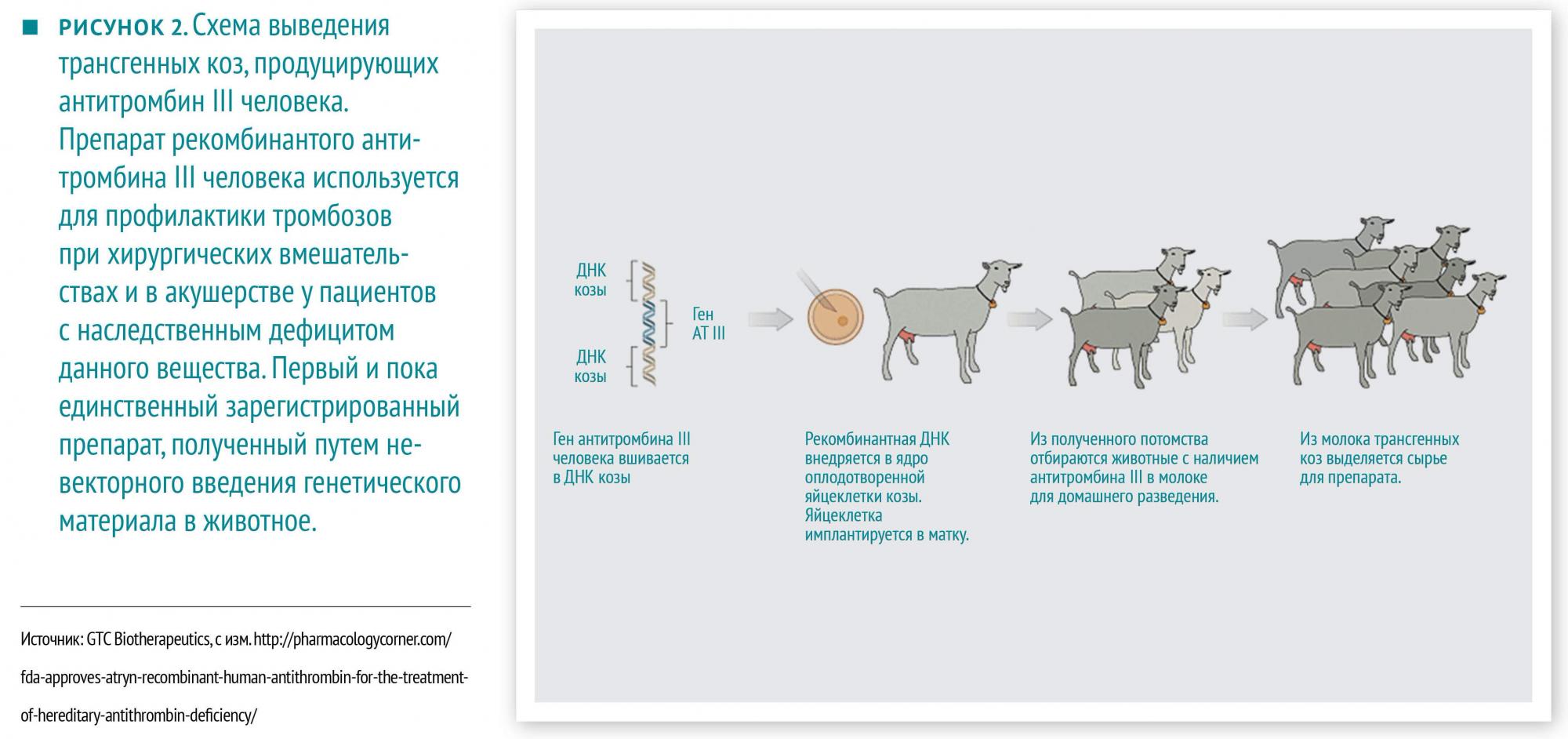
Дальнейшее развитие данной отрасли науки привело к появлению генной терапии. Тут уже всё по‑взрослому, хотя пока и экспериментально. Устраняются посредники типа бактерий, коз и бананов. Как правило, так пытаются лечить тяжелые и редкие наследственные или спорадически возникающие заболевания, патогенез которых обусловлен дефектом какого‑либо одного гена, например, первичные иммунодефициты. При этом другие методы лечения неэффективны или труднодоступны, и терять, в общем, нечего. Результаты впечатляющие, но и цена нежелательных реакций высока.
В начале 2000‑х гг. в Англии и Франции проводились клинические испытания генной терапии Х-сцепленного тяжелого комбинированного иммунодефицита, при котором нарушен синтез общего рецептора нескольких цитокинов, отвечающих за дифференцировку и пролиферацию лимфоцитов. При отсутствии аллогенной трансплантации гемопоэтических стволовых клеток дети умирают от тяжелых инфекций в 1‑й год жизни. В ходе испытаний 20 маленьким пациентам были трансплантированы собственные (то есть дефектные) стволовые клетки костного мозга, в которые был введен ретровирусный вектор, несущий ген нормального белка рецептора и вирусный промотор. Блестящие результаты — восстановление функций иммунной системы, отсутствие рецидива в течение всего периода наблюдения (4–11 лет) — были омрачены развитием Т-клеточного острого лимфобластного лейкоза у 5 детей (известно, что один ребенок погиб). Выяснилось, что ген белка и вирусный промотор у всех 5 заболевших встроились в ДНК рядом с протоонкогенами, т. е. генами, при усилении экспрессии которых возможно неконтролируемое деление клеток. Встраивание генного материала в ДНК хозяина в наше время в основном дело случая.
Первые ошибки были учтены, в настоящее время исследователи выбирают неонкогенные вирусы с известными местами встраивания в человеческую ДНК, или плазмиды.
В общем, в генной инженерии остается достаточно технологических трудностей, иммунологического несоответствия, опасности инфицирования человека вирусами животных с потенциальным появлением новых болезней. Всего этого упрямые и беспринципные ученые не очень‑то и боятся. Понятно, что у человечества хватит мозгов, чтобы как‑то решить эти проблемы, остается надеяться, что хватит ума не наделать новых.
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.


История Развития Генетики. 4
Генетика и медицина. 5
Методы исследования. 5
Интерес медицины. 6
Генетика человека. 7
Медицинская генетика. 8
Список литературы: 13
Введение.
Генетика человека и такие фундаментальные дисциплины, как анатомия, физиология, биохимия, составляют основу современной медицины. Место генетики среди биологических наук и особый интерес к ней определяются тем, что она изучает основные свойства организмов, а именно наследственность и изменчивость.
Наследственность и изменчивость у человека являются предметом изучения генетики человека на всех уровнях его организации: молекулярном, клеточном, организменном, популяционном. Генетика человека своими успехами в значительной мере обязана медицинской генетике - науке, изучающей роль наследственности в патологии человека. Прикладной раздел медицинской генетики - это клиническая генетика, которая использует достижения медицинской генетики, генетики человека и общей генетики в решении клинических проблем, возникающих у людей.
Генетика представляет собой одну из наиболее сложных дисциплин современного естествознания. Чтобы разобраться в ней глубоко, в своей работе я рассмотрю основные этапы развития генетики, виды генетики, достижения генетики в современной медицине и т.д.
История Развития Генетики.
Генетика – это наука, изучающая закономерности наследственности и изменчивости, а также обеспечивающие их биологические механизмы.
Официальной датой рождения генетики считают 1900 год. Тогда были опубликованы данные Г. де Фриза, К. Корренса и К.Чермака, переоткрывших закономерности наследования признаков, установленные Г.Менделем. Первые десятилетия 20-го века оказались плодотворными в развитии основных положений и направлений генетики. Было сформулировано представление о мутациях, популяциях и чистых линиях организмов, хромосомная теория наследственности, открыт закон гомологических рядов, получены данные о возникновении наследственных изменений под действием рентгеновских лучей, была начата разработка основ генетики популяций организмов.
В 1953 году в международном научном журнале была напечатана статья биологов Джеймса Уотсона и Френсиса Крика о строении дезоксирибонуклеиновой кислоты – ДНК.
Структура ДНК оказалась совершенно необычной: её молекулы имеют огромную по молекулярным масштабам длину и состоят из двух нитей, сплетённых между собой в двойную спираль. Каждую из нитей можно сравнить с длинной нитью бус. У белков "бусинами" являются аминокислоты двадцати различных типов. У ДНК – всего четыре типа "бусин", и зовутся они нуклеотидами. "Бусины" двух нитей двойной спирали ДНК связаны между собой и строго друг другу соответствуют. В ДНК напротив нуклеотида аденина находится тимин, напротив цитозина – гуанин. При таком построении двойной спирали каждая из цепей содержит сведения о строении другой. Зная строение одной цепи, всегда можно восстановить другую.
Получаются две двойные спирали – точные копии их предшественницы. Это свойство точно копировать себя имеет ключевое значение для жизни на Земле.
Генетика и медицина.
В генетике основным методом исследования является генетический анализ, который проводится на всех уровнях организации живого (от молекулярного до популяционного). В зависимости от цели исследования "видоизменяется" в частные методы - гибридологический, популяционный, мутационный, рекомбинационный, цитогенетический и др.
Гибридологический метод позволяет установить закономерности наследования отдельных признаков и свойств организма путем проведения серии прямых или возвратных скрещиваний в ряде поколений. Закономерности наследования признаков и свойств у человека устанавливают, используя генеалогический метод (анализ родословных). Законы наследования признака в популяциях определяют с помощью популяционного метода, или популяционного анализа.
Цитогенетический метод, объединивший принципы цитологического и генетического анализа, применяют при изучении закономерностей материальной преемственности в поколениях отдельных клеток и организмов и "анатомии" материальных носителей наследственности.
Феногенетический анализ позволяет изучать действие гена и проявления генов в индивидуальном развитии организма. Для этого используют такие приемы, как пересадка генетически различных тканей, клеточных ядер или отдельных генов из одной клетки в другую, а также исследование так химер - экспериментально полученных многоклеточных организмов, состоящих из генетически различных клеток, исходно принадлежащих разным индивидуумам.
Мутационный и рекомбинационный анализ используют при изучении тонкой организации и функции генетического материала, структуры различных ДНК, их изменений, механизмов функционирования и обмена генами при скрещивании. Интенсивно развивается метод молекулярного генетического анализа.
С развитием генетики стало возможным применение её методов в исследовании неизлечимых ранее болезней, патологий и т.д. Что начало привлекать немалый интерес со стороны ученых, работающих в области медицины. Известно несколько тысяч генетических заболеваний, которые почти на 100% зависят от генотипа особи. К наиболее страшным из них относятся: кислотный фиброз поджелудочной железы, фенилкетонурия, галактоземия, различные формы кретинизма, гемоглобинопатии, а также синдромы Дауна, Тернера, Кляйнфельтера. Кроме того, существуют заболевания, которые зависят и от генотипа, и от среды: ишемическая болезнь, сахарный диабет, ревматоидные заболевания, язвенные болезни желудка и двенадцатиперстной кишки, многие онкологические заболевания, шизофрения и другие заболевания психики.
Генетика человека (human genetics) – это особый раздел генетики, который изучает особенности наследования признаков у человека, наследственные заболевания (медицинская генетика), генетическую структуру популяций человека. Из направлений генетики человека наиболее интенсивно развиваются цитогенетика, биохимическая генетика, иммуногенетика, генетика высшей нервной деятельности, физиологическая генетика.
Генетика человека является теоретической основой современной медицины и современного здравоохранения. Её подразделяют на антропогенетику, изучающую закономерности наследственности и изменчивости нормальных признаков человеческого организма, демографическую генетику (генетика народонаселения), экологическая генетику (учение о генетических аспектах взаимоотношений человека с окружающей средой) и генетику медицинскую, которая изучает наследственные патологии (болезни, дефекты, уродства и др.).
Наиболее важной областью генетики человека является медицинская генетика. Медицинская генетика помогает понять взаимодействие биологических и факторов среды в патологии человека. Иногда ее рассматривают не как раздел генетики человека, а как самостоятельную область общей генетики.
Медицинская генетика изучает явления наследственности и изменчивости в различных популяциях людей, особенности проявления и развития нормальных (физических, творческих, интеллектуальных способностей) и патологических признаков, зависимость заболеваний от генетической предопределенности и условий окружающей среды, в том числе от социальных условий жизни. А также разрабатывает системы диагностики, лечения, профилактики и реабилитации, больных наследственными болезнями и диспансеризации их семей, изучает роль и механизмы наследственной предрасположенности при заболеваниях человека.
Формирование медицинской генетики началось в 30-е гг. XX века, когда стали появляться факты, подтверждающие, что наследование признаков у человека подчиняется тем же закономерностям, что и у других живых организмов.
Задачей медицинской генетики является выявление, изучение, профилактика и лечение наследственных болезней, а также разработка путей предотвращения воздействия факторов среды на наследственность человека.
Основным разделом медицинской генетики является клиническая генетика, которая изучает этиологию и патогенез наследственных болезней, изменчивость клинических проявлений и течения наследственной патологии и болезней, характеризующихся наследственным предрасположением, в зависимости от влияния генетических факторов и факторов окружающей среды, а также разрабатывает методы диагностики, лечения и профилактики этих болезней. Клиническая генетика включает в себя нейрогенетику, дерматогенетику (изучающую наследственные заболевания кожи — генодерматозы), офтальмогенетику, фармакогенетику (изучающую наследственно обусловленные реакции организма на лекарственные средства). Медицинская генетика связана со всеми разделами современной клинической медицины и другими областями медицины и здравоохранения, в том числе, с биохимией, физиологией, морфологией, общей патологией, иммунологией.
Существенными достижениями в области клинической генетики явились расшифровка биохимической и молекулярно-генетической природы большого числа моногенных наследственных болезней и разработка на этой основе точных методов диагностики.
Применение методов генетической инженерии позволило точно выяснить характер перестроек в структуре мутантных генов для целого ряда наследственных болезней, в т.ч. талассемий (a,b, d, g), миопатий Дюшенна и Беккера, гемофилии А и В, фенилкетонурии; исследования в этой области осуществляются так интенсивно, что любые данные быстро становятся устаревшими.
В области генетики мультифакториальных заболеваний, к которым относятся ишемическая болезнь сердца, психозы, сахарный диабет, язвенная болезнь, большинство изолированных пороков развития, по-видимому, некоторые инфекционные заболевания (туберкулез, лепра, ревматизм), интенсивно развиваются теоретические исследования в области особого направления медицинской генетики - генетической эпидемиологии. Не менее важным в генетике мультифакториальных заболеваний является также выяснение значимости факторов окружающей среды, в том числе социальных, а также их взаимодействия с генетическими факторами для развития широко распространенных заболеваний.
Знание основ медицинской генетики позволяют врачам понимать механизмы индивидуального течения болезни и выбирать соответствующие методы лечения. На основе медико-генетических знаний приобретаются навыки диагностики наследственных болезней, а также появляется умение направлять пациентов и членов их семей на медико-генетическое консультирование для первичной и вторичной профилактики наследственной патологии. Приобретение медико-генетических знаний способствует формированию чётких ориентиров в восприятии новых медико-биологических открытий, что для врачебной профессии необходимо в полной мере, поскольку прогресс науки быстро и глубоко изменяет клиническую практику.
Несмотря на успехи в лечении ряда наследственных болезней существенная роль в борьбе с ними принадлежит профилактике, которая осуществляется в двух направлениях: предупреждение появления новых мутаций и распространения мутаций, унаследованных от предыдущих поколений. Профилактика болезней, возникающих в результате спонтанных мутаций в зародышевых клетках здоровых родителей, пока затруднена. Наибольшее значение для профилактики проявления патологических мутаций, унаследованных от предыдущих поколений, имеет медико-генетическое консультирование.
Эффективное внедрение научных достижений медицинской генетики в практическое здравоохранение может осуществляться только на основе подготовки квалифицированных кадров. Во многих странах, в том числе в США, Канаде, ФРГ, сложилась система подготовки кадров по медицинской генетике, в которой особое место отведено 2—4-летнему постдипломному обучению врачей, заканчивающемуся экзаменами и выдачей соответствующего сертификата. Кроме того, в большинстве случаев в рамках подготовки специалистов по медицинской генетике предусматривается специализация по цитогенетике и клинической генетике. В перечень медицинских специальностей в России введены специальности врача-генетика и врача лаборанта-генетика, подготовка которых осуществляется на кафедрах медицинской генетики в медицинских вузах и институтах усовершенствования врачей.
Заключение.
Развитие генетики до наших дней – это непрерывно расширяющийся фронт исследований. В этой области сделано уже очень много, и с каждым днем передний край науки приближается к цели – разгадки природы гена. К настоящему времени установлен целый ряд явлений, характеризующих природу гена. Во-первых, ген в хромосоме обладает свойством самовоспроизводится (авторепродукции); во-вторых, он способен мутационно изменяться; в-третьих, он связан с определенной химической структуры дезоксирибонуклеиновой кислоты – ДНК; в-четвертых, он контролирует синтез аминокислот и их последовательностей в белковой молекулы. В связи с последними исследованиями формируется новое представление о гене как функциональной системе, а действие гена на определение признаков рассматривается в целостной системе генов – генотипе.
Раскрывающиеся перспективы синтеза живого вещества привлекают огромное внимание генетиков, биохимиков, физиков и других специалистов.
Генетика очень важна для решения многих медицинских вопросов, связанных прежде всего с различными наследственными болезнями нервной системы (эпилепсия, шизофрения), эндокринной системы (кретинизм), крови (гемофилия, некоторые анемии), а также существованием целого ряда тяжелых дефектов в строении человека: короткопалость, мышечная атрофия и другие. С помощью новейших цитологических методов, цитогенетических в частности, производят широкие исследования генетических причин различного рода заболеваний, благодаря чему существует новый раздел медицины - медицинская цитогенетика.
Разделы генетики, связанные с изучением действия мутагенов на клетку (такие как радиационная генетика), имеют прямое отношение к профилактической медицине.
Особую роль генетика стала играть в фармацевтической промышленности с развитием генетики микроорганизмов и генной инженерии. Несомненно, многое остается неизученным, например, процесс возникновения мутаций или причины появления злокачественных опухолей. Именно своей важностью для решения многих проблем человека вызвана острая необходимость в дальнейшем развитии генетика. Тем более что каждый человек ответственен за наследственное благополучие своих детей, при этом важным фактором является его биологическое образование, так как знания в области аномалии, физиологии, генетики предостерегут человека от совершения ошибок.
Список литературы:
1). Баранов В.С., Горбунова В.Н.//Введение в молекулярную диагностику и генотерапию наследственных заболеваний. //Спб.: Специальная литература, 1997.
2). Медицинская генетика. / / Под ред. Бочкова Н.П. - М.: Мастерство, 2001
3). Орехова. В.А., Лажковская Т.А., Шейбак М.П.//Медицинская генетика. - Минск: Высшая школа, 1999
4). Айала Ф., Кайгер Дж// Современная генетика. В 3-х томах. - М.: Мир, 1987
5). Н. Н. Приходченко, Т. П. Шкурат “Основы генетики человека”, Ростов- на-Дону, 1997 г.

В настоящее время генетические технологии играют ключевую роль в разработке новых подходов к диагностике и лечению заболеваний. Российские учёные уже успешно внедрили в практику эффективные препараты на основе моноклональных антител и ведут разработки в области CAR-T-терапии и генотерапевтических препаратов на основе рекомбинантных аденоассоциированных вирусов. Также в практику внедряются инструменты генодиагностики, позволяющие существенно повысить эффективность медицинской помощи за счёт персонализированного подхода к лечению заболеваний. Успешное внедрение новейших технологий и современных методов диагностики и лечения невозможно без сотрудничества академической науки и бизнеса. Компании, создающие условия для сотрудничества с академической наукой, привлечения специалистов разного профиля, приближают массовое внедрение генетических технологий, а значит, победу над многими ранее неизлечимыми социально значимыми заболеваниями.
Ключевые слова
Полный текст
Генетические технологии – основной драйвер развития современной медицины и фармацевтики не только на Западе, но и в России. Наша компания уже разработала и внедрила в производство аналоги многих современных биотехнологических препаратов. Разработки обеспечивают импортозамещение, несут большой экономический эффект, но главное – повышают доступность эффективной терапии в России. Например, появление на рынке нашего биоаналога трастузумаба – препарата, жизненно необходимого для значительной части пациентов с раком молочной железы, – за два года позволило снизить стоимость лечения на 65 %. В 2017 г. трастузумаб получило на 68 % больше больных, чем в 2015 г., при этом уже на второй год после начала выпуска препарата экономия бюджетных средств достигла 2,5 млрд руб.
После успешного освоения технологии производства биоаналогов мы обладаем всеми необходимыми компетенциями для разработки оригинальных биотехнологических препаратов. В конце 2018 г. наша компания представила результаты II фазы клинических исследований пролголимаба – анти-PD1 препарата, применяемого при метастатической меланоме. Более 30 % больных с множественными метастазами демонстрируют выраженное уменьшение размера и числа опухолевых очагов, ещё у трети больных рост опухоли останавливается. У больных, ранее не получавших терапии, частота ответа опухоли на лечение достигает 42 %. Ожидается, что выход пролголимаба существенно снизит стоимость лечения пациентов и сделает современные иммуноонкологические препараты доступнее для них. Мы уверены, что Россия станет первой страной, которая сможет обеспечить инновационным иммуноонкологическим методом терапии всех пациентов с впервые выявленной метастатической меланомой.
Другой оригинальный препарат российского производства – нетакимаб, анти-IL17, применяемый для терапии тяжёлого псориаза, – также показал хорошие результаты в рамках клинических исследований. Исследование II фазы показало, что применение нетакимаба в течение года позволяет достичь PASI75 (уменьшения площади псориатических бляшек более чем на 75 %) у более чем 98 % пациентов. Примерно у половины пациентов достигнуто полное исчезновение проявлений псориаза (PASI100). При этом эффект препарата удивительно стабилен: ни у одного из пациентов с "полным ответом" не отмечено повторного появления симптомов заболевания после приёма препарата в максимальной дозе.
В октябре 2018 г. проанализированы результаты 12-недельной терапии псориаза нетакимабом в рамках исследования III фазы. В исследовании приняли участие 213 пациентов. Через 12 недель как в группе введения препарата 1 раз в 2 недели, так и в группе введения 1 раз в 4 недели около 80 % достигли 75 %-ного уменьшения площади псориатических бляшек. В группе плацебо такой эффект не был достигнут ни у одного пациента. Наблюдение за больными продолжается с целью оценки эффективности годового курса терапии.
В исследовании II фазы в рамках терапии нетакимабом анкилозирующего спондилита (болезни Бехтерева) более чем у 70 % пациентов при применении нетакимаба в максимальной дозе было достигнуто более чем 40 %-ное снижение выраженности симптомов заболевания. Примечательно, что во всех исследованиях безопасность препарата не имела отличий от плацебо.
Следующий наш шаг – разработка генотерапевтических лекарственных препаратов, ставшая возможной благодаря активному развитию генетических технологий в последние 10–15 лет. Это новое поколение препаратов, механизм действия которых основан на модификации генетического аппарата клеток человека [1]. Сегодня это единственный эффективный способ борьбы со многими тяжёлыми наследственными заболеваниями, которые прежде считались неизлечимыми [2].
Механизм действия генотерапевтических препаратов основан на проникновении генетической конструкции в клетку, где происходит либо интеграция трансгена в геном, либо его эписомальная (внехромосомная) локализация. На сегодня наиболее удобным инструментом для такой генной терапии считаются аденоассоциированные вирусы (AAV) [3, 4]. Они отличаются безопасностью, отсутствием патогенности и низкой иммуногенностью для человека. Их используют в качестве системы доставки, и в последние 10 лет это решение стало в генной терапии наиболее распространённым и универсальным. Уже существуют десятки схем доставки трансгенов in vivo , в которых применяются рекомбинантные аденоассоциированные вирусы (rAAV) [5]. Создание на их основе отечественных генотерапевтических препаратов для лечения моногенных наследственных заболеваний, не поддающихся традиционному лечению, – гемофилии А и Б [6], миодистрофии Дюшенна [7], спинальной мышечной атрофии [8], глазных патологий [9] и других – одна из важнейших задач для разработчиков на ближайшие годы.
Для эффективной генной терапии нового поколения, которая могла бы применяться при лечении тяжёлых генетических заболеваний, решающее значение имеют поиск и получение новых серотипов rAAV с уникальным тропизмом и с повышенной пакующей ёмкостью. Для создания инновационных векторов доставки в организм пациента "терапевтических генов" ведутся разработки в области улучшения свойств имеющихся природных серотипов вирусных капсидов: придание rAAV-векторам высокой тканеспецифичности, увеличение ёмкости экспрессионной кассеты AAV с целью доставки трансгенов большего размера. Достижение этих целей позволит существенно расширить круг нозологий, поддающихся заместительной генной терапии.
Терапевтические генетические технологии позволили создать новый вид противоопухолевой терапии, основанной на модификации иммунных клеток человека. Этот инновационный метод лечения совмещает в себе технологии клеточной терапии и генной инженерии. Наиболее эффективная адаптивная клеточная иммунотерапия – CAR-T-терапия, основанная на введении в организм пациента аутологичных или аллогенных Т-лимфоцитов. Они подвергаются ex vivo генетической модификации и экспрессируют на своей поверхности химерный антигенный рецептор (CAR, от англ. Chimeric antigen receptor) [10, 11], способный узнавать опухолевые антигены и связываться с ними. При В-клеточных лимфопролиферативных новообразованиях CAR-рецепторы нацелены на связывание с маркером нормальных и трансформированных B-клеток поверхностным антигеном CD19. В клинических исследованиях СD19 CAR-T-терапия показывает высокую эффективность в лечении злокачественных новообразований В-клеток (острого лимфобластного лейкоза из В-клеток, неходжкинских лимфом, хронического лимфолейкоза) – до 82 % полных ремиссий [12, 13]. В последние 5 лет количество разработок в области адаптивной клеточной иммунотерапии генетически модифицированными Т-лимфоцитами возросло на порядок [14] (рис.).

Адаптивная клеточная иммунотерапия на основе CAR-T-лимфоцитов
Полученные на моделях in vitro и in vivo данные о противоопухолевом эффекте разработанного в России клеточного продукта anti-CD19 CAR-T уже демонстрируют возможность успешного лечения гемобластозов с применением генетически модифицированных Т-лимфоцитов [15]. Сейчас проводятся работы по масштабированию процесса производства CAR-T для запуска программы клинических исследований, а также дальнейшей оптимизации схемы введения клеточного препарата и контроля аспектов безопасности его применения.
Стратегии развития таких препаратов могут быть разнообразны. Но если говорить об отечественной CAR-T-терапии, то, мы уверены, следующим этапом развития технологии станут работы над уменьшением сопутствующих побочных эффектов. Для этого наши учёные ведут поисковые работы по созданию технологий комплексной генетической модификации иммунных клеток человека: выключение экспрессии Т-клеточного рецептора и молекул главного комплекса гистосовместимости, внедрение в CAR-T клетки молекулярных индуцибильных систем "антидотов", тестирование комбинаций CAR-T-терапии с иммуноонкологическими препаратами – моноклинальными антителами, ингибиторами контрольных точек и иммуноцитокинами. Создание универсального CAR-T способно повысить доступность терапии, понизив её стоимость.
Разработки варьируются по степени готовности от доклинических исследований до III фазы клинических испытаний. И мы надеемся, что уже в ближайшие годы российская фарминдустрия одержит победу над ранее неизлечимыми заболеваниями. Создание генотерапевтических препаратов для лечения заболеваний, не поддающихся традиционному лечению, – один из наших важнейших приоритетов.
Ещё одна активно развивающаяся область применения генетических технологий – генодиагностика. Роль генетической информации возрастает при одновременном удешевлении технологий её получения. Одной из областей, где уже используются возможности генодиагностики, является персонализированная медицина. Информация, хранящаяся в геноме человека, позволяет предотвратить развитие множества заболеваний, повысить эффективность лечения и улучшить качество жизни. Успешным примером её использования можно считать комплексный подход к диагностике онкологических заболеваний, в рамках которого на основе морфологии и "молекулярной сигнатуры" опухоли, опухолевого микроокружения и анализа микробиома формируется индивидуальная комбинация вариантов терапии.
Внедрение современных методов генодиагностики – необходимое условие успешного применения генной терапии. Но её широкое распространение в России невозможно без создания отечественных секвенаторов нового поколения, основанных на новых физических принципах. Новое оборудование и технологии обеспечат высокое качество и низкую стоимость полногеномного секвенирования, создание собственных баз данных генетической информации и инструментов её анализа, что сделает метод более доступным и, следовательно, более массовым. Именно поэтому сотрудничество коммерческих компаний и академических учреждений в этой высококонкурентной технологической нише нам кажется особенно перспективным. Создание условий для формирования консорциумов специалистов мультидисциплинарного уровня позволит обеспечить широкое распространение технологий получения генетической информации в медицине.
Для реализации проектов по развитию передовых генетических технологий необходимы специалисты с уникальными компетенциями, потребность в которых постоянно растёт. За последние 3 года штат научных сотрудников в компании "Биокад" вырос в 2 раза. Ежегодно компании требуются ещё 150–200 высококвалифицированных сотрудников, способных поддержать увеличение числа проектов и направлений исследований. Прежде всего это должны быть специалисты в области генетики, клеточной и молекулярной биологии.
Несмотря на высокий уровень подготовки кадров естественно-научного направления, которым славится Россия, академическая наука не всегда успевает за изменениями в фармацевтической отрасли и её потребностями. Именно поэтому мы считаем оптимальной моделью, способной предотвратить недостаток кадров, сотрудничество бизнеса и науки в области обучения. Компания "Биокад" открыта для стажировок студентов различных направлений. Более того, она реализовала более 10 масштабных проектов, среди которых и магистерские программы. Санкт-Петербургский государственный химико-фармацевтический университет готовит студентов по направлению "Биомедицина и биоинженерия", Московский физико-технический институт – по направлению "Биоинформатика", а факультет в Пущинском государственном естественно-научном институте – по направлению "Молекулярная и клеточная биотехнология". Совместные образовательные программы дают фундаментальные университетские знания и обогащают их реальными практическими навыками, которые студенты оттачивают на решении прикладных задач – в процессе работы над реальными проектами компании. Подход показывает отличные результаты: почти все выпускники профильной программы Пущинского государственного естественно-научного института трудоустроены в компании "Биокад".
Чтобы выстроить полноценную систему образования специалистов, заточенную под практику современной фармацевтики, мы планируем открыть бакалавриат по биоинженерии на базе ведущего вуза Санкт-Петербурга – СПбГУ. Также в 2019 г. в рамках сотрудничества с Новосибирским государственным университетом будут запущены два авторских курса – "Инновационные направления биотехнологии в фармацевтике" и "Редактирование генома".
Именно тесное взаимодействие между академической наукой, образовательными учреждениями и компаниями должно стать ключевым фактором успешного развития российской науки и промышленности в области биотехнологии и биомедицины. Реализация образовательных проектов помогает вести подготовку студентов с учётом потребностей и изменений индустрии, которые произойдут в ближайшие 5–10 лет. Но польза от этого сотрудничества чувствуется уже сейчас: удаётся предоставлять рабочие места для выпускников научных специальностей и почти полностью удовлетворять потребности бизнеса в молодых квалифицированных кадрах, необходимых для запуска инновационных проектов, в том числе внедрения современных генетических технологий.
Финансирование доклинических и клинических исследований препаратов нетакимаб и пролголимаб частично осуществлялось за счёт бюджетных средств, полученных в соответствии с государственными контрактами и договорами субсидий, заключёнными в рамках Федеральной целевой программы "Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу".
Читайте также:

