Бензол и его гомологи реферат
Обновлено: 28.06.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Урок №23. Класс 10 а, б Дата урока _________
Тема урока: Свойства и применение бензола и его гомологов.
на примере бензола познакомиться с углеводородами, которые имеют замкнутые цепи углеродных атомов и специфические химические свойства;
закрепить умение сравнивать состав, строение, свойства углеводородов ряда бензола;
выяснить области применения ароматических углеводородов;
Тип урока – изучение нового материала.
1. Организационный момент - 2 мин;
2. Изучение нового материала – 40 мин.
3. Подведение итогов урока и завершение работы – 3 мин.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
Толуол (метилбензол)
Ксилол (диметилбензол)
Пропилбензол
Кумол (изопропилбензол)
Стирол (винилбензол)
Бензол – легкокипящая ( t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Химические свойства аренов
I . РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
Б) в нейтральной и слабощелочной до солей бензойной кислоты
II . РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
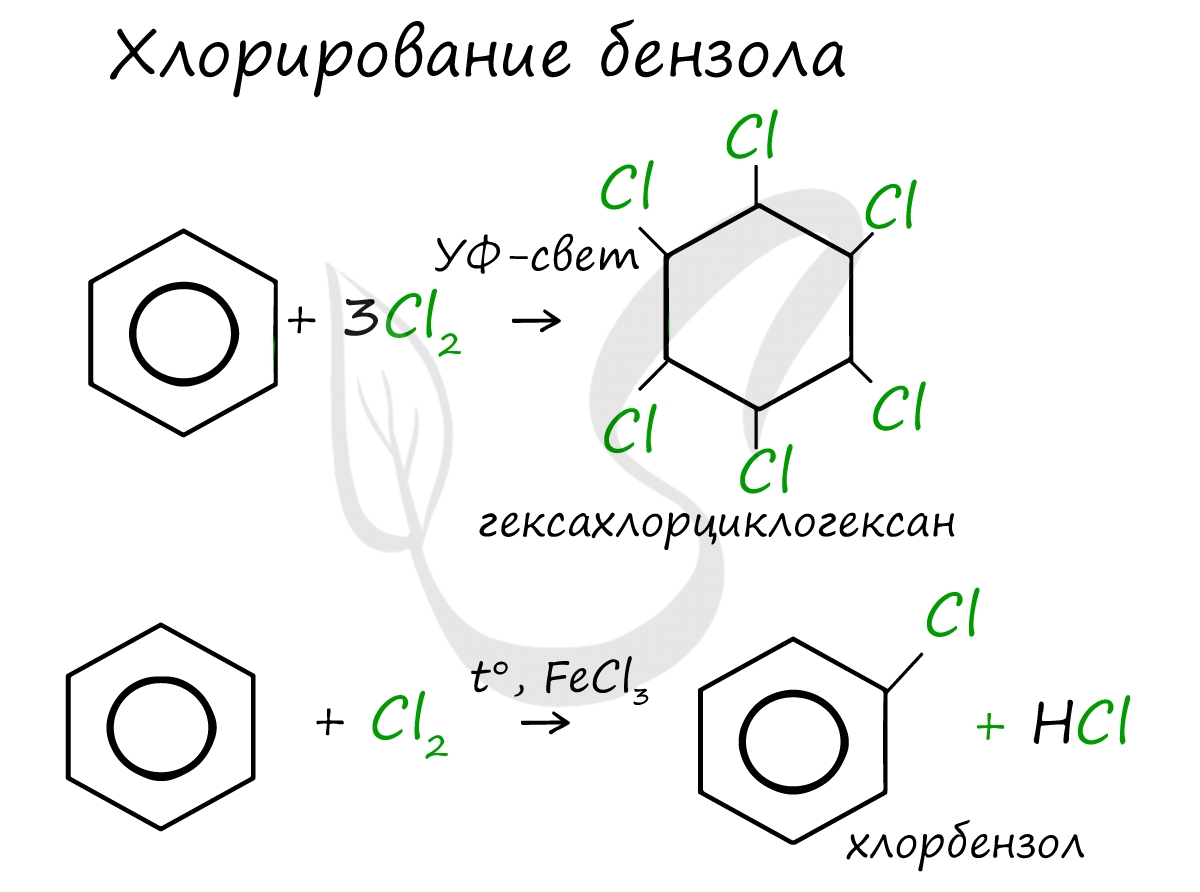
1. Галогенирование
C 6 H 6 +3 Cl 2 h ν → C 6 H 6 Cl 6 (гексахлорциклогексан - гексахлоран)

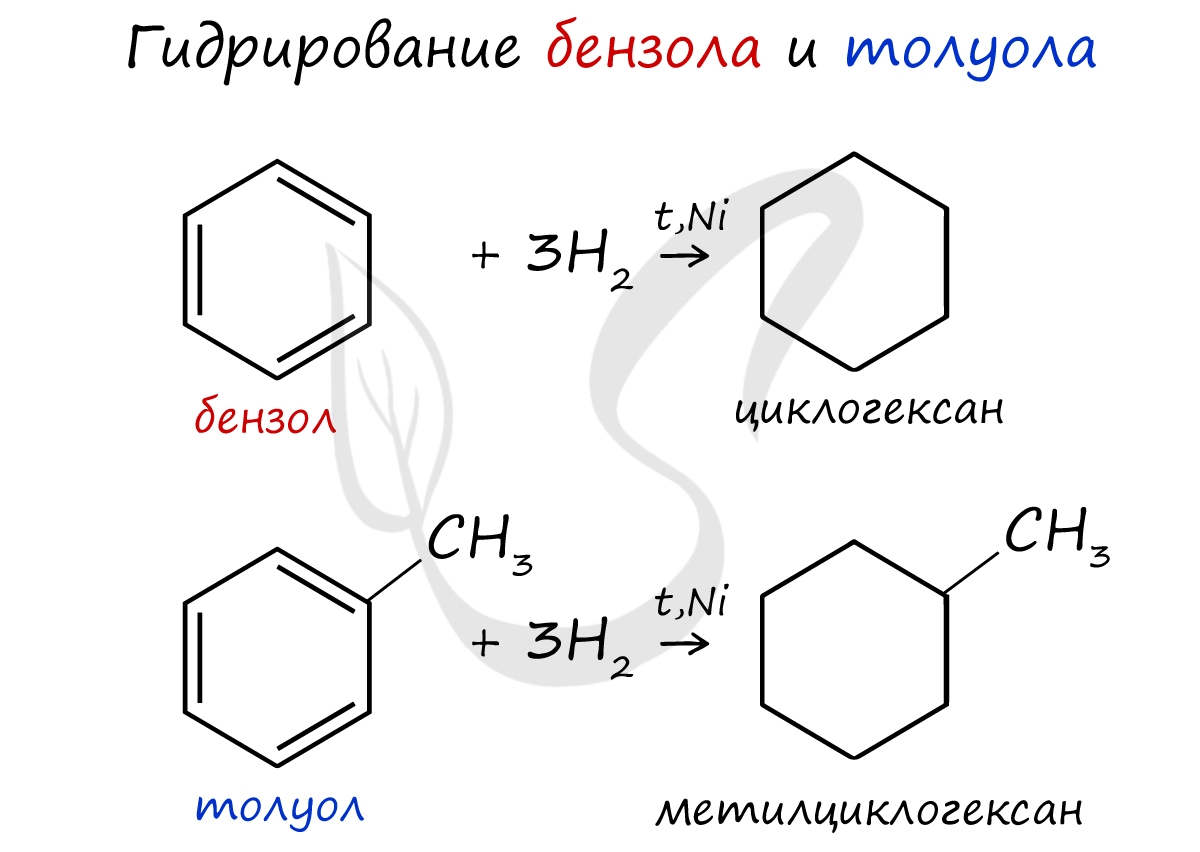
2. Гидрирование
C 6 H 6 + 3 H 2 t , Pt или Ni → C 6 H 12 (циклогексан)

3. Полимеризация

III . РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование -
a ) бензола
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 - Cl + HCl (хлорбензол)

C 6 H 6 + 6 Cl 2 t , AlCl 3 → C 6 Cl 6 + 6 HCl (гексахлорбензол)
C 6 H 6 + Br 2 t , FeCl 3 → C 6 H 5 - Br + HBr (бромбензол)

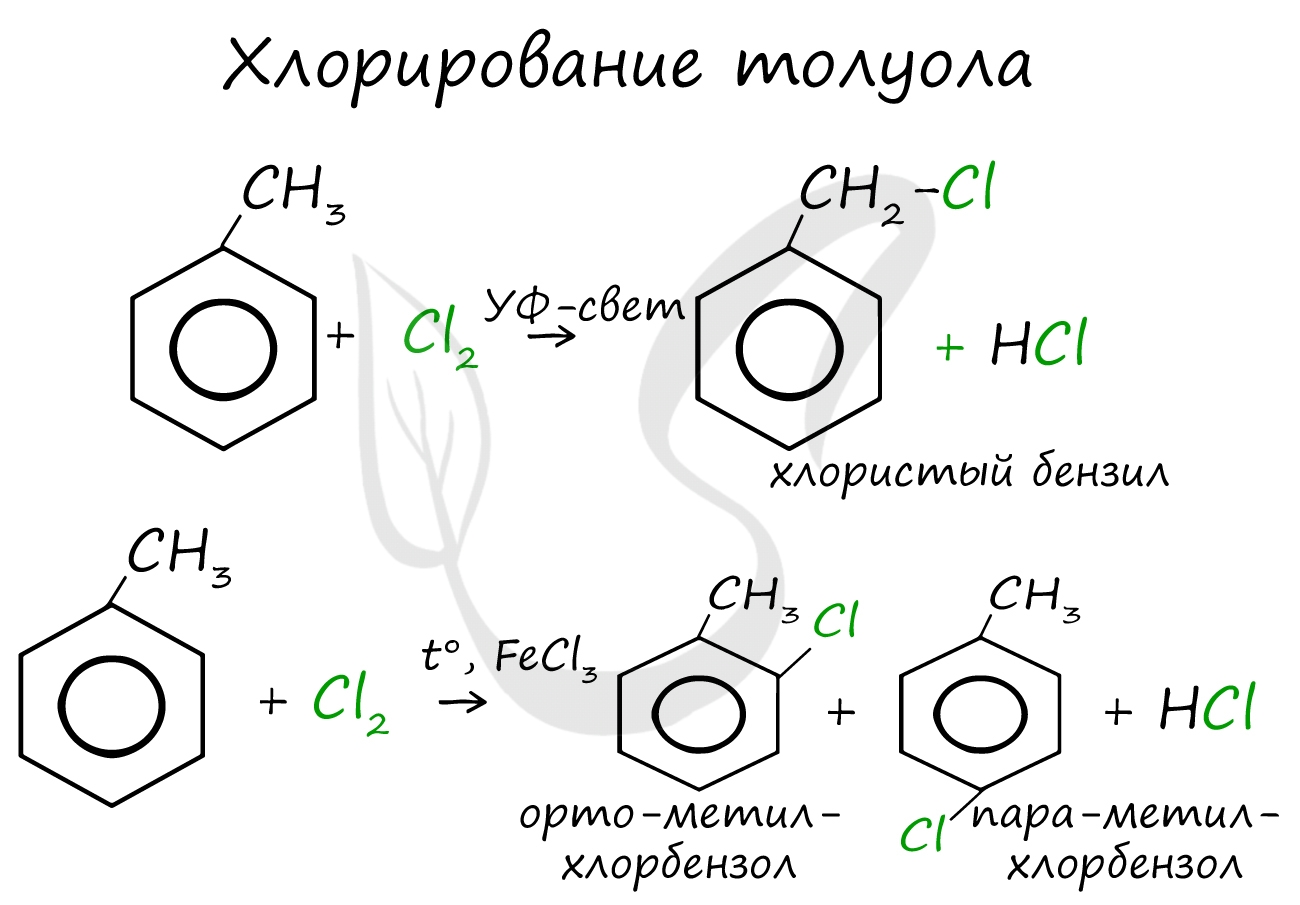
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
в) гомологов бензола в присутствии катализатора
C 6 H 5 - CH 3 + Cl 2 AlCl 3 → (смесь орта, пара производных) + HCl
2. Нитрование (с азотной кислотой)
C 6 H 6 + HO - NO 2 t , H 2 SO 4 → C 6 H 5 - NO 2 + H 2 O
нитробензол - запах миндаля !

2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C 6 H 6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C 6 H 5 NO 2 (растворитель, из него получают анилин), хлорбензола C 6 H 5 Cl, фенола C 6 H 5 OH, стирола и т.д.
Толуол C 6 H 5 –CH 3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C 6 H 4 (CH 3 ) 2 . Технический ксилол – смесь трех изомеров ( орто -, мета - и пара -ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C 6 H 5 –CH(CH 3 ) 2 служит для получения фенола и ацетона.
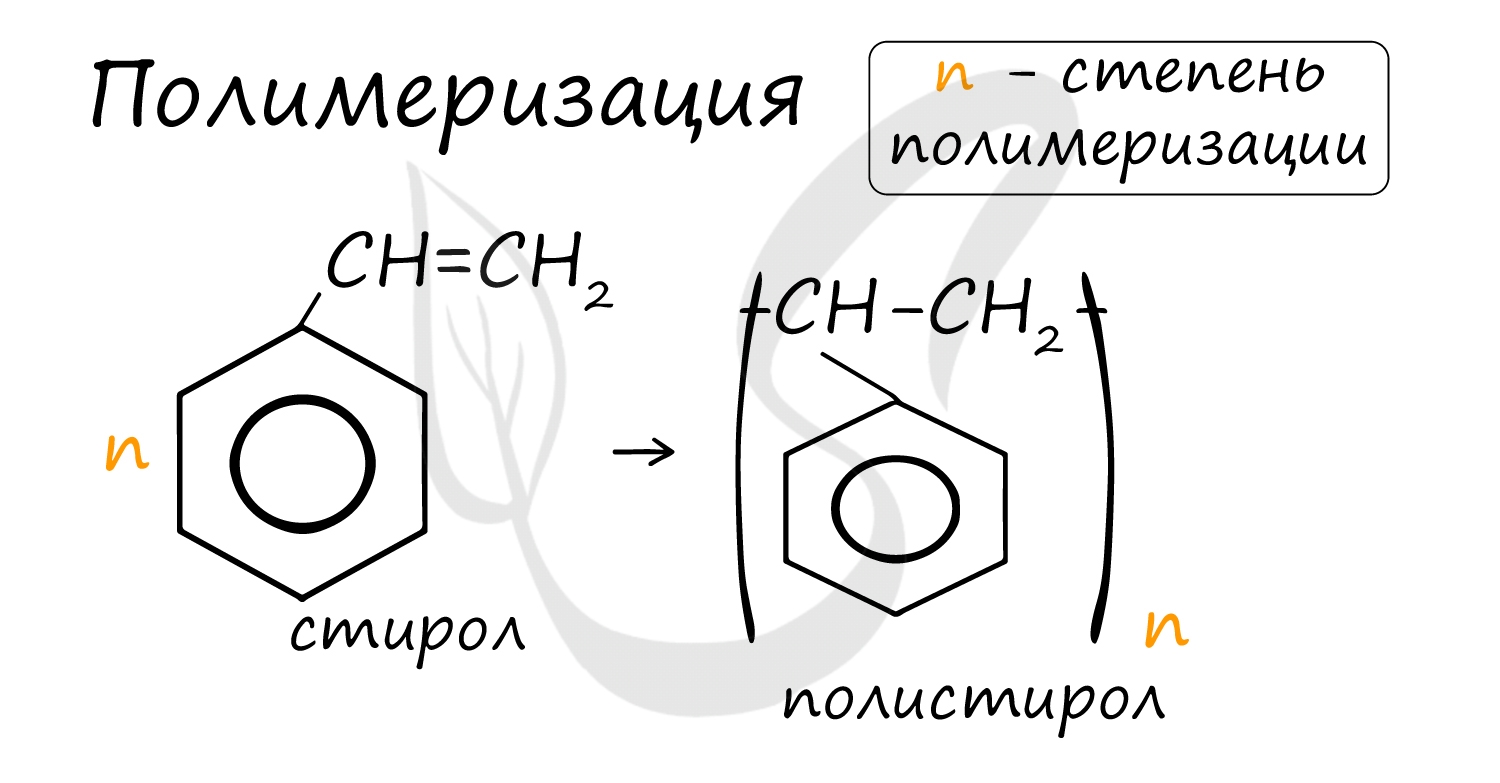
Стирол C 6 H 5 – CH = CH 2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
Ароматические углеводороды/ Арены — соединения, молекулы которых содержат одно или несколько бензольных колец.
Бензольные кольца – циклические группы атомов углерода с особым характером связей.

О бщая формула ароматических углеводородов ряда бензола:
Бензол
Бензол — 1) первый представитель класса аренов/ ароматических углеводородов; простейший ароматический углеводород.

С троение
Шесть атомов углерода, образующих правильный шестиуголник ( σ - скелет), находятся в sp 2 -гибридном состоянии. Каждый атом углерода образует при σ -связи с двумя другими атомами углерода и
одним атомом водорода, лежащие в одной плоскости.
Валентные углы между тремя σ -связями равны 120°
(см. σ -скелет молекулы бензола)
Шесть p-электронов взаимодействуют между собой, образуя единое π-электронное облако, которое изображают кружочком внутри шестичленного цикла:

Почему рисуют кружок в шестиугольнике? Это обозначение того, что все связи в молекуле одинаковые.

Дело в том, что если рисовать бензол по валентностям углерода (у каждого атома должно быть 4 связи), то надо было бы нарисовать с двойными связями.
Но!Каждая связь — это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длинна связи.
все связи одинаковы, т.е. нет разделения на двойные и одинарные;
эти связи представляют собой промежуточный вариант между двойной и одинарной.
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая — образуется общее ∏-электронное облако и оно распространено (=делокализовано) по всей молекуле:

Слева показана плотность бензольного кольца
Делокализация – электронная плотность.
Физическое состояние
Бесцветная жидкость с характерным запахом
Температура плавления: t пл =5,5°С
Температура кипения: t кип =80,1°С
Давление: p = 0,88г/см 3 .
Не растворяется в воде, хорошо растворяется в органических растворителях.
σ-скелет молекулы бензола
Н ![]()
оменклатура гомологов бензола
Если в молекуле арена есть несколько одинаковых радикала, то применяются приставки: орто-, мета— и пара-
Все эти вещества изомерны друг другу. У бензола и его гомологов довольно много изомеров —это обусловлено как количеством атомов, так и геометрией молекулы.

Названия радикалов
В ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах.
Химические свойства бензола
В первом разделе о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Первая такая характеристика — прочность бензольного кольца. Прочность не просто геометрической фигуры шестиугольника, а именно системы связей и делокализованного электронного облака.
Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор и т.д.
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов.
По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Например: взаимодействие с бромом — качественная реакция на бензол.
C6H6 + Br2 = C6 H5Br + HBr
Нитрованиебензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH)
Нитрирующая смесь – смесь концентрированных азотной и серной кислот.
Реакция происходит с помощью алкилгалогенид и алкенов.
Катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):

С6H6 + С2H5Cl → C6H5C2H5 + HCl
(гексахлоран)
Химические свойства гомологов бензола — алкилбензолов
Гомологи бензола более ракционноспособны — легче вступают в реакции
Эти реакции идут немного по-другому
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr

Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3

тринитротолуол, он же тротил
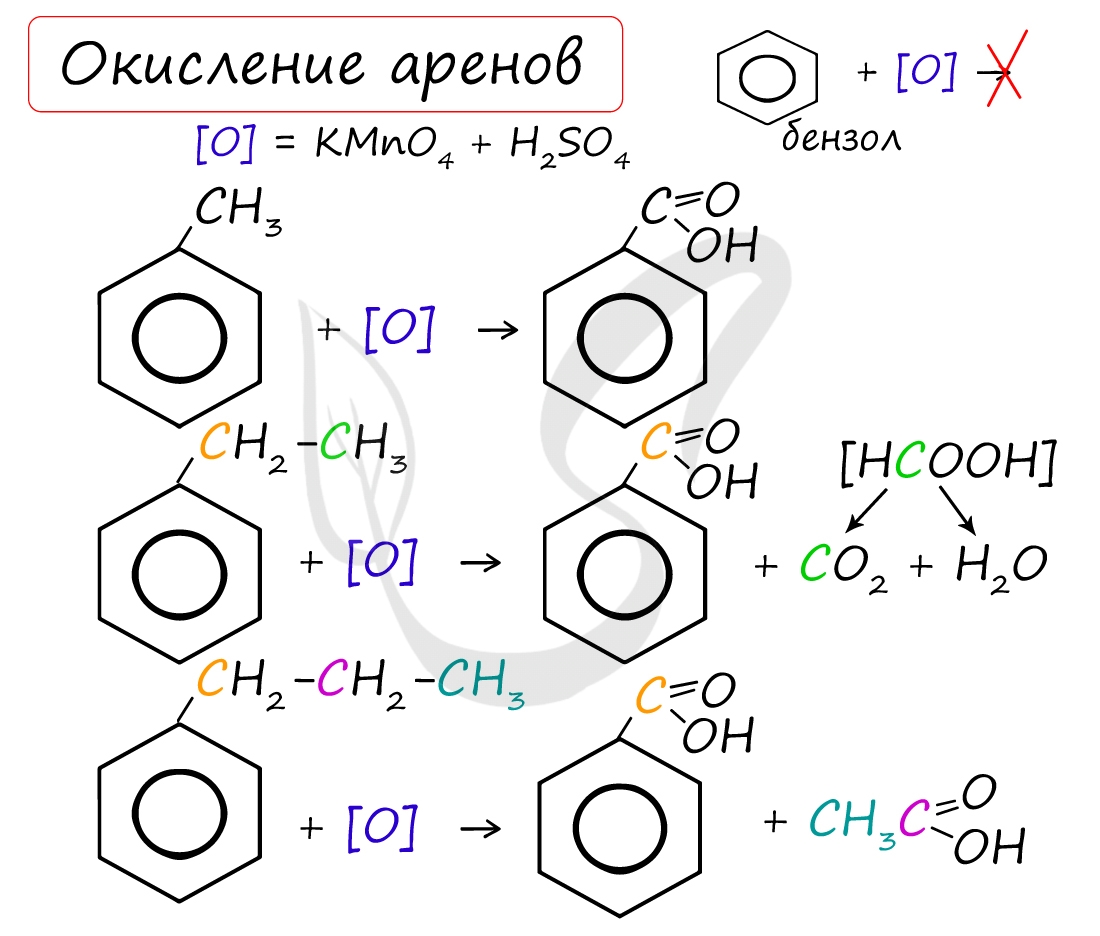
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота

Гидрирование бензола и алкилбензолов:
Тут уже различий нет. При гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан

Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)\2 O2 → nCO2 + (n-3)H2O
Получение бензола и его гомологов
Дегидрирование циклогексана: этот метод хорошо тем, что можно получить не только бензол, но и его гомологи. Для этого надо взять циклогексан с нужным количеством атомов С в боковой цепи
Получение гомологов бензола.Алкилирование бензола:
- Реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
1. Получение бензола из неорганических веществ:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского: 3С2H2 → C6H6
Это самый короткий путь получения.
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH(Br)-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH(Br)-(CH2)4-CH2Br
CH3-CH(Br)-(CH2)4-CH2Br + Zn → C6H13-СH3
C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
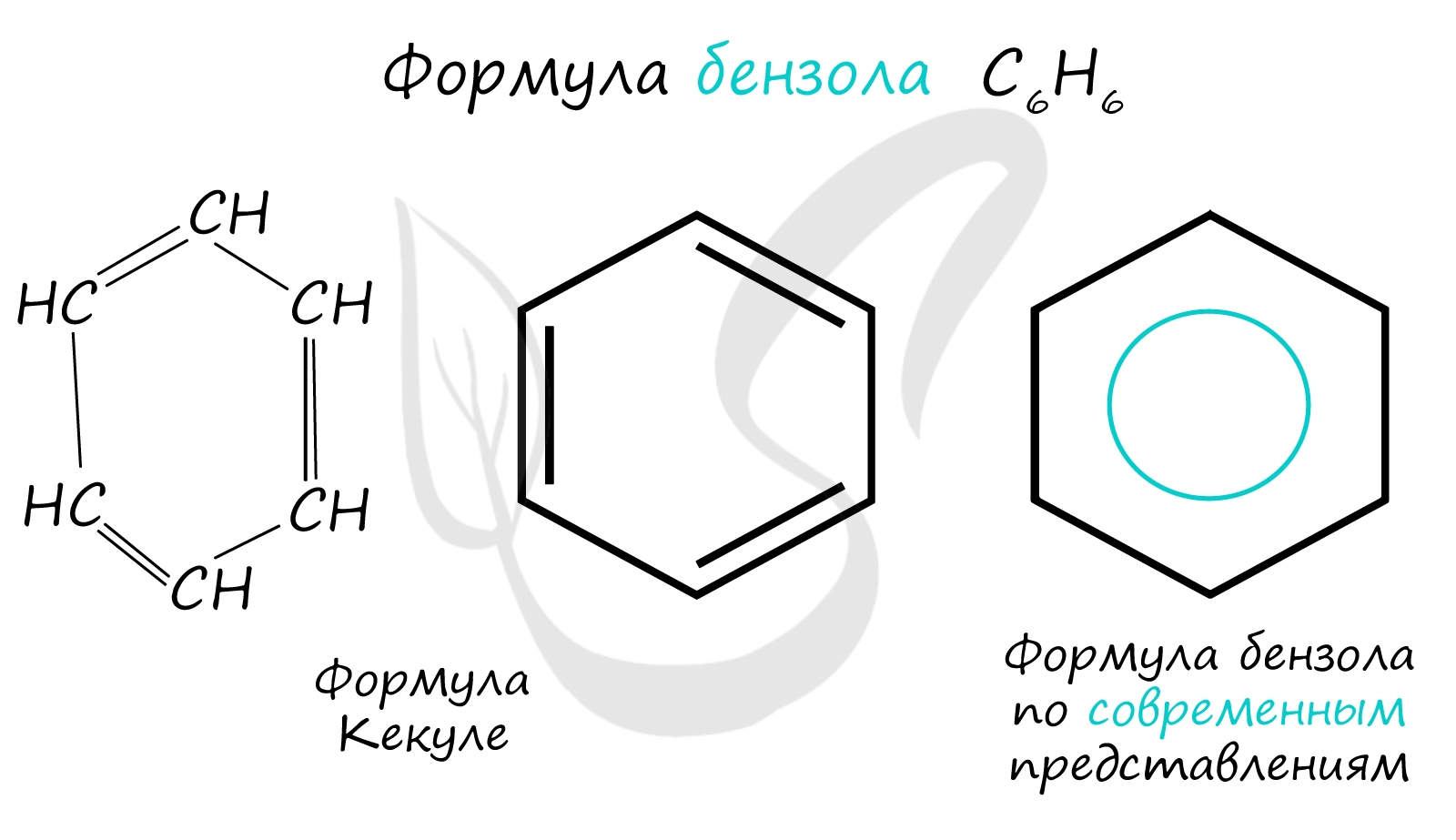
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
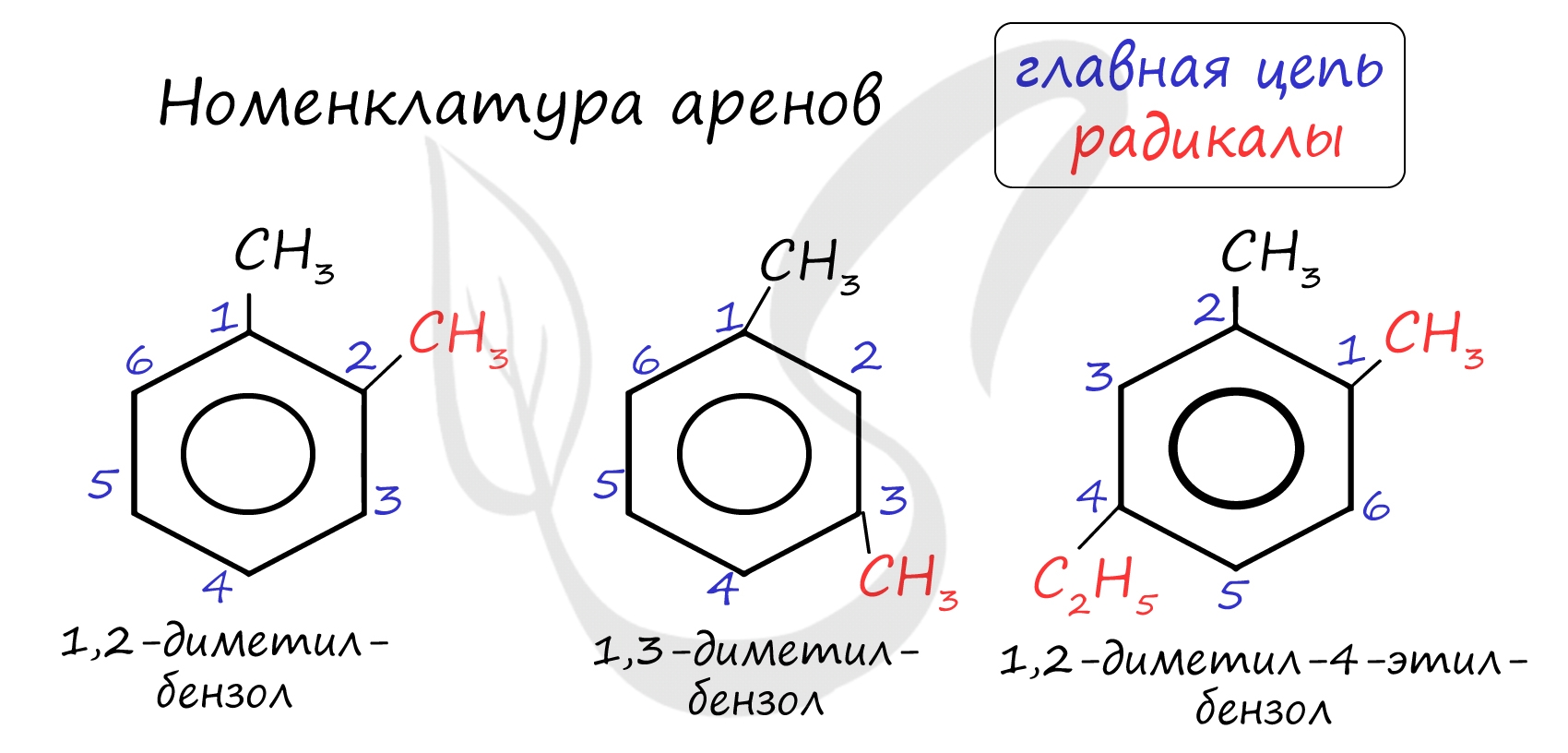
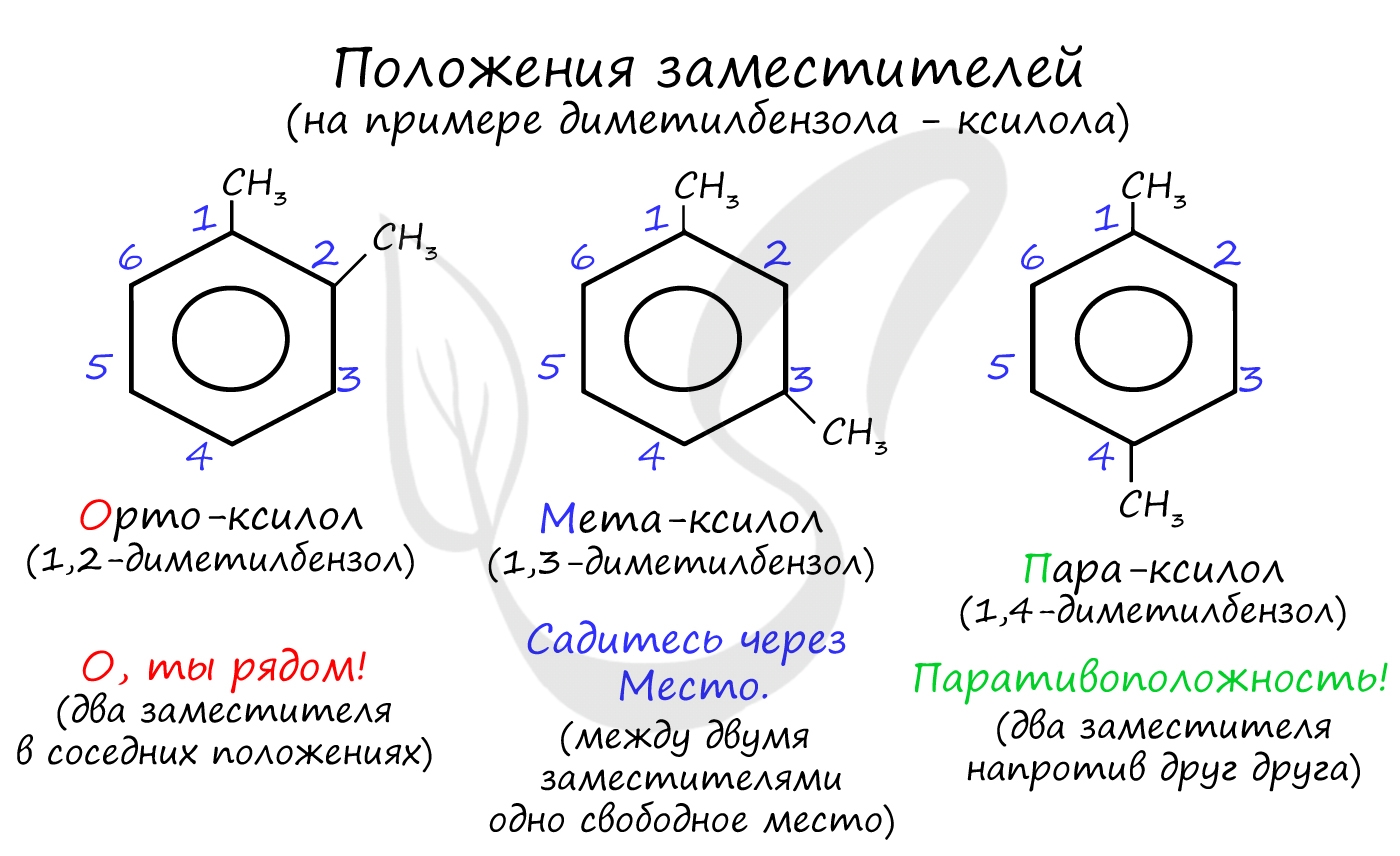
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
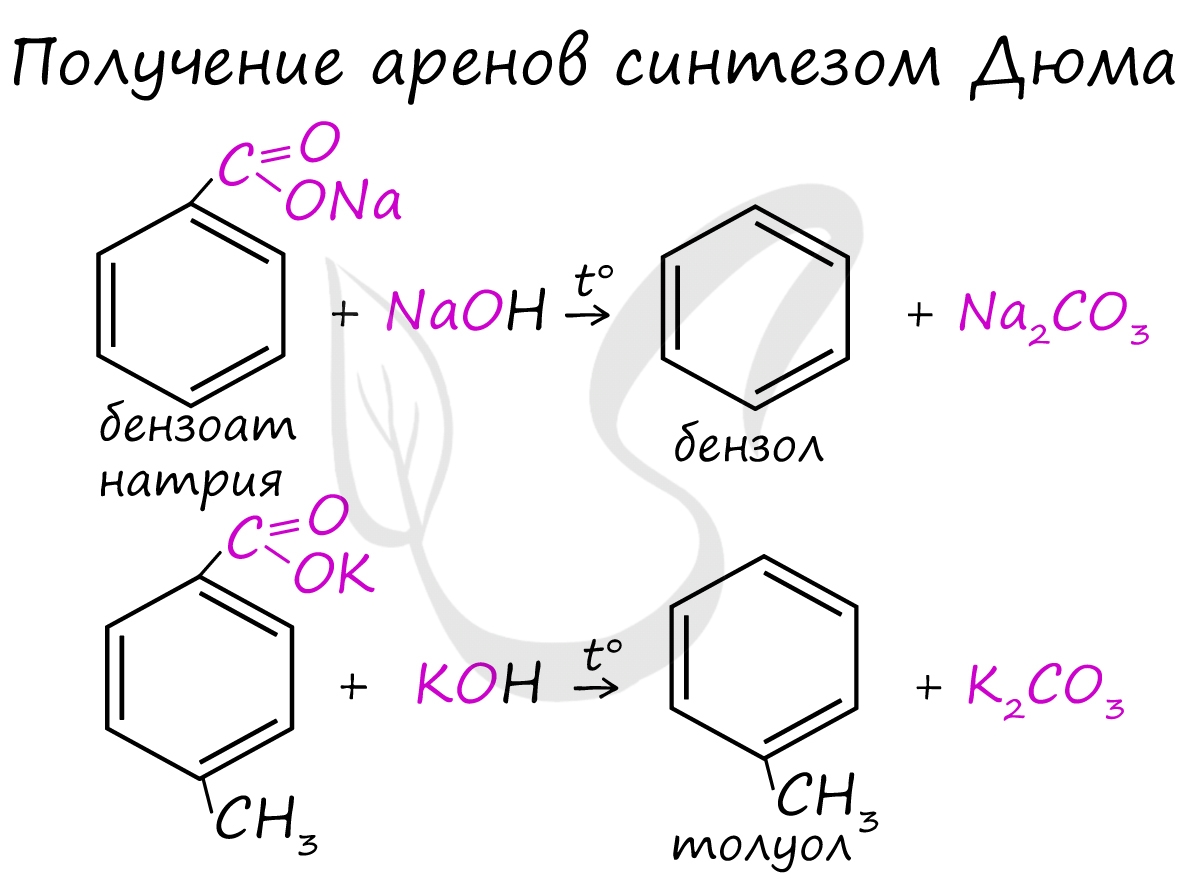
Получение аренов
-
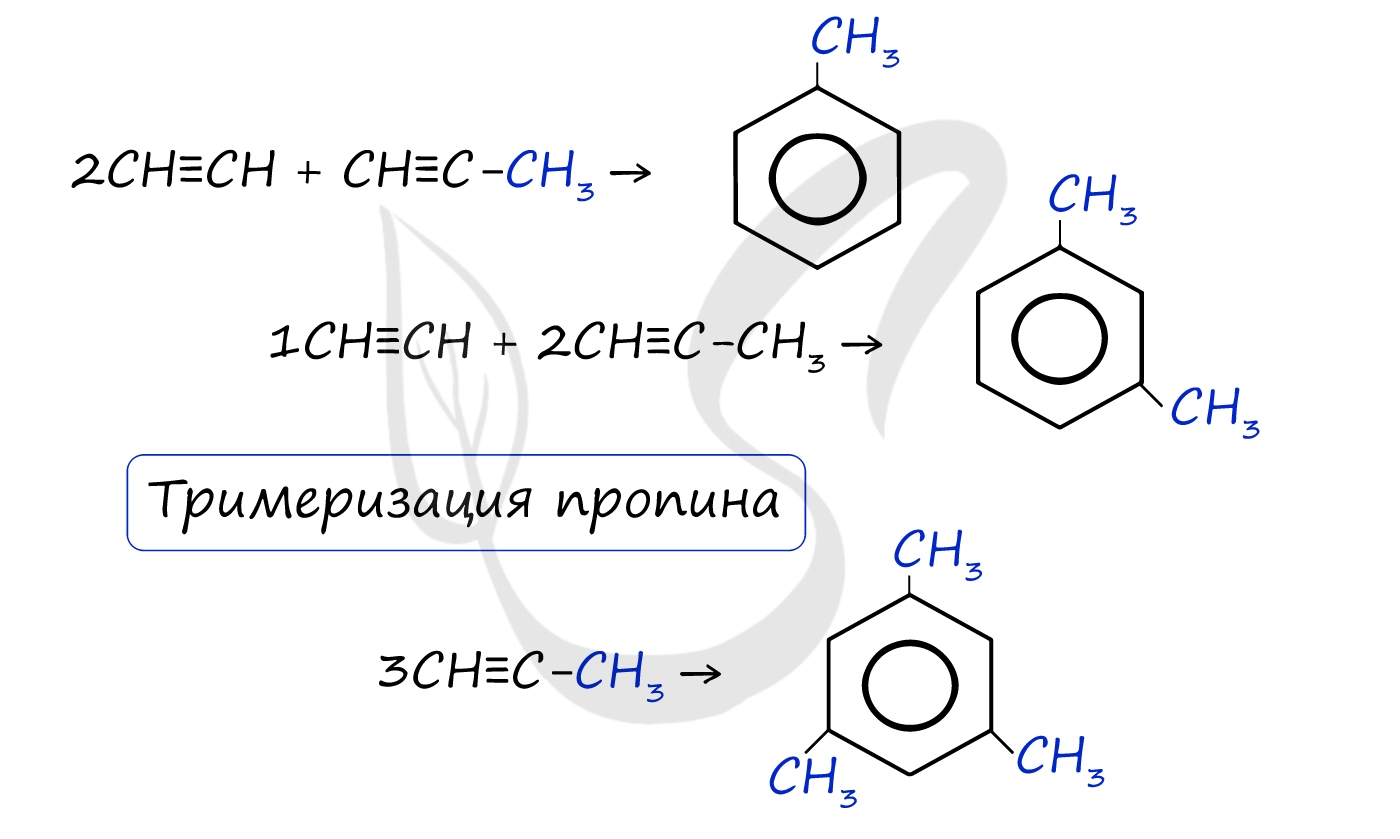
Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
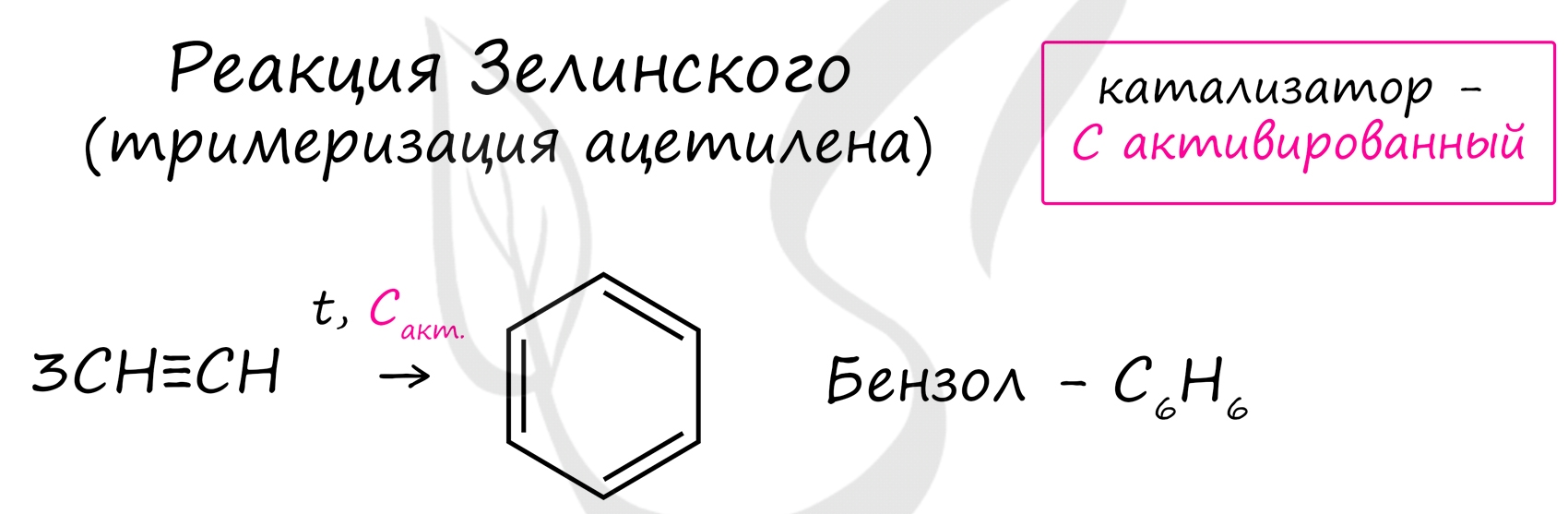
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
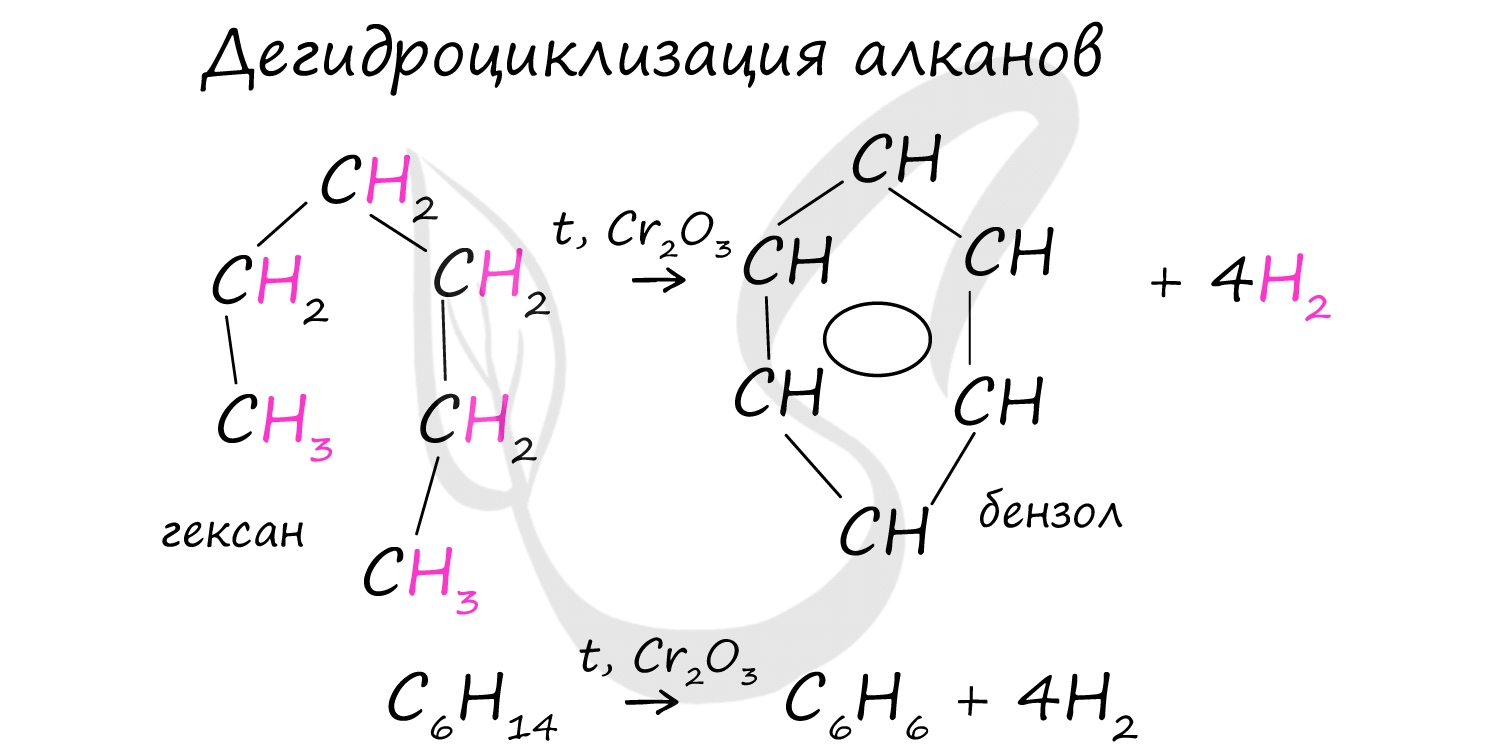
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
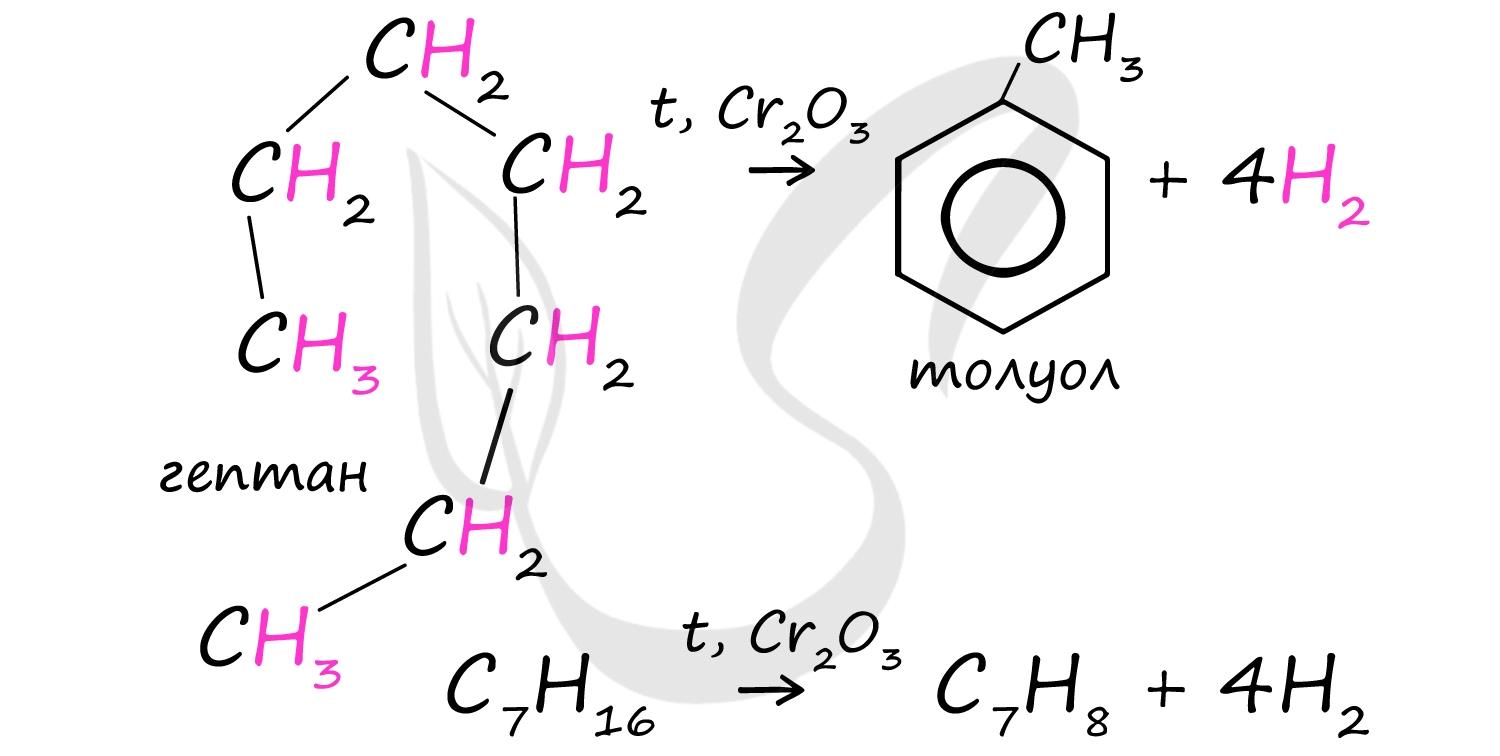
При дегидроциклизации гептана получается толуол.
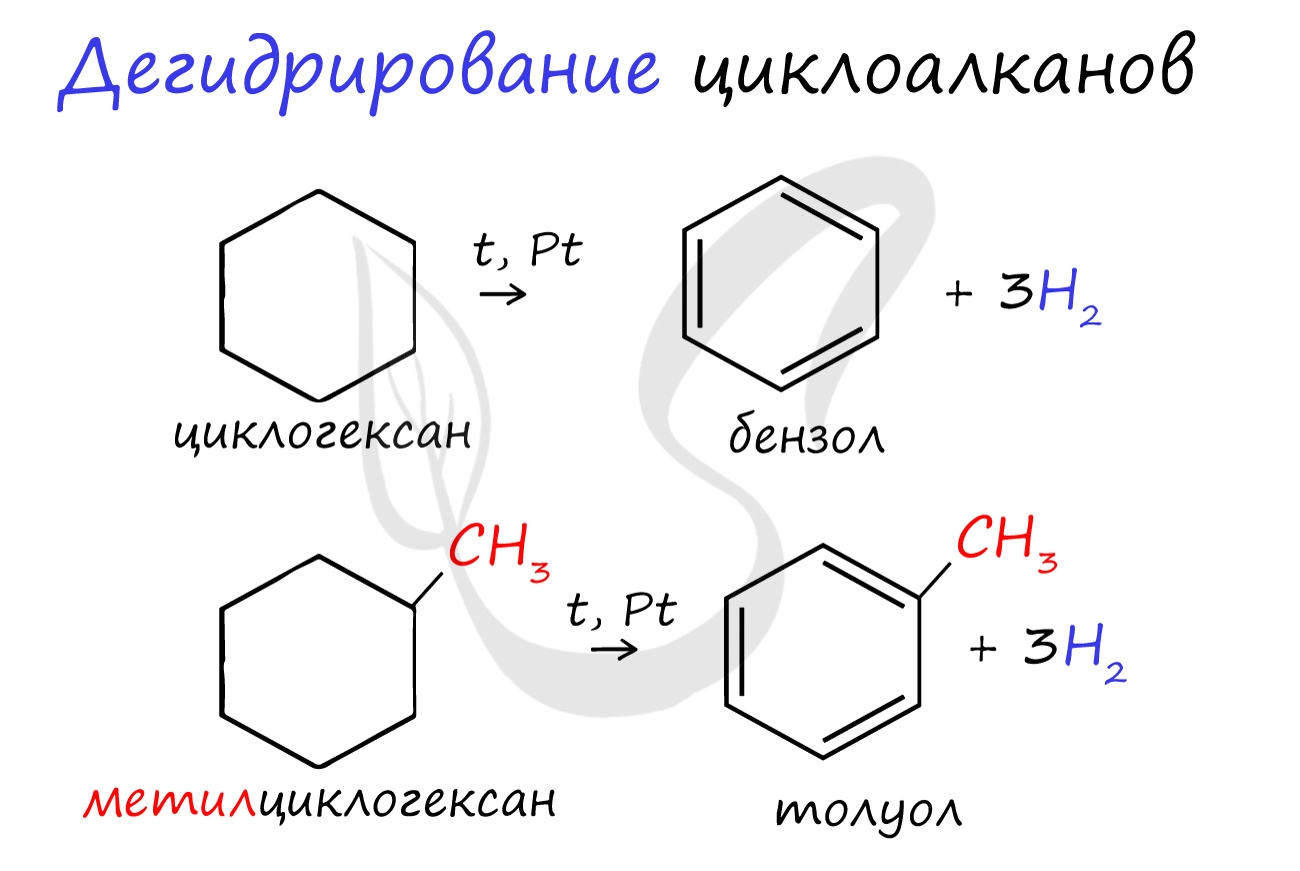
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
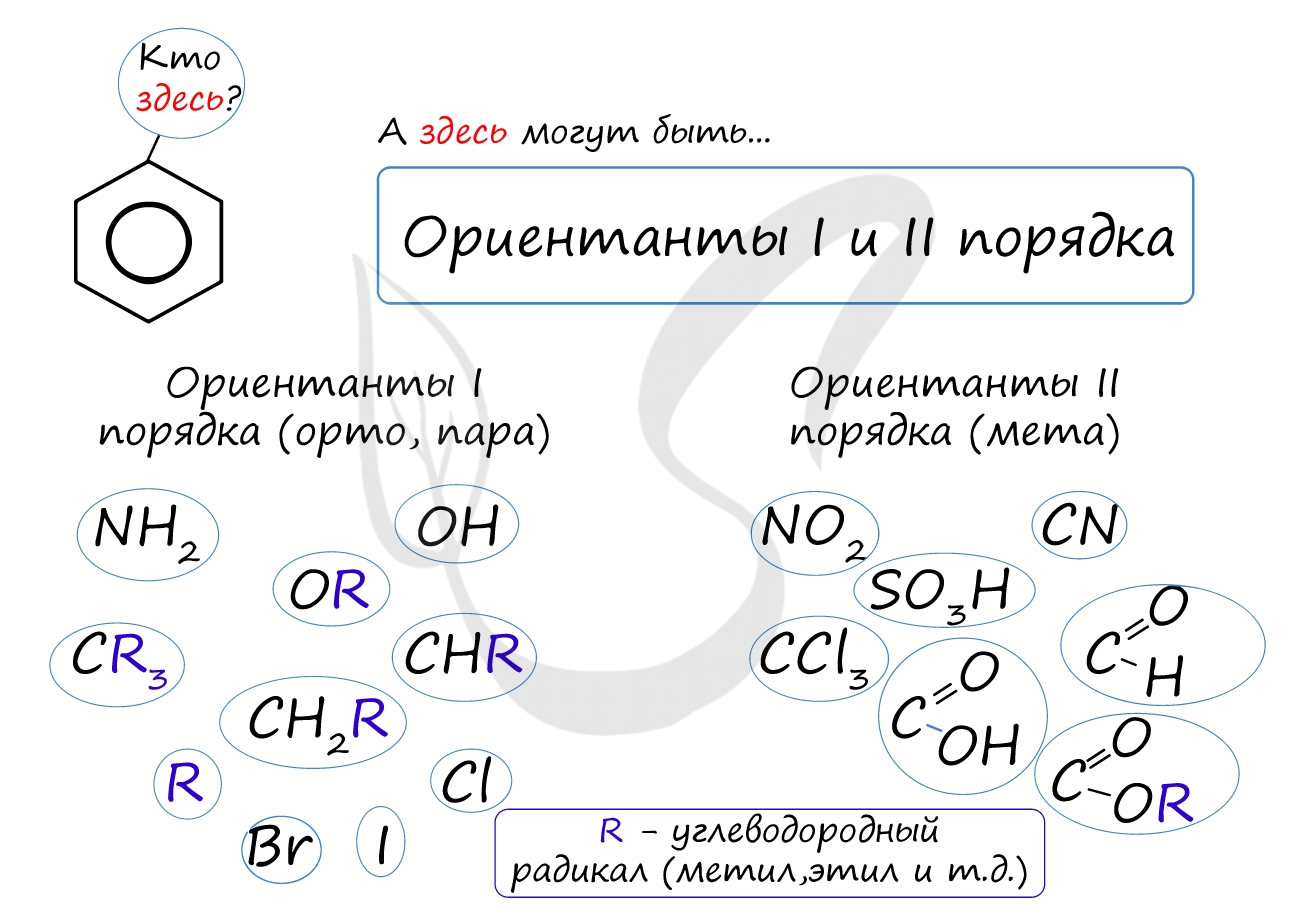
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
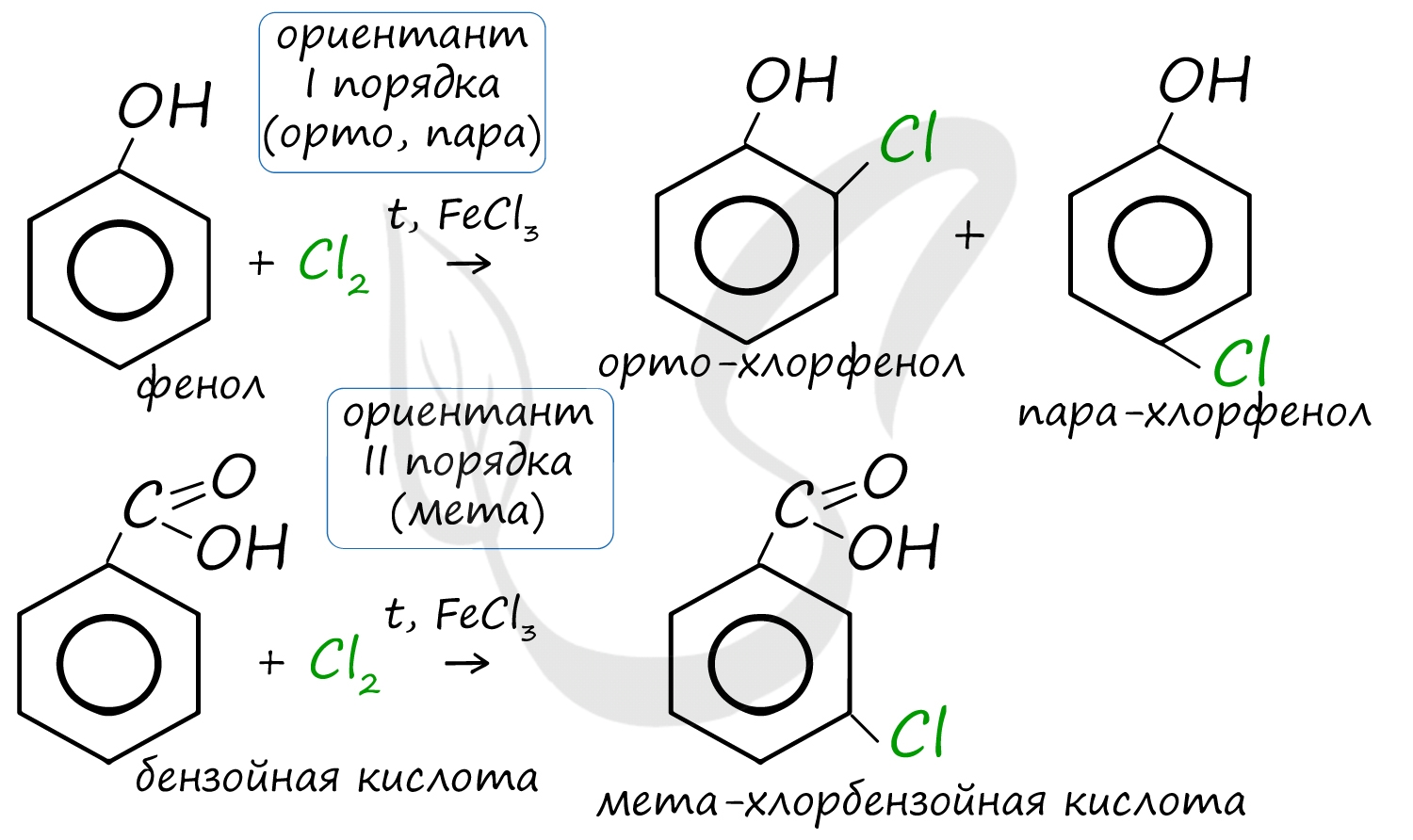
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
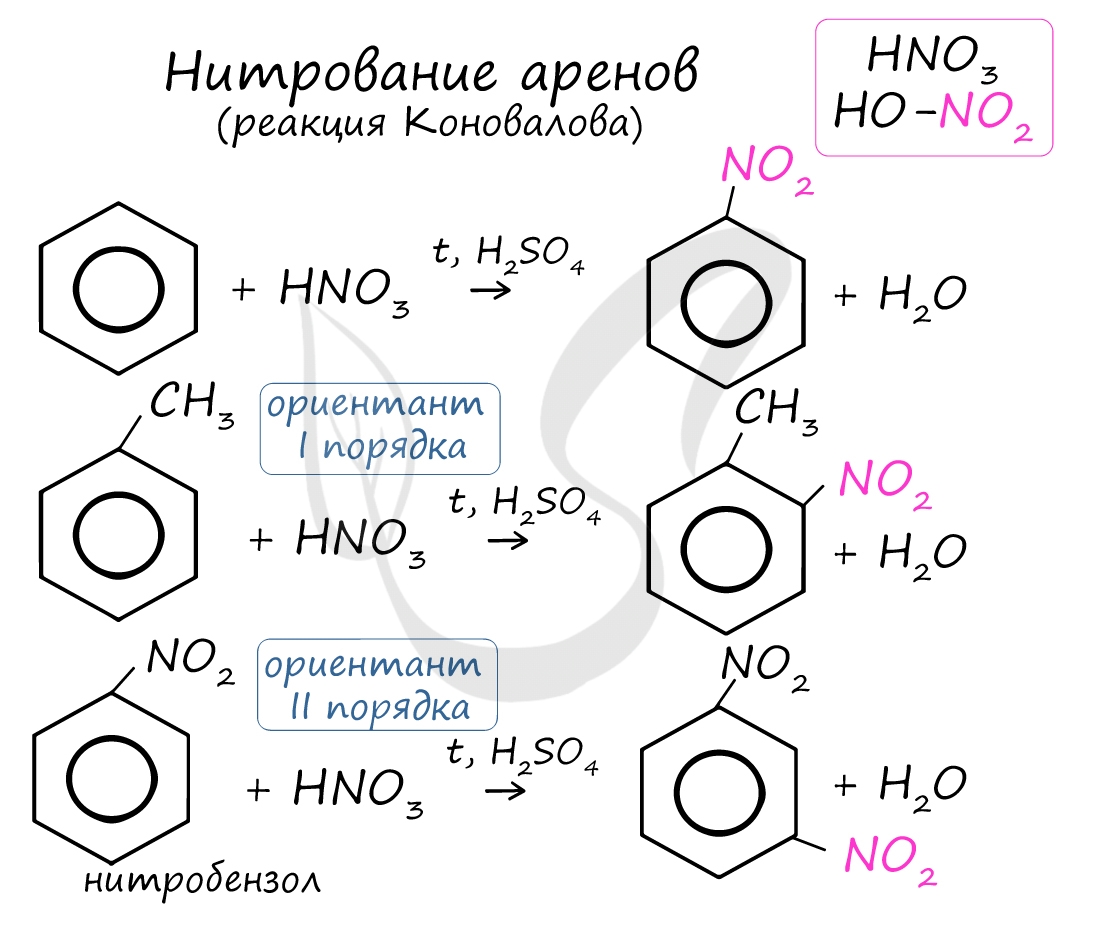
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола - C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,5 0 C;
температура кипения — 80 0 C;
общая плотность вещества — 0,879 г/см 3 ;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 25 0 C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
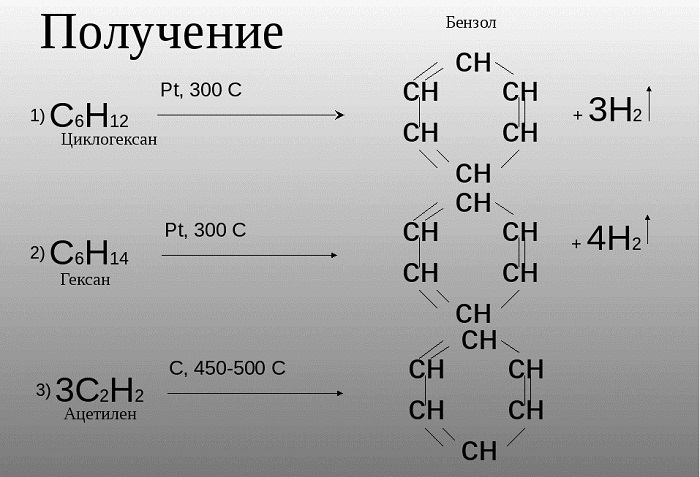
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
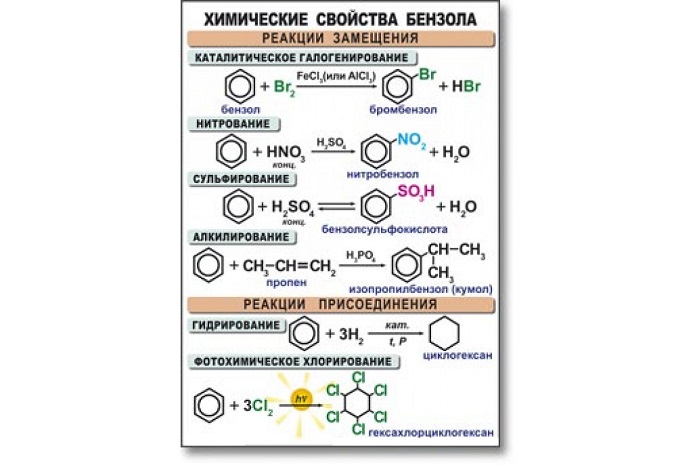
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.

Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
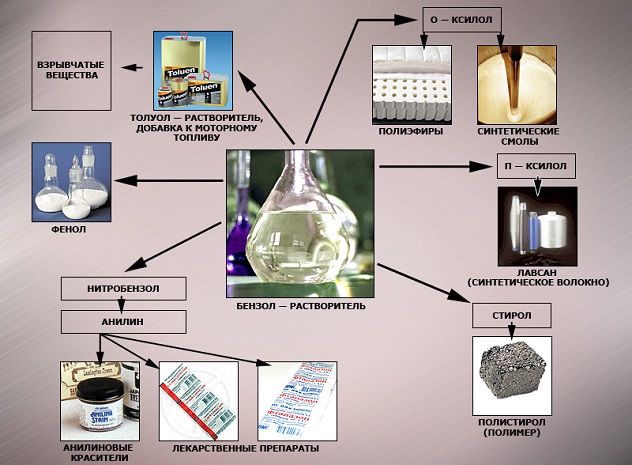
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Читайте также:


