Бактериологическое исследование консервов реферат
Обновлено: 07.07.2024
22.4. Санитарно-бактериологический контроль консервов
Консервирование – это процесс, применяемый для сохранения пищевого продукта. Он заключается в уничтожении микроорганизмов, способных развиваться в продукте и вызывать его порчу, и направлен на создание пищевых продуктов, длительно сохраняющих высокие питательные свойства и обеспечивающие безопасность здоровья потребителя. При производстве консервов большое значение придается санитарно-микробиологическому контролю качества. Консервы (полные) – это пищевые продукты, расфасованные и укупоренные в герметичную тару, подвергнутые тепловой обработке, обеспечивающей микробиологическую стабильность и безопасность продукта при хранении и реализации в обычных (вне холодильника) условиях. Полуконсервы – это пищевые продукты, укупоренные в герметичную тару, обработанные при температурном режиме, который обеспечивает гибель нетермостойкой вегетативной микрофлоры, уменьшение количества спорообразующих микроорганизмов и гарантирует микробиологическую стабильность и безопасность продукта в течение ограниченного срока годности при температуре 6 °С и ниже.
Все консервы в зависимости от величины активной кислотности продукта и содержания сухих веществ делят на 5 групп: А, Б, В, Г, Д, Е. Консервированные продукты групп А, Б, В, Г и Е относят к полным консервам, а группа Д – к полуконсервам.
Микробиологический контроль осуществляется на основании действующих нормативно-методических документов и включает: контроль санитарного состояния технологического оборудования, инвентаря, тары, персонала, контроль сырья, вспомогательных материалов, полуфабрикатов, консервируемых продуктов перед стерилизацией; контроль готовых консервов. Микробиологический контроль готовых консервов сводится к:
- • определению промышленной стерильности (отсутствие в консервированном продукте микроорганизмов, способных развиваться при температуре хранения, установленной для конкретного вида консервов, а также микроорганизмов и микробиальных токсинов, опасных для здоровья человека);
- установлению микробиологической стабильности (соответствие микробиологических показателей качества консервов требованиям, установленным нормативно-технической документацией на конкретный вид продукта);
- санитарно-эпидемиологическому анализу (при пищевых отравлениях) и выяснению причин возникновения дефектов консервов.
Отбор проб консервов и подготовка их к лабораторным исследованиям на соответствие требованиям безопасности по микробиологическим показателям проводится после осмотра и санитарной обработки; проверки герметичности; термостатирования консервов; определения внешнего вида консервов после термостатирования.
Перед исследованием на промышленную стерильность осматривают внешний вид, герметичность консервов и термостатируют невскрытые консервы (для обеспечения оптимальных условий жизнедеятельности мезофильных аэробных, факультативно анаэробных микроорганизмов (МАФАМ) – при 30–37 °С от 5 до 7 сут, а для проявления жизнедеятельности термофильных аэробных, факультативно аэробных и анаэробных – при 55–62 °С не менее 3 сут. Перед анализом пастеризованных газированных фруктовых соков и напитков необходимое количество продукта отбирают в стерильную колбу с ватной пробкой, помещают в водяную баню с температурой 30–35 °С и, встряхивая колбу, освобождают продукт от двуокиси углерода и нейтрализуют до рН 7,0±0,3. После этого банки вскрывают и делают посев на питательные среды для выявления и идентификации микроорганизмов, предусмотренных нормативным документом. Если такие требования отсутствуют, определяют следующие микроорганизмы:
- в консервах группы А, предназначенных к реализации при температуре ниже 40 °С, – мезофильные аэробные, факультативно-анаэробные микроорганизмы, к реализации при температуре 40 °С и выше дополнительно выявляют термофильные аэробные и анаэробные микроорганизмы, выделяя среди них кислотообразующие бациллы;
- в консервах групп Б и В выявляют мезофильные анаэробные микроорганизмы, плесневые грибы, дрожжи и молочнокислые бактерии;
- в консервах группы Г – плесневые грибы, дрожжи и молочнокислые микроорганизмы, а в концентрированных плодово-ягодных консервах (соках концентрированных, варенье, джеме, повидле, конфитюре и др.) – плесневые грибы и дрожжи;
- в консервах группы Е – МАФАМ; бактерии группы кишечных палочек (колиформные бактерии); плесневые грибы, дрожжи и молочнокислые микроорганизмы.
Консервы не подлежат оценке на промышленную стерильность, если:
- обнаружена негерметичность швов или укупорки тары; после термостатирования и охлаждения консервов до комнатной температуры обнаружены дефектные банки;
- при микроскопировании консервированного продукта, выработанного из продуктов, приготовленных без использования микробных культур, обнаружено большое число микроорганизмов (свыше 10 клеток в поле зрения); pH консервированного продукта меньше на 0,5 и более допустимого значения, указанного в нормативном документе на конкретный вид консервов.
Оценку результатов исследования проводят по каждой упаковочной единице консервов отдельно; если в нормативном документе на определенные виды консервов не приведены требования к видовому составу и(или) количеству обнаруженных микроорганизмов, то при оценке промышленной стерильности руководствуются следующими указаниями.
Для групп А и Б допускается в нормальных по внешнему виду консервах присутствие только бацилл группы B.subtilis. Их количество не должно превышать 11 клеток в 1 г (1 см3) продукта. Количество мезофильных клостридий, исключая C.botulinum и(или) С.perfringens, не должно превышать одной клетки в 1 г (см 3 ) продукта. При обнаружении термофильных микроорганизмов консервы должны храниться при температуре не выше 20 °С.
В консервах детского и диетического питания наличие мезофильных клостридий и термофильных микроорганизмов не допускается. В продуктах этой группы недопустимо наличие неспорообразующих бактерий, и(или) кокков, и(или) дрожжей, и(или) плесневых грибов в чистой культуре или в смеси со спорообразующими видами.
Для группы В: из мезофильных аэробных и факультативно-анаэробных бацилл в консервах допускается присутствие негазообразующих видов, не более 90 КОЕ в 1 г (1 см 3 ) продукта. Наличие мезофильных клостридий, неспорообразующих бактерий, кокков, дрожжей, плесневых грибов оценивается, как для групп А и Б.
Для группы Г: наличие неспорообразующих бактерий, кокков, дрожжей, плесневых грибов в чистой культуре или в смеси со спорообразующими видами микроорганизмов не допускается.
Для группы Е: микробиологические показатели, их характеристики и нормы устанавливаются в нормативных документах на конкретные продукты.
Выявление бактерий группы кишечных палочек (колиформных бактерий) в пастеризованных газированных фруктовых соках и напитках. Подготовленный продукт для выявления колиформных бактерий высевают в количестве трех объемов по 100 см 3 , трех объемов по 10 см 3 и трех объемов по 1 см 3 . Каждый объем по 100 и 10 см 3 высевают соответственно в такое же количество одной из питательных сред двойной концентрации, а каждый объем по 1 см 3 – в 10 см 3 среды нормальной концентрации.
Объемы продукта 100 и 10 см 3 можно высевать соответственно в 10 и 1 см 3 концентрированной лактозопептонной среды, а 1 см 3 – в 10 см 3 лактозопептонной среды нормальной концентрации.
Термостатирование посевов, пересевы на среду Эндо для выделения чистой культуры, подтверждение принадлежности выросших микроорганизмов к колиформным бактериям представлены выше.
Дефекты консервов. Дефектами консервированного продукта считают:
а) присутствия аэробных и анаэробных микроорганизмов;
б) наличия термофильных микробов - возбудителей плоскокислой порчи;
в) присутствия ботулинических токсинов;
г) наличия возбудителей ботулизма.
1. Обнаружение в стерилизованных консервах непатогенных спорообразующих аэробов типа subtilis-mesenteгiсus при отсутствии явлений бомбажа и при нормальных органолептических свойствах консервов не служит препятствием к выпуску их с завода, хранению и употреблению в пищу.
3. При обнаружении в консервах при исследовании облигатных спорообразующих анаэробов посевы культур направляются на идентификацию в местные санэпидстанции, кустовые или научно-исследовательские лаборатории. Выявление при дополнительных исследованиях бациллы ботулизма или токсигенных штаммов Clostridium perfringens свидетельствует о непригодности данной партии консервов для употребления в пищу. Заключение об этом выдается органами Государственного санитарного надзора - санэпидстанциями и министерствами здравоохранения республик.
4. Выявление в консервах аэробных и анаэробных микроорганизмов, а также возбудителей плоскокислой порчи осуществляется старшим микробиологом завода, который и несет ответственность за правильность и своевременность выполнения анализов.
5. Готовая продукция, содержащая возбудителей плоскокислой порчи, должна храниться при температуре не выше 15 °С. При сохранении нормальных органолептических свойств она может быть реализована для питания с обязательным указанием в документе необходимости хранения при температуре от 0 до 15 °С не более 3 месяцев. По истечении этого срока порядок реализации партии консервов определяется органами Госсаннадзора.
Бактериологическое исследование готовых баночных консервов
Подготовка к исследованию
Бактериологический анализ готовой продукции (консервов после стерилизации), как уже указывалось, производят:
а) для партий консервов, у которых была обнаружена повышенная бактериальная обсемененность перед стерилизацией;
б) для партий консервов, при изготовлении которых были допущены отступления от технологической инструкции или стерилизация осуществлялась в автоклавах, не имеющих терморегистрирующих приборов.
Если на отдельных аппаратах технологической линии изменяются условия работы или наблюдается отклонение в показаниях контрольно-измерительных приборов, то от таких автоклавоварок следует отбирать на анализ отдельно по одной банке на каждые 500 банок сменной выработки.
Проверка на герметичность осуществляется либо в сосудах с водой, нагретой почти до кипения, либо в аппаратах Бомбаго или Жадана. Аппарат Жадана рекомендован для арбитражной проверки герметичности консервных банок с продуктом. В этом аппарате проверяемая на герметичность банка помещается в специальную герметически закрывающуюся камеру. С помощью воздушного насоса в камере создается избыточное давление 1 ат (98,1-103 н/м2). Если банка негерметична, то нагнетаемый насосом воздух, проникая в консервную банку через неплотности, вызывает вспучивание крышки. При этом крышка касается клеммы электрического звонка или сигнальной лампочки. Звуковой или световой сигнал служит признаком негерметичности банки.
Аппарат Бомбаго состоит из двух частей: стеклянного резервуара, герметически закрывающегося крышкой с резиновой прокладкой, и поршневого насоса. Предназначенные для испытания банки хорошо протирают тряпочкой, смоченной бензином. Особенно тщательно следует протирать продольные швы и фальцы жестяных банок и укупорочный шов у крышек стеклянных банок. В стеклянный резервуар аппарата наливают свежепрокипяченную в течение 15 мин и охлажденную до 40-45 °С воду с таким расчетом, чтобы погруженные в нее банки были полностью покрыты водой (помещают обычно три банки). Резервуар герметически закрывают крышкой. Через специальный кран, расположенный на крышке и соединенный с насосом, из резервуара начинают отсасывать воздух. Разрежение в резервуаре определяется по вакуумметру, также установленному на крышке резервуара. Оно должно составлять 500 мм рт. ст. (66,5-103 н/м2). Состояние герметичности устанавливают по количеству и месту выделения пузырьков воздуха из банки. Негерметичной считается банка, в которой из одного и того же места выходит струйка пузырьков или периодически несколько пузырьков. При определении герметичности банок в аппарате Бомбаго пользоваться некипяченой водой нельзя, так как в этом случае при удалении из резервуара воздуха консервные банки покрываются большим количеством пузырьков воздуха, которые, отрываясь от разных мест банок, могут создать неверное впечатление о их герметичности.
Наиболее просто (хотя и менее точно) герметичность банок устанавливают помещая их в сосуд с горячей водой (например, в эмалированную кастрюлю). Температуру воды во время испытания поддерживают на уровне 85-80 °С. Через 5-7 мин при условии негерметичности банки через неплотности начинают выделяться пузырьки воздуха. В данном случае банка должна быть погружена в воду так, чтобы слой воды над ней был не меньше 25-30 мм. Доводить воду до кипения во время испытания нельзя, так как образующиеся пузырьки пара при кипении воды не дадут возможности установить, выделяются из банки с продуктом пузырьки или нет. Банки с нарушенной герметичностью также не подлежат микробиологическому исследованию. Анализируется содержимое только герметически укупоренных банок. После установления герметичности отобранные для исследования банки с консервами подвергаются термостатированию.
Термостатирование банок с готовой продукцией перед бактериологическим анализом осуществляется для выявления остаточной микрофлоры консервов. Проверенные на герметичность и тщательно вытертые насухо банки помещают в термостат. Для выявления аэробных и анаэробных мезофильных микроорганизмов банки выдерживают в термостате при температуре 37 °С в течение 5 суток. Для выявления термофильных микроорганизмов банки с консервами нужно выдерживать непосредственно перед посевом в термостате с температурой 55 °С в течение 2 суток.
Если при термостатировании возникает вздутие крышки или донышка, не опадающее при нажиме пальцами, либо передающееся на противоположную сторону (в жестяных банках), либо снова восстанавливающееся после нажима, банку необходимо охладить. Если вздутие не опадает и после охлаждения, банка считается бомбажной. Бомбажные банки подвергаются анализу только в исключительных случаях.
При возвращении крышек и донышек банок после охлаждения в нормальное состояние содержимое банок анализируют. Вздутие крышки и донышка в этом случае может быть объяснено некоторым расширением продукта, нагревающегося в процессе термостатирования.
Подготовка помещения для анализа готовой продукции
Бактериологическое исследование готовых консервов производится в боксах. Мероприятия по созданию в боксе стерильных условий (стерилизация воздуха, дезинфекция помещения), подготовка рабочего места для проведения анализа описаны в начале второй части настоящей книги. Дополнительно на столе в боксе следует поставить консервную банку с водой, в которую в дальнейшем после стерилизации крышек банок и окончания посева сбрасываются горящие ватные тампоны и кольца.
Вскрытие банок и отбор проб для анализа
После термостатной выдержки банки с консервами ставят на стол в боксе по порядку их записи в журнале анализов. Крышки консервных банок перед вскрытием тщательно протирают ватой, смоченной спиртом. Подготовленные стерильные ватные тампоны и кольца хорошо смачивают спиртом, поместив их в чашки Петри.
Из подготовленных ватных тампонов пинцетом берут один, отжимают излишек спирта и проносят над пламенем горелки. Загоревшимся ватным тампоном обжигают крышку банки. После стерилизации тампон сбрасывают в банку с водой.
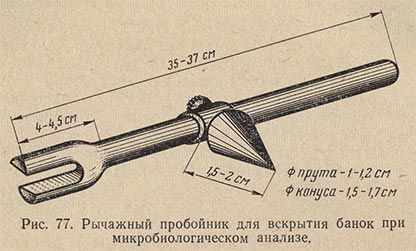
Так как при вскрытии консервов вследствие наличия в банках вакуума внутрь банок засасывается воздух, а вместе с ним могут попасть и микроорганизмы, то на подготовленную крышку банки нужно наложить пинцетом горящее ватное кольцо. Затем вилку предварительно обожженного пробойника подводят под опорное кольцо на штативе и сквозь пламя внутри горящего кольца острием пробойника прокалывают отверстие в крышке банки (рис. 77 и 78).

Не отнимая пробойника, отверстие в крышке осторожно расширяют до 1-1,5 см в диаметре. После вскрытия банки пробойник убирают и тотчас же производят посев содержимого банки в соответствующую питательную среду. Вначале, перед посевом, из связанных вместе и одновременно простерилизованных трубок берут одну и проверяют ее стерильность. Для этого трубку промывают стерильным мясопептонным бульоном путем 2-3-кратного засасывания его из пробирки. После промывания трубки пробирка с бульоном выдерживается в термостате вместе с другими посевами из банки; эта пробирка и служит контролем на стерильность трубок. Наличие роста микроорганизмов в контрольной пробирке ставит под сомнение все другие посевы, так как остальные трубки из этой пачки не проверяются.
Взятие пробы консервов для посева при помощи стеклянной трубки производится почти в пламени горящего кольца; при этом горячий воздух поднимается вверх, чем предотвращается возможность попадания из воздуха какой-либо инфекции. В каждой отобранной пробе для посева должно быть некоторое количество жидкой части консервов (бульона, заливки и пр.) и твердых его частей (кусочки мяса, фарша и т.д.). Перед вскрытием следующей банки пробойник тщательно протирается ватой, смоченной спиртом, и для стерилизации обжигается в пламени горелки. Если пробойник в течение анализа сильно загрязняется содержимым банки, его следует периодически промывать горячей водой и насухо вытирать чистым полотенцем. После посева банки выносят из бокса, вскрывают обычным консервным ножом и содержимое исследуют органолептически.
Выявление в готовых консервах аэробных микроорганизмов
Для выявления в консервах аэробных микроорганизмов в качестве питательной среды для посева содержимого банок применяют разведенный мясопептонный бульон (pH 7,0-7,2). Для посева рыбных консервов применяют мясопептонный или рыбный бульон (pH 7,0-7,2). Из каждой банки засевают, две пробирки. Засеянные пробирки выдерживают в термостате при 37 °С 5 суток, ежедневно наблюдая за ростом микроорганизмов (образование пленки, помутнение бульона, выделение газов и пр.).
При появлении явного роста микроорганизмов содержимое засеянных пробирок исследуют под микроскопом в мазках, окрашенных по Граму, и в отдельных случаях по истечении 5 суток проводят каталазную реакцию. В журнале анализов отмечают наличие или отсутствие роста, внешние признаки роста и характеристику выявленных микроорганизмов (палочки, кокки, спорообразование, отношение к окраске по Граму и каталазной реакции).
При посеве некоторых консервов (например, содержащих много жира, мясных паштетов и др.) наблюдается, что внешние признаки роста выражены неясно. В этих случаях из сомнительных пробирок делают посев на скошенный агар. Через сутки выращивания посева на скошенном агаре при 37 °С окончательно устанавливают рост микробов. При наличии роста анализ заканчивают, как описано выше.
В случае, если в банке окажется выявленной неспорообразующая микрофлора, необходимо провести повторный анализ, отобрав от этой же автоклавоварки повторную среднюю пробу.
Каталазная реакция
При посевах рыбных и овощных закусочных консервов на поверхности жидкой среды нередко в пробирках образуется пристенное кольцо, напоминающее бактериальную пленку. Кроме того, в посевах образуется муть, напоминающая бактериальный рост. Для быстрого установления природы этой пленки или мути проводят каталазную реакцию (пробу с перекисью водорода).
На предметное стекло, предварительно профламбированное и охлажденное, или в стерильную пробирку переносят небольшое количество содержимого из исследуемой пробирки, предварительно охлажденной до комнатной температуры. Добавляют 1-2 капли 3-4%-ной перекиси водорода. При наличии аэробных микроорганизмов происходит выделение молекулярного кислорода в виде мелких пузырьков.
У облигатных анаэробов фермент каталаза отсутствует, поэтому реакция с перекисью водорода пригодна только для выявления аэробных микроорганизмов.
Выявление в готовых консервах анаэробных микроорганизмов
Для выявления анаэробных микроорганизмов посев производится в две пробирки со средой Китта-Тароцци с добавлением 0,15% агара. Непосредственно перед посевом агаризованную (полужидкую) среду Тароцци прогревают 25 мин в кипящей водяной бане и затем быстро охлаждают до температуры 30-40 °С. Засеянные пробирки помещают в термостат при 37 °С на 5 суток и ежедневно наблюдают за появлением роста микроорганизмов.
В дальнейшем клетки анаэробных микробов начинают лизироваться (растворяться), муть в среде постепенно исчезает, культура остается на дне в виде небольшого осадка. В мазках из такого осадка присутствуют палочки с субтерминальными или терминальными спорами в виде ракеток, окрашивающиеся по Граму отрицательно. Количество палочек-ракеток может быть очень невелико.
Дальнейшего исследования заводская лаборатория не производит. Для обнаружения культуры Clostridium botulinum пробирку с анаэробной культурой запаивают и направляют для исследования в санитарно-эпидемиологическую, кустовую или научно-исследовательскую лабораторию.
Выявление в консервах спор аэробных термофилов - возбудителей плоскокислой порчи
Консервы, подлежащие исследованию на выявление возбудителей плоскокислой порчи, перед анализом выдерживают в термостате при температуре 55 °С в течение 2 суток. Банки обрабатывают и вскрывают, как описано выше. Затем из банки в четыре стерильные пробирки отбирают по 5-6 мл продукта. В две пробирки асептически добавляют стерильный раствор индикатора - 0,04%-ный водный раствор бромкрезолпурпура в следующих количествах: в консервы с заливкой (зеленый горошек, сахарная кукуруза) - по 0,1-0,15 мл, в пюреобразные продукты - по 0,2 мл.
Для получения равномерного окрашивания консервы с заливкой легко взбалтывают, а пюреобразные консервы перемешивают стерильной стеклянной палочкой. Если содержимое пробирок после добавления бромкрезолпурпура окрасилось в желтый цвет, то необходимо приготовить из него мазки, окрасить и промикроскопировать. Наличие в мазках бациллярных форм микробов и изменение цвета продукта при добавлении индикатора свидетельствуют о присутствии в консервах спор аэробных термофилов - возбудителей плоскокислой порчи.
Если содержимое пробирок не окрасилось в желтый цвет после добавления индикатора, то из оставшихся двух пробирок (в которые индикатор добавлен не был) производят посев 1-2 мл консервов в чашки Петри, заливают посев мясопептонным агаром с добавлением 1% глюкозы и 0,004% бромкрезолпурпура и инкубируют при температуре 55 °С в течение 2 суток. Рост кислотообразующих термофильных микроорганизмов обусловит изменение окраски среды вокруг колонии от фиолетовой до желтой.
Исследование консервов на присутствие стафилококка
Рыбные консервы в масле (треска, шпроты и пр.) являются благоприятной средой для сохранения и размножения стафилококков и образования ими токсина. На консервных заводах, вырабатывающих рыбные консервы в масле, при низком санитарном уровне производства обсемененность стафилококком оборудования и пищевых продуктов возрастает, поэтому возникает необходимость исследования этих консервов на присутствие стафилококка.
Для выявления стафилококков небольшое количество консервов (1 г) высевается в мясопептонный бульон, содержащий 1% глюкозы и 6-7% поваренной соли. Поваренная соль добавляется к бульону для подавления развития сопутствующей стафилококку микрофлоры.
После термостатирования посевов в течение 2 суток при 37 °С и помутнения бульона из проросших пробирок делают мазки и определяют форму микробов. При наличии в мазках стафилококка производят пересев на скошенный агар и полученную культуру направляют для дальнейшего исследования на санитарно-эпидемиологическую станцию.
Вы можете изучить и скачать доклад-презентацию на тему Бактериологическое исследование мясных консервов. Презентация на заданную тему содержит 30 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!




























Консервы — пищевые продукты, предназначенные для длительного хранения, специально обработанные и герметично упакованные в тару, которая защищает их от проникновения микроорганизмов во время хранения и транспортировки. Консервы — пищевые продукты, предназначенные для длительного хранения, специально обработанные и герметично упакованные в тару, которая защищает их от проникновения микроорганизмов во время хранения и транспортировки.
все консервы в зависимости от состава сырья, термической обработки и величины рН подразделяют на 6 групп все консервы в зависимости от состава сырья, термической обработки и величины рН подразделяют на 6 групп Группа А — полные консервы (говядина, свинина, конина, мясо птицы с растительными наполнителями или без них), простерилизованные в автоклавах при температуре +110. +120°С, со сроком хранения от 9 месяцев до 2 лет при температуре не выше + 30°С.
Группы Б, В, Г, Е — растительные консервы (овощи, фрукты, плодово-ягодные компоты, соки). Группы Б, В, Г, Е — растительные консервы (овощи, фрукты, плодово-ягодные компоты, соки).
Группа Д — полуконсервы (ветчина, бекон, сосиски), стерилизованные при температуре +100.. .+110°С. Их безопасность и сохранность гарантируются при хранении при температуре +2. +15°С. Группа Д — полуконсервы (ветчина, бекон, сосиски), стерилизованные при температуре +100.. .+110°С. Их безопасность и сохранность гарантируются при хранении при температуре +2. +15°С.
От партии отбираются три единицы потребительской тары для продукции вместимостью до 1 л включительно и одна единица, если вместимость больше 1 л. От партии отбираются три единицы потребительской тары для продукции вместимостью до 1 л включительно и одна единица, если вместимость больше 1 л.
Пробоины Пробоины подтеки или следы продукта, вытекающего из банки бомбаж — вздутие консервной банки.
Банки моют теплой водой и вытирают. Затем крышку банки протирают смоченным в спирте тампоном, фламбируют и вскрывают консервным ножом. Банки моют теплой водой и вытирают. Затем крышку банки протирают смоченным в спирте тампоном, фламбируют и вскрывают консервным ножом.
Проводят органолептическое исследование: определяют внешний вид, цвет, запах и состояние содержимого. Проводят органолептическое исследование: определяют внешний вид, цвет, запах и состояние содержимого.
В консервированном продукте промышленной стерильности допускается наличие только ограниченного числа видов спорообразующих микроорганизмов. В консервированном продукте промышленной стерильности допускается наличие только ограниченного числа видов спорообразующих микроорганизмов. В нем должны отсутствовать микроорганизмы и токсины микробного происхождения, опасные для здоровья людей, а также микроорганизмы, способные развиваться и вызывать порчу продукта при температуре хранения, установленной для данного вида консервов.
Из пробы готовят исходное и ряд 10-кратных разведений. Из каждого разведения по 1 мл вносят в две чашки Петри, заливают МПА, термостатируют 24 ч при температуре +37°С, подсчитывают среднее арифметическое количество колоний. Из пробы готовят исходное и ряд 10-кратных разведений. Из каждого разведения по 1 мл вносят в две чашки Петри, заливают МПА, термостатируют 24 ч при температуре +37°С, подсчитывают среднее арифметическое количество колоний. Расчет ведут но формуле: где а — количество колоний на поверхности среды в чашке; n — степень разведения продукта при приготовлении разведений; Vвод — объем воды, использованный для приготовления пробы; Vпр — объем продукта, использованного для приготовления пробы; q — объем посевного материала, внесенного в чашку Петри.
При анализе сливов с продукта расчет ведут по формуле: (2) Из параллельных посевов определяют среднеарифметическое число колоний на чашках, умножают его на соответствующее разведение и находят количество микроорганизмов в 1 мл или 1 г продукта по формуле (1). При анализе сливов с продукта расчет ведут по формуле (2). После подсчета колоний определяют родовую и видовую принадлежность выделенного микроба.
Проводят посев по 1 г натурального продукта и по 1 мл из разведений 1:10, 1:100 в среду Кесслера. Посевы культивируют 24 ч в термостате при температуре +37°С, предварительный учет проводят через 24 ч, окончательный — через 48 ч. При отсутствии признаков роста делают заключение об отсутствии БГКП в исследуемом продукте. Проводят посев по 1 г натурального продукта и по 1 мл из разведений 1:10, 1:100 в среду Кесслера. Посевы культивируют 24 ч в термостате при температуре +37°С, предварительный учет проводят через 24 ч, окончательный — через 48 ч. При отсутствии признаков роста делают заключение об отсутствии БГКП в исследуемом продукте.
Для подтверждения делают высев 0,1 мл культуральной жидкости на одну из дифференциально-диагностических сред — агар Эндо или агар Смирнова (характерно появление желтых колоний). Посевы инкубируют в термостате при температуре +37°С в течение 24 ч. Для подтверждения делают высев 0,1 мл культуральной жидкости на одну из дифференциально-диагностических сред — агар Эндо или агар Смирнова (характерно появление желтых колоний). Посевы инкубируют в термостате при температуре +37°С в течение 24 ч.
Из изолированных колоний делают препараты, окрашивают по Граму, Из изолированных колоний делают препараты, окрашивают по Граму,
1. Предварительное обогащение — выдерживание пробы в термостате в жидкой неселективной среде (МПБ) при температуре +37°С; 1. Предварительное обогащение — выдерживание пробы в термостате в жидкой неселективной среде (МПБ) при температуре +37°С; 2. Обогащение — посев в две жидкие селективные среды с последующим выдерживанием в термостате при температуре +37 или +42°С в течение 24-48 ч (в этих средах происходит накопление энтеробактерий и подавление сопутствующей микрофлоры);
3. Пересев с двух обогащенных сред на плотные селективно-диагностические среды в чашках Петри (среда Эндо), которые после выдерживания в термостате при температуре +37°С исследуют на наличие колоний, по своим характеристикам подозрительных на сальмонеллы; 3. Пересев с двух обогащенных сред на плотные селективно-диагностические среды в чашках Петри (среда Эндо), которые после выдерживания в термостате при температуре +37°С исследуют на наличие колоний, по своим характеристикам подозрительных на сальмонеллы; 4. Идентификация — пересев подозрительных на сальмонеллы колоний и определение культурально-биохимических и антигенных свойств выделенных микроорганизмов.
По 1 г подготовленной пробы продукта (или его разведения) вносят параллельно в две чашки Петри и заливают средой Вильсон-Блера (или сульфит-полимиксин-неомициновый агар), равномерно перемешивают с посевным материалом, а после застывания заливают слоем голодного агара. Чашки выдерживают в анаэробных условиях при температуре +37°С в течение 24 ч. Посевы просматривают, отбирают те чашки, в которых выросло от 15 до 150 характерных черных колоний, подсчитывают их количество. По 1 г подготовленной пробы продукта (или его разведения) вносят параллельно в две чашки Петри и заливают средой Вильсон-Блера (или сульфит-полимиксин-неомициновый агар), равномерно перемешивают с посевным материалом, а после застывания заливают слоем голодного агара. Чашки выдерживают в анаэробных условиях при температуре +37°С в течение 24 ч. Посевы просматривают, отбирают те чашки, в которых выросло от 15 до 150 характерных черных колоний, подсчитывают их количество.
Для подтверждения принадлежности обнаруженных колоний к CI. perfringens отбирают не менее 5 с характерными признаками и пересевают их в МППБ для мезофильных анаэробных микроорганизмов. Посевы культивируют в термостате 24 ч при температуре +37°С и изучают морфологические и биохимические свойства выделенной культуры. Для подтверждения принадлежности обнаруженных колоний к CI. perfringens отбирают не менее 5 с характерными признаками и пересевают их в МППБ для мезофильных анаэробных микроорганизмов. Посевы культивируют в термостате 24 ч при температуре +37°С и изучают морфологические и биохимические свойства выделенной культуры.
Cl. perfringens — крупные грамположительные палочки, расположенные одиночно или в виде коротких цепочек. Споры овальные, расположенные субтерминально. Каталазу не образуют; ферментируют лактозу; разжижают МПЖ; в лакмусовом молоке образуют губчатый сгусток красновато-сиреневого цвета. Для них характерен анаэробный рост. Cl. perfringens — крупные грамположительные палочки, расположенные одиночно или в виде коротких цепочек. Споры овальные, расположенные субтерминально. Каталазу не образуют; ферментируют лактозу; разжижают МПЖ; в лакмусовом молоке образуют губчатый сгусток красновато-сиреневого цвета. Для них характерен анаэробный рост.
Продукт измельчают, растирают в стерильной ступке до однородной консистенции, добавляя физраствор до соотношения 1:1. Полученную смесь экстрагируют в холодильнике в течение 2 ч. Затем процеживают через ватно-марлевый фильтр. Полученный фильтрат переносят в две пробирки по 3 мл, в третью — 2,7 мл фильтрата, в который добавляют 0,3 мл раствора трипсина, устанавливают рН 6,0 и помещают в термостат на 1 ч, периодически перемешивая. Продукт измельчают, растирают в стерильной ступке до однородной консистенции, добавляя физраствор до соотношения 1:1. Полученную смесь экстрагируют в холодильнике в течение 2 ч. Затем процеживают через ватно-марлевый фильтр. Полученный фильтрат переносят в две пробирки по 3 мл, в третью — 2,7 мл фильтрата, в который добавляют 0,3 мл раствора трипсина, устанавливают рН 6,0 и помещают в термостат на 1 ч, периодически перемешивая.
Содержимое первой пробирки оставляют без обработки, а второй кипятят в водяной бане 10 мин для разрушения ботулинического токсина и охлаждают до комнатной температуры. Содержимое первой пробирки оставляют без обработки, а второй кипятят в водяной бане 10 мин для разрушения ботулинического токсина и охлаждают до комнатной температуры.
Биопробу ставят на белых мышах массой 15-20 г, которым вводят внутрибрюшинно по 0,5 мл исследуемых фильтратов. Биопробу ставят на белых мышах массой 15-20 г, которым вводят внутрибрюшинно по 0,5 мл исследуемых фильтратов. Наблюдение за животными проводят через 1,2,4,12 ч, далее — 2 раза в день в течение 3 суток. Клинические симптомы ботулинической интоксикации появляются через 10-12 ч, токсином типа Е — через 2-4 ч.. Гибель животных наступает через 4-6 ч, а при высоких концентрациях токсина — в течение 1-2 ч без характерных признаков, в этих случаях биопробу повторяют с разведением исходной жидкости 1:10-1:100.
Делают посев исследуемых консервов с использованием селективно-диагностических сред. Если в посевах обнаружены грамположительные кокки, способные коагулировать плазму крови, образующие каталазу, ферментирующие мальтозу в анаэробных условиях, то выявленные микроорганизмы относят к Staph. aureus. Делают посев исследуемых консервов с использованием селективно-диагностических сред. Если в посевах обнаружены грамположительные кокки, способные коагулировать плазму крови, образующие каталазу, ферментирующие мальтозу в анаэробных условиях, то выявленные микроорганизмы относят к Staph. aureus.
При оценке санитарно-бактериологического состояния консервов определяют:
1. промышленную стерильность
2. наличие патогенной и токсигенной микрофлоры по эпидемиологическим показателям.
Под промышленной стерильностью понимают отсутствие в консервах микроорганизмов, способных развиваться при температуре хранения, установленной для данного вида консервов, патогенных микробов и их токсинов.
4.7.1. Отбор проб. При санитарно-эпидемиологическом анализе консервов от каждой партии отбирают не менее трех единиц потребительской тары.
Консервные банки могут иметь три основных дефекта:
1. Бомбаж — наличие вздутий крышек и дна, не опадающих при нажиме;
2. Хлопуша — вздутие дна или крышки банки, опадающие при нажиме пальцев руки. При этом вздувается противоположный конец банки, а после снятия давления вновь вздувается первоначальный участок с характерным звуком;
3. Банки с вибрирующими концами — консервы в нормальной по внешнему виду таре, при нажиме на которую происходит выпячивание противоположного конца, возвращающегося в нормальное состояние после снятия нажима.
На исследование отбирают из нормальных по внешнему виду консервов 1 единицу из каждых пятисот, но не менее трех и не более пятидесяти.
Перед исследованиями банки моют водой с мылом или детергентом, швы протирают щеткой, ополаскивают водой и высушивают. Затем проверяют банки на герметичность. Для этого их помещают в сосуд с водой, нагретой до кипения, и выдерживают 5-7 минут. Слой воды над банками должен быть не менее 25-30 мм, а температура воды не менее 70-80 оС. Если банки не герметичны, то в воде появятся пузырьки газа. Бактериологическому исследованию на промышленную стерильность подлежат лишь герметичные банки.
Бездефектные по внешнему виду консервы, предназначенные для определения промышленной стерильности, перед исследованием термостатируют (ставят контроль на бомбаж). Для обнаружения мезофильных микроорганизмов консервы объемом до 1 л термостатируют 5 суток при 37 оС , объемом более 1 л — 7 суток. Для определения термофильных микробов консервы любого объема термостатируют не более 3-х суток при 55 оС. Затем их выдерживают 24 часа при комнатной температуре, после чего просматривают и используют для исследований.
Вскрытие консервов и их бактериологическое исследование проводят в специальном боксе. Перед вскрытием банки несколько раз переворачивают для тщательного перемешивания. Затем крышку обрабатывают стерильным тампоном, смоченным спиртом. Тампон оставляют на крышке и поджигают. В непосредственной близости от тампона пробойником делают проколы, расширяя отверстия до 1-3 см.
Отбор навесок производят немедленно. Масса навески должна быть не менее 10 г или см3. Из навески при необходимости готовят разведение, используя стерильный физиологический раствор.
4.7.2. Определение промышленной стерильности консервов:
1. Для определения наличия мезофильных аэробных и факультативно-анаэробных микроорганизмов производят посев по 1 см3 образца в две пробирки с МПБ и глюкозой. Посевы инкубируют 5 суток при 30 оС.
2. Для определения наличия мезофильных анаэробных микроорганизмов по 1 см3 образца засевают глубинно на дно двух пробирок со средой Китта-Тароцци и инкубируют 5 суток. при 30 оС.
3. Для определения наличия термофильных аэробных и факультативно-анаэробных микроорганизмов по 1 см3 образца высевают в две пробирки с картофельно-пептонной средой. Посевы инкубируют 3 суток при 55-62 оС.
4. Для определения наличия термофильных анаэробных микроорганизмов по 1 см3 образца засевают глубинно на дно двух пробирок со средой Китта-Тароцци и инкубируют 3 суток при 55-62 оС.
Затем изучают посевы и при отсутствии роста дают заключение о том, что данные микроорганизмы не обнаружены (консервы промышленно стерильны). В случае наличия роста микробов выделяют чистые культуры, изучают их свойства и идентифицируют.
Норматив: Наличие в консервах аэробной и факультативно анаэробной неспорообразующей микрофлоры указывает на недостаточную эффективность применяемых методов стерилизации и возможности их порчи. Присутствие сапрофитных аэробных бацилл является допустимым при герметичности консервных банок.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
ТЕМА 5. МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ МЯСНЫХ КОНСЕРВОВ
Консервы - это продукты, предназначенные для длительного хранения, расфасованные в герметично упакованную тару, которая защищает их от проникновения микроорганизмов.
Микробиологическое исследование мясных консервов включает в себя анализ сырья и полуфабрикатов, вспомогательных материалов, а также содержимого консервных банок до и после стерилизации.
Микробиологический анализ исходного сырья проводится при повышенной микробной его обсемененности после разделки и мойки, анализ полуфабрикатов и вспомогательных материалов - по мере поступления их на консервное производство.
5.1. Отбор проб
Пробы для анализа содержимого банок отбирают в зависимости от вида и консистенции продукта. Если консервы содержат большое количество заливки или бульона, то для посева берут непосредственно жидкую часть продукта. Если в консервах жидкая фаза отсутствует или имеется в незначительном количестве, то в продукт добавляют стерильную воду в соотношении 1:1 и высевают смыв с продукта без разбавления или из последовательно приготовленных разведений. При фасовке в тару объемом до 0,5 л содержимое банки перекладывают в стерильную посуду (вместимостью 1,5 — 2,0 л) с таким же содержанием воды, закрывают крышкой и встряхивают в течение 3 мин, после чего отбирают пробу для посева. В зависимости от предполагаемого микробного обсеменения пробу разводят с таким расчетом, чтобы в чашке Петри с питательной средой выросло не более 300 колоний.
5.2. Бактериологическое исследование мясных консервов перед стерилизацией
Микробиологическое исследование банок перед стерилизацией проводят немедленно после закатки банок. Исследование включает в себя определение общего количества микроорганизмов в содержимом банок, выявление спор облигатных анаэробов и термофильных бактерий. Контроль наличия термофильных бактерий - возбудителей плоскокислой порчи - проводится только для консервов, содержащих продукты с нейтральным значением рН.
Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) проводят по методике, приведенной в разделе 1.3.1.
Выявление спор облигатных анаэробов. Из подготовленного для анализа образца стерильной пипеткой или трубкой отбирают 10 см продукта, вносят в стерильную пробирку и ставят на кипящую водяную баню на 20 мин. После охлаждения 0,5 см прогретого продукта засевают в пробирку с накопительной средой Китта-Тароцци. Посевы культивируют при температуре 37 °С в течение 48 ч. По окончании культивирования отмечают наличие газообразования и анаэробного роста в накопительной среде. При наличии анаэробного роста из накопительных посевов 1-2 капли высевают в чашки Петри, которые заливают 30 см расплавленного МПА с 1 % глюкозы. Сразу же после застывания агара на его поверхность пинцетом кладут стерильное предметное стекло так, чтобы под ним не было пузырьков воздуха. Затем чашку переворачивают крышкой вниз и ставят на 48 ч в термостат с температурой 37 °С.
Облигатные анаэробы выявляются на чашке под стеклом в центральной части в виде отдельных колоний или сплошного роста на расстоянии 3-4 мм от края стекла, образуя иногда под ним пузырьки газа. Факультативные анаэробы растут не только под стеклом, но и на всей поверхности среды в чашке.
Выявление спор термофильных бактерий. Из предварительно прогретой при температуре 80-85 °С пробы отбирают 5 см 3 взвеси и вносят 25 см 3 МПА, содержащего 1% глюкозы и 0,004 % бромкрезолпурпурного (среда должна иметь слабо-фиолетовую окраску). Посевы культивируют при температуре 55 °С в течение 24-48 ч. Изменение окраски среды от фиолетовой до желтой или появление желтых ореолов вокруг колоний свидетельствует о наличии в исследуемой пробе спор термофильных бактерий.
Возбудителями плоскокислой порчи консервов являются термофильные спорообразующие аэробные микроорганизмы следующих видов: Bacillus stearothermophilus, B. aerothermophilus, B. coagulans и другими. Характеристика этих микроорганизмов представлена в табл. 5.1.
Термофильные микроорганизмы, размножаясь в продукте в условиях его хранения при повышенных температурах (40-70 °С), могут разлагать углеводы с образованием органических кислот без выделения газа. Они не вызывают бомбажа банок, но продукт приобретает кислый запах и неприятный кислый вкус.
5.3. Микробиологическое исследование мясных консервов после стерилизации
Готовые консервы после стерилизации подвергают микробиологическому исследованию в следующих случаях:
✵ при обнаружении в партии банок до стерилизации повышенного количества микроорганизмов или спор облигатных анаэробов;
✵ при закладке консервов на длительное хранение;
✵ при отсутствии показателя допустимой бактериальной обсемененности консервов до их стерилизации.
Отобранные для анализа образцы консервов осматривают и проверяют на герметичность в сосудах с горячей водой или в специальных аппаратах. Микробиологическому анализу подвергают только герметичные банки. С целью установления стерильности и выявления жизнедеятельности мезофильных и термофильных микроорганизмов отобранные консервные банки выдерживают в термостате с температурой 37 °С в течение 3 сут. (для определения наличия мезофильных микроорганизмов) или при температуре 55 °С в течение 5 сут (для определения наличия термофильных микроорганизмов).
Из остаточной микрофлоры в консервах чаще всего обнаруживаются споры таких аэробных бацилл, как Bacillus subtilis, B. licheni- formis, B. polymyxa, B. cereus, B. coagulans, B. stearothermophilus, и анаэробных клостридий (Clostridium perfringens, C. putrficum, иногда C. butyricum). В консервах редко обнаруживается C. botulinum. Споры палочки ботулизма обладают меньшей термоустойчивостью, чем споры других анаэробных клостридий, поэтому гибель C. botulinum служит минимальной стандартной нормой при разработке режимов стерилизации мясных консервов.
В результате жизнедеятельности микроорганизмов, сохранивших жизнеспособность после стерилизации, консервы подвергаются микробиологической порче. К основным видам порчи консервов относятся бомбаж, плоскокислая порча, сульфитная порча.
Бомбаж - вздутие банки в результате повышения внутреннего давления за счет накопления газов (СО2, H2S, NH3) газообразующими спорообразующими бактериями видов C. sporogenes, C. thermosaccharolyticum, C. perfringens, C. thermoaceticum и др. Бомбаж консервов могут также вызвать БГКП и дрожжи, попавшие в готовый продукт при нарушении герметичности тары. Органолептические свойства консервов в результате накопления продуктов жизнедеятельности микроорганизмов сильно изменяются, наблюдается мацерация ткани, кислый или гнилостный запах, пенообразование. Обычно такие изменения наблюдаются при высоком уровне размножившихся микроорганизмов - 10-10 клеток в 1 г продукта. Бомбажные консервы по внешним признакам легко отбраковываются.
Плоскокислая порча - изменение органолептических свойств консервов без газообразования. Консервы приобретают неприятный кислый запах и вкус, иногда изменяется цвет продукта. Возбудителями данного вида порчи являются термофильные спорообразующие аэробные бациллы: В. subtilis, B. cereus, B. stearo- thermophilus, B. aerothermophilus, B. coagulans и др. (табл. 5.1.) Эти микроорганизмы разлагают углеводы с образованием различных органических кислот без выделения газа.
Сульфитная порча - накопление в консервах сероводорода термофильными спорообразующими бактериями вида Clostridium nigrificans. Они разлагают серосодержащие аминокислоты с образованием H2S. При сульфитной порче наблюдается вздутие донышек банки, продукт чернеет и приобретает тухлый запах.
Таблица 5.1. Характеристика некоторых видов бактерий, вызывающих плоскокислую порчу консервов
Читайте также:

