3 группа катионов реферат
Обновлено: 05.07.2024
Справочные таблицы, в которых даны сероводородная, кислотно-основная и аммиачно-фосфатная аналитическая классификация катионов 1-5 групп, качественные реакциии и групповые реагенты, а также аналитические сигналы на катионы.
Сероводородная аналитическая классификация катионов таблица
Классическая сероводородная аналитическая классификация катионов включает 5 групп катионов.
Катионы, относящиеся к данной группе
K + , Na + , NH4 + ,Mg +2
Хлориды, карбонаты и сульфиды растворимы в воде, MgCO3 растворима в солях амония
Карбонаты в воде нерастворимы
Карбонаты аммония в аммиачном буфере (NH4)2CO3
Fe +3 , Fe +2 , Co +2 , Mn +2 , Zn +2 , Al +3 , Cr +3 , Ni +2
Карбонаты сульфиды и гидроксиды нерастворимы в воде, но растворимы в разбавленных кислотах
1 подгруппа: Hg + , Hg +2 , Ag + , Pb +2 , Cu +2
2 подгруппа: As(III, V), Sb(III, V), Sn(II, IV)
1 подгруппа: сульфиды нерастворимы в воде
2 подгруппа: сульфиды растворимы в полисульфиде амония с образованием тиоанионов
Сероводород в кислой среде H2S
Sn +2 , Sn +4 , As +3 , As +5 , Sb +3 , Sb +5
Сульфиды нерастворимы в разбавленных кислотах, но растворимы в сульфиде аммония
Сероводород в кислой среде HCl
Таблица аналитические сигналы на катионы первой группы
Аналитические сигналы на катионы
гексанитрокобальтат - II натрия Na 3[ Co ( NO 2)6]
Желтый кристаллический осадок K 2 Na [ Co ( NO 2)6]
гексагидроксостибиат- V калия - K [ Sb ( OH )6]
Белый кристалличосадок Na [ Sb ( OH )6]
Белый аморфн. осадок
Белый кристаллич осадок Mg [ Sb ( OH )6]
Щелочи N а OH или КОН
выделение аммиака, запах
Таблица аналитические сигналы на катионы второй группы
Аналитические сигналы на катионы
щелочь( N а OH , КОН)
Кислотно-основная аналитическая классификация катионов таблица
Кислотно-основная аналитическая классификация включает 6 групп катионов: растворимая, сульфатная, хлоридная, амфотерная, гидроксидная и аммиакатная.
Групповой реактив (реагент)
К + , Na + , NH4 + , Li +
Почти все соединения растворимы в воде
Ca 2+ , Ва 2+ , Sr 2+
Сульфаты нерастворимы в воде и разбавленных растворах кислот и щелочей
Хлориды нерастворимы в воде и разбавленных растворах кислот и щелочен
Al 3+ , Cr 3+ , Zn 2+ , Sn 4+ , As +3
Гидроксиды растворимы в избытке щелочи
Mg 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Bi 3+ , Sb 5+ , Ti +4
Гидроксиды нерастворимы в избытке щелочи и аммиаке, растворимы в рабавленных кислотах
Cu 2+ , Co 2+ , Ni 2+ , Hg 2+ , Cd 2+
Гидроксиды нерастворимы в щелочи, но растворимы в избытке водного раствора аммиака
Аммиачно-фосфатная аналитическая классификация катионов таблица
Аммиачно-фосфатная аналитическая классификация включает в себя 5 групп катионов
Фосфаты pастворимы в воде
1 подгруппа: Li + , Mg 2+ , Ca 2+ , Ba 2+ , Sr 2 , Mn 2 , Fe 2+
2 подгруппа: Al 3+ , Cr 3+ , Fe 3+ , Bi 3+
Фосфаты нерастворимы в воде и NH4OH.
Фосфаты 1 подгруппы pастворимы в СН3СООН.
Фосфаты 2 подгруппы нерастворимы в СН3СООН, pастворимы в НСl
Co 2+ , Ni 2+ , Cu 2+ , Zn 2+ , Cd 2+ , Hg 2+
Фосфаты pастворимы в NH4OH
As(III, V), Sb(III, V), Sn(II, IV)
Метаоловянная и метасурьмяная кислоты нерастворимы и адсорбируют мышьяковую кислоту H3AsO4
Ag + , Hg 2 , Pb 2+
Хлориды нерастворимы в воде и разбавленных кислотах
Схема анализа смеси катионов аммиачно-фосфатным методом
Ос. 1: Хлориды V группы
Р-р 1: Катионы IV—I групп, (РЬ 2+ )
Ос. 1 анализируют, как в сероводородной схеме
Р-р 2: Катионы I—III групп, (РЬ 2+ )
Р-р 1 выпарив, с HNO3 досуха на водяной бане. При отсутствии олова добавляют SnCl4 и 0,5 н. Na2HPO4. Сухой остаток р-ют в 2 н. HNO3
В растворе проверяют присутствие AsO 3 . Ос. 3 после р-ния в 2 М НСl анализируют, как в сероводородной схеме
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Лекция 6. Катионы 3-ей аналитической группы Ca 2+ , Ba 2+ , Sr 2+
Общая характеристика катионов третьей группы
Катионы третьей группы – осаждаются серной кислотой и ее солями, которые являются групповыми реагентами. При взаимодействии с сульфатом катионы дают нерастворимые в воде сульфаты бария и стронция и плохо растворимый сульфат кальция. Они образуют также нерастворимые в воде фосфаты, сульфиты, карбонаты. Нитраты, бромиды, хлориды, гидрокарбонаты хорошо растворимы в воде.
Гидроксиды кальция, бария, стронция обладают слабощелочными свойствами и в воде растворимы плохо. Катионы бесцветны, окраска их солей зависит от аниона. Соединения кальция, бария и стронция широко применяют как реактивы, минеральные краски, строительные материалы.
Значение в медицине и фармации катионов 3-ей аналитической группы
В медицинской и фармацевтической практике применяют соли кальция и бария. Сульфат кальция или гипс применяют для наложения повязок, при изготовлении зубных порошков. Хлорид кальция, глюконат кальция, лактат кальция используют при аллергических заболеваниях, как кровоостанавливающее средство, при пониженной свертываемости крови. Карбонат кальция или мел способен снижать повышенную кислотность желудочного сока. Он входит в состав зубных порошков и паст. Соединения кальция играют важную роль в организме, входя в состав костей, тканей, крови. Они регулируют деятельность системы свертывания крови, нервные и имунные процессы, работу сердца.
Из солей бария в медицине применяется сульфат бария как рентгеноконтрасное средство при рентгеноскопии желудка и кишечника.
Действие группового реактива
Для открытия катионов 3-ей группы применяется групповой реактив – разбавленная серная кислота и ее соли. При взаимодействии катионов 3-ей группы с сульфат-ионом в в растворах образуются белые кристаллические осадки:
Наименьшую растворимость имеет сульфат бария. Сульфат стронция и кальция растворяются в воде лучше, особенно сульфат кальция, который выделяется в осадок из концентрированных солей кальция. Поэтому при проведении реакции осадок сульфата бария образуется практически мгновенно, сульфат стронция – после стояния, сульфат кальция – только из концентрированных растворов. Благодаря высокой растворимости в воде сульфат кальция образует насыщенный раствор, который может служить реактивом на катионы бария:
Насыщенный раствор сульфата стронция соответственно является реактивом на катионы бария:
Эти особенности сульфатов катионов 3-ей группы объясняются различием из произведений растворимости (ПР Ba = 1,1*10 -10 ; ПР Sr =2,8*10 -7 ; ПР Са =6,1*10 -5 ). Наименьшую величину произведения растворимости имеет сульфат бария, наибольшую сульфат стронция. В осадок, прежде всего, выпадает соль, имеющая наименьшую величину произведения растворимости.
Осадки сульфатов катионов 3-ей группы нерастворимы в кислотах и щелочах, лишь сульфат кальция растворим в растворе сульфата аммония ( NH 4 ) 2 SO 4 с образованием комплексной соли:
Эту реакцию иногда используют для отделения ионов кальция от остальных. В виду высокой растворимости сульфата кальция в воде его осаждение следует проводить из спирто-водных растворов (50º), растворимость CaSO 4 в них значительно снижается.
При отделении катионов 3-ей группы от других катионов с помощью сульфат-ионов образующиеся осадки нерастворимы в кислотах или щелочах. С целью улучшения их растворимости сульфаты переводят в карбонаты. Для перевода сульфатов бария, стронция и кальция в карбонаты осадок обрабатывают при нагревании многократно раствором Na 2 CO 3 :
При этом образуются осадки карбонатов бария, стронция и кальция, растворимые в кислотах:
Полученный раствор затем используют для качественного открытия отдельных ионов 3-ей группы.
Реакции катионов бария Ba 2+
Реакция с солями хромовой кислоты:
Образуется желтый кристаллический осадок хромата бария, растворимый в азотной и соляной кислотах:
В серной кислоте желтый осадок осадок хромата бария переходит в белый осадок сульфата бария:
В уксусной кислоте и других слабых кислотах осадок хромата бария нерастворим.
При взаимодействии солей бария с солями дихромовой кислоты также образуется осадок хромата бария:
При проведении реакции выделяется соляная кислота, которая частично растворяет осадок хромата бария, поэтому при применении дихроматов осаждение хромата бария происходит не полностью.
Для полного осаждения хромата бария с помощью дихроматов используют добавку солей уксусной кислоты. Соли уксусной кислоты взаимодействует с соляной кислотой, в итоге образуется слабая уксусная кислота, в которой осадок хромата бария не растворяется:
CH 3 COONa + HCl → CH 3 COOH + NaCl
Ионы стронция и кальция осадка с дихроматами не образуют, так как образующиеся хроматы кальция и стронция растворяются полностью в выделяющейся соляной или уксусной кислоте.
Реакция с солями щавелевой кислоты:
Образуется белый кристаллический осадок оксалата бария, растворимый в соляной и азотной кислотах, при нагревании – в концентрированной уксусной кислоте.
Реакция с карбонатами:
Образуется белый аморфный осадок, при нагревании переходящий в кристаллический, растворимый в соляной, азотной и уксусной кислотах.
Реакция с моногидрофосфатом натрия:
Образуется белый кристаллический осадок, растворимый в соляной, азотной и уксусной кислотах.
Реакция с гипсовой водой:
Образуется белый осадок сульфата бария.
Капельная реакция с родизонатом натрия:
CO – CO – CO – Na CO – CO – CO
BaCl 2 + │ ║ → │ ║ Ba ↓+ 2NaCl
CO – CO – CO – Na CO – CO – CO
При нанесении на фильтровальную бумажку капли нейтрального раствора соли бария и раствора родизоната натрия появляется красно-бурое окрашивание вследствие выделения осадка родизоната бария. При добавлении капли соляной кислоты красно-бурое окрашивание переходит в красное, так как родизонат бария переходит в гидрородизонат бария красного цвета.
CO – CO – CO CO – CO – CO -
2 │ ║ Ba+2HCl → │ ║ Ba ↓+ BaCl 2
CO – CO – CO CO – CO – COH 2
В присутствии K 2 CrO 4 родизонат бария не образуется . Реакция специфична для катионов бария.
Реакция окрашивания пламени. При внесении в пламя газовой горелки летучих солей бария(хлорид, нитрат) – пламя окрашивается в желто-зеленый цвет.
Реакции катионов стронция Sr 2+
Дает осадки, аналогичные по свойствам катиону бария с солями щавелевой, угольной и хромовой кислот, с гидрофосфатами, щелочами, гипсовой водой. Но не дает осадка с дихроматами.
Капельная реакция с родизонатом натрия:
CO – CO – CO – Na CO – CO – CO
SrCl 2 + │ ║ → │ ║ Sr ↓+ 2NaCl
CO – CO – CO – Na CO – CO – CO
При проведении этой реакции на фильтровальной бумаге образуется красно-бурое окрашивание осадка родизоната стронция, исчезающее при добавлении капли соляной кислоты (растворение осадка). Реакция катиона стронция с родизонатом натрия происходит в присутствии K 2 CrO 4 вследствие слабой растворимости осадка SrCrO 4 . Это свойство используют при открытии ионов стронция в присутствии ионов бария. На фильтровальную бумагу наносят каплю раствора K 2 CrO 4 и каплю исследуемого раствора. При этом бумага окрашивается в желтый цвет вследствие образования осадков SrCrO 4 и Ва CrO 4 . Затем на пятно наносят каплю раствора родизоната натрия. В присутствии ионов стронция пятно окрашивается в буро-красный цвет, в отсутствии стронция окраска остается желтой, так как Ва CrO 4 реакцию с родизонатом натрия не дает.
Реакция с родизонатом натрия позволяет открыть катионы бария и стронция при совместном присутствии. Если при проведении этой реакции на бумаге образовалось красно-бурое пятно, исчезающее при добавлении HCl , в растворе присутствует стронций. Если красно-бурое пятно краснеет при добавлении HCl , то в растворе присутсвует барий и возможно стронций. Для подтверждения присутствия стронция проводят реакцию с родизонатом натрия в присутствии K 2 CrO 4 . Окрашивание желтого пятна в красно-бурый цвет указывает на присутствие стронция.
Реакция окрашивания пламени. При внесении летучих солей стронция (хлорид, нитрат) в пламя газовой горелки пламя окрашивается в карминово-красный цвет.
Реакции катионов кальция С a 2+
Катион кальция образует в растворах осадки с гидрофосфатами, карбонатами, щелочами, хроматами, аналогичные по свойствам осадкам, образуемым катионами бария и стронция. Реакции с гипсовой водой, дихроматами, хроматами ион кальция не дает. С родизонатом натрия ион кальция образует фиолетовый осадок в щелочной среде, растворимый в HCl .
Реакция с оксалатами:
Образуется кристаллический белый осадок оксалата кальция, который растворим в минеральных кислотах и нерастворим в уксусной кислоте( в отличие от оксалатов бария и стронция).
Реакция с гексациано(2) ферратом калия K 4 [ Fe ( CN ) 6 ]:
CaCl 2 + K 4 [ Fe ( CN ) 6 ]+2 NH 4 OH → Ca ( NH 4 ) 2 [ Fe ( CN ) 6 ]↓+ 2 KCl +2 KOH
В слабощелочной среде рН=9 образуется белый кристаллический осадок гексациано (2) феррата кальция-аммония, растворимый в минеральных кислотах, но не растворимый в уксусной кислоте. Реакцию проводят в присутствии буферной смеси NH 4 Cl + NH 4 OH при нагревании. Проведению реакции мешает ион Ba 2+ .
Реакция окрашивания пламени. Пламя газовой горелки при внесении солей кальция окрашивается в кирпично-красный цвет.
Анализ смеси катионов третьей аналитической группы
Из растворов катионы 3-ей аналитической группы выделяют с помощью разбавленной серной кислоты. При осаждении катионов 3-ей анал. группы разбавленной серной кислоты добавляют 50% (от объема исследуемого раствора) этилового спирта для понижения растворимости сульфата кальция. Дают осадку постоять 5-10 мин, испытывают на полноту осаждения. Осадок фильтруют и промывают холодной водой.
Т.к. осадки сульфатов катионов3-ей группы практически нерастворимы в кислотах и щелочах, проводят реакцию их перевода в карбонаты. Для этого добавляют большой избыток карбоната натрия и кипятят. При этом сульфаты переходят в карбонаты. Осадок карбонатов промывают холодной водой до нейтральной реакции фильтрата и растворяют в уксусной кислоте. В фильтрате открывают катионы 3-ей группы. Катион бария открывают реакцией с дихроматом калия. При обнаружении катиона бария, его удаляют из раствора, добавляя избыток дихромата калия. Отделяют осадок и в фильтрате обнаруживают катионы стронция и кальция. Их осаждают, добавляя избыток насыщенного раствора карбоната натрия и нагревают. Осадок карбонатов стронция и кальция промывают горячей водой до удаления ионов хромата и растворяют в уксусной кислоте. К части раствора удаляют гипсовую воду и кипятят. При наличии в растворе катиона стронция образуется осадок сульфата стронция. Его при обнаружении удаляют, осаждая раствором сульфата аммония.
После отделения стронция в фильтрате открывают кальций с помощью раствора оксалата аммония или гексациано(2) феррата калия.
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10 -5 ,Ks° (SrSO4) = 3,2 10 -7 , Ks°(BaSO4) = 1,110 -10 ,Ks°(PbSO4) = 1,6 10 -8 . При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция - частьионов Ca 2 + остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария - не растворяются.
Аналитические реакции катиона кальция Ca 2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO4 2- белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса - дигидрата сульфата кальция-CaSO4*2H2O:
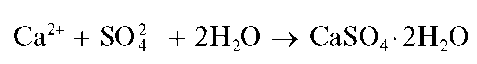
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола - в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]:
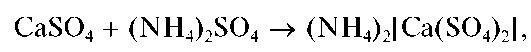
что позволяет отделить катионы Ca 2+ от катионов Sr 2+ иBa 2+ .
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
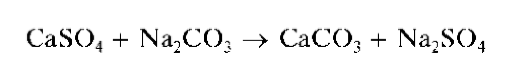
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-10 4 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4•2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca 2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:
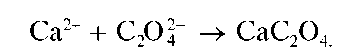
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
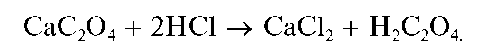
Открываемый минимум - около 100 мкг, предельное разбавление - 6 10 4 мл/г (подругимданным~3 • 10 5 мл/г).
Мешают катионы Sr 2+ ,Ba 2+ ,Mg 2+ , дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca 2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристаллический осадок смешанного гексацианоферрата(П) аммония и кальция Осадок нерастворим в уксусной кислоте.
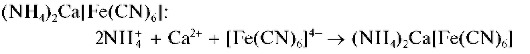
Открываемый минимум равен 25 мкг, предельное разбавление - 2-10 3 мл/г.
Мешают катионы Ba 2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca 2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 в щелочной среде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2:
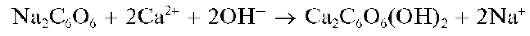
Реакция довольно чувствительна: предел обнаружения - 1 мкг, предельное разбавление - 5-10 4 мл/г. Катионы Sr 2+ иBa 2+ не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и ~2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca 2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами - белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 - белый CaHPO4 (растворяется в кислотах), с хроматами - желтый CaCrO4, с фторидами - белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr 2+
Реакция с сульфат-ионами. Катионы Sr 2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4:
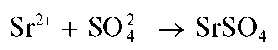
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
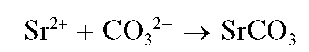
Реакция с карбонат-ионами. Катионы Sr 2+ образуют при нагревании с карбонат-ионами CO3 2- белый кристаллический осадок карбоната стронция:
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr 2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6:
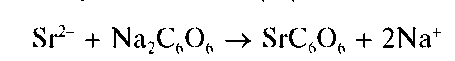
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения - 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr 2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 - белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 - белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 - желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения - 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление - 10 4 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba 2+
Катионы бария Ba 2+ образуют с сульфат-ионами белый кристаллический осадок сульфата бария BaSO4:
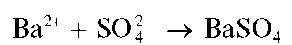
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2:
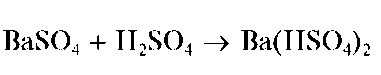
При нагревании с растворами карбонатов (например, соды Na2CO3) сульфат бария превращается в малорастворимый в воде карбонат бария BaCO3, который растворяется в кислотах.
Предел обнаружения каионов бария данной реакцией составляет 10 мкг. Мешают катионы Ca 2+ ,Sr 2+ ,Pb 2+ .
Методика. В пробирку вносят 2-3 капли раствора BaCl2,прибавля-ют по каплям раствор H2SO4 Выпадает белый мелкокристаллический осадок сульфата бария.
Реакция с дихромат-ионами. Катионы Ba 2+ образуют с дихромат-ионами Cr2O7 2- в присутствии ацетат-ионов желтый осадок хромата бария BaCrO4:
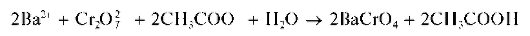
Образование хромата бария BaCrO4, а не дихромата BaCr2O7,вэтой реакции объясняется тем, что хромат бария менее растворим в воде, чем дихромат бария.
В водных растворах дихроматов устанавливается равновесие
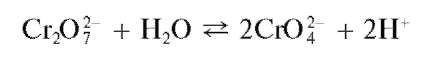
В присутствии катионов Ba 2+ образуется и выпадает в осадок малорастворимый хромат BaCrO4,тогда как дихроматBa2Cr2O7 в осадок не выпадает вследствие его более высокой растворимости. В результате равновесие смещается вправо, и в растворе накапливаются ионы водорода, что, однако, препятствует более глубокому смещению равновесия. Поэтому для нейтрализации ионов водорода в раствор вводят ацетат натрия CH3COONa. Ацетат-ионы CH3COO - , образующиеся при электролитической диссоциации ацетата натрия, связывают ионы водорода в малодиссоциированную слабую уксусную кислоту CH3COOH, вследствие чего равновесие образования хромат-ионов из дихромат-ионов смещается вправо. При этом возрастает полнота осаждения хромата бария.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag + ,Pb 2+ ,Cd 2+ ,Co 2+ ,Ni 2+ и другие катионы, дающие осадки хроматов. Катионы Ca 2+ ,Sr 2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора BaCl2, прибавляют 5 капель раствора дихромата калия K2Cr2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
Хромат бария образуется также при реакции катионов Ba 2+ с хромат-ионами:
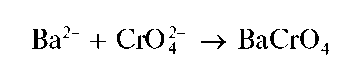
Однако при реакции с дихромат-ионами в присутствии ацетат-ионов катионы бария осаждаются практически количественно.
Реакция с родизонатом натрия. Катионы Ba 2+ реагируют с родизона-том натрия Na2C6O6 в нейтральной среде с образованием красно-бурого осадка родизоната бария:
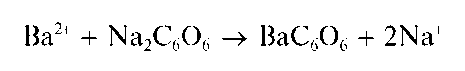
При прибавлении раствора хлороводородной кислоты красно-бурый осадок родизоната бария превращается в ярко-красный гидроро-дизонат бария Ba (HC6O6)2.
Предел обнаружения - 0,25 мкг. Мешают катионы Pb 2+ .
Реакцию проводят капельным методом на фильтровальной бумаге. Методика аналогична описанной для реакции катионов стронция с родизонатом натрия.
Окрашивание пламени газовой горелки. Соли и другие соединения бария окрашивают пламя газовой горелки в желто-зеленый цвет. Методика - такая же, как и в других вышеописанных случаях.
Другие реакции катионов бария. Катионы Ba 2+ образуют также осадки при реакциях: с растворимыми оксалатами - белый BaC2O4 (растворяется в HCl, HNO3, при нагревании - также и в CH3COOH); с гидрофосфатом натрия Na2HPO4 - белый BaHPO4 (растворяется в кислотах); с растворимыми карбонатами - белый BaCO3 (растворяется в кислотах); с сульфитами - белый BaSO3 (растворяется в кислотах).
Групповым реактивом III аналитической группы катионов является , который в нейтральной и щелочной средах при (т. е. при ) осаждает катионы III группы в виде гидроокисей: и сульфидов: .
Это отличает III группу от 1 и II групп катионов, не образующих осадков при действии .
Сульфиды катионов III группы, нерастворимые в воде, растворяются в разбавленных минеральных кислотах и поэтому не осаждаются сероводородом из хлористоводородных растворов.
Катионы III группы, в отличие от катионов II группы, образуют нерастворимые гидроокиси и растворимые в воде сульфаты.
Одним из характерных свойств катионов III группы является их способность образовывать комплексные соединения. Например, ионы железа (III) образуют следующие комплексные ионы: , и внутрикомплексные соединения с органическими оксисоединениями, комплексоном III, купферроном, -нитрозо--нафтолом, оксихинолином, с производными салициловой кислоты и др.
Другим характерным свойством многих катионов III группы , Со, является их способность к реакциям окисления—восстановления (см. ниже).
Большинство соединений катионов III группы окрашено в различные цвета: все соли трехвалентного хрома — зеленые или фиолетовые, соединения шестивалентного хрома (-желтые, бихроматы — оранжевого цвета; соли никеля — зеленые; кобальта — красные; соединения двухвалентного марганца — розовые, четырехвалентного — черно-бурые, шестивалентного (-зеленые, семивалентного красно-фиолетовые; ацетат железа (III) — красно-чайного цвета; арсенат железа (III) — зеленый; бромид железа (II) — красный; хлорид железа (-желтый; гексацианоферрат (II) железа (-синий (берлинская лазурь), гексацианоферрат (III) железа (-синий (турнбулева синь), роданид кобальта — синий; роданид железа (-красный.
Окрашены также некоторые гидроокиси и все сульфиды, за исключением . Соединения трех- и шестивалентного хрома, двух- и трехвалентного железа, двух-, четырех- и семивалентного марганца, двух- и трехвалентного никеля и кобальта неустойчивы в присутствии окислителей или восстановителей.
обнаруживают сходство в способности образовывать малорастворимые в воде и даже в уксусной кислоте фосфаты (при действии ), оксиацетаты (при действии ) и гидроокиси (при действии избытка или насыщенного раствора ). Ионы же образуют с осадки, растворимые в уксусной кислоте, и не осаждаются в виде оксиацетатов (при действии ) и гидроокисей (при действии избытка или насыщенного раствора ).
Читайте также:

