Золото физические свойства кратко
Обновлено: 02.07.2024
Физические свойства золота
Цвет золота ярко-желтый, если в нем отсутствуют примеси. Но чистое золото (и то не совсем) бывает почти исключительно в банковских слитках.
В природном золоте и ювелирных изделиях всегда есть примеси серебра, меди и др., то есть фактически мы всегда имеем дело со сплавами золота с другими металлами.
Из белого золота изготавливают ювелирные украшения с бриллиантами. Такая оправа прекрасно отражает блеск камней и будто дополнительно их освещает. По сравнению с желтым белое золото более стойко к воздействию атмосферы. Таким образом, цвет сплавов зависит от количества и состава примесей (табл.1).
Табл.1. Цвет золота в зависимости от количества и состава примесей
Основной состав примесей
медь, серебро, никель; медь, серебро
никель, цинк, медь; палладий, серебро, медь
серебро, палладий, медь
Золото - очень мягкий металл, его твердость 2,5-3,0 по 10-балльной шкале твердости (шкале Мооса). В этой шкале самое твердое вещество - алмаз. Его твердость равна 10. Самый мягкое вещество - мел. Его твердость - 1. Твердость стекла – 5, хорошей стали – 4,5. В полевых условиях твердость проверяют, прежде всего, с помощью ножа. Его острием проводят по поверхности изучаемого минерала. Если нож оставляет царапину, значит твердость меньше 5.
Золото легко полируется и обладает высокой отражательной способностью. Через очень тонкие листы золота отлично могут проходить солнечные лучи, при этом тепловая их часть будет отражаться. По этой причине, тонкие слои золота используются для тонированных стекол современных небоскребов в жарком климате. Это позволяет экономить энергию, необходимую на то, чтобы содержать интерьер таких зданий в прохладности в течение всех горячих летних месяцев. Подобные тонкие слои золота используются также в защитном шлеме космонавтов, чтобы отражать большой поток инфракрасных лучей в открытом космосе.
Золото обладает исключительной способностью распыляться, давать частицы, соизмеримые с длиной световой волны, уноситься тоннами в виде мельчайшей пыли в реках, рассеиваться по полу, стенам и мебели золотосплавочных лабораторий и исчезать из банковского обмена за счет истирания монет. При золотом обращении ежегодно терялось от 0,01 до 0,1% веса монеты.
В этих исключительных свойствах золота известный австрийский геолог Зюсс видел назревающий "золотой голод" и указывал на необходимость осторожно решать вопрос о золотом обращении как основе мирового хозяйства. Может быть, опасения Зюсса были преждевременны, однако их значение осталось в силе, хотя темпы приближения золотого истощения не оправдались.
Золото имеет чрезвычайно высокую пластичность (тягучесть) и ковкость (расковывается до толщины 8∙10 -5 мм), т.е. из одного грамма золота можно получить лист фольги площадью до 1м 2 . Благодаря высокой пластичности, золото может быть измельчено, искривлено, сдавлено, сжато, золоту можно придать различную форму, не ломая на части. Фактически, желтый металл может быть истолчен до полупрозрачности, может быть тонким, как лист бумаги, и оставаться таким же красивым и блестящим. Производство тонколистового (сусального) золота позволяет покрывать им купола церквей, отделывать дворцовые залы.
Из одного грамма золота можно вытянуть проволоку длинной 2610 м. Получаемая нить очень тонкая (диаметром 2∙10 -6 мм), что необходимо сегодняшней электронной индустрии, где нужно создавать электрические цепи в чипах очень маленьких размеров. Из-за высокой электрической проводимости и устойчивости к окислению, золото имеет большой спрос в электронной промышленности. Сейчас неудивительно найти золото в таких устройствах как телевизор, мобильный телефон, калькулятор, не говоря уже о более сложной электронике.
Высокая ковкость золота еще один признак, позволяющий отличить золото от похожих минералов. Например, если положить частицу золота на твердый камень и ударить по ней молотком, то она расплющится, а кусочек желтого пирита рассыплется на мелкие частички.
Температура плавления золота составляет 1063˚ С, кипения 2947˚ С. Расплавленное золото имеет бледно-зеленый цвет. Пары золота зеленовато-желтого цвета. Все металлы, входящие в состав сплава с золотом, понижают температуру его плавления. При нагревании золота и его сплавов выше температуры плавления золото начинает улетучиваться, и летучесть его тем выше, чем выше температура. Летучесть золота в значительной мере возрастает также в том случае, когда в сплаве присутствуют другие металлы, обладающие летучими свойствами, например, цинк, мышьяк, сурьма, теллур, ртуть и др. Сплавы по своим свойствам не похожи на те металлы, из которых они образовались. Так, например, сплав золота с серебром обладает значительно большей твердостью, чем золото и серебро, но зато не имеет их ковкости и тягучести. То же самое дает и примесь меди.
Золото имеет еще одно отличительное качество, которое является, возможно, наиболее важным для золоторазведчика (кроме цены) - это плотность золота. Его плотность - 19,3 г/см 3 - означает, что оно весит в 19,3 раза больше, чем равный объем чистой воды. Более высокую плотность имеют только некоторые металлы платиновой группы (индий - 22,6 г/см 3 ). Частица золота в 2,5 раза тяжелее, чем такая же по размеру частица серебра, и приблизительно в 8 раз тяжелее куска кварца, который обычно находится рядом с золотом. 1 кг золота можно представить в виде куба с ребром 37,3 мм или шара диаметром 46,2 мм. Полстакана золотого песка, добытого из россыпного месторождения, также весит около килограмма. Высокая плотность золота – это свойство, которое чаще всего используется для его извлечения из породы.
Плотность самородного золота несколько ниже, чем химически чистого, и, в зависимости от примесей в нем серебра и меди, колеблется в пределах 18—18,5.
Табл. 2. Важнейшие физические свойства и диагностические признаки золота
Цвет черты (на неглазированной фарфоровой пластинке)
Твердость по шкале Мооса
Плотность при температуре 20º C
Температура, плавления, град.С
Удельная теплопроводность при температуре 0º C , Вт/(м∙К)
Сопротивление при температуре 0º, Ом
Электропроводность по отношению к меди, %
Предел прочности отожженного золота при растяжении, МПа
Химические свойства золота
Золото (Au, от латинского Aurum) - химический элемент 1-й группы периодической системы таблицы Менделеева, атомный номер 79. Почти все природное золото состоит из изотопа 197 Au. Валентность золота в химических соединениях обычно +1, +3. За прошедшие столетия химики (а до них алхимики) провели с золотом огромное количество различных экспериментов, и оказалось, что золото вовсе не так инертно, как об этом думают неспециалисты. Правда, сера и кислород, агрессивные по отношению к большинству металлов (особенно при нагревании), на золото не действуют ни при какой температуре. Исключение – атомы золота на поверхности. При 500–700°С они образуют чрезвычайно тонкий, но очень устойчивый оксид, не разлагающийся в течение 12 часов при нагреве до 800° С. Это может быть Au2O3 или AuO(OH). Такой оксидный слой найден на поверхности крупинок самородного золота.
Не реагирует золото с водородом, азотом, фосфором, углеродом, а галогены с золотом при нагревании образуют соединения: AuF3, AuCl3, AuBr3 и AuI. Особенно легко, уже при комнатной температуре, идет реакция с хлорной и бромной водой. С этими реактивами встречаются только химики. В быту опасность для золотых колец представляет иодная настойка – водно-спиртовый раствор иода и иодида калия:
После осторожного выпаривания раствора выделяются желтые кристаллы комплексной золотохлористоводородной кислоты HAuCl4 ·3H2O. Царскую водку, способную растворять золото, знал еще арабский алхимик Гебер, живший в 9–10 веке. Менее известно, что золото растворяется в горячей концентрированной селеновой кислоте:
В концентрированной серной кислоте золото растворяется в присутствии окислителей: иодной кислоты, азотной кислоты, диоксида марганца. В водных растворах цианидов при доступе кислорода золото растворяется с образованием очень прочных дицианоауратов:
эта реакция лежит в основе важнейшего промышленного способа извлечения золота из руд - цианирования.
Действуют на золото и расплавы из смеси щелочей и нитратов щелочных металлов:
пероксиды натрия или бария: 2Au + 3BaO2 ® Ba[AuO2]2 + 3BaO,
водные или эфирные растворы высших хлоридов марганца, кобальта и никеля:
тионилхлорид: 2Au + 4SOCl2 ® 2AuCl3 + 2SO2 + S2Cl2, некоторые другие реагенты.
Интересны свойства мелкораздробленного золота. При восстановлении золота из сильно разбавленных растворов оно не выпадает в осадок, а образует интенсивно окрашенные коллоидные растворы – гидрозоли, которые могут быть пурпурно-красными, синими, фиолетовыми, коричневыми и даже черными. Так, при добавлении к 0,0075%-му раствору H[AuCl4] восстановителя (например, 0,005%-го раствора солянокислого гидразина) образуется прозрачный голубой золь золота, а если к 0,0025%-му раствору H[AuCl4] добавить 0,005%-й раствор карбоната калия, а затем по каплям при нагревании добавить раствор танина, то образуется красный прозрачный золь. Таким образом, в зависимости от степени дисперсности окраска золота меняется от голубой (грубодисперсный золь) до красной (тонкодисперсный золь).
При размере частиц золя 40 нм максимум его оптического поглощения приходится на 510–520 нм (раствор красный), а при увеличении размера частиц до 86 нм максимум сдвигается до 620–630 нм (раствор голубой). Реакция восстановления с образованием коллоидных частиц используется в аналитической химии для обнаружения малых количеств золота.
При восстановлении соединений золота хлоридом олова в слабокислых растворах образуется интенсивно окрашенный темно-пурпурный раствор так называемого кассиевого золотого пурпура (он назван так по имени Андреаса Кассия, стекловара из Гамбурга, жившего в 17 в.). Кассиев пурпур, введенный в расплавленную стеклянную массу, дает великолепно окрашенное рубиновое стекло, количество затрачиваемого при этом золота ничтожно. Кассиев пурпур применяется и для живописи по стеклу и фарфору, давая при прокаливания различные оттенки – от слаборозового до ярко-красного.
В геологических процессах подвижность золота связана с водными растворами, имеющими высокую температуру (сотни градусов) и находящимися под высоким давлением. Золото при этом может находиться в форме различных простых и смешанных комплексов: гидроксильных, гидроксохлоридных, гидросульфидных. В низкотемпературных гидротермальных условиях, а также в биосфере, миграция золота возможна в виде растворимых металлоорганических комплексов.
В нормальных природных условиях золото стойко к различным типам минеральных вод и атмосферной коррозии. Частицы золота практически не меняются с течением времени. Изделия из золота сделанные тысячи лет назад сохраняются практически неизменными в земле и морской воде. Со временем они не только не теряют своей ценности, но становятся дороже. Такая устойчивость дает основание относить золото к группе благородных металлов.
Проба золота
Количественное содержание химически чистого золота (по массе) в природном твердом растворе или сплаве (изделии) выражается пробой. В международной практике применяются метрическая (в большинстве стран, в том числе и в России) и каратная системы проб.
При метрической системе содержание металла определяется числом его единиц в 1000 единицах лигатурной массы раствора (сплава), при каратной в 24 единицах. До 1927 года в СССР, а также в дореволюционной России, действовала золотниковая система проб, при которой содержание золота определялось количеством золотников в фунте лигатурной массы (1 русский фунт = 409,5 г = 96 золотникам; 1 золотник = 4,27 г = 96 долям; 1 доля = 44,4 мг).
В метрической системе химически чистому золоту соответствует 1000-я проба, а твердый раствор (сплав), например, 750-й пробы, содержит 750 частей химически чистого золота и 250 частей примесей (лигатуры), или же 75,0% золота и 25,0% примесей.
Расчетом устанавливается взаимное отношение и перевод различных систем проб. Например, 450-я метрическая проба изделия (сплава) соответствует:
450/1000 ´ 96= 43,2 золотниковой
и 550/1000 ´ 24= 10,8 каратной пробам.
Самородное золото обладает различной пробой (наиболее часто 940-900, 890-740, 680-600-й и крайне редко 550-й). Для производства ювелирно-бытовых изделий обычно используются золотые сплавы различной пробы, так как золото в чистом виде слишком мягкое и легко истирается.
Ювелирным сплавам за счет добавления лигатурных цветных металлов (меди, серебра, реже никеля, палладия, цинка, кадмия и др.) придаются требуемые для механической обработки свойства и желательный цвет. В таблице 3 указаны наиболее часто используемые для производства ювелирных украшений сплавы и соотношение различных систем обозначения их пробы, распространенные в бывшем СССР и России.
Табл.3. Пробы и основной состав лигатуры ювелирных золотых сплавов, принятых в бывшем СССР и Российской Федерации
Система обозначения проб
*Пробы Российской Федерации
Золото в природе
Золото в небольших количествах содержится во многих горных породах. Среднее его содержание в литосфере (Кларк) составляет 4,3 мг/т.
Золото содержится в организмах и в растениях. Есть предположение, что золото имеет определенное значение для организма животных. В золе растений золото впервые обнаружено французским химиком Клодом Луи Бертолле в XVIII веке. По современным данным содержание золота в некоторых гумусовых почвах достигает 0,5 г/т. Растения, произрастающие на таких участках, поглощают золото, сосредотачивая его в корневой системе, стеблях, стволах и в ветвях. В настоящее время разработаны методы поиска месторождений (биогеохимические), основанные на выявлении ореолов с повышенным содержанием золота в золе растений.
Огромное количество золота содержится в гидросфере. Во всех видах пресных вод его среднее содержание составляет порядка 3∙10-9% (0,03 мг/т), но иногда многократно выше, например, в подземных водах золоторудных месторождений содержание золота достигает порядка 1 мг/т. На изменении содержания золота в подземных водах основан один из методов поиска золоторудных месторождений (гидрохимический метод).
В морских водах содержание золота также колеблется: в полярных морях - 0,05 мг/т, у берегов Европы - 1-3∙мг/т. Наиболее высокая концентрация золота отмечается в прибрежной зоне США - до 16 мг/т., в водах Карибского моря - 15-18 мг/т., в водах Мертвого моря - до 50 мг/т.
Океаны насыщаются золотом вследствие привноса его грунтовыми, поземными и поверхностными водами, за счет распыления метеоритов, выбросов вулканических веществ и ряда других естественных источников. Французскими исследователями было выяснено, что сицилийский вулкан Этна каждый день выбрасывает в виде мелких частиц более 2,5 кг и большая часть этого уходит в океан. По подсчетам каждый год в атмосфере Земли распыляется примерно 3,5 тыс. метеоритного вещества, содержащие примерно 18 кг золота, что составляет за миллион лет где-то 18 тыс.т. Поступление золота в океаны происходит также с речными и морскими взвесями, а также в виде растворимых металлоорганических комплексов. Циркулирующие на золотоносных площадях поверхностные и подземные водотоки содержат, как правило, золото, находящееся во взвешенном состоянии, или растворенное золото, которое может достигнуть океана. Особенно велик перенос золота речными системами. Специалисты посчитали, что только Амур в своих водах за год выносит в океан около 8,5 т золота.
Общее количество золота в водах Мирового океана оценивается в 25-27 млн.т. Это чрезвычайно много. Человечеством за все время добыто около 150 тыс.т. Ведутся изыскания технологий извлечения золота из воды океанов, запатентованы технические решения, но приемлемых экономических показателей добычи золота из воды пока не достигнуто.
В земной коре золото может находиться в сплошных горных массах— рудах или в разрушенных горных породах — россыпях. В первом случае оно называется рудным, а во втором — россыпным золотом. Россыпи обычно встречаются в долинах рек, ручейков или сухих логов и образуют более или менее мощные пласты, прикрытые слоем пустой породы, так называемыми торфами. Золото находится в россыпях в виде кусочков, чешуек, зерен и пыли.
Золото в рудных и россыпных месторождениях встречается главным образом в сплавах с серебром, медью, железом и другими металлами. Кроме этих природных сплавов золота известны также платинистое и родистое золото, в состав которых соответственно входят платина и родий. Чаще всего в состав самородного золота входит от 5 до 30 % серебра. Относительно редко, но все же встречается в природе сплав золота с 30—40% серебра, который называется электрумом. Довольно распространено в природе самородное медистое золото, состоящее из 74—80% золота, 2—16% серебра, 9—20% меди.
Больше всего в природе частиц золота размером от доли микрона до десятков микронов. Такие частицы называются дисперсными. Условно они делятся на грубодисперсные и тонкодисперсные (высокодисперсные). В грубодисперсных системах частицы имеют размеры от 1 мкм и выше, в тонкодисперсных — от 1 нм до 1 мкм (0,001 мм).
Дисперсные частицы золота есть в породах, в воде и в растениях. Такие частицы видны только в электронный микроскоп, их не удастся взвесить на лучших микроаналитических весах. Расчетная масса частицы размером 0,001 мм составляет всего 0,00000001 мг, а предел взвешивания лучших микроаналитических весов — 0,0001 мг. Количество мельчайших частиц золота несметное. В каждом грамме золота заключено больше 100 миллиардов таких частиц. При огромном количестве дисперсных частиц их извлечение представляет наибольшую трудность и обходится дороже всего.
Чрезвычайно много в природе также золотин размером порядка 0,01 мм. Самая крупная золотина этого класса (0,01 мм) имеет массу порядка 0,00001 мг и ее также невозможно взвесить на микроаналитических весах. В каждом грамме золота количество таких частиц превышает 100 миллионов. Несмотря на то, что золота мельче 0,01 мм в природе больше, чем любого другого, оно находится преимущественно в рассеянном состоянии. Иногда оно концентрируются в виде включений в некоторые минералы (пирит, арсенопирит и т.п.), но если свободное золото крупностью 0,01-0,1 мм попадает в речной поток, то оно преимущественно рассеивается. Мелкие легкие золотинки свободно переносятся во взвешенном состоянии даже при небольшой скорости течения.
Самый крупный самородок золота найден в Австралии - “Плита Холтермана” (285 кг вместе с кварцем, чистого золота 83,3 кг); на Урале найден самородок золота “Большой треугольник” (36,2 кг). Большинство крупных самородков имеют свои имена (Табл.4).

Золото — минерал, являющийся природным твёрдым раствором серебра (следы, до 43%) в золоте; обычны примеси (следы, до 0,9%) меди, железа, свинца, реже – висмута, ртути, платины, марганца и др. Известны разновидности с повышенным содержанием меди – до 20% (медистое золото, купроаурит), висмута – до 4% (висмутистое золото, висмутаурит), платиноидов (платинистое и иридистое золото; порпецит – Au, Pd, родит – Au, Rh), природные амальгамы (Au, Hg).
СТРУКТУРА
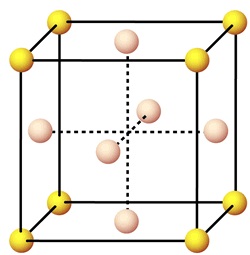
Кристаллическая структура золота
Кристаллизуется в кубической сингонии, в виде октаэдров, ромбододекаэдров, кубов и более сложных по форме кристаллов; нередко они искажены, сильно вытянуты, образуя “проволочки”, “волоски”, или уплощены параллельно грани октаэдра. Для самородного золота особенно низкопробного, характерно многообразие форм роста, оно обычно в виде скелетных кристаллов, дендритов, нитевидных и скрученно-нитевидных кристаллов. Широко распространены прожилковидные и неправильные комковидные, “крючковатые” выделения; на их поверхности нередко сохраняются отпечатки кристаллов других минералов, агрегаты которых включали скопления самородного золота. Травление выявляет кристаллически-зернистое строение золотых частиц.
СВОЙСТВА

Золотые слитки и самородки
Золото — очень тяжёлый металл: плотность чистого золота равна 19,32 г/см³ (шар из чистого золота диаметром 46,237 мм имеет массу 1 кг). Диамагнетик, то есть, магнитное поле в золоте ослабевает. Среди металлов по плотности занимает седьмое место после осмия, иридия, рения, платины, нептуния и плутония. Сопоставимую с золотом плотность имеет вольфрам (19,25). Высокая плотность золота облегчает его добычу, отчего даже простые технологические процессы — например, промывка на шлюзах, — могут обеспечить высокую степень извлечения золота из промываемой породы.
Золото — очень мягкий металл: твёрдость по шкале Мооса ~2,5, по Бринеллю 220—250 МПа (сравнима с твёрдостью ногтя).
Золото также высокопластично: оно может быть проковано в листки толщиной до ~0,1 мкм (100 нм) (сусальное золото); при такой толщине золото полупрозрачно и в отражённом свете имеет жёлтый цвет, в проходящем — окрашено в дополнительный к жёлтому синевато-зеленоватый. Золото может быть вытянуто в проволоку с линейной плотностью до 2 мг/м.
Температура плавления золота 1064,18 °C (1337,33 К), кипит при 2856 °C (3129 К). Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см 3 при температуре плавления. Жидкое золото довольно летучее, и активно испаряется задолго до температуры кипения.
ЗАПАСЫ И ДОБЫЧА

Содержание золота в земной коре очень низкое — 4,3·10 -10 % по массе (0,5-5 мг/т), но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. Один литр и морской, и речной воды содержит менее 5·10 −9 граммов Au, что примерно соответствует 5 килограммам золота в 1 кубическом километре воды.
Золоторудные месторождения возникают преимущественно в районах развития гранитоидов, небольшое их количество ассоциирует с основными и ультраосновными породами.
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). С развитием современных технологий более популярными становятся химические способы.
В 1947 году американские физики Ингрем, Гесс и Гайдн проводили эксперимент по измерению эффективного сечения поглощения нейтронов ядрами ртути. В качестве побочного эффекта эксперимента было получено около 35 мкг золота. Таким образом, была осуществлена многовековая мечта алхимиков — трансмутация ртути в золото. Однако экономического значения такое производство золота не имеет, так как обходится во много раз дороже добычи золота из самых бедных руд.
ПРОИСХОЖДЕНИЕ

Изделия из золота
Самородное золото – главная форма нахождения золота в природе. Оно концентрируется в гидротермальных месторождениях образуя золотые руды, неравномерно распределяясь в трещиноватом жильном кварце и в сульфидах – пирите, арсенопирите, пирротине и др. В существенно сульфидных рудах самородное золото тонкодисперсное. При окислении руд на земной поверхности мелкое самородное золото частично растворяется и переотлагается; в ряде случаев оно обогащает верхние части рудных тел. Процессы их разрушения приводят к освобождению частиц самородного золота и их накоплению в россыпях; перемещаясь водными потоками вместе с другим кластическим материалом, частицы окатываются, округляются, деформируются, частично перекристаллизовываются; в результате электрохимической коррозии на них образуется тонкая оболочка высокопробного золота, что приводит к общему повышению пробы самородного золота в россыпях.
ПРИМЕНЕНИЕ

По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе. Тонкий слой золота (20 нм) на внутренней поверхности оконных и витражных стекол существенно уменьшает нежелательные тепловые потери зимой, а летом предохраняет внутренние помещения зданий и транспортных средств от нагревания инфракрасными лучами.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия. Стойкость к коррозии таких сплавов определяются, в основном, содержанием в них золота, а цветовые оттенки и механические свойства — соотношением серебра и меди.
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза, ревматоидных артритов и т. д.). Радиоактивный изотоп 198 Au (период полураспада 2,967 сут.) используется при лечении злокачественных опухолей в радиотерапии.
Некоторые свойства золота сделали его одним из самых ценных металлов на Земле. Чистое золото — это элемент и минерал. Люди ценят его за привлекательный внешний вид, способность длительное время сохранять яркий цвет и ряд других уникальных свойств. Золото было названо самыми красивым из всех химических элементов. Это первый металл, который люди стали использовать в чистом виде. Он применяется в ювелирном деле, изготовлении монет и произведений искусства на протяжении тысяч лет.

Распространение в окружающем мире
Золото можно найти главным образом в виде самородков. Следовые количества его встречаются повсеместно, но крупные месторождения находятся лишь в нескольких местах. Оно может находиться как в чистых золоторудных залежах, так и комплексно с иными, родственными металлами. Рудное или жильное золото располагается в первичных залежах, а промывное или рассыпное находится во вторичных. Жильные залежи, в зависимости от того, как глубоко находятся от поверхности земли, делятся на высокотемпературные и низкотемпературные. Присутствие в породе серебра или меди придает разный оттенок: от золотисто-желтого до серебристо-белого. Примесь меди дает ей розоватый тон с металлическим блеском.
Мировой океан содержит золото в количестве 5–10 мг на 1 т воды, поэтому промышленным способом добывать его из морской воды невыгодно. Золото содержится как в виде самородков, так и в составе руд. Кроме того, встречается в виде соединений с сероводородом, которые залегают в геотермальных водах. Получают металл несколькими способами:
- вымыванием из золотосодержащей породы;
- амальгамным способом;
- цианидным способом.
Уровень чистоты золота и присутствия в нем лишних примесей обозначается пробой. Она записывается в промилле (%о) и показывает процент чистого золота. Так, 560 проба означает, что в образце содержится 560%о и 440%о чужих примесей.
Физические характеристики металла
Золото представляет блестящий металл желтого цвета. В процессе нагревания происходит его окисление и появляется красноватый оттенок (червонный). Основные физические свойства золота следующие:
- температура плавления – 1063ºС;
- плотность – 19,32 г/см3;
- твердость (по шкале Мооса) — 2,5–3;
- температура кипения – 2700ºС.

Металл имеет достаточно хорошие отражательные свойства, пластичный и легко полируется. 1 г Au возможно раскатать в лист толщиной не более 0,0001 мм или растянуть в длинную проволоку (до 3,5 м). Золото из-за его мягкости в чистом виде почти не применяется. Сплавы с иными металлами снижают температуру плавления, изменяя механические характеристики Au. Это свойство давно используется в производстве: для нанесения позолоты, изготовления зубных протезов и различных изделий.
Виды сплавов
В золотых сплавах дополнительными компонентами могут выступать: серебро, медь, никель, палладий, платина, цинк, кадмий. Каждое из веществ имеет свое влияние на золото и свойства сплава:
- Серебро несколько понижает температуру плавления, при этом изменяя цвет Au, но сохраняет прочность на прежнем уровне. Высокое содержание Ag влечет за собой изменение цвета от желтого к более светлому.
- Медь несколько повышает твердость соединения, сохраняя при этом пластичность и ковкость. Когда содержание Cu достигает 14,6%, сплав приобретает ярко-красный тон. Основным недостатком такого легирования является понижение антикоррозионных свойств. Сплав может потемнеть, если меди содержится слишком много.
- Никель тоже меняет твердость соединений, повышая ее, и придает соединению белый цвет с едва уловимым желтым оттенком.
- Палладий изменяет (повышает) температуру плавления Au и придает сплаву белый цвет со стальным оттенком. Такое золото качественно превосходит прочие соединения и считается более благородным.
- Платина придает золоту совершенный белый цвет, удаляя желтизну.

Золото считается одним из самых тяжелых металлов. Поэтому часто для объемных изделий используется золочение — покрытие тонким слоем драгметалла. Проводится оно накатыванием фольги или методом гальваники с применением электролита, а также способом автокаталитической реакции. Подобные покрытия отличают высокая стойкость и светоотражающие свойства. Золоченые детали используются в радиоаппаратуре, на рентгеновских аппаратах.
Химические свойства
Au, как все благородные металлы, пассивный химический элемент. Вещество не окисляется на воздухе, проявляет инертность к большинству как неорганических, так и органических веществ. На золото не действуют концентрированные кислоты и щелочи. Исключение составляют нагретая селеновая кислота и “царская водка” (соединение концентрированных соляной и азотной кислот), растворяясь в которой Au образует кислоту — золотохлористоводородную. Валентность металла может изменяться по типу соединения и составляет +1 или +3. Au легко восстанавливается из соединений. При нагревании оно вступает в химическую реакцию с галогенами, при нормальной температуре образует связи с хлорной и бромной водой. С прочими неметаллами золото не взаимодействует.

При воздействии на тонкие листы или порошок данного металла хлором при 200ºС образуется хлорид золота со степенью окисления +3. При растворении в воде красные иглы данного соединения образуют комплексное соединение с кислотными свойствами, окрашивающее раствор в красно-коричневый цвет. Воздействуя на хлорид золота едкой щелочью, можно получить гидроксид металла желто-коричневого цвета, который имеет свойства кислоты и потому носит название золотой кислоты, его соли – аураты. Последние неустойчивы и разлагаются при повышении температуры, с рядом органических веществ они образуют взрывчатые смеси.
Химические свойств элемента дают возможность определять подлинность золота в домашних условиях. Капля водно-спиртового йода оставляет на металле 585 и 583 пробы темные трудновыводимые пятна. Золото высоких проб не реагирует с йодом.
Золото в медицинских целях
Драгоценный металл применяется в терапии как масляная взвесь (кризанил) и водный раствор (санкризин и солганал). Препараты назначаются в виде инъекций для лечения ревматического артрита, эритематозной волчанки.
После открытия радиоактивных изотопов роль Au для медицины возросла. Коллоидные растворы применяют для терапии раковых опухолей, а также для обследования печени, селезенки и других органов.
В чистом виде золото представляет собой мягкий металл, легко узнаваемый по блестящему желтому цвету, – на протяжении многих веков люди сравнивали его с солнцем. Однако в природе золото многолико. Примеси из других элементов придают ему красный оттенок, а в тонких пластинах металл просвечивает светло-зеленым цветом. Также при определенной реакции он может менять цвет на бледно-желтый или серебристо-желтый. Встречаются и другие минералы, похожие на него. Чтобы не запутаться, необходимо знать основные физические свойства золота.
Высокая плотность золота
Золото имеет высокую плотность – 19,32 г/куб.см., соответственно – его можно считать одним из самых тяжелых металлов в мире. Тяжелее него лишь три элемента:
Так, золотой кубик с длиной сторон 3,7 сантиметров весит 1 килограмм. Кубический метр металла весит 19 320 килограмм. Для сравнения возьмем кубический метр железа – он будет равен 7 874 килограммам. Сопоставимую с этим металлом плотность имеет только вольфрам. В связи с этим самые элементарные технологические процессы (к примеру, промывка на шлюзах) способны обеспечить полное извлечение металла из породы.
Низкая твердость золота

Температура плавления и кипения
Золото имеет следующие физические показатели:
- температура плавления – до 1064,43°С;
- температура кипения – до 2947°С.
В процессе плавления золото меняет свой цвет, приобретая зеленый оттенок. В случае его нагревания выше указанной температуры металл улетучивается. Также золото отличается отличной тепловой проводимостью, устойчивостью к процессу окисления и минимальным уровнем электрического сопротивления.
Пластичность и ковкость
Золото и инфракрасный свет
Еще одним свойством металла можно назвать хорошее отражение инфракрасного света. Благодаря этому золото используют в процессе остекления многоэтажных домов. Покрытие стекла тонким напылением не дает инфракрасным лучам проникнуть в помещение, чем снижает затраты на его охлаждение. Соединение золота с пластиком применяется при изготовлении шлемов космонавтов. Оно помогает избежать излучению, но, при этом, пропускает достаточное количество света.
Выводы о физических свойствах золота
Физические свойства золота обеспечивают ему активное использование в разных областях, включая микроэлектронику. В совокупности эти качества позволили золоту занять лидирующее место среди всех драгоценных металлов.
Читайте также:

