Взаимодействие молекул жидкости кратко
Обновлено: 02.07.2024
Жидкость представляет собой вещество, пребывающее в промежуточном между твердым и газообразным состоянии. Это такое агрегатное состояние вещества, в котором прослеживается взаимосвязь молекул и атомов между собой таким образом, что это дает ему возможность сохранения своего объема, но при это, не настолько сильно, чтобы добиться сохранения еще и формы.
Рисунок 1. Взаимодействие молекул жидкостей. Автор24 — интернет-биржа студенческих работ
Молекулярно-кинетическая теория направлена на исследование строения и свойств вещества на основе представлений о существовании атомов и молекул в качестве наименьших частиц химических веществ. В основу данной теории положены три основные положения:
- Все вещества (как жидкие, так и газообразные, и твердые) появились из мельчайших частиц (молекул, состоящих из атомов). Молекулы химического вещества существуют в виде простых и сложных (состоящих из одного либо нескольких атомов).
- Молекулы и атомы являются электрически нейтральными частицами. При определенных условиях они способны к приобретению дополнительного электрического заряда и превращаются в положительные (отрицательные) ионы.
- Атомы и молекулы пребывают в непрерывном хаотическом движении. Частицы между собой осуществляют взаимодействие за счет сил, обладающих электрической природой. При этом гравитационное взаимодействие между частицами оказывается пренебрежимо малым.
Свойства и строение жидкостей
Жидкости склонны к легкому изменению своей формы с сохранением объема. В стандартных условиях они привычно принимают форму емкости, в которой находятся. Поверхность жидкости, что не соприкасается со стенками сосуда, называется свободной. Ее образование происходит вследствие воздействия силы тяжести на молекулы жидкости.
Готовые работы на аналогичную тему
Свойства жидкостей можно объяснить малыми промежутками между их молекулами малы. Так, молекулы упакованы настолько плотным образом, что расстояние между каждыми двумя из них оказывается меньше их размеров.
Молекулярная теория воды
Существует ряд определенных гипотез, объясняющих строение льда, пара, воды. Все они в какой-то степени опираются на молекулярно-кинетическую теорию строения вещества, чьи основы заложил М. Ломоносов.
Рисунок 2. Масса и размеры молекул. Автор24 — интернет-биржа студенческих работ
Данная теория исходит из принципов классической механики, что рассматривает молекулы (атомы) в формате шариков правильной формы, электрически нейтральных, идеально упругих. Такие молекулы склонны подвергаться исключительно механическим соударениям и не испытывать каких-либо электрических сил взаимодействия.
Водяной пар, согласно положениям молекулярно-кинетической теории, представляет собрание молекул, расстояние между ними многократно превышает размеры самих молекул. Молекулы газа, пребывающие в непрерывно-хаотическом движении, пробегают путь между стенками сосудов, где заключен газ и при этом происходит их столкновение между собой на данном пути.
При приближении температуры газа к температуре кипения (100°C) наступает уменьшение скорости молекул, и при соударении силы притяжения между ними возникает больше сил упругих отталкиваний в момент удара. По этой причине газ способен конденсироваться в жидкость.
Жидкость, в отличие от газа, является совокупностью близкорасположенных между собой молекул. Это расположение настолько близкое, что между ними начинается проявление сил взаимного притяжения. Это не позволяет молекулам жидкости разлетаться в разные стороны, подобно молекулам газа, а только колебаться около собственного равновесного положения.
Наряду с тем, из-за недостаточной плотности строения жидкости, в ней присутствуют свободные места, вследствие чего (исходя из теории Френкеля), обладающие большей энергией молекулы начинают вырываться из своего привычного окружения и скачкообразно перемещаться в соседнее отверстие на расстоянии, равном размерам самих молекул.
В случае охлаждения жидкости можно наблюдать обратный процесс. Начинается уменьшение скоростей колебательного движения молекул, становится более прочной структура жидкости, а сама она переходит в состояние льда (кристаллическое).
Структура воды в трех ее агрегатных состояниях
Проблема оценки структуры воды пока представляет для ученых определенные сложности. Наиболее популярной считается гипотеза, предложенная в 1883 году Уайтингом.
В ней утверждается, что:
- в качестве основной строительной единицы водяного пара выступает молекула гидроль (моногидроль);
- основной строительной единицей воды будет являться двойная молекула дигидроль;
- лед считается состоящим из тройных молекул тригидроль.
На данных представлениях основывается гидрольная теория структуры воды, согласно которой водяной пар считается состоящим из комплекса простейших молекул моногидроля, их ассоциаций и также из незначительного числа молекул дигидроля.
В жидком виде вода считается смесью молекул моногидроля, дигидроля и тригидроля. Соотношение количества таких молекул в воде будет различным и зависимым от температуры. Поскольку молекула воды сама по себе несимметрична, центры тяжести положительных и отрицательных зарядов у нее не будут совпадать.
Рисунок 3. Полярные молекулы. Автор24 — интернет-биржа студенческих работ
Молекулы обладают двумя полюсами – положительным и отрицательным, создающими, подобно магниту, силовые молекулярные поля. Такие молекулы называются полярными (диполями). Количественная характеристика полярности при этом определяется электрическим моментом диполя.
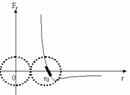
На расстоянии r0 , примерно равном сумме радиусов молекул, F=0, т.к. = . При r r0 - притяжение. Утолщенный участок - выполнение закона Гука (малые деформации).
На рисунке - график зависимости потенциальной энергии от расстояния.
При Eполн=E1: если частица движется справа налево из бесконечности, то в точке r0потенциальная энергия минимальна. В точке r1 полная энергия равна потенциальной энергии отталкивания, а кинетическая энергия равна нулю - точка поворота. Дальше молекула движется в положительном направлении оси r и уходит в бесконечность
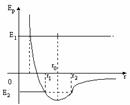
При Eполн=E2 СВОЙСТВА ТВЕРДЫХ, ЖИДКИХ И ГАЗООБРАЗНЫХ ТЕЛ.
Состояние
вещества.
Расположение частиц.
Характер движения частиц.
Соотношение между кинетической энергией молекул и потенциальной энергией межмолекулярного взаимодействия.
Некоторые свойства.
Твердое.
Расстояния сравнимы с размерами частиц. Истинно твердые тела имеют кристаллическую структуру (дальний порядок упорядоченности).
Колебания около положения равновесия.
Потенциальная много больше кинетической. Силы взаимодействия большие.
Сохраняют форму и объем. Упругость. Прочность. Твердость. Имеют определенную точку плавления и кристаллизации.
Жидкое
Расположены почти вплотную друг к другу. Наблюдается ближний порядок упорядоченности.
В основном колеблются около положения равновесия, изредка перескакивая в другое. С повышением температуры время оседлой жизни уменьшается.
Кинетическая энергия лишь незначительно меньше по модулю потенциальной энергии.
Сохраняют объем, но не сохраняют форму. Мало сжимаемы. Текучи.
Газообраз-ное.
Расстояния много больше размеров частиц. Расположение совершенно хаотическое.
Хаотическое движение с многочисленными столкновениями. Скорости сравнительно большие.
Кинетическая энергия много большепотенциальной по модулю.
Не сохраняют ни форму, ни объем. Легко сжимаемы. Заполняют весь предоставленный им объем.
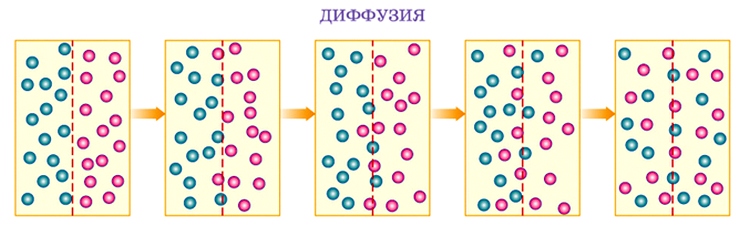
Диффузия — явление проникновения молекул одного вещества в промежутки между молекулами другого вещества.
Мы ощущаем запах духов на некотором расстоянии от флакона. Это объясняется тем, что молекулы духов, так же как и молекулы воздуха, движутся. Между молекулами существуют промежутки. Молекулы духов проникают в промежутки между молекулами воздуха, а молекулы воздуха — в промежутки между молекулами духов.
Опыты показывают, что диффузии в газах — самый быстрый процесс, в жидкостях он протекает гораздо медленнее, но может наблюдаться даже в твердых телах. Соединив гладко отполированными поверхностями два бруска из разных металлов, например из меди и алюминия, и оставив их в таком положении на длительное время (на 4—5 лет), мы обнаружим их сращивание за счет проникновения атомов меди в алюминиевый образец и, наоборот, проникновения атомов алюминия в медный.
Диффузия в газах происходит быстрее, чем в жидкостях, потому, что газы имеют меньшую плотность, чем жидкости, т.е. молекулы газов расположены на больших расстояниях друг от друга. Ещё медленнее происходит диффузия в твёрдых телах, поскольку молекулы твёрдых тел находятся ещё ближе друг к другу, чем молекулы жидкостей.
Скорость диффузии зависит не только от агрегатного состояния вещества, но и от температуры. При более высокой температуре диффузия будет происходить быстрее. Это происходит потому, что при повышении температуры быстрее движутся молекулы. Скорость движения молекул и температура тела взаимосвязаны. Чем больше средняя скорость движения молекул тела, тем выше его температура.
Проявление диффузии: окрашивание, склеивание, проникновение питательных веществ из кишечника в кровь.
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создают давление газа.
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил название среднее время оседлой жизни (или среднее время релаксации) и обозначается буквой τ. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10 -11 с. Время одного колебания составляет 10 -12 …10 -13 с.
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Читайте также:

