Возрастные особенности миелинизации кратко
Обновлено: 05.07.2024
Черепные нервы у новорожденных четко специализированы, но развитие их не завершено. Макроскопически они представлены неодинаково: более крупными являются обонятельные, зрительные, блуждающие; другие (например, лицевой) - относительно тонкие.
Раньше других миелинизируются волокна преддверного нерва (проводят импульсы от рецепторов гравитации)- на 4 месяце внутриутробного развития. Миелинизация остальных
головных нервов ,начинается на 7 месяце пренатального развития. Двигательные нервы миелинизируются раньше, чем чувствительные. К моменту рождения в значительной степени миелинизированы глазодвигательный, блоковой, отводящий; меньше - двигательная часть тройничного нерва.
После рождения процесс миелинизации продолжается до 15 месяцев жизни в следующем порядке: лицевой, подъязычный, двигательная часть тройничного, далее - чувствительная часть тройничного, блуждающий, языкоглоточный, зрительный нервы. В течение первых лет жизни формируются связи черепных нервов между собой и добавочного нерва с ветвями шейного сплетения.
Развитие с п и н н о м о з г о в ы х нервов у новорожденных не завершено. Нервы характеризуются меньшим числом ветвей и малым количеством связей. Спинномозговые нервы отчетливо контурированы, относительно крупные в диаметре. Вентральный корешок миелинизирован, дорзальный - не полностью. Корешки грудных спинномозговых нервов приобретают миелиновые чехлы позднее, чем корешки шейных и поясничных нервов.
Спинномозговые нервы заканчивают процесс миелинизации к 3-5 годам. С возрастом происходит увеличение поперечника нервных стволов, в основном за счет эпиневральной клетчатки у новорожденных развитие в е г е т а т и в н о й нервной системы не завершено: нервные клетки в симпатических и парасимпатических узлах не дифференцированы.
В ганглиях симпатического отдела клетки мелкие и содержат только основные дендриты, добавочные - образуются после рождения, и этот процесс продолжается в течение всего периода детства. Клетки ганглиев растут быстро до 3 лет, затем рост их замедляется.
В парасимпатических ганглиях новорожденных клетки дендритов не имеют, они появляются после рождения и растут от 3 до 14 лет. Раньше других в постнатальном периоде дифференцируются нейроны вегетативных сплетений пищеварительного тракта.
Солнечное сплетение новорожденных состоит из большого числа нервных узелков, соединенных тонкими нервными ветвями. К пубертатному периоду из них формируются 2-3 узла, соответствующие взрослому.
Черепные нервы у новорожденных четко специализированы, но развитие их не завершено. Макроскопически они представлены неодинаково: более крупными являются обонятельные, зрительные, блуждающие; другие (например, лицевой) - относительно тонкие.
Раньше других миелинизируются волокна преддверного нерва (проводят импульсы от рецепторов гравитации)- на 4 месяце внутриутробного развития. Миелинизация остальных
головных нервов ,начинается на 7 месяце пренатального развития. Двигательные нервы миелинизируются раньше, чем чувствительные. К моменту рождения в значительной степени миелинизированы глазодвигательный, блоковой, отводящий; меньше - двигательная часть тройничного нерва.
После рождения процесс миелинизации продолжается до 15 месяцев жизни в следующем порядке: лицевой, подъязычный, двигательная часть тройничного, далее - чувствительная часть тройничного, блуждающий, языкоглоточный, зрительный нервы. В течение первых лет жизни формируются связи черепных нервов между собой и добавочного нерва с ветвями шейного сплетения.
Развитие с п и н н о м о з г о в ы х нервов у новорожденных не завершено. Нервы характеризуются меньшим числом ветвей и малым количеством связей. Спинномозговые нервы отчетливо контурированы, относительно крупные в диаметре. Вентральный корешок миелинизирован, дорзальный - не полностью. Корешки грудных спинномозговых нервов приобретают миелиновые чехлы позднее, чем корешки шейных и поясничных нервов.
Спинномозговые нервы заканчивают процесс миелинизации к 3-5 годам. С возрастом происходит увеличение поперечника нервных стволов, в основном за счет эпиневральной клетчатки у новорожденных развитие в е г е т а т и в н о й нервной системы не завершено: нервные клетки в симпатических и парасимпатических узлах не дифференцированы.

В ганглиях симпатического отдела клетки мелкие и содержат только основные дендриты, добавочные - образуются после рождения, и этот процесс продолжается в течение всего периода детства. Клетки ганглиев растут быстро до 3 лет, затем рост их замедляется.
В парасимпатических ганглиях новорожденных клетки дендритов не имеют, они появляются после рождения и растут от 3 до 14 лет. Раньше других в постнатальном периоде дифференцируются нейроны вегетативных сплетений пищеварительного тракта.
Солнечное сплетение новорожденных состоит из большого числа нервных узелков, соединенных тонкими нервными ветвями. К пубертатному периоду из них формируются 2-3 узла, соответствующие взрослому.
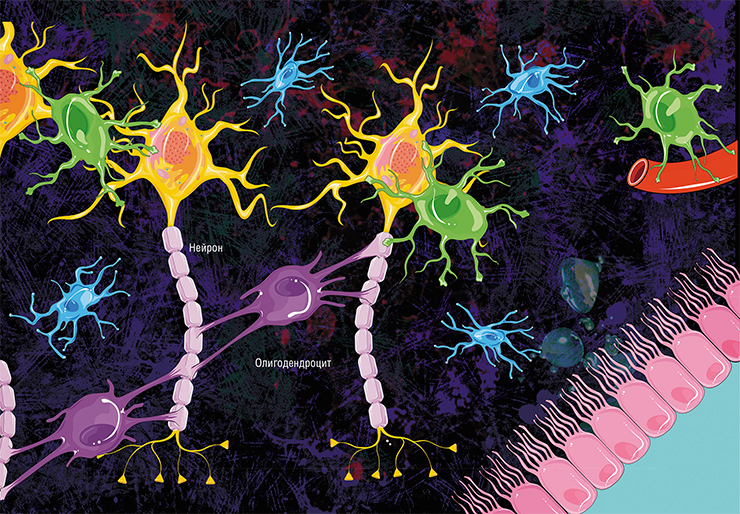
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета.
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов.
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
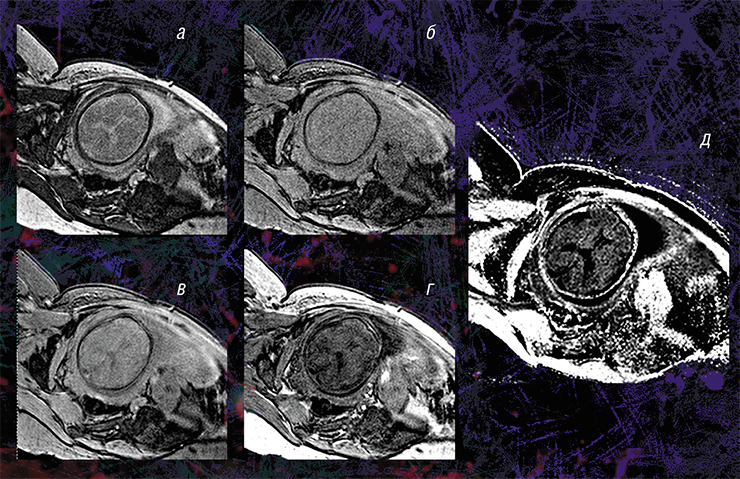
Карта МПФ (д) реконструируется с помощью специальной математической программы из четырех видов исходных изображений: в режиме переноса намагниченности (а) и протонной плотности (б), референсного (в) и анатомического (г), которые можно получить на обычном томографе
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
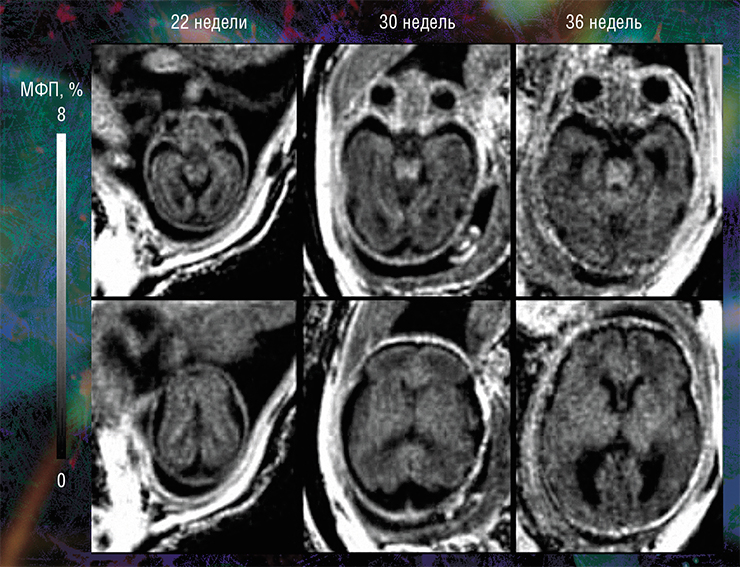
Наиболее высокие значения МФП и, соответственно, степени миелинизации выявлены в стволовых структурах головного мозга плода. Меньшие значения МПФ обнаружены в таламусе и мозжечке, а минимальные — в полушариях головного мозга. При этом количество миелина в центральных мозговых структурах стабильно увеличивается с эмбриональным возрастом
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
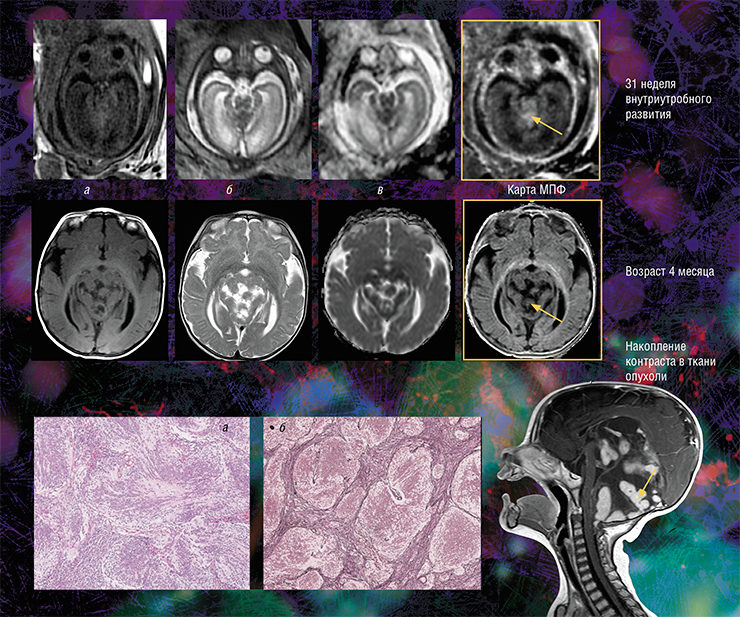
Медуллобластома — злокачественная опухоль центральной нервной системы, развивающаяся из эмбриональных клеток и локализующаяся преимущественно в мозжечке. Она составляет пятую часть всех опухолей головного мозга у детей. Формирование у ребенка врожденной медуллобластомы удалось проследить с внутриутробного периода. На традиционных МРТ-изображениях головного мозга (карте коэффициента диффузии воды — а и анатомических изображениях с различным контрастом — б, в) опухоль можно диагностировать после рождения: например, она хорошо видна в возрасте 4 месяцев. Однако в последнем семестре беременности опухоль не выделяется на фоне окружающей ткани, но ее можно увидеть на МПФ-карте, потому что медуллобластома содержит большое количество коллагена, влияющего на величину детектируемого сигнала МРТ. Справа — МРТ-изображение нервной системы больного в возрасте 4 месяцев, полученное при обычном сканировании с контрастным усилением. В возрасте 5,5 месяцев ребенку была сделана оперативная резекция опухоли. Внизу — гистологические срезы опухолевых фрагментов, окрашенных гематоксилин-эозином (а) и импрегнированных серебром (б), на которых видны множественные слившиеся опухолевые узлы, окруженные фиброзными волокнами, в состав которых входит коллаген. Фото из архива НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва)
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)

В марте 2018 года в журнале Nature была опубликована статья американских исследователей John H. Gilmore, Rebecca C. Knickmeyer, Wei Gao о развитии головного мозга у детей в период с рождения и до 2 лет, в которой они при помощи анализа описательных исследований проследили его структурные и функциональные изменения, их роль в развитии психических расстройств, а также попытались установить возможные признаки будущих отклонений в нервно-психической сфере.
Все наши знания о строении головного мозга базируются на множестве посмертных исследований, которые в большинстве случаев ограничены поперечным дизайном. Согласно данным работам, объём головного мозга ребёнка в возрасте 2 – 3 недель составляет около 35% от объёма головного мозга взрослого. К концу второго года жизни данная цифра увеличивается до 80%. После этого рост головного мозга становится более равномерным.

Нейроонтогенез человека на клеточном уровне
Сразу же после рождения значительно увеличиваются объёмы серого и белого веществ. Но, в отличие от белого, которое растёт постепенно и практически до 30 лет, серое вещество увеличивается быстрее и замедляет свой рост уже к подростковому возрасту.
Корковый слой достигает пика своего роста к 1 – 2 годам, а затем его рост прекращается. Особенно быстро растут извилина Гешля, Роландова борозда, передняя центральная извилина. Площадь поверхности мозга расширяется вплоть до 8 – 12 лет. Её рост также гетерогенен по областям: кора латеральной лобной, латеральной теменной и затылочной долей мозга развиваются быстрее, чем орбитальная часть лобной доли и центральная доля. В целом рисунок извилин головного мозга, примерно, одинаков как у новорожденных, так и у взрослых.

Структурное развитие мозга в раннем детстве: созревание миелина
С рождения начинается миелинизация нервных волокон, распространяясь с мозжечка, моста и внутренней капсулы и продолжаясь от валика мозолистого тела, зрительных путей до затылочных, теменных долей и передней части лобной и височной долей.

Оценочные траектории структурных параметров головного мозга в течение развитии. FA – фракционная анизотропия
Не меньший интерес представляет развитие нервных сетей, так как их структурные и функциональные нарушения ведут к различным нервно-психическим заболеваниям. Согласно множеству исследований, нервные центры появляются ещё до рождения. Это показано путём проведения МРТ недоношенным детям в сравнении с обследованиями здоровых детей. Первыми появляются сенсомоторные, зрительные и слуховые центры. Они располагаются в тех же зонах мозга, что и у взрослых.
Языковой центр у взрослых располагается более латерально и окружён нижней лобной и верхней височной извилинами. Иерархия областей головного мозга также закладывается с рождения.
В настоящее время имеются исследования, указывающие на то, что разница в структуре и функциональной активности головного мозга, зависящая от пола, имеется с рождения. Например, при рождении мозг мужчин на 6% больше, чем у женщин. Медиальная часть височной доли коры головного мозга и Роландова борозда также больше у мужчин, в то время как у женщин преобладают моторные и зрительный центры. Мозг мужчин увеличивается более быстро, чем у женщин. После двухлетнего возраста процесс гирификации более выражен у мужчин (но не в период от 0 до года). Нервные волокна некоторых мозговых структур быстрее подвергаются миелинизации у женщин, чем у мужчин (например, мозолистое тело). В раннем возрасте нервные сети примерно одинаковы у обоих полов. Но затем в процессе развития связи между амигдалой и средней височной извилиной, постцентральной извилиной и гиппокампом сильнее у женщин. У мужчин в свою очередь преобладают связи между амигдалой и зонами, ответственными за страх. Все эти различия способствуют последующей дифференциации в выработке гормонов, в поведенческих паттернах.
Изучая головной мозг со стороны его структурных особенностей в зависимости от пола, мы можем приблизится к пониманию половых особенностей психических расстройтв. Как и пол, наследственность также играет роль в общем объёме мозговой ткани, развитии корковых структур, распределении серого и белого веществ. Некоторые исследования отмечают генетические влияния на структуру и функциональные особенности головного мозга. Особенно обращают на себя внимания гены, контролирующие процесс транскрипции, регуляторы хроматина, РНК-связывающий белок.
Есть исследования, доказывающие, что социо-экономические факторы играют не последнюю роль в структурном развитии головного мозга. Мозг детей, чьи семьи имеют небольшой доход, подвергающихся родительской депривации, имеет меньший объём серого вещества в коре, гиппокампе, амигдале. При этом различий в белом веществе не обнаруживается. С возрастом влияние социо-экономических факторов становится ещё заметнее.
Также обнаружено влияние стресса, депрессии и тревоги матери во время беременности на последующее развитие мозга её ребёнка. В частности, повышенный уровень кортизола у матери коррелирует с большим размером амигдалы у семилетних девочек.
Депрессия матери, вероятно, приводит к уменьшению коркового слоя у ребёнка. У детей, чьи матери испытывали тревогу во время беременности, в период с рождения до полугода рост гиппокампа происходит медленнее. Существуют исследования, подтверждающие влияние алкоголя и наркотических веществ на развитие головного мозга. Так, приём кокаина во время беременности ведёт к нарушению связи между амигдалой и срединной префронтальной корой, между таламусом и фронтальной корой.
Некоторые исследования ещё в раннем детстве обнаруживают нарушения развития головного мозга, являющиеся предикторами развития нервно-психических заболеваний,. Например, изменения в объёме серого и белого веществ ведёт к отставанию в росте всех структур головного мозга.
В настоящее время есть исследования, демонстрирующие, что у новорождённых мальчиков, имеющих родственников, страдающих шизофренией, головной мозг содержит больше серого вещества по сравнению с контрольной группой. У детей с риском развития аутизма до шести месяцев проявление фракционной анизотропии на МРТ выше, чем в норме; после 6 месяцев данный показатель снижается, и к году достигает меньшего уровня, чем в популяции.
Сильная связь между амигдалой, передней инсулой и вентральным стриатумом, возможно, является предиктором развития тревожных расстройств. Существует исследование, показавшее небольшое, но тем не менее статистически значимую зависимость между миелинизацией нервных волокон в лобной и височной долях и речевым развитием в возрасте от 3 месяцев до 4 лет, а также между общей миелинизацией головного мозга и уровнем когнитивного развития в этот же возрастной период.
Описательные исследования показали нам, что головной мозг с момента рождения до года претерпевает множество изменений: быстрый рост серого вещества, миелинизация, развитие мозговых структур, гирификация. После двух лет процесс развития замедляется.
Благодаря описательным исследованиям нам удалось проследить влияние наследственности, генных факторов, социальной среды, индивидуальных особенностей на развитие мозга, удалось обнаружить предикторы риска нервно-психических расстройств. Возможно, подобные исследования дадут нам в будущем возможность обнаруживать биомаркёры этих заболеваний задолго до того, как они проявятся клинически. Это даст нам возможность более мягко вмешаться в развитие головного мозга, что в последующем приведёт к более благоприятным исходам нервно-психических заболеваний.
Подготовила : Вирт К.О.
Источники : Gilmore J.H. et al. Imaging structural and functional brain development in early childhood. Nat Rev Neurosci. 2018 Feb 16;19(3):123-137. doi: 10.1038/nrn.2018.1.
Дорогой читатель, в благодарность ты можешь материально поддержать наш проект или конкретно автора данной статьи, написав его фамилию в сопроводительном письме денежного перевода.
Такая поддержка являются пока единственным способом развития нашего проекта.
Сбербанк – 5469 5500 1827 1533 ЯндексДеньги – 410011063875586 Сбербанк – 5469 5500 1827 1533 ЯндексДеньги – 410011063875586 Сбербанк – 5469 5500 1827 1533 ЯндексДеньги – 410011063875586
Читайте также:

