Воспроизведенный лекарственный препарат это кратко
Обновлено: 05.07.2024
Главная → Архив → 2016 год, выпуск №2 → ОРИГИНАЛЬНЫЕ И ВОСПРОИЗВЕДЕННЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
ОРИГИНАЛЬНЫЕ И ВОСПРОИЗВЕДЕННЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
А.В. ЩУЛЬКИН 1,2 , Н.М. ПОПОВА 1 , И.В. ЧЕРНЫХ 1
Рязанский государственный медицинский университет им. акад. И.П. Павлова, г. Рязань (1) Городская клиническая больница №11, г. Рязань (2)
Популярные статьи
2017 год, выпуск №2
2017 год, выпуск №2
2018 год, выпуск №2
2016 год, выпуск №2
2013 год, выпуск №1
Наука молодых (Eruditio Juvenium)
© 2022 Рязанский государственный медицинский университет им. акад. И.П. Павлова
Создание сайта - Управление информационных технологий, телекоммуникаций и оперативной полиграфии РязГМУ

Внимание! Торговые названия всех препаратов в этой статье указаны исключительно для примера и не являются указаниями на преимущества применения каких-то отдельных препаратов.
О торговых и международных названиях препаратов
У всех лекарственных препаратов, представленных на фармацевтическом рынке России, есть два названия – торговое название и международное непатентованное название (МНН). МНН обозначает действующее вещество препарата – лекарственную субстанцию, которая и оказывает необходимое терапевтическое действие. Как следует из термина, МНН препарата будет одинаковым во всех странах, в которых доступен лекарственный препарат. Как правило, МНН выбирается на основании химического названия действующего вещества препарата.
Компания-производитель может не регистрировать дополнительное торговое название препарата и выпускать его под МНН. В этом случае его торговое название будет совпадать с МНН, зачастую для идентификации таких препаратов к названию действующего вещества добавляется название производителя.
Для того, чтобы поддержать процессы разработки новых лекарств, в которых нуждаются пациенты, принята система патентной защиты оригинальных препаратов. Она подразумевает, что компания, которая первой разработала и выпустила на рынок новое лекарство, на какой-то срок получает эксклюзивное право на его производство и продажу. Срок такой патентной защиты в разных странах неодинаков, так, в США он составляет 12 лет, в России может достигать 25 лет.
В период действия патента на рынке присутствует только оригинальный препарат, компания-производитель, обладая монопольным правом на его производство, стремится окупить свои затраты на его разработку и исследования (а еще и на все свои препараты, которые не дошли до рынка). Следствием этого является высокая цена оригинальных препаратов.
Надлежашая производственная практика – стандарт GMP (Good Manufacturing Practice)
Отсутствие соблюдения производственных норм и стандарта GMP несет за собой следующие основные риски:
- Закупка и использование некачественной фармацевтической субстанции – действующего вещества препарата, которая может быть неэффективной или небезопасной;
- Хранение и транспортировка лекарственных препаратов в ненадлежащих условиях, следствием чего может являться разрушение действующего вещества препарата – например, часто применяемый цитостатический препарат 5-фторурацил разрушается под действием солнечного света;
- Бактериальное загрязнение препарата в ходе производства лекарства и его фасовки в конечную потребительскую упаковку, разрушение препарата в случае некачественной упаковки;
Как понять качественный ли лекарственный препарат мне предлагают?
В Российской Федерации существует специальная база данных, в которой содержится информация обо всех препаратах, находящихся в обороте на фармацевтическом рынке в нашей стране – Государственный Реестр Лекарственных Средств (ГРЛС). Он находится в открытом доступе по адресу ссылка . На этом же сайте доступны для ознакомления последние версии инструкций по медицинскому применению лекарственных препаратов.
В нем можно проводить поиск лекарственных препаратов по торговому, международному названию, производителю препарата и т.д. Интерфейс ГРЛС представлен на Рисунке 1.

Рисунок 1. Общий вид интерфейса Государственного Реестра Лекарственных Средств
В качестве примера рассмотрим один из наиболее часто применяющихся в онкологической практике лекарственных препаратов – паклитаксел. Произведя поиск по МНН данного препарата, можно увидеть, что на фармацевтическом рынке РФ представлено множество его торговых названий. На Рисунке 2 представлен пример поиска по данному препарату.
Стоит отметить, что не всегда факт регистрации фирмы-производителя в какой-либо стране означает, что препарат полностью производится на её территории. В качестве примера можно взять препарат Интаксел производства компнаии Fresenius Kabi (Германия). Открыв подробную информацию по препарату, можно увидеть, что фармацевтическая субстанция и сам препарат были изготовлены в Индии (само по себе это не означает, что препарат низкого качества, см. ниже). Подобная же ситуация, как правило, наблюдается с препаратами, произведенными в России.
- TEVA (Тева)
- Actavis/Allergan (Актавис/Аллерган)
- Fresenius Kabi (Фрезениус Каби)
- Sandoz/Ebewe (Сандоз/Эбеве)
- БИОКАД
Следует учитывать, что соблюдение приведенного выше алгоритма не является гарантией качества препаратов. Даже производители оригинальных препаратов не застрахованы от ошибок в процессе производства, хотя и позволяет значительно снизить её вероятность.
Кроме того, в аптечной сети также встречаются фальсифицированные лекарственные средства – подделки, которые могут значительно отличаться от своего состава от того препарата, за который они себя выдают. С учетом этого, в случае, если Вы приобретаете лекарственные препараты самостоятельно, это стоит делать в специализированных онкологических аптеках, частных или государственных сетевых аптеках – во многих случаях они напрямую сотрудничают с производителями.
Резюме
В условиях отсутствия контроля над качеством лекарственных препаратов со стороны государства и массовым попаданием дешевых препаратов сомнительного качества в онкологические учреждения осведомленность пациентов об этой проблеме является критически важной. Получите у своего врача информацию о том, какие препараты и в какой дозе вам назначены. Обязательно уточняйте конкретное торговое название препарата. В случае, если у Вас имеются сомнения в том, что предложенный Вам препарат является качественным помните о своем праве приобрести необходимые препараты самостоятельно.
Красноярское РО организовало фестиваль "Доступной среды" на территории национального парка "Столбы"
16 февраля в Республиканской детской клинической больнице состоялась встреча, приуроченная к Международному дню детей, больных раком
Замена оригинального препарата на дженерик, подбор аналогов лекарств - очень частая ситуация в аптеке. Это происходит и из‑за того, что нужного препарата не оказывается на полке, и из‑за того, что пациентпросит произвести замену препаратов на более дешевые аналоги. Сэкономить деньги дженерики помогают не только пациентам, но и системе здравоохранения в целом. Цена на воспроизведенное лекарственное средство может быть ниже стоимости оригинального почти на 80 %. Это заставило некоторые страны внимательно отнестись к вопросам генерической замены. США, Канада, Германия, Великобритания и еще ряд стран Европейского союза объявили о том, что увеличение доли дженериков в общей структуре потребления лекарственных средств является стратегической задачей. Мировое потребление дженериков постоянно растет. По данным IMS Health, в период c 2005 по 2010 г. оно выросло с 124 до 234 миллиардов долларов США. По прогнозам компании, к 2015 г. потребление дженериков возрастет еще почти в два раза и составит 400–430 млрд долларов США.
Замена лекарств аналогами может происходить по разным причинам и описываться различными терминами. В частности, врач может заменить один препарат другим препаратом того же класса — это терапевтическая замена, которая может быть произведена только специалистом-медиком. В аптеке, без консультации с врачом, может происходить замена одной лекарственной формы на другую, замена оригинального препарата на дженерик или одного дженерика — на другой в рамках одного международного непатентованного названия (МНН). Во всех перечисленных случаях специалисту аптеки необходимы данные о взаимозаменяемости препарата.
В зарубежных источниках взаимозаменяемость (interchangeability) понимают как медицинскую или фармацевтическую практику перехода с одного лекарственного средства на другое, эквивалентное ему при одинаковых показаниях. А термин замещаемость (substitution or substitutability) относится к аптечной практике и характеризует замену в аптеке одного лекарственного средства на другое эквивалентное и взаимозаменяемое лекарственное средство без требования консультации с врачом, назначившим препарат. Законодательное регулирование замещения в разных странах различается.
Казалось бы — небольшая разница в понятиях. Но на самом деле эта разница (имеется в виду исключение возможности взаимозаменяемости биологических лекарственных препаратов) имеет очень важное значение, в том числе и в сфере государственных закупок. Учитывая, что многие биологические лекарственные препараты входят в различные программы финансирования и государство инвестирует большие средства в бесплатное обеспечение населения этой группой препаратов, данный вопрос находится в центре активных дискуссий фармацевтического сообщества.
Каким в итоге будет понятийный аппарат в законе, покажет время, однако уже сегодня можно определить ключевые вопросы, которые встают перед специалистом аптеки при необходимости заменить оригинальный препарат на дженерик или биосимиляр.
Отдельного рассмотрения требуют два вопроса — взаимозаменяемость оригинальных препаратов и дженериков, а также оригинальных биотехнологических препаратов и биосимиляров.
Казалось бы, при фармацевтической и биологической эквивалентности препараты должны быть идентичными по своему воздействию на пациента. Однако существуют исследования, показывающие, что это так не во всех случаях. Например, в 2000 г. было опубликовано исследование авторов С. В. Недогода, И. В. Марченко, Т. А. Чаляби, в котором изучалась клиническая эффективность четырех генерических эналаприлов от известных производителей. Исследование показало, что эффективность по достижению целевого уровня артериального давления у исследуемых препаратов была ниже, чем у оригинального препарата, хотя все анализируемые дженерики были биоэквивалентны оригиналу. В итоге был сделан вывод о различной терапевтической эквивалентности воспроизведенных препаратов эналаприла.
Получение разрешения для вывода биосимиляра на фармацевтический рынок не гарантирует взаимозаменяемости.
Сегодня для снижения затрат правительства многих стран заинтересованы в широком применении биосимиляров при лечении пациентов. Однако эксперты системы здравоохранения отмечают, что возможное снижение затрат все же не должно служить поводом для того, чтобы разрешать автоматическую замену в аптеках оригинальных препаратов на биосимиляры. По мнению ВОЗ разрешение автоматического замещения оригинального биотехнологического лекарственного средства на биоподобные лекарственные средства должно приниматься на национальном уровне, с учетом профиля безопасности лекарства, а также с учетом научных и клинических данных. Во многих странах оригинальные биотехнологические лекарственные средства и биосимиляры не являются взаимозаменяемыми и выписываются по торговому названию, а не по МНН (Великобритания, Голландия, Польша, Дания, Норвегия, Австрия, Словакия, Франция и др.). В Японии действует схожее с европейским законодательство, регулирующее вопросы обращения биоподобных лекарственных средств и их взаимозаменяемость.
Сегодня необходимо создание руководств во всех странах мира по определению взаимозаменяемости биоподобных лекарственных средств на законодательном уровне. В России также планируется создание подобного документа. В частности, планируется создание перечня взаимозаменяемых лекарственных средств.
Биотехнологические лекарственные средства — иммунобиологические лекарственные средства, произведенные с помощью генной инженерии (документы Европейского медицинского агентства, EMA — European Medicines Agency). В российском законодательстве отсутствует определение биотехнологического лекарственного средства. В законе имеется лишь определение иммунобиологических препаратов.
Биосимиляр — это биотехнологическое лекарственное средство, схожее с произведенным впервые оригинальным лекарственным средством и представленное на регистрацию после истечения срока действия патента оригинального препарата (Директива Евросоюза 2003 года.). В российском законодательстве понятие биосимиляра в настоящее время отсутствует. Однако, понятие биоаналогичного (биоподобного) включено в текст поправок.

После вступления приказа в силу на плечи аптечных работников ложится ответственность по выбору лекарственного средства в рамках одного МНН. Рекомендация провизора будет являться одним из ключевых факторов при выборе лекарственных препаратов пациентом. Исследовательская компания Synovate Comcon в 2010 году опубликовала результаты опроса пациентов, показавшие, что среди факторов, влияющих на выбор препарата посетителем аптеки, на третьем месте (после рекомендации врача и наличия скидок) стоит рекомендация аптечного работника.
В 2011 году той же компанией было опубликовано исследование, как фармацевты и провизоры относятся к оригинальным препаратам и дженерикам. Исследование показало: 89,7 % опрошенных считают, что оригинальный препарат всегда лучше, чем дженерик, поскольку по нему проведено больше исследований. Лишь 8,7 % опрошенных сообщили, что оригинальные препараты и дженерики действуют одинаково, поскольку выпущены в рамках одного МНН. Наконец, 0,6 % опрошенных считают, что дженерик лучше, поскольку дешевле.
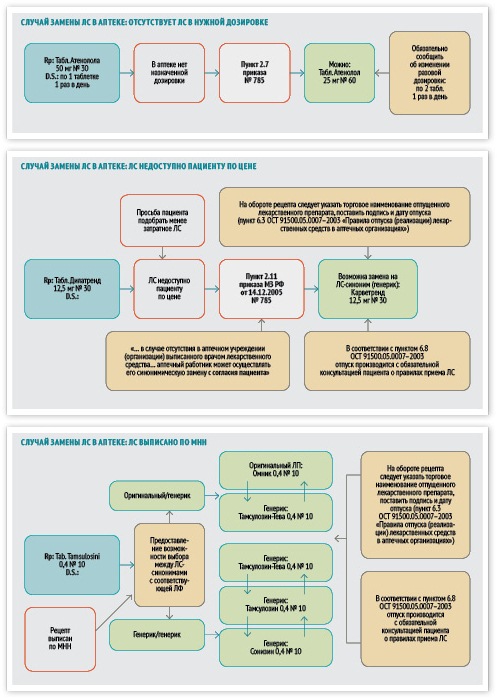
Несмотря на такое отношение к оригинальным препаратам и дженерикам, сотрудники аптек регулярно сталкиваются с необходимостью рекомендовать тот или иной дженерик. Это происходит, когда нужное лекарственное средство отсутствует в аптеке и когда тот или иной препарат недоступен пациенту по цене. Каким образом действовать специалисту аптеки при выборе нужного препарата?
Шаг 2. Отпуск препарата. Дальнейшие действия зависят от того, как выписан рецепт. Если в нем указан конкретный препарат, то специалисту аптеки остается только отпустить этот препарат или, при отсутствии нужного препарата, предложить синонимическую замену, другую лекарственную форму или препарат с другой дозировкой. Отпуск производится с обязательной консультацией пациента о правилах приема лекарственного средства. На обороте рецепта следует указать торговое наименование отпущенного лекарственного препарата, поставить подпись и дату отпуска.
Если же пациент принес рецепт, в котором указано МНН, то провизор должен предложить ему на выбор имеющиеся аналоги и синонимы лекарственных препаратов. При этом нужно учесть несколько принципов.
Во-первых, при выборе одного из синонимов может возникнуть ситуация, когда пациент приобретет препарат с другой дозировкой. В этом случае его необходимо предупредить, каким образом принимать препарат, чтобы соблюсти прописанную врачом дозировку.
Во-вторых, при рекомендации того или иного препарата необходимо учесть платежеспособность пациента. Если для него необходимо приобрести препарат по максимально сниженной цене, то желательно провести экспресс-оценку стоимости синонимов и предложить пациенту тот препарат, курс лечения которым будет стоить дешевле всего.
В-третьих, если у пациента нет предпочтений в выборе из нескольких лекарственных средств с одинаковым составом, формой выпуска, дозировкой и незначительными различиями в цене, то приоритет отдается тому препарату, который пациент принимал ранее (при хроническом заболевании), или препарату, который дольше других находится на фармацевтическом рынке и доказал свою эффективность и безопасность в повседневной практике.
Для обеспечения полной безопасности пациентов при замене препаратов в аптеке важна разработка рекомендаций по взаимозаменямости препаратов. Кроме того, принципиальное значение имеет квалифицированный и ответственный подход специалистов аптеки к консультированию пациентов, приобретающий еще большее значение с введением выписки рецептов по международному непатентованному названию.

Есть случаи, когда качеством копии можно пренебречь. Но есть области, в которых качество копии определяет вопрос сохранения жизни и здоровья. Это выпуск воспроизведенных лекарств.
В руководствах по проведению клинических исследований биоэквивалентности допускаются достаточно большие отличия фармакокинетических параметров двух сравниваемых лекарств. Так, их биоэквивалентность считается доказанной, если отношение сравниваемых параметров в организме человека укладывается в интервал 80,00-125,00 процента при 90-процентном доверительном интервале. В этом случае, даже при получении результатов на самой грани допустимых значений, лекарства считают "одинаковыми". То есть воспроизведенное лекарство признается эффективной и безопасной копией референтного препарата.
А есть ли у них отличия? Конечно, да. В частности, параметры фармакокинетики могут отличаться на большую величину. Это значит, что лекарства - с определенными оговорками - могут быть взаимозаменяемыми. Но если мы хотим создать копию самого первого (по мировой терминологии - оригинального) лекарственного средства, то в качестве референтного необходимо взять именно исходный, оригинальный продукт, а не его копию.
Далеко не все воспроизведенные лекарства имеют высшую оценку терапевтической эквивалентности оригинальному средству
В частности, в Управлении по контролю за лекарственными средствами и продуктами питания США (Food and Drug Administration, USA) разработан общедоступный перечень взаимозаменяемых "терапевтических эквивалентов", в котором, помимо прочего, есть оценка терапевтической эквивалентности пар "оригинальное лекарство - воспроизведенное лекарство" с присвоением кодового обозначения степени терапевтической эквивалентности. При этом далеко не все воспроизведенные лекарства имеют высшую оценку терапевтической эквивалентности оригинальному средству. А ведь действующее вещество в них одно и то же. Таким образом, воспроизведенное лекарство - это копия исходного (оригинального) препарата с определенными допущениями и погрешностями.
Производя очередной воспроизведенный аналог какого-либо лекарства, в качестве референтного лучше всего брать оригинальный лекарственный препарат. Поскольку если в качестве референтного препарата будет выбран уже воспроизведенный, то будущий новый продукт будет отличаться от референтного еще на одну величину допущений.
Изолируясь от международной системы фармаконадзора, мы занижаем глобальные возможности своевременной идентификации сигналов о безопасности препаратов
Возможно, этот факт кто-то сочтет несущественным - ведь можно подобрать эффективную дозу и для дженерика, а затем ее корректировать. Но это не всегда так. И в первую очередь это касается вопросов мониторинга безопасности. В этом случае отсутствие понятия "оригинальный лекарственный препарат" создает целый комплекс затруднений - как административных, так и практических.
К примеру, в 2013 году Росздравнадзор выпустил методические рекомендации по подготовке периодических отчетов по безопасности. В них указано, что отсчет срока подготовки отчета должен вестись от даты первой регистрации препарата с данным действующим веществом в мире, а не на территории какой-либо страны. Оценка рисков и сигналов по данному действующему веществу в мире в этом случае синхронизирована, а регуляторные агентства будут одновременно получать информацию и иметь полноценные базы данных.
А в приказе ведомства № 1071 от 15 февраля 2017 г. указано, что порядок исчисления даты окончания сбора сведений для очередного периодического отчета утверждается самим Росздравнадзором. И лишь для лекарств, сроки и периодичность представления отчета на которые не утверждены Росздравнадзором, срок отсчитывается от даты первой регистрации в мире. Таким образом, синхронизация с мировыми сроками переоценки пользы-риска применения конкретного препарата может отсутствовать.
Почему так важна синхронизация сроков? Во-первых, синхронизация отчетов всех производителей лекарств одного международного непатентованного названия позволяет регуляторным органам одновременно получить от всех производителей все данные по безопасности, которые были ими собраны за завершенный отчетный период. Чем больше данных, тем более объективную оценку дает регуляторный орган, так как основные статистические методы глобальной обработки данных по безопасности построены на статистических методиках выявления диспропорций. А в случае асинхронности поступления информации мощности статистического метода может не хватить для того, чтобы выявить тот или иной сигнал. Изолируясь от этой системы, регуляторные органы России искусственно занижают как свои, так и глобальные возможности по своевременной идентификации сигналов по безопасности, создавая риски не только себе, но и мировому сообществу в целом. Кроме того, хотя мониторинг безопасности лекарств - процесс непрерывный, оценка безопасности препаратов на глобальном уровне происходит с определенной периодичностью. Отсутствие синхронности в предоставлении отчетов по безопасности может привести к тому, что некоторые риски, связанные с очень редкими или отсроченными в развитии нежелательными явлениями, могут быть выявлены с опозданием, что также создает довольно масштабную угрозу.
Помимо этого, отличия параметров фармакокинетики, обусловленные особенностями проведения клинических исследований биоэквивалентности, ведут к тому, что из-за искусственно полученных "слишком больших" или "слишком малых дозировок" по сравнению с оригинальным лекарством, возникает благоприятная почва для токсических эффектов либо для случаев отсутствия эффективности.
Особенно наглядно это видно на психотропных препаратах, обладающих узким терапевтическим диапазоном. При снижении дозы могут возникнуть опасные для жизни судороги, а при увеличении - еще и галлюцинации, которые не только создают угрозу для жизни больных, но и значительно снижают качество жизни. В то же время при правильно подобранной фармакотерапии больные могут длительно сохранять не только качество жизни, но и трудоспособность.
Отмеченный разброс в параметрах фармакокинетики создает условия для искусственно созданных проблем в профиле безопасности - отсутствия эффективности с одновременным токсическим воздействием. Это создает ложное впечатление "неблагополучности" данного действующего вещества, что закономерно и необратимо снижает приверженность лечению у больных и веру в препарат у врачей. Причем эта вера - как субъективный фактор и постмаркетинговые исследования эффективности - как фактор объективный могут привести к тому, что вероятно эффективная и безопасная молекула с высоким терапевтическим потенциалом окажется отозванной с рынка при очередном сеансе глобальной оценки пользы-риска. Отзыв с рынка - не самое редкое явление. За годы активного развития систем фармаконадзора как на глобальном, так и на локальном уровне накопилось немало примеров отзывов лекарства с рынка из-за того, что они не оправдали ожиданий, выйдя за пределы контролируемых условий клинических исследований. Так годы упорного труда, огромные человеческие и финансовые инвестиции, а главное - надежда пациентов на возможности современной медицины могут быть обесценены лишь по причине исключения из закона фундаментального понятия "оригинальный препарат". И это лишь начало.
Евгений Рогов, независимый GCP/GLP аудитор:
Оксана Монж, генеральный менеджер рецептурного подразделения компании "Санофи" в России и Беларуси:
Читайте также:

