Водородный показатель это кратко
Обновлено: 06.07.2024
Важной характеристикой водных растворов является уровень концентрации в них положительно заряженных ионов водорода и отрицательно заряженных гидроксид-ионов относительно друг друга. При одинаковых концентрациях и раствор считается нейтральным, при избытке катионов – кислотным и при избытке анионов – основным (щелочным). Величина, называемая водородным показателем, или pH раствора, – это количественное выражение кислотности.
Понятие о водородном показателе
Определение pH-фактора базируется на кислотно-основных свойствах воды. Ее молекулы способны к самопроизвольной диссоциации, благодаря чему в воде всегда присутствует некоторое количество ионов и . Их концентрация мала вследствие обратимости процесса диссоциации, который выражается формулой
O" width="36" height="15" />
⇄ " width="26" height="15" />
+ " width="40" height="12" />
Из формулы видно, что ионы водорода и гидроксила содержатся в воде в равной концентрации: [" width="26" height="15" />
]=[" width="40" height="12" />
]. В стандартных условиях (при температуре 22–25° C) она составляет " width="35" height="16" />
моль⁄л.
Величина " width="30" height="15" />
=[" width="26" height="15" />
]∙[" width="40" height="12" />
] называется ионным произведением воды. При заданной температуре она является постоянной (при 22–25° C " width="30" height="15" />
=" width="42" height="16" />
моль" width="7" height="9" />
/л" width="7" height="9" />
) не только для воды, но и для разбавленных растворов. При добавлении кислоты к воде повышается концентрация [" width="26" height="15" />
] и понижается [" width="40" height="12" />
] (кислотность возрастает), при добавлении щелочи падает [" width="26" height="15" />
] и растет [" width="40" height="12" />
] (кислотность понижается).
![]()
] с обратным знаком:
![]()
]
![]()
= -(-7) = 7
Шкала pH

Методы определения величины pH
В зависимости от целей и условий значение водородного показателя устанавливается различными методами. Качественно оценить кислотность среды позволяет применение индикаторов. Точные количественные результаты получают с помощью измерительных методов.
Использование индикаторов
Метод основан на способности ряда органических веществ к изменению окраски в зависимости от кислотности среды. Распространенные индикаторы – лакмус, метилоранж, фенолфталеин. Каждый из них проявляет свои свойства в ограниченном диапазоне значений pH.
Индикаторный метод отличает простота наглядность и быстрота, но он недостаточно точен и зависит от субъективного восприятия цвета.
Достичь большей точности позволяет применение универсального индикатора. Он представляет собой смесь веществ и охватывает широкий диапазон pH от 0 до 14. Цвет, приобретенный нанесенным на бумажную полосу индикатором в той или иной среде, сравнивают с эталонной шкалой. Универсальный индикатор дает возможность определять pH с точностью до десятых долей.

Индикаторные методы неэффективны в случаях, когда раствор слишком слабый, имеет собственную яркую окраску или замутнен.
Ионометрический метод
Водородный показатель можно определить с точностью до 0,01 в широком диапазоне, применяя pH-метр. Прибор представляет собой электронный милливольтметр, определяющий разность потенциалов на электродах, один из которых (измерительный pH-электрод) помещен в исследуемый раствор. Другой (электрод сравнения) погружен в электролит с определенным pH. На нем создается стабильный потенциал, относительно которого измеряют pH анализируемой среды. Разность потенциалов пропорциональна величине показателя кислотности.
pH-метр требует тщательной калибровки. Для нее используются специально приготовленные буферные растворы с эталонными значениями pH, устойчивыми при разбавлении или добавкам небольших количеств сильных кислот или оснований. В приготовлении буферных растворов для pH-метрии применяются стандарт-титры – наборы чистых реактивов с точно известной массой, которые разводят дистиллированной водой до необходимой концентрации.

Конструкция современных pH-метров предусматривает вместо двух электродов один комбинированный, что значительно упрощает их использование.
Аналитический объемный метод
В данном способе определения водородного показателя применяется процедура кислотно-основного титрования, ведущую роль в которой играет реакция нейтрализации исследуемого образца титрантом – стандартным раствором с определенным pH. Если титруется раствор кислоты, в качестве титранта используют щелочь (гидроксид натрия или калия), если основание – титрантом является раствор сильной кислоты (соляной или серной).
Титрант медленно добавляют к образцу до достижения точки эквивалентности – момента, когда происходит полная нейтрализация титруемого раствора. Фиксация конечной точки титрования может производиться несколькими способами: с помощью индикатора, потенциометрии, спектрофотометрии или измерения электропроводности. Определив необходимый для нейтрализации объем титранта и зная его концентрацию, вычисляют pH препарата.

Влияние температуры на значение pH
Повышение температуры приводит к росту диссоциации слабых электролитов, в том числе и воды. Повышается равновесная концентрация ионов и и возрастает величина ионного произведения. Соответственно меняется и водородный показатель для нейтральной среды:
Температурные изменения оказывают сложное и неоднозначное влияние на измерения pH. В целом органические и щелочные пробы более зависимы от них, чем неорганические и кислотные. При pH-метрии и титровании температура строго контролируется, а полученные результаты пересчитываются с целью приведения к значению, характерному при 25° C.
Значения pH некоторых растворов
При определении величины pH для растворов кислот и оснований принято выражать концентрацию раствора в единицах нормальности. Нормальная концентрация – это количество моль-эквивалентов вещества в 1 л раствора: .
Эквивалентом называется частица (реальная либо условная), которая в химических реакциях равноценна одному катиону или одному электрону. Моль-эквивалент содержит эквивалентов, а его масса в единицах называется молярной массой эквивалента .
pH растворов кислот
| Кислота | Концентрация | pH |
| Азотная | 0,1 н. | 1,0 |
| Борная | 0,1 н. | 5,2 |
| Муравьиная | 0,1 н. | 2,3 |
| Серная | н. | 0,3 |
| 0,1 н. | 1,2 | |
| 0,01 н. | 2,1 | |
| Сернистая | 0,1 н. | 1,5 |
| Сероводородная | 0,1 н. | 4,1 |
| Уксусная | н. | 2,4 |
| 0,1 н. | 2,9 | |
| 0,01 н. | 3,4 | |
| Соляная | н. | 0,1 |
| 0,1 н. | 1,1 | |
| 0,01 н. | 2,0 | |
| Щавелевая | 0,1 н. | 1,3 |
pH растворов оснований
Нормальность щелочей определяется аналогично нормальности кислот, исходя из количества гидроксид-ионов, которые отщепляются при диссоциации.
| Основание | Концентрация | pH |
| Гидроксид калия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 | |
| Гидроксид кальция | насыщенный | 12,4 |
| Гидроксид натрия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 |
Значения pH некоторых бытовых веществ и пищевых продуктов
| Вещество | pH | Продукт | pH |
| электролит аккумуляторный на основе | Роль показателя кислотности |
Знание и использование водородного показателя играет значительную роль во многих областях жизни людей, особенно в здравоохранении и медицине, в водоснабжении, в производстве и грамотном потреблении продуктов питания и средств бытовой химии. Оно также важно в организации сельского хозяйства, в производстве кормов и удобрений. Показатель pH имеет большое значение при проведении научно-исследовательских работ в химии и биологии, а также при мониторинге многих технологических процессов в нефтехимической, топливной, атомной и других отраслях промышленности.

Лимонный сок. Ввиду наличия 5%-6% лимонной кислоты, водородный показатель сока равен 2,2 (высокая кислотность).
Для водных растворов (при стандартных условиях), водородный показатель составляет:
pH 7 соответствует осно́вному раствору .
Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром или вычислен по формуле как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр:

.
История водородного показателя pH .
Понятие водородного показателя введено датским химиком Сёренсеном в 1909 году. Показатель называется pH (по первым буквам латинских слов potentia hydrogeni — сила водорода, либо pondus hydrogeni — вес водорода). В химии сочетанием pX обычно обозначают величину, которая равна lg X, а буквой H в этом случае обозначают концентрацию ионов водорода (H + ), либо, вернее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH .
Вывод значения pH .
В чистой воде при 25 °C концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) оказываются одинаковыми и равняются 10 −7 моль/л, это четко следует из определения ионного произведения воды, равное [H + ] · [OH − ] и равно 10 −14 моль²/л² (при 25 °C).
Если концентрации двух видов ионов в растворе окажутся одинаковыми, в таком случае говорится, что у раствора нейтральная реакция. При добавлении кислоты к воде, концентрация ионов водорода возрастает, а концентрация гидроксид-ионов понижается, при добавлении основания — напротив, увеличивается содержание гидроксид-ионов, а концентрация ионов водорода уменьшается. Когда [H + ] > [OH − ] говорится, что раствор оказывается кислым, а при [OH − ] > [H + ] — щелочным.
Чтоб было удобнее представлять, для избавления от отрицательного показателя степени, вместо концентраций ионов водорода используют их десятичный логарифм, который берется с противоположным знаком, являющийся водородным показателем — pH.

.
Показатель основности раствора pOH .
Немного меньшую популяризацию имеет обратная pH величина — показатель основности раствора, pOH, которая равняется десятичному логарифму (отрицательному) концентрации в растворе ионов OH − :

как во всяком водном растворе при 25 °C , значит, при этой температуре:

.
Значения pH в растворах различной кислотности.
- Вразрез с распространённым мнением, pH может изменяться кроме интервала 0 - 14, также может и выходить за эти пределы. Например, при концентрации ионов водорода [H + ] = 10 −15 моль/л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH= −1.
Т.к. при 25 °C (стандартных условиях) [H + ] [OH − ] = 10 −14 , то ясно, что при такой температуре pH + pOH = 14.
Т.к. в кислых растворах [H + ] > 10 −7 , значит, у кислых растворов pH 7, pH нейтральных растворов равняется 7. При более высоких температурах константа электролитической диссоциации воды увеличивается, значит, увеличивается ионное произведение воды, тогда нейтральной будет pH = 7 (что соответствует одновременно возросшим концентрациям как H + , так и OH − ); с понижением температуры, наоборот, нейтральная pH увеличивается.
Методы определения значения pH .
Существует несколько методов определения значения pH растворов. Водородный показатель приблизительно оценивают при помощи индикаторов, точно измерять при помощи pH-метра либо определять аналитическим путём, проводя кислотно-основное титрование.
- Для грубой оценки концентрации водородных ионов часто используют кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. Самые популярные индикаторы: лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и др. Индикаторы могут быть в 2х по-разному окрашенных формах — или в кислотной, или в основной. Изменение цвета всех индикаторов происходит в своём интервале кислотности, зачастую составляющем 1–2 единицы.
- Для увеличения рабочего интервала измерения pH применяют универсальный индикатор, который является смесью из нескольких индикаторов. Универсальный индикатор последовательно изменяет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным способом затруднено для мутных либо окрашенных растворов.
- Применение специального прибора — pH-метра — дает возможность измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем при помощи индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, которая включает стеклянный электрод, потенциал которого зависим от концентрации ионов H + в окружающем растворе. Способ обладает высокой точностью и удобством, особенно после калибровки индикаторного электрода в избранном диапазоне рН, что дает измерять pH непрозрачных и цветных растворов и поэтому часто применяется.
- Аналитический объёмный метод — кислотно-основное титрование — тоже даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) каплями добавляют к раствору, который исследуется. При их смешивании происходит химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, для полного завершения реакции, — фиксируется при помощи индикатора. После этого, если известна концентрация и объём добавленного раствора титранта, определяется кислотность раствора.
- Влияние температуры на значения pH:
0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3,
0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83,
Влияние температуры на значения pH объясняют разчной диссоциацией ионов водорода (H + ) и не есть ошибкой эксперимента. Температурный эффект нельзя компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии.
Кислотность среды имеет важное значение для большинства химических процессов, и возможность протекания либо результат той или иной реакции зачастую зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований либо на производстве применяют буферные растворы, позволяющие сохранять почти постоянное значение pH при разбавлении либо при добавлении в раствор маленьких количеств кислоты либо щёлочи.
Водородный показатель pH часто применяют для характеристики кислотно-основных свойств разных биологических сред.
Для биохимических реакций сильное значение имеет кислотность реакционной среды, протекающих в живых системах. Концентрация в растворе ионов водорода зачастую оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается под действием буферных систем организма.
В человеческом организме в разных органах водородный показатель оказывается разным.
Химический состав питьевой воды и продуктов питания влияет на процессы, происходящие в организме человека. Считается, что некоторые из них закисляют его и способствуют различным заболеваниям. Изучение понятия, что такое pH в химии, помогает определить правильный кислотно-щелочной баланс в работе внутренних органов. Отклонения от нормального значения этого показателя указывают на возможные нарушения в состоянии здоровья.

Теоретические основы
Вода является средой, в которой растворяются органические и неорганические химические вещества, и обладает способностью распадаться на ионы. Одна молекула отдает свой протон другой, поэтому в воде постоянно находится некоторое количество положительно заряженных ионов водорода H и отрицательно заряженных гидроксид-ионов OH. Этот процесс называется электролитической диссоциацией.
Говоря об ионе водорода, делается упрощение, так как на самом деле положительно заряженный ион в воде — это ион гидроксония H3O. Он образуется из целой молекулы воды и протона, оторванного от другой молекулы. Чем больше таких ионов в воде, тем больше и ее кислотность.
Ионы очень подвижны и постоянно переходят от одной молекулы к другой. Таким образом, процесс распада и процесс соединения в новую молекулу идут постоянно и уравновешивают друг друга, т. е. диссоциация воды находится в равновесии.

Количество ионов H+ и мера их активности в большинстве растворов очень малы, их записывают в виде числа с отрицательной степенью, что очень неудобно. Поэтому датским биохимиком Сёреном Сёренсеном в 1909 году было предложено выражать это число в виде показателя кислотности (водородного показателя) pH, который вычисляется как десятичный логарифм от меры активности ионов H+ с обратным знаком: pH = - lg [H+].
С. Сёренсен руководил химико-физиологической лабораторией при пивоваренном заводе Carlsberg, где разработал шкалу для измерения показателя pH. На ее основе были созданы специальные приборы: pH-метры, которые применяются для измерения кислотности растворов и жидкостей в промышленности, и ацидогастрометры для диагностики желудочно-кишечных заболеваний в медицине.
Показатель основности раствора, выражающийся десятичным логарифмом с отрицательным знаком от концентрации в растворе гидроксид-ионов: pOH = - lg [OH-], применяется гораздо реже. Величины pH и pOH могут быть как положительными, так и отрицательными.
Важно не путать pH с понятиями кислотности и щелочности. Главное различие заключается в том, что pH — это показатель не количества, а активности.
Он отражает степень кислотности или щелочности среды, а не количественное содержание в воде химических веществ. В разбавленных растворах мера активности эквивалентна концентрации, поэтому при определенном допущении один термин заменяют другим.
Влияние pH на свойства среды
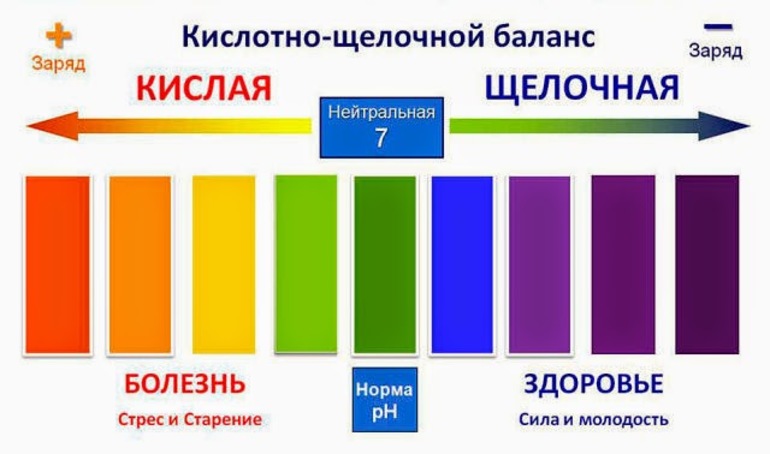
С помощью несложных математических вычислений можно доказать, что сумма показателей pH и pOH для воды — величина постоянная и равна 14. Например, если рН = 5, то рОН = 9; для рН = -2 pOH = 16. У чистой воды без примесей (дистиллированной) и у водных растворов, образуемых неэлектролитами, pH = 7, а значит и рОН = 7, т. е. кислотный и основной (щелочной) показатели уравновешивают друг друга, и получается нейтральная среда.

При попадании в воду многих химических соединений происходит их гидролиз. Растворяемое вещество распадается на катионы и анионы, которые могут соединяться с ионами, получившимися в результате диссоциации воды. При этом получается смещение равновесия диссоциации воды. Показатель pH определяет, в какую сторону оно произошло. Если pH 7 — щелочная.
Показатель pH влияет на протекание химических реакций как на производстве, так и в природе и является универсальным показателем состояния среды. С помощью его контроля производят все виды горючего, краски, удобрения, средства личной гигиены и косметику. В пищевой промышленности проверяется качество изготовления напитков, молокопродуктов, изделий из злаков. Все живые обитатели природных почв и вод могут жить только при определенных значениях водородного показателя, от него же зависит и урожайность многих растений, поэтому ведется наблюдение за pH в почвоведении и земледелии, особенно в гидропонике.
При этом обычно необходимо поддерживать постоянное значение pH в течение длительного времени. Для этого используют так называемые буферные растворы. Они представляют собой смеси слабого основания и его соли или слабой кислоты и ее соли, в которых мера активности ионов водорода постоянна и устойчива.
Измерение водородного показателя
Формулы для расчета pH зависят от того, к какому классу относится химическое вещество, входящее в исследуемый раствор, и приведены в специальных справочниках. Более точное значение получают другими методами. Цели и условия проведения исследований определяют, как будет измеряться водородный показатель.
Индикаторные способы
Приблизительно оценить меру активности ионов водорода можно с помощью кислотно-основных индикаторов. Такие вещества обычно относятся к органическим соединениям и имеют свойство изменять свой цвет в разных средах:

- Лакмус меняет цвет от красного в кислой среде через фиолетовый в нейтральной до синего в щелочной.
- Фенолфталеин становится синим в щелочной среде, оставаясь бесцветным в остальных.
- Метилоранж розового цвета соответствует повышенной кислотности, оранжевого — показывает нейтральность среды, в щелочах становится синим.
Изменение происходит для каждого индикатора в своём диапазоне кислотности, обычно составляющем 1—2 единицы. При этом методе результат можно получить быстрый и наглядный при небольших затратах, но недостаточно точный, с большой погрешностью при исследовании очень слабых растворов, окрашенных или мутных вод. Используется, когда нужно найти предварительное определение pH.

Более широкий диапазон и выше точность у универсального индикатора. Он соединяет в себе несколько индикаторов и градуируется в соответствии со значениями pH от единицы до десяти. Соответствие значения водородного показателя и цвета:
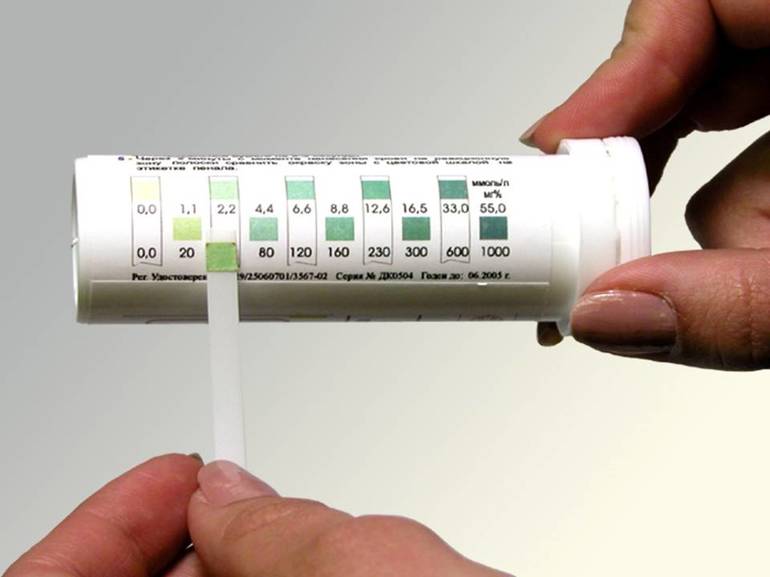
- 1 — красный;
- 2 — розовато-оранжевый;
- 3 — оранжевый;
- 4 — темно-желтый;
- 5 — желтый;
- 6 — желтовато-зеленый;
- 7 — светло-зеленый;
- 8 — насыщенный зеленый;
- 9 — сине-зеленый;
- 10 — сине-серый.
Аналитический объемный метод
Кислотно-основное титрирование — метод определения водородного показателя среды с помощью так называемых титрантов. В основном для этого используются сильные кислоты (серная, соляная) и сильные щелочи (едкий калий, каустическая сода).

Раствор-титрант добавляют в исследуемую жидкость по каплям. При этом они вступают в химическую реакцию. Когда она завершается, наступает точка эквивалентности, т. е. момент отчетливого изменения окраски исследуемого раствора. По установленному в результате опыта объему титранта, необходимому для получения точки эквивалентности, и известному значению его концентрации можно рассчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический метод, при котором кислотный показатель можно измерить с помощью специализированного прибора — pH-метра, является наиболее точным (до сотых от единицы pH), удобным и имеет широкий диапазон измерения. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов со стеклянных электродов. У него также есть система пересчета напряжения в pH.

В исследуемый раствор погружают индикаторный электрод и электрод сравнения, замыкая таким образом гальваническую цепь. Величина электродвижущей силы в ней зависит от активности ионов H+ в растворе, т. е. является функцией только его pH. Индикаторный электрод состоит из стеклянной трубки, заполненной специальной суспензией в растворе соляной кислоты, и погруженной в нее серебряной проволоки.
Полезный сигнал возникает на границе соприкосновения раствора и индикаторного электрода и передается через металлический проводник на вход pH-метра. Таким способом можно измерять pH любых жидкостей, в том числе непрозрачных и цветных.
Специализированный прибор, применяемый в медицине для исследований pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Включает в себя регистрирующий блок и один или несколько зондов. Для измерения уровня pH таких биологических жидкостей, как слюна и моча, применяются электронные pH-метры.
Кислотно-щелочной баланс человека

На pH почек и печени оказывают влияние не только метаболические процессы в самом организме, но также пища и вода. Излишнюю кислотность потребленных продуктов организм выводит через мочу. Низкий уровень pH мочи говорит о том, что почки работают на пределе. Когда излишняя кислота не может быть выведена из организма естественным путем, она скапливается в подкожной жировой прослойке, имеющей кислотный pH. Это приводит к излишнему весу. В борьбе с этим явлением помогает щелочная вода, снижая нагрузку на почки.
В желудке среда резко кислая, в момент пищеварения pH равен 1,8−3. Вопреки распространненому мнению, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития правильных бактерий и запускает механизм переваривания пищи, а болезнетворные микроорганизмы и гельминты расщепляются пищеварительными ферментами.

pH крови организм поддерживает в постоянном состоянии на уровне 7,4—7,45. Малейшее отклонение его от нормы может привести к тяжелым последствиям для человека. При понижении pH ниже 7,35 возникает ацидоз. При превышении нормы — алкалоз. Это не самостоятельные заболевания, они свидетельствуют о нарушениях в работе легких, почек, печении. Такие состояния сопровождаются очень опасными для здоровья симптомами, приводящими иногда даже к коме. По мнению врачей, ацидоз переносится легче алкалоза.
Кровеносные сосуды питают слюнные железы, поэтому за уровнем pH крови можно следить по pH слюны. Поддержание кислотно-щелочного баланса в кровеносной системе — это важнейшая функция организма человека. Внешние факторы не оказывают влияния на pH крови, он регулируется только внутренними механизмами тела человека:
- Буферные системы крови поддерживают устойчивость среды.
- Легочная (респираторная) система удаляет излишки углекислого газа из крови.
- Выделительная система (почки). Самый медленный, но и самый мощный механизм, может полностью восстанавливать pH организма путем выведения ионов водорода через мочу.
Таким образом, хотя кислотный показатель крови совершенно не подвержен внешнему влиянию, механизмы его поддержания на нужном уровне имеют зависимость от того, чем человек питается и какую воду пьет. Мясо и молоко повышают общую кислотность организма, а зелень и зеленые овощи лучше всего нейтрализуют ее. Кислотность и щелочность различных пищевых продуктов можно узнать из специальных таблиц. Оптимальное значение pH для воды находится в пределах от 6 до 9.
Придерживаясь принципов правильного питания для поддержания кислотно-щелочного равновесия в своем организме, человек надолго сохранит молодость, красоту и здоровье.
Читайте также:

