Вода с точки зрения физики кратко
Обновлено: 04.07.2024
Сегодня каждый человек знает, что самым распространенным веществом на Земле является вода. Любой без труда назовет ее химическую формулу - H2O. Однако, окунувшись чуть глубже в вопрос строения и свойств воды, водных растворов, оказывается, что вода таит в себе множество неразрешенных вопросов и аномалий. Эти вопросы могут интересовать ученых, производственников, медиков. Эти же вопросы должны быть интересны каждому человеку, ведь мы по большей части состоим из воды. Так, интересно понять:
- Каковы современные представления о структуре воды. Особенно - есть ли у воды "память" не в мистическом, а в строго научном смысле;
- Вода, которую мы пьем - по сути разбавленный раствор. Что это и как концентрация веществ в растворе может влиять на его биологическую активность?
- Как внешние физические факторы, окружающие нас, могут влиять на воду и водные растворы, из которых в т.ч. состоит человек.
- Как вода, поступающая в организм, в зависимости от химического состава влияет на него? Какую воду можно пить?;
- Как лучше произвести очистку воды в домашних условиях.
2. Немного фактов о воде.
- С точки зрения названия вода имеет много синонимов: оксид водорода, гидроксид водорода, монооксид дигидрогена, оксидан, дигидромонооксид, гидрид кислорода.
- В малом объеме вода бесцветна. Толстые же слои воды имеют голубовато-зеленую окраску.
- На нашей планете около 16 млрд. км 3 воды - это 0,25% массы Земли. Из них 0,2 млрд. км 3 - озера и реки, 13 тыс. км 3 - водяной пар атмосферы.
- 97,6% известной свободной воды содержится в Мировом океане. В мантии Земли воды еще в 10-12 раз больше, чем в океане.
- Человек в среднем состоит на 70% из воды, медуза - на 96%, а водоросли - на 99%. В младенце содержится значительно больше воды, чем в человеке преклонных лет.
- В костях человека содержится 22% воды, в крови - 83%, в стекловидном теле глаз - 99%.
- Человек в некотором смысле является гидравлической машиной, поэтому застой жидкости в разных частях организма или преграды для ее свободного перемещения обязательно вызывают заболевания.
- За год через организм человека проходит около 1 тонны воды.
3. Свойства воды.
3.1 Некоторые физические свойства.
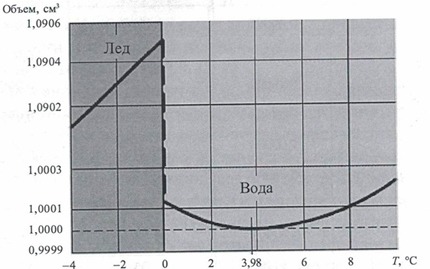
• Зависимость относительного объема воды от температуры:
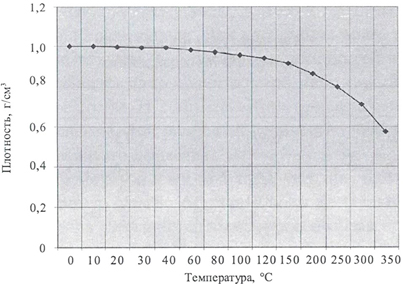
• Зависимость плотности массы воды от температуры:
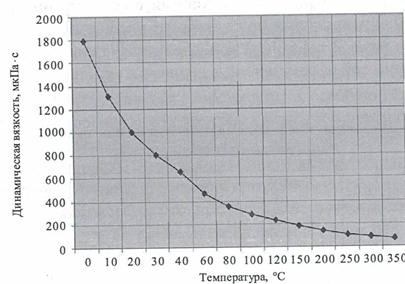
• Зависимость динамической вязкости воды от температуры.
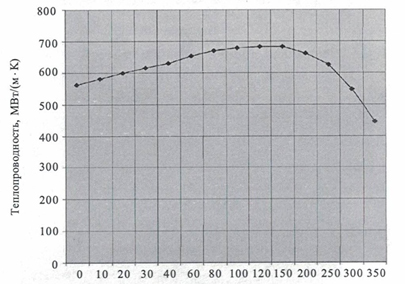
• Зависимость коэффициента теплопроводности воды от температуры.
3.2 Важнейшие химические свойства воды.
- При температуре выше 1000 о С вода постепенно начинает разлагаться на водород и кислород.
- Полярные молекулы воды связываются с ионами и молекулами (сольватируют), образуют гидраты и кристаллогидраты.
- Многие оксиды, соединяясь с водой образуют кислоты и основания.
- Наиболее активные металлы взаимодействуют с водой с выделением водорода.
- Вода взаимодействует со фтором и межгаллоидными соединениями, с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз; с ангидридами и галогенангидридами карбоновых и неорганических кислот; с активными металлоорганическими соединениями (диэтилцинк, реактив Гриньяра, метилнатрий и т.д.); с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (Ca, Na, Li и др.); с боранами, силанами, кетенами, фторидами благородных газов.
- При нагревании вода реагирует с Fe, Mg, C, CH4, с некоторыми алкилгалогенидами.
- Вода - катализатор некоторых реакций, например, реакции Cl2 с металлами.
- Вода вступает в реакции с амидами, эфирами карбоновых кислот, ацетиленом и другими алкинами, алкенами, нитрилами на катализаторах.
- Вода образует клатраты - соединения без химических связей. Так вода реагирует с газами, которые заполняют полости в ее структуре.
- Важнейшая реакция воды - синтез крахмала растениями с выделением O2.
3.3 Аномалии воды.
Почти все физико-химические свойства воды представляют исключения в сравнении с гидратами элементов VI группы. Вероятно, именно благодаря этому стала возможна жизнь:
• При замерзании вода расширяется, а не сжимается, как все другие жидкости. Лед со структурой Ih (см. фазовую диаграмму льда, рисунок 22) при одинаковом давлении имеет на 10% меньшую плотность, чем жидкая вода. Именно поэтому айсберги способны плавать. Большая часть льда на земле имеет Ih-структуру. Благодаря этому зимой верхние слои водоемов не смешиваются и вода в них не промерзает на всю глубину вместе со всеми обитателями. И все же есть небольшое количество "тяжелого" льда Ic тонущего в жидкой воде.
• С ростом давления на каждые 130 атм. температура замерзания воды уменьшается на 1 о С. Поэтому вода в жидком виде существует на больших глубинах в морях при температурах значительно ниже 0 о С.
• Cогласно периодическому закону Д.И.Менделеева в ряду гидридов серы, селена и теллура вода должна была бы иметь температуру замерзания -90 о С, а кипения - плюс 70 о С, что, как мы знаем, не так.
• Удельная теплоемкость воды в 5-10 раз выше, чем у других природных веществ. Теплоемкость лития и древесины приближается к воде и лишь у аммиака она выше. Благодаря высокой теплоемкости вода является мощнейшим энергоносителем и регулятором температуры поверхности на Земле. Вода медленно охлаждается ночью и медленно нагревается днем. Аналогично при смене времен года. Для того, чтобы испарить 1 г воды требуется 537 калорий. Если бы водородные связи у воды были сильнее или слабее, то картина нашего мира была бы совершенно иной.
• Удельная теплоемкость воды уменьшается при повышении температуры от 0 до 37 о С, тогда как у других веществ (кроме ртути, где идет монотонное уменьшение) она увеличивается. Выше 37 о С теплоемкость воды увеличивается, как и положено жидкостям. Только у воды есть "температурная яма" при 37 о С, в которой она быстрее всего нагревается и охлаждается благодаря минимальной теплоемкости. Заметим, что температура тела человека равна 36,6 о С, т.е. организм человека, как водная система, как раз и находится практически в это "яме". В жидком виде вода в 2 раза более теплоемка, чем лед или пар.
• Плотность дистиллированной воды при нагреве от 0 до 100 о С проходит через максимум при 4 о С. У других жидкостей плотность при нагревании монотонно уменьшается.
• Воду можно переохладить до температур значительно ниже точки плавления льда, сохранив ее при этом в жидком виде. Вообще, ледовые кристаллы могут образоваться только в метастабильной "переохлажденной" воде. В природе и лаборатории дистиллированная вода может достичь глубокого переохлаждения при условии полной ее неподвижности и отсутствия центров кристаллизации - пылинок, кристалликов льда и т.п. Так, дегазованная дистиллированная вода может быть переохлаждена до -70 о С. Но от легкого встряхивания или попадания пылинки такая вода мгновенно превращается в лед.
При -50 о С вода может существовать в виде мельчайших капель и внутри тонких капилляров.
При -30 о С вода в жидком виде может находиться в облаках.
• Нагретая вода замерзает быстрее охлажденной, что не находит пока строгого и убедительного объяснения (парадокс Мпембы).
• Удельная теплота плавления льда необыкновенно высокая. Вода и лед при 0 о С различаются между собой по содержанию скрытой энергии на 333*10 3 Дж. С повышением температуры удельная теплота плавления не увеличивается, а уменьшается на 2,1 Дж/ о С.
• Вязкость воды при температурах ниже 30 о С имеет параболическую зависимость от давления. Для всех веществ вязкость уменьшается с ростом температуры и увеличивается с ростом давления.
• В капиллярах, диаметр которых близок к 10-9 м, вода резко увеличивает вязкость, уплотняется в 1,5 раза и замерзает при температурах ниже минус 73 о С. Молекулы воды в нанотрубках при температуре минус 23 о С и давлении 40000 атм. выстраиваются в спиральные "лесенки", напоминающие двойные спирали.
• Диэлектрическая проницаемость у воды чрезвычайно велика, наивысшая, среди жидкостей и равна 81 (у льда при минус 5 о С она равна 73). У большинства жидкостей она равна 2-8 и лишь у некоторых спиртов - 27-35. Вследствие этого вода обладает большей растворяющей способностью, чем другие жидкости.
• Коэффициент преломления света водой равен 1,333 для длины волны 580 нм при температуре плюс 20 о С, вместо требуемого теорией значения 9.
• Удельная теплоемкость водяного пара до температуры плюс 500 о С отрицательна, т.е. пар при сжатии остается прозрачным, а при разрежении превращается в туман (сгущается).
• Удельная теплота парообразования воды при понижении температуры увеличивается, достигая при 0 о С очень высокого значения 25*10 5 Дж/кг.
• Вода обладает самым высоким, за исключением ртути, поверхностным натяжением среди жидкостей (0,0727 Н/м при 20 о С). Связанное с ним явление капиллярности очень важно для объектов биосферы.
• Существовали исследования "четвертой фазы воды". Так, известный отечественный физико-химик Дерягин предположил существование "аномальной воды", имеющей плотность на 40% выше нормальной и кипящей при температуре 300 о С. Позднее он опроверг свои исследования, объяснив их "неряшливо поставленными экспериментами". В то же время, американский профессор Д.Поллак также говорил об "аномальной воде".

Интересные факты о воде
Вода — самая удивительная и загадочная из всех жидкостей, существующих на Земле.
Учёные на протяжении многих столетий продолжают проводить исследования, находя новые интересные факты. Каждый человек знает, что без воды жизнь невозможна.
Вода участвует в формировании климата, для многих живых организмов является средой обитания. Её важность сложно недооценить. Не случайно, нашу планету называют голубой, именно вода покрывает 71 % поверхности земного шара.
В статье мы собрали самую важную и интересную информацию про воду: гипотезы её появления на нашей планете, особенности строения молекулы, агрегатные состояния, уникальные и необычные свойства.
Что такое вода, химические названия
Вода — это бинарное неорганическое соединение, химическая формула H2O.
При нормальных условиях представляет собой прозрачную, бесцветную жидкость, которая не имеет вкуса и запаха, текуча (принимает форму сосуда).
Молекула воды состоит из одного атома кислорода и двух атомов водорода, которые соединены между собой ковалентной связью. Никакие другие элементы таблицы Менделеева при соединении не образуют жидкости. Рассмотрим строение молекулы H2O на изображении.

Вода имеет несколько химических названий:
- оксид водорода;
- гидроксид водорода;
- монооксид дигидрогена;
- дигидромонооксид;
- гидроксильная кислота.
Агрегатные состояния
Из всех веществ, существующих на Земле, только вода может иметь три принципиально разных агрегатных состояния: жидкое, газообразное и твердое. Благодаря трём агрегатным состояниям происходит круговорот воды в природе и жизнь на Земле. Рассмотрим подробнее каждое агрегатное состояние.
- Жидкое (вода). В нормальных условиях вода является жидкостью. Образует мировой океан, реки, ручьи и т.д.
- Газообразное (водяной пар) — это бесцветный газ, не имеет вкуса и запаха. Испаряется с поверхности океанов, рек, болот, почвы, растений и поступает в воздух или образуется путём кипения жидкой воды или сублимации из льда. Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя стадию плавления (перехода в жидкое состояние).
- Твердое (лёд). При температуре от нуля и ниже вода превращается в лёд. В холодное время года он сковывает реки и лужи, выпадает в виде осадков: снежинок, града, инея, образует ледяные облака. Встречается в виде ледников и айсбергов.
Строение в различных агрегатных состояниях
Жидкая вода, лёд и водяной пар имеют один и тот же состав, но разные состояния.
Рассмотрим строение молекулы на изображении.

Многочисленные исследования ученых подтверждают, что по структуре вода и лед близки друг к другу. Структура льда – это решетчатый каркас. Структура воды зависит от содержания разных веществ, которые в ней растворяются, а также от нерастворимых соединений и некоторых других факторов.
При температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах. При температуре близкой к точке кипения они располагаются более свободно.
Свойства
Вода — уникальный природный компонент, который обладает рядом свойств. Рассмотрим основные:
- не имеет цвета, запаха и вкуса;
- распространенный растворитель;
- обладает высоким поверхностным натяжением, уступая в этом только ртути;
- имеет большую теплоту испарения (используется для терморегуляции);
- чистая вода — хороший изолятор;
- обладает большой теплоёмкостью (увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры);
- плотность в разных диапазонах температур меняется неодинаково.
Существуют необычные свойства. Например, в твердом виде вода легче, чем в жидком. Лёд не тонет в воде. В твёрдом состоянии частички воды располагаются по порядку, между ними остается много свободного пространства. Когда лёд тает, активность частичек повышается, свободное пространство заполняется. Жидкая форма становится более тяжелой, нежели твердая.
Такая уникальная способность даёт возможность любому водоёму не замерзать по всей глубине. Даже при самом сильном морозе температура воды у дна не опускается ниже +4 ᵒС. Все живые существа (рыбы и другие) могут спокойно пережить самую суровую зиму подо льдом.
Когда лёд тает, плотность увеличивается, и становится максимальной при температуре +4 ᵒС. В диапазоне от +4 ᵒС до +40 ᵒС плотность снижается, потом снова увеличивается. При понижении температуры ниже +4 ᵒС плотность уменьшается, т.е. при замерзании вода расширяется.
Горячая вода замерзает быстрее, чем холодная. Это связано с большей скоростью испарения и излучения тепла.
Теплоемкость и некоторые другие физические свойства воды тоже зависят от температуры неодинаково. Другие виды жидкостей не имеют таких особенностей – чтобы какой-то один параметр менялся по-разному на разных порогах температуры.
Круговорот воды в природе
Вода образует водную оболочку нашей планеты – гидросферу.
Её делят на Мировой океан, континентальные поверхностные воды и ледники, а также подземные водоёмы. Переходы H2O из одних частей гидросферы в другие составляют сложный круговорот воды на Земле
Круговорот воды в природе — это непрерывное движение воды в гидросфере Земли. В процессе этого обмена водная масса меняет агрегатное состояние: из жидкой или твердой превращается в газообразную и обратно.
Рассмотрим на примере.
- С поверхности океанов, морей, рек и суши вода в виде пара поднимается вверх.
- Высоко над землей он охлаждается и образует множество водяных капелек и льдинок. Из них образуются облака.
- В виде осадков вода возвращается на Землю.
Происхождение воды на планете
Возникновение воды на нашей планете является предметом научных споров. Существует 2 основные гипотезы:
- Космическое происхождение. Часть учёных считают, что вода появилась вследствие падающих метеоритов, астероидов, которые содержали воду.
- Земное происхождение. Другие учёные считают, что вода образовалась на Земле во время формирования, а не занесена с космоса.
Наука о воде
Изучением природных вод, явлений и процессов занимается наука Гидрология.
Первые упоминания о гидрологии появились на заре истории человечества около 6000 лет назад.
Начало гидрологических наблюдений в России относится к XV–XVI вв.: в записях русских летописцев сохранились сведения о свойствах воды, наводнениях, паводках, замерзании.
Значение на Земле
Без воздуха человек может прожить несколько секунд, без еды – несколько месяцев, без воды – максимум несколько суток. Снижение содержания воды в организме всего лишь на 2% может вызвать сильную слабость. При нехватке 8% уже может возникнуть серьезное недомогание, а при 12% – смерть.
Каждая клетка живого организма состоит из жидкости и нуждается в регулярном пополнении. Без воды не проживут ни люди, ни растения, ни животные.
Вода формирует климат, участвует в круговороте воды в природе, для многих живых организмов является средой обитания.
Применение
Все люди на планете прекрасно знают, что жизнь без воды невозможна. Любое начало жизни изначально зарождается в воде.
Человек применяет воду:
- для поддержании жизни (приготовления пищи, обеспечения организма водой);
- для бытовых нужд (гигиены, уборки и т. д);
- в сельском хозяйстве и животноводстве;
- промышленности (используется при производстве продуктов питания, чугуна, стали, резины и т. д);
- медицине;
- химии (в качестве реагента для химических реакций, опытов, исследований);
- рыболовстве;
- для транспортировки людей и грузов;
- для спорта;
- в земледелии;
- для пожаротушения;
- служит источником энергии (электростанции).
Сколько жидкости в теле человека

Эмбрион человека состоит из жидкости не менее, чем на 97%. Когда ребенок рождается, вода составляет около 80% его тела. В первые несколько суток после рождения этот показатель существенно снижается.
В дальнейшем содержание воды в организме человека постоянно уменьшается. В пожилом возрасте в теле человека доля воды не превышает 50-60%.
Как определить, сколько воды в теле человека?
Массу тела необходимо разделить на 3 и умножить на 2.
Стоит отметить, что расчет считается приблизительным (может отличаться на 5-10%) Так как количество воды зависит от возраста, пола, физической активности, состояния здоровья.
Основные функции
Вода необходима каждому живому существу. Каждый живой организм состоит из клеток. Ключевую роль выполняет вода. Она составляет около 70 процентов от её массы. Рассмотрим кратко основные функции.
- Растворитель. Большинство химических реакций протекают только в водной среде.
- Транспортная функция. Переносит питательные вещества из одной части в другую.
- Функция регенерации. С помощью воды удаляются ненужные продукты жизнедеятельности.
- Регулирует терморегуляцию. Защищает организм от перегрева и обеспечивает равномерное распределение тепла по организму.
- Все обменные процессы в организме регулируются водой.
Польза чистой питьевой воды
Врачи, диетологи и другие специалисты часто совершают ошибку, когда слишком много внимания уделяют разным продуктам питания и забывают про воду. Любые вещества, даже самые питательные и полезные, могут оказаться совершенно неэффективными, если нет растворителя, способного доставить их в нужные части тела. На Земле есть только один простой, надежный и распространенный растворитель – вода.
Вода участвует абсолютно во всех обменных процессах. И чтобы они протекали нормально, необходимо пить достаточное количество чистой воды. Именно воды, не чая, не напитков. Содержание разных примесей, консервантов и прочих веществ существенно меняют структуру, нормальное молекулярное состояние воды.
Изначально природой заложено употреблять чистую воду. Когда в организм вносится некая смесь, то пищеварительной системе приходится прикладывать много усилий, растрачивать много энергии, чтобы отделить все лишнее и получить воду. Кроме этого, высокое содержание сахара неизбежно провоцирует нарушение нормального обмена веществ.
Сколько нужно пить воды в день
Рекомендуется употреблять чистую воду без примесей 30-40 мл на 1 кг веса.
Средние показатели:
для женщины: 1,5 – 2 литра ежедневно;
для мужчины: 2,5 – 5 литров ежедневно.
Количество рекомендуемой нормы зависит от физической активности, климата и веса.
Процентное содержание в органах
Вода в теле человека находится в разных субстанциях и никогда не смешивается в единое целое.
Жидкости больше в тех клетках, в которых обмен веществ протекает более интенсивно. Рассмотрим таблицу № 1.
Таблица № 1. Процент содержания в органах человека
| Органы | Процент содержания |
| Мозг | 90 |
| Лёгкие | 86 |
| Печень | 86 |
| Кровь | 83 |
| Яйцеклетки | 90 |
| Кости | 72 |
| Кожа | 72 |
| Сердце | 75 |
| Желудок | 75 |
| Селезёнка | 77 |
| Почки | 83 |
| Мышцы | 75 |
Признаки обезвоживания
Если содержание воды резко меняется в одну или другую сторону, то это сразу сказывается на общем состоянии здоровья. Чрезмерное количество воды организм переносит намного легче, чем ее нехватку. Рассмотрим основные симптомы проявления нехватки воды в организме человека.
- Жажда – первый сигнал нехватки жидкости в организме.
- У человека возникают твердые каловые массы и запоры.
- Появляется усталость и слабость.
- Возникают головные боли и головокружения.
- Кожа становится сухой.
- Состояние может сопровождаться сильным упадком настроения (вплоть до тяжелой депрессии).
При длительном сохранении такого состояния могут возникнуть проблемы:
- с артериальным давлением;
- нарушением пищеварения;
- заболеваниями органов ЖКТ;
- может появиться диабет, ожирение (или наоборот – истощение, дистрофия);
- появляются зрительные и слуховые галлюцинации (при потери воды 10%);
- сильное обезвоживание может привести к смерти.
Проходя гидрологический цикл, вода может дополняться химическими элементами: ионами, растворенными газами, микроэлементами и т.д.
Воду квалифицируют по следующим признакам:
- по наличию и составу изотопов в молекуле;
- по степени растворения частиц солей и других примесей;
- по источнику;
- по взаимодействию с другими элементами и компонентами;
- по воздействию человека;
- по индивидуальным параметрам.
Рассмотрим некоторые виды на рисунке.

Запасы пресной воды
Несмотря на то, что Земля более, чем на 70% покрыта водой, лишь 1% является пресной (её солёность не превышает 0,5 ‰).
Более 2/3 запасов пресной воды на Земле хранится в ледниках. Крупнейшим водоёмом пресной воды считается озеро Байкал в России.
Показатели качества
Современные нормы очистки водопроводной питьевой воды предполагают использование хлорсодержащих реагентов, которые избавляют воду от инфекций. В дополнение рекомендуется использовать дополнительные методы очистки. Например, фильтры.
Большой популярностью в развитых странах пользуется бутилированная питьевая вода. Она является экологически чистым продуктом. Реализуется в гигиенически чистой ёмкости и соответствует всем установленным требованиям.
25 интересных фактов
Ученые постоянно исследуют оксид водорода, находя интересные факты.
- Лёд не тонет в воде. Дело в том, что плотность льда меньше чем, воды в жидком состоянии. Поэтому морские обитатели продолжают жизнедеятельность. Другие вещества увеличивают плотность при замерзании.
- Большинство загрязнений вымораживаются при образовании льда.
- Более 2/3 запасов пресной воды на Земле хранится в ледниках.
- Вёдра для воды изготавливают в форме конуса для того, чтобы их не разорвало при случайном замерзании воды.
- Теплоёмкость и некоторые другие физические свойства воды зависят от температуры не одинаково.
- Жидкая вода регулирует температуру Земли, водяной пар — влажность воздуха.
- Снег способен отражать лучи света на 75%, а вода только на 5%, поэтому снежные ночи такие светлые.
- В Антарктиде есть озеро с водой, в 11 раз солёнее морской. В нем настолько соленая вода, что не замерзает даже при — 50 С.
- Горячая вода имеет способность замерзать быстрее, чем холодная. Этот факт легко проверить самостоятельно.
- Лёд встречается на полюсах Луны, а также на полюсах Марса и Меркурия.
- В Антарктике находится самый холодный лёд, а вот самым теплым льдом считается Альпийский, так как его температура составляет 0 градусов по Цельсию.
- Температура кипения воды не всегда составляет 100 градусов по Цельсию. Показатель зависит от атмосферного давления. Например, на Эльбрусе — самой высокой вершине Европы (5642 м), — вода закипит при 80,8 °С.
- Примерно на каждые 100 метров вглубь к центру Земли температура кипения увеличивается на 3°C.
- Озеро Байкал — самое большое пресное озеро в мире.
- Для производства 1 тонны стали требуется 300 тонн воды.
- Учёные считают, что мировой океан изучен только на 2-7%.
- На 1 кг тела коровы приходится 600 грамм жидкости.
- В теле рыбы 70-80 процентов.
- В медузе больше 95 процентов.
- Растения на 50-90 процентов состоят из жидкости.
- Вода участвует в фотосинтезе растений.
- Бегемот употребляет около 250 литров воды в сутки.
- Древесное растение Эвкалипт в сутки поглощает из почвы и испаряет 320 л влаги.
- Верблюд способен выпить больше 100 литров воды менее, чем за 15 минут.
- Скалистая белка может жить без воды до 100 дней.
Заключение
Вода – удивительное вещество, обладающее химическими и физическими свойствами. Она формирует климат на планете, для многих живых организмов является средой обитания, необходима для фотосинтеза растений и жизнедеятельности всех живых организмов.
При обычных условиях вода — прозрачная жидкость без вкуса и запаха . В тонком слое она бесцветна , а при толщине более \(2\) м имеет голубой оттенок.
Плотность жидкой воды максимальна при \(4\) °С и равна \(1\) г/см³ (\(1000\) г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при \(0\) °С составляет \(0,92\) г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.

Температура плавления воды равна \(0\) °С, а температура кипения — \(100\) °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой.
Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей .
Водородная связь — это взаимодействие между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами кислорода, фтора или азота другой молекулы.
Эта связь слабее ковалентной. Но благодаря ей значительно повышаются температуры плавления и кипения веществ.

Водородными связями объясняется также способность воды образовывать при замерзании снежинки разной формы.

Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость . Она медленно нагревается и так же медленно остывает. Благодаря такому свойству вода влияет на климат Земли, сглаживая колебания температуры. Моря и океаны накапливают тепло в тёплое время, а в холодное — его освобождают.
У воды высокие значения теплоты плавления и теплоты парообразования . Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года: зима — весна — лето — осень.
Ещё одна особенность воды — высокое поверхностное натяжение . Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку и позволяет некоторым насекомым перемещаться по ней.


Высокая полярность молекул обуславливает способность воды растворять вещества с ионной или ковалентной полярной связью. Такие вещества часто называют гидрофильными . К ним относятся соли, щёлочи, некоторые кислоты и другие. Неполярные вещества в воде не растворяются. Их называют гидрофобными .


Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
Содержание
Виды воды
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
-
и жёсткая вода — по содержанию катионов кальция и магния
- По изотопам молекулы:
-
(по составу почти соответствует обычной) (дейтериевая)
- Сверхтяжёлая вода (тритиевая)
-
, Водопроводная вода и деионизированная вода
Химические названия воды
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода
- Гидроксид водорода
- Гидроксильная кислота
- Оксидан
- Дигидромонооксид
Свойства
Физические свойства
Вода в нормальных атмосферных условиях сохраняет жидкое агрегатное состояние, тогда как аналогичные водородные соединения являются газами. Это объясняется особыми характеристиками слагающих молекулы атомов и присутствием связей между ними. Атомы водорода присоединены к атому кислорода, образуя угол 104,45°, и эта конфигурация строго сохраняется. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды является активным диполем, где кислородная сторона отрицательна, а водородная положительна. В результате молекулы воды притягиваются своими противоположными полюсами, и образуют полярные связи, на разрыв которых требуется много энергии [2] . В составе каждой молекулы Ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, в результате чего он может проникать в электронную оболочку отрицательно поляризованного атома кислорода соседней молекулы, образуя водородную связь с другой молекулой. Каждая молекула связана с четырьмя другими посредством водородных связей — две из них образует атом кислорода и две атомы водорода [2] . Комбинация этих связей между молекулами воды — полярной и водородной и определяет очень высокую температуру её кипения и удельную теплоты парообразования [2] . В результате этих связей в водной среде возникает давление в 15-20 тыс. атмосфер, которое и объясняет причину трудносжимаемости воды, так при увеличении атмосферного давления на 1 бар, вода сжимается на 0,00005 доли её начального объёма [2] [В каких пределах изменения давления корректна эта оценка?] .
Структуры воды и льда между собой очень похожи [2] . В воде, как и во льду, молекулы стараются расположиться в определённом порядке — образовать структуру, однако тепловое движение этому препятствует. При температуре перехода в твёрдое состояние тепловое движение молекул более не препятствует образованию структуры, и молекулы воды упорядочиваются, в процессе этого объёмы пустот между молекулами увеличиваются и общая плотность воды падает, что и объясняет причину меньшей плотности воды в фазе льда. При испарении, напротив, рвутся все связи. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Однако удельная теплоёмкость воды, в отличие от других веществ непостоянна: при нагреве от 0 до 35 градусов Цельсия её удельная теплоёмкость падает, в то время как у других веществ она постоянна при изменении температуры. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (0 °C и 333,55 кДж/кг) и парообразования (2250 кДж/кг).
| Температура °С | Удельная теплоёмкость воды кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Вода обладает также высоким поверхностным натяжением среди жидкостей, уступая в этом только ртути [3] [4] [5] [6] . Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде [7] . Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.


Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O + ) и гидроксильных ионов HO − составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния

Фазовая диаграмма воды: по вертикальной оси — давление в Па, по горизонтальной — температура в Кельвинах. Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные структурные модификации льда
Читайте также:

