Вирусная теория рака кратко
Обновлено: 05.07.2024
В 1946 г. выдающийся советский вирусолог Лев Александрович Зильбер предложил вирусогенетическую теорию рака. Согласно этой теории, вирусы вызывают рак, но в отличие от других заболеваний вирусного происхождения рак – патологический процесс, а не инфекционный.
При онкогенезе ДНК вирусного происхождения внедряется (интегрируется) как фрагмент в ДНК клетки и становится составной частью клеточного генома. Поэтому при электронно-микроскопическом исследовании опухолей далеко не всегда в их клетках можно обнаружить вирус. Эта интеграция – начальное звено в цепи процессов превращения нормальной клетки в раковую.
Впервые возможность интеграции вирусных геномов в геном клетки была установлена на умеренных фагах. При заражении бактериальных клеток фагами может либо развиться острая инфекция, заканчивающаяся лизисом бактериальной клетки и выходом из нее новых фаговых частиц, либо произойти интеграция генома фага с геномом бактериальной клетки.
В середине 1950-х гг. американский ученый Ренато Далбекко показал, что вирус полиомы, подобно умеренным фагам, либо размножается обычным путем и вызывает острую инфекцию клеток, либо его геном интегрируется в геном клетки, после чего может вызвать ее злокачественную трансформацию.
Большую роль в развитии рака может играть действие химических и физических канцерогенов, а также старение организма. У кур, зараженных вирусом птичьей оспы, при смазывании кожи метилхолантреном развивается рак кожи. Нанесение дегтя на кожу кролика, зараженного вирусом папилломы Шоупа, сокращает латентный период и увеличивает частоту образования опухолей.
ДНК- и РНК-содержащие вирусы
Среди опухолеродных вирусов есть ДНК- и РНК-содержащие. ДНК-содержащие вирусы разделяются на следующие 5 классов.
1. Полиомавирусы – обезьяний вирус SV40, вирус полиомы мышей и вирусы человека ВК и JC.
2. Папилломавирусы – 16 вирусов папилломы человека и множество папилломовирусов животных.
3. Аденовирусы – 37 вирусов человека, множество аденовирусов животных (например, 24 вируса обезьян и 9 вирусов крупного рогатого скота).
4. Герповирусы – вирусы простого герпеса человека, цитомегаловирус человека, вирус Эпштейна–Барр и онкогенные вирусы приматов, лошадей, кур, кроликов, лягушек.
5. Вирусы, подобные вирусу гепатита В, – вирус гепатита В человека, гепатита североамериканского сурка, гепатита земляных белок и гепатита уток.
РНК-содержащие опухолеродные вирусы разделяются на 4 класса.
1. Вирусы типа С – возбудители лейкозов и сарком.
2. Вирусы типа В – вирус рака молочных желез мышей.
3. Вирусы типа А.
4. Вирусы типа D – вирус, выделенный при раке молочных желез обезьян резус, и вирус, выделенный из перевиваемых клеток человека.
Объяснение возникновения рака интеграцией вирусного и клеточного геномов, данное Л.А. Зильбером, было понятно для ДНК-содержащих вирусов. Однако его теория сталкивалась с большими трудностями в случае онкогенных вирусов, содержащих РНК, поскольку вирусная РНК не может встраиваться непосредственно в геном клетки.
Между ДНК- и РНК-содержащими опухолеродными вирусами существуют кардинальные различия. При заражении клеток ДНК-содержащими вирусами происходит либо репликация, приводящая к инфекции, либо интеграция геномов, приводящая к трансформации клетки. РНК-содержащие вирусы индуцируют только трансформацию нормальной клетки в злокачественную, т.е. при заражении клетки таким вирусом должна происходить интеграция их геномов.
Только в 1970 г. американские ученые Г.Темин и Мицутани и независимо от них Д.Балтимор разрешили эту загадку. Они доказали возможность передачи генетической информации от РНК к ДНК. Это открытие перевернуло центральную догму молекулярной биологии о том, что генетическая информация может переноситься только в направлении ДНК–РНК–белок.
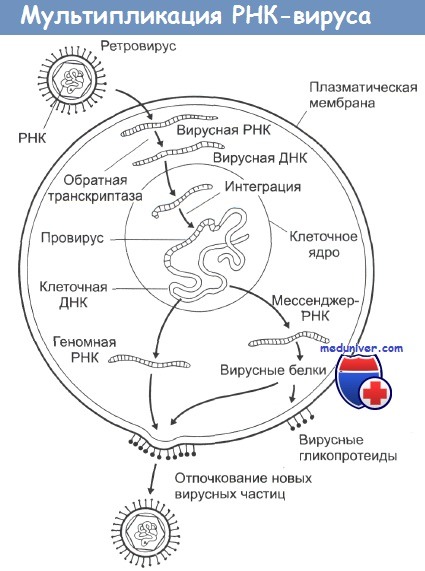
Пять лет понадобилось Г.Темину для обнаружения фермента, осуществляющего перенос информации от РНК к ДНК, – РНК-зависимой ДНК-полимеразы. Этот фермент получил название обратной транскриптазы. Г.Темину удалось не только получить фрагменты ДНК, комплементарные заданной цепи РНК, но и доказать что ДНК-копии могут встраиваться в ДНК клеток и передаваться потомству.
Группа РНК-содержащих вирусов, в цикле развития которых по геномной РНК с помощью обратной транскриптазы осуществляется синтез ДНК, встраивающейся затем в геном клетки хозяина, получила название ретровирусов (Retroviridae – от REversed TRanscription). В семейство ретровирусов входят вирусы саркомы Рауса, миелоцитоматоза, саркомы мышей Харви и Молони, лейкоза птиц, ретикулоэндотелиоза птиц, лейкоза мышей, Т-клеточного лейкоза человека, иммунодефицита человека.
Вирусная ДНК, встроившаяся в геном эукариотической клетки-хозяина, может в течение многих поколений никак себя не проявлять. Однако при определенных условиях вирусные гены могут активироваться и вызывать либо репликацию вируса, либо превращение клетки в раковую.
Многочисленные работы, проведенные в 1970–1980-х гг. показали, что у многих видов животных есть гены, похожие, но не совпадающие с генами ретровирусов. Эти гены животных и человека иногда называют эндогенными ретровирусами (HERV), или провирусами.
Обычно HERV не активны и менее онкогенны для вида-хозяина, чем экзогенные. Возможно, вызывающие рак гены ряда ретровирусов когда-то, на ранних этапах биологической эволюции, закрепились в ДНК предков вида-хозяина. При репликации всей ДНК клетки онкогены передавались из поколения в поколение. По оценкам ученых HERV появились в геноме предков человека приблизительно 50 млн лет назад.
Интеграция экзогенного ретровируса в геном хозяина не сайт-специфична (случайна), поэтому закрепление его в геноме подчиняется достаточно жестким правилам. Поскольку провирус не исчезает из генома, присутствует во всех клетках своего носителя и распространяется по популяции, то его присутствие должно быть безвредным для организма и, возможно, дает какие-то преимущества своему хозяину.
Имеются данные об участии HERV в регуляции экспрессии генов, в эмбриональном развитии, в предотвращении заражения родственными экзогенными ретровирусами, в иммуносупрессии и развитии некоторых аутоиммунных заболеваний.
Необходимо упомянуть также, что существует теория происхождения ретровирусов из клеточных генов. Главную роль в этом процессе отводится обратной транскриптазе, включению созданных ею ДНК в ДНК клетки и процесс рекомбинации (Г.Темин).
Опухолеродные вирусы, как правило, видоспецифичны, т.е. поражают животных только определенного вида. Но из каждого правила есть исключения. Например, вирусом куриной саркомы можно заразить крыс, кроликов, хомячков, обезьян, ящериц и даже змей.
Группа ученых под руководством Б.А. Лапина установила, что вирус лейкоза человека может вызывать сходное заболевание у двух видов обезьян. Это привело к созданию экспериментальной модели для изучения всех стадий развития заболевания, начиная с самых первых этапов.
Исследователи показали, что при заражении клетки ретровирусом синтез его ДНК происходит в два этапа: вначале по нити вирусной РНК синтезируется комплементарная ей нить ДНК, затем на последней достраивается комплементарная ей вторая нить ДНК и одновременно происходит, деградация нити РНК вируса.
Онковирусы могут принимать участие в развитии иммунологических заболеваний. Так, при изучении красной волчанки методом молекулярной гибридизации было показано, что в ДНК клеток пораженных болезнью тканей имеются последовательности, комплементарные РНК вируса кори и обратная транскриптаза. Это указывало на экспрессию онковируса в клетках больных волчанкой.
На основании полученных данных было высказано предположение, что на начальных стадиях заболевания происходит взаимодействие коревого вируса с латентным онковирусом. В результате обратная транскриптаза онковируса транскрибирует коревую РНК в ДНК, которая затем встраивается в геном клетки. Экспрессия этих дополнительных генов проявляется в синтезе специфических вирусных белков, часть из которых встраивается в мембраны клеток и изменяет их свойства. Эти клетки становятся чужеродными для организма и подвергаются атаке собственной иммунной системы.
Онковирусы могут активироваться при трансплантации (пересадке) тканей. Рассмотрим следующий пример. При скрещивании двух чистых линий мышей рождается потомство, толерантное к пересадке тканей любого из родителей: все виды тканей, включая и лимфоидную, содержащую иммуноактивные клетки, приживаются. Однако если перед пересадкой лимфоидной ткани у реципиента подавить иммунную систему, то после трансплантации у мышей резко усиливается экспрессия онковирусов. С течением времени у животных развиваются злокачественные лимфомы.
Возможно, онковирусы – нормальные компоненты организма, принимающие участие в процессах клеточного цикла, дифференциации и пролиферации. Тогда старение, действие физических и химических канцерогенов может вызвать развитие рака. Однако присутствие канцерогенов нехарактерно для естественной среды обитания, а заболевание особей, вышедших из репродуктивного периода, не может отразиться на судьбе популяции. В то же время, интегрированный в геном клетки онковирус со слабыми онкогенными свойствами может защитить клетку от родственного высокоактивного вируса.
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
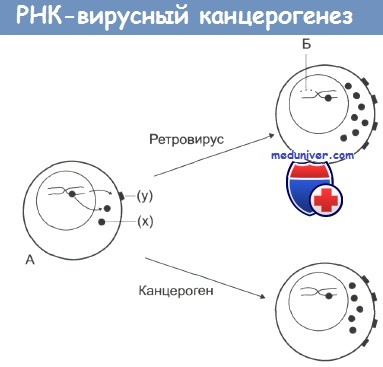
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Введение
Онкология – это раздел медицины, изучающий доброкачественные и злокачественные опухоли, механизмы и закономерности их возникновения и развития, методики их профилактики, диагностики и лечения. Онкологические заболевания представляют собой обширный и разнородный класс заболеваний, являются системными и затрагивают, так или иначе, все органы и системы человека. Пациенты зачастую воспринимают онкологический диагноз как приговор, но далеко не все, даже злокачественные, опухоли приводят к летальному исходу. Ни одно возможное заболевание не вызывает столько страхов и мифов, как злокачественное новообразование или рак.
Цель данной работы – изучение онкологических заболеваний с целью выявления причин их возникновения, и рекомендаций по профилактике данных заболевания.
Задачи: 1. Рассмотреть основные теории появления рака; 2. Изучить осложнения онкологических заболеваний, и процедуры предотвращения заболеваний из области онкологии.
Используемые методы исследования: теоретический анализ источников и литературы по данной теме.
Объект исследования – онкологические заболевания. Предмет – организм человека.
Гипотезой данного исследования служит предположение о том, что если мы будем владеть как можно большим объёмом информации о принципах возникновения онкологических заболеваний и осложнениях данного заболевания, то можем дать рекомендации по профилактике появления подобных заболеваний.
Актуальность данной работы заключается в открытой проблеме онкологических заболеваний у населения. Данная работа дает людям информацию о возникновении подобных заболеваниях, и процедурах предотвращения появления в организме человека различных новообразований.
Основной и общепринятой теорией является мутационная теория, согласно которой злокачественные образования развиваются из одной опухолевой клетки. Рак возникает в организме человека вследствие накопления мутаций в некоторых участках клеточной ДНК, и эти мутации приводят к образованию дефектных белков.
Другая теория канцерогенеза – теория случайных мутаций. Данная теория заключается в предположении о появлении случайной мутации, за всю жизнь клетки, только в одном гене. Возможно, под воздействием канцерогенов частота мутаций возрастает в несколько раз. Хромосомные перестройки в пределах данной теории рассматриваются лишь как побочный эффект канцерогенеза.
Еще одной теорией происхождения рака является теория ранней хромосомной нестабильности. Было обнаружено, что ранняя хромосомная нестабильность приводит к появлению мутаций. Нестабильность генома как генетический фактор вместе с естественным отбором может привести к появлению доброкачественной опухоли, которая, по мнению авторов теории, может перейти в злокачественное новообразование.
Осложнения онкологических заболеваний
После появления первый симптомов заболевания таких как: резкое снижение веса, высокая температура, слабость, болевые ощущения, изменения эпидермиса, появление бородавок или родинок, слабый кашель или охриплый голос, небольшие уплотнения, нарушения стула и функционирования мочеполовой системы, проблемы с желудочно-кишечным трактом и затрудненное глотание. Злокачественные клетки начинают в быстром темпе развиваться в определенной системе организма, поражая ее. Также возможно распространения этих клеток в другие системы. После этого и выявляются осложнения. Выделяют несколько осложнений онкологических заболеваний:
1. Болевой синдрому пациентов с раком часто бывает связан с метастазами в костях, вовлечением нерва или нервного сплетения, давлением, оказываемым опухолью или выпотом.Агрессивная терапия болинеобходима для лечения рака и поддержания качества жизни.
2. Плевральный выпотдолжен быть дренирован, если имеет клинические проявления, и необходим мониторинг возобновления образования выпота. При быстром возобновлении возможно наложениеторакостомы для дренирования, склерозирование или повторное дренирование с помощью катетера.
3. Компрессия спинного мозгаможет случиться из-за распространения опухоли в позвоночник и требует экстренного хирургического вмешательства или лучевой терапии. Симптомами могут быть боль в спине, парестезии нижних конечностей, дисфункция кишечника и мочевого пузыря. Диагноз подтверждается с помощью компьютерной томографии или Магнитно-резонансная томография.
4. Тромбы в венахнижних конечностей, вызывающиетромбоэмболии ветвей легочной артерии, часто диагностируются у больных раком поджелудочной железы, легких и другими солидными опухолями, а также у пациентов с опухолями головного мозга. Опухоли продуцируют прокоагулянты, такие как тканевый фактор, что ведёт к повышению тромбообразования, особенно у пациентов, подвергающихся хирургическому вмешательству.
5. Метаболические и иммунные осложнения ракавключают гиперкальциемию, гиперурикемию, повышенную продукцию адренокортикотропного гормона, антител, вызывающих неврологические нарушения, гемолитическую анемию, и другиепаранеопластические процессы.
Профилактика онкологических заболеваний
Специалисты выделяют 10 основных шагов для профилактики онкологических заболеваний:
1. Употребляйте в пищу много фруктов, овощей и грубой волокнистой пищи. Природа – это естественная кладовая полезных веществ, нельзя недооценивать ее возможности.
2. Употребляйте пищу с низким содержанием жиров. Сократите потребление жирных продуктов питания, они должны составлять не более 30% всех потребляемых ежедневно калорий.
4. Ведите активный образ жизни. 30 минут физических упражнений три - четыре раза в неделю уменьшат риск возникновения онкологических заболеваний.
5. Не злоупотребляйте спиртными напитками. Злоупотребление алкоголем может привести к необратимым разрушительным процессам. Специалисты рекомендуют мужчинам выпивать не больше двух порций алкоголя в день, женщинам – в два раза меньше. Порция – это 250 мл пива; 50 мл крепких спиртных напитков; один бокал вина.
6. Откажитесь от курения. Некурящий человек живет в среднем на 15 лет дольше курящего. Если вы курите, это увеличивает риск возникновения рака легкого, мочевого пузыря, поджелудочной железы, полости рта, носоглотки, гортани, пищевода, желудка, шейки матки, почки, печени и острого лейкоза. Помните, что, бросая курить сегодня, вы обеспечиваете себя здоровьем завтра.
7. Следите за состоянием Вашей кожи. Появление новых пигментных пятен, кровоточащие, не заживающие, вызывающие зуд, быстро растущие родинки - сигналы тревоги. Избегайте прямого солнечного воздействия, особенно с 10.00 утра и до 16.00 дня. Если Вам необходимо находиться на улице, позаботьтесь о защите открытых участков кожи. Не забывайте использовать солнцезащитные крема с фактором защиты 15 и более.
8. Женщины, следите за здоровьем вашей груди. Женщинам после 18 лет необходимо ежемесячно проводить самообследование молочных желез, ежегодно проходить обследование в смотровом кабинете.
9. Женщины, регулярно посещайте гинеколога. Каждая женщина должна не реже одного раза в год быть осмотрена врачом-гинекологом с обязательным ультразвуковым исследованием.
10. Ежегодно проходите профилактические осмотры. Обращайтесь к врачу, если испытываете какие-либо из перечисленных симптомов:не проходящий кашель или охриплость;одышка;боль в груди;длительное повышение температуры тела;затруднение глотания;значительное снижение веса (по неочевидной причине);потеря аппетита;чувство тяжести в животе;заметное, не проходящее изменение ритма дефекации по неочевидной причине;безболезненные, увеличенные лимфоузлы.
При соблюдении данных процедур профилактики, возможность появления онкологических заболеваний снижается.
Выводы
Мы изучили теории появления рака. Хотя и нет одного определенного обоснования появления рака, понимаем примерный механизм его появления. Рассмотрели осложнения, появляющиеся при течении онкологических заболеваний, осознали их серьезность. Из-за возникновения этих осложнений, лечение данных заболеваний затрудняется, но все же поддается лечению, с помощью определенных процедур терапии. Также мы изучили информацию о профилактике онкологических заболеваний, данные профилактические процедуры снижают возможность появления рака в организме человека. Помимо снижения риска возникновения онкологических заболеваний, данные процедуры полезны для поддержания здоровья организма, и помогают снизить возможность появления других заболеваний, которые могут затронуть различные системы организма человека. Рак – это очень страшно, не зря этот диагноз некоторые пациенты воспринимают как смертный приговор, но даже из-за не полной изученности данного заболевания, существуют различные методы диагностирования и терапии данного заболевания. Поэтому хоть рак и страшен, но его в большинстве случаев можно победить, если вовремя его обнаружить, а для этого нужно проводить регулярные хотя бы базовые обследования собственного организма.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.

Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.

Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV

Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.

Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma–Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein–Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.
Рак – бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям – первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению.
Роль вирусов в канцерогенезе
В.А. Матусевич, И.В. Стукалова
Рак – бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям – первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению.
Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами.
К факторам, способным вызывать развитие опухоли, относятся:
- различные канцерогенные вещества,
- наследственная предрасположенность,
- ионизирующее излучение
- опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения.
В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы.
К таким вирусам относятся:
- вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus),
- вирус иммунодефицита человека (ВИЧ),
- вирус папилломы человека (ВПЧ),
- вирусы гепатита В и С,
- вирус Эпштейна-Барр (ВЭБ)
- и другие.
Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1)
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1). HTLV-1 – это онкогенный вирус, способный вызывать Т-клеточный лейкоз/лимфому у взрослых, а также тропический спастический парапарез и ряд других неонкологических заболеваний.
Существуют 3 основных пути передачи инфекции от инфицированных лиц:
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/HCV)
Смертность от рака печени на планете среди всех смертностей от онкологических заболеваний занимает 3-е место после смертности от рака легкого и желудка. При этом каждая пятая диагностируемая в мире опухоль – это рак печени.
Основными методами диагностики вирусов гепатита В и С являются методы иммуноферментного анализа и полимеразной цепной реакции.
Вирус папилломы человека
В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие.
Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений.
Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов).
Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин.
Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса.
Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Диагностика ВПЧ-инфекции обладает очень высокой клинической значимостью. Она позволяет выявить тех пациенток, для которых жизненно необходимы активные, комплексные меры, направленные на профилактику и раннюю диагностику рака шейки матки. Самым надежным диагностическим тестом по выявлению всех 12 онкогенных типов вируса папилломы человека в настоящее время является метод полимеразной цепной реакции в режиме реального времени.
Вирус Эпштейна-Барр (ВЭБ)
Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8)
В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Следует понимать, что HHV-8 является всего лишь фактором риска развития вышеуказанных заболеваний. Если человек инфицирован HHV-8, то это не означает, что у него обязательно разовьётся саркома Капоши или лимфома.
Сам по себе вирус герпеса 8 типа опасности для здорового человека практически не представляет. Большинство людей с нормальным иммунитетом, инфицированных этим вирусом, не отмечают каких-либо проявлений, и он не оказывает на них никакого вредного влияния.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии).
По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Вирус иммунодефицита человека (ВИЧ)
ВИЧ может создавать необходимые условия (иммунодефицит) для возникновения рака. Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г.
Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей неходжкинских лимфом.
Биологические свойства онкогенных вирусов
Несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая процессы деления клеток и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- от момента инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой вероятностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к прогрессированию наиболее агрессивного опухолевого клона.
Такими дополнительными факторами, играющими роль сопутствующих канцерогенов, могут быть: злоупотребление алкоголем, табакокурение, коинфекция генитальным герпесом, малярия, нитрозамины в продуктах питания, пестициды.
Основные методы диагностики
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР).
Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа
Метод иммуноферментного анализа является стандартным методом лабораторной диагностики.
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок.
Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий обнаружить возбудителя заболевания на основе его генетической информации.
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п.
При помощи данного метода вирусные инфекции можно обнаружить уже через 5–7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95–99%, а специфичность достигает 100%.
Достижения науки в области онкологии
Таким образом, достижения науки в области онкологии внесли определенную ясность в понимание механизмов возникновения некоторых злокачественных новообразований и все же большую часть из них не удается увязать с инфицированностью тем или иным вирусом, что создает большое поле деятельности современным онкологам в направлении дальнейшего изучения механизмов развития онкологических заболеваний.
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова.
В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.
Читайте также:

