Валентность атомов типы химических связей кратко
Обновлено: 08.07.2024
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:

Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.

σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
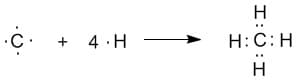
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp 2 , sp 3 ).
Типы гибридизации атомных орбиталей
sp 3 -гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp 3 -гибридизацией.

sp 3 -гибридизация орбиталей в молекуле метана
Как видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp 3 -гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.

Гибридизация орбиталей молекул метана, аммиака, воды
sp 2 -гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
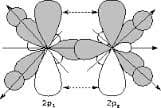
sp 2 -гибридизация атомов этилена
Плоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp 2 -гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
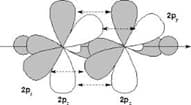
sp-гибридизация атомов ацетилена
Ниже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp 2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp 3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4 — , TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp 2 d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4] 2 — |
| s,p,p,p,d | sp 3 d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp 3 d 2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)6 3- , CoF6 3- |
Гибридные орбитали в пространстве располагаются различным образом:

Пространственное расположение гибридных орбиталей различных типов
Познакомившись с разными типами химической связи, мы можем теперь уточнить одно из ключевых понятий химии - понятие " валентность" . Это понятие используется для количественной характеристики способности атома соединяться с определенным числом других атомов.
| Валентность (W) - число химических связей, образуемых атомом. |
Понятие " валентность" имеет смысл только для двух типов химической связи: ионной и ковалентной.В случае ковалентной связи используется понятие ковалентность.
| Ковалентность (Wк) - число ковалентных связей, образованных атомом. |
Ковалентность атома равна числу электронных пар, связывающих атом с другими атомами молекулы или кристалла.В случае ионной связи используется понятие электровалентность.
| Электровалентность (Wэ) - абсолютная величина формального заряда атома. |
Если атом образует одну связь, то его называют одновалентным, если две связи - двухвалентным, и так далее.
Валентность атома определяется как сумма электровалентности и ковалентности: W = Wэ + Wк
Если известно химическое строение вещества, то валентность каждого из атомов можно просто посчитать по структурной формуле, например:
1) NaCl, (Nа ) (Cl ) Wэ(Nа) = 1, Wк (Nа) = 0, W(Nа) = 1 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
2) НCl, Н -Cl Wэ(Н) = 0, Wк(Н) = 1, W(H) = 1 Wэ(Cl) = 0, Wк(Cl) = 1, W(Cl) = 1
3) CaCl2, (Ca 2 )(Cl )2 Wэ(Ca) = 2, Wк(Ca) = 0, W(Ca) = 2 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
4) CH4, Wэ(C) = 0, Wк(C) = 4, W(C) = 4 Wэ(H) = 0, Wк(H) = 1, W(H) = 1
5) NH4Cl, Wэ(H) = 0, Wк(H) = 1, W(H) = 1 Wэ(N) = 1, Wк(N) = 4, W(N) = 5 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
- Можно ли, зная только валентности атомов, входящих в состав вещества, составить структурную формулу этого вещества?
- Нет, нельзя! Например, зная, что Wк(O) = 2, а Wк(H) = 1, можно составить сколько угодно структурных формул соединений кислорода с водородом: H-О-Н, Н-О-О-Н, Н-О- О-О-Н и т.д.
Формально все эти структурные формулы правильные, но реально существующим соединениям соответствуют только первые две из них.
Чтобы составить структурную формулу вещества, нужно прежде всего знать:
1) тип структуры (молекулярный или немолекулярный);
2) простейшую или молекулярную формулу;
3) тип химических связей (ионные или ковалентные);
4) валентности атомов.
Для простейших соединений этого достаточно, а для более сложных потребуется дополнительная информация (химическая).
Попробуем составить структурную формулу сернистого газа. Это молекулярное вещество с молекулярной формулой SO2. Связи в молекуле ковалентные. Wк(S) = 4, Wк(O) = 2. По этим данным можно составить единственную структурную формулу: O=S=O.
Составим теперь структурную формулу серной кислоты. Это тоже молекулярное вещество. Молекулярная формула H2SO4. Связи в молекуле ковалентные. Wк(H) = 1, Wк(S) = 6, Wк(O) = 2. В этом случае по имеющимся данным можно составить пять " правильных" структурных формул:
Чтобы выбрать из них действительно правильную, нам придется вспомнить, что серная кислота - гидроксид, а из этого следует, что все атомы водорода в ее молекуле связаны с атомами кислорода. Отсюда правильная структурная формула серной кислоты:
Для соединений, в которых атомы связаны только ионными связями, структурные формулы составляют, используя заряды ионов, например:
А как определить, какую валентность атом может проявлять, соединяясь с другими атомами, то есть как охарактеризовать его валентные возможности? Для этого прежде всего вспомним, что должно быть у атома, чтобы он мог образовать химические связи. Это может быть
1) электрический заряд;
2) неспаренный валентный электрон;
3) неподеленная пара валентных электронов;
4) свободная валентная орбиталь.
Все это вместе взятое и определяет валентные возможности атома каждого из элементов. При этом надо помнить, что прежде всего реализуются валентные возможности, определяемые зарядом и наличием неспаренных электронов как в основном, так и в возбужденном состоянии (основные валентные возможности), а уж затем - определяемые наличием у атома неподеленных электронных пар и свободных валентных орбиталей (дополнительные валентные возможности).
Валентные возможности зависят от того, в каком валентном состоянии находится атом.
| Валентное состояние - состояние электронной оболочки атома перед образованием связи. |
К валентным состояниям относятся основное, возбужденные и ионизированные состояния атома.
Аналогично можно проанализировать основные валентные возможности атомов других элементов.
Дополнительные валентные возможности проявляются атомами при образовании связей по донорно-акцепторному механизму. Причем атомы прежде всего реализуют свои основные валентные возможности и только после этого при наличии соответствующих условий - дополнительные валентные возможности. Как проявляются дополнительные валентные возможности атомов бора, азота и кислорода, вы уже знаете (см. параграф 7.12). С дополнительными валентными возможностями других атомов вы познакомитесь позже.
| Хлороводород - HCl. Бесцветный газ с резким неприятным запахом. Сухой хлороводород - устойчивое и малоактивное соединение. Большую часть этого вещества не получают специально, а выделяют из промышленных газов, где оно скапливается в качестве побочного продукта разнообразных химических производств; не утратил своего значения и прямой синтез хлороводорода из простых веществ. Почти весь хлороводород расходуется на производство соляной (хлороводородной) кислоты - раствора хлороводорода в воде. Максимальная массовая доля хлороводорода соляной кислоте зависит от температуры и давления (при комнатной температуре и атмосферном давлении она равна примерно 40 %). Соляная кислота - один из самых разрушительных реагентов для большинства металлов. В очень разбавленном виде соляная кислота присутствует в желудке человека и участвует в пищеварении. Используется соляная кислота для очистки поверхности металлов, в производстве лекарств, разнообразных хлоридов, уксусной кислоты, органических красителей, пластмасс и во многих других отраслях промышленности. |
ВАЛЕНТНОСТЬ, КОВАЛЕНТНОСТЬ, ЭЛЕКТРОВАЛЕНТНОСТЬ, ВАЛЕНТНОЕ СОСТОЯНИЕ, ОСНОВНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ, ДОПОЛНИТЕЛЬНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ.
1.Определите электровалентность, ковалентность и общую валентность атомов в следующих веществах:
Запишите для молекулярных веществ молекулярные формулы, а для немолекулярных - простейшие. Назовите эти вещества.
2.Составьте структурные формулы следующих соединений:
а) триоксид серы SO3 [молекулярное вещество, Wк(S) = 6];
б) сернистая кислота H2SO3 [молекулярное вещество, Wк(S) = 4];
в) гидроксид бария Ba(OH)2 [немолекулярное вещество, ионный кристалл, в анионе связь ковалентная, W(O) = 2, Wэ(Ba) = 2, Wк(H) = 1];
г) сульфат марганца MnSO4 [немолекулярное вещество, ионный кристалл, в анионе связь ковалентная, Wэ(Mn) = 2, Wк(S) = 6, W(O) = 2].
3.Охарактеризуйте основные валентные возможности атомов следующих элементов: Na, Ca, Se, Br. Приведите примеры простейших соединений этих элементов. Составьте молекулярные (или простейшие) и структурные формулы этих веществ; назовите их.
7.16. Степень окисления
При химических реакциях происходит разрыв одних и образование других химических связей. Валентные электроны при этом часто переходят от одного атома к другому. Это происходит, например, при образовании хлорида натрия по реакции натрия с хлором:
На одном из этапов этой реакции атомы натрия отдают электроны, а атомы хлора их принимают, то есть происходит переход электронов от атомов натрия к атомам хлора с образованием ионов:
Эти процессы носят названия " окисление" и " восстановление" .
Окисление - процесс, при котором атомы теряют электроны.
Восстановление - процесс, при котором атомы принимают электроны.
Натрий при образовании хлорида натрия окисляется (теряет электроны), а хлор восстанавливается (принимает электроны). При этом хлор является окислителем, а натрий - восстановителем.
Но не всегда электроны при химических реакциях полностью переходят от одного атома к другому. Например, при образовании воды из водорода и кислорода
электроны образующейся полярной ковалентной связи Н- O лишь частично переходят от атомов водорода к атомам кислорода.
Для характеристики состояния атома после полной или частичной потери одного или нескольких электронов или их приобретения используется величина, называемая степенью окисления (С/О). Можно дать два определения этой величины.
Степень окисления атома:
1) тот заряд, который приобрел бы атом в молекуле (в кристалле), если бы все связи в ней (в нем) стали ионными;
Итак, степень окисления - это условный заряд атома (условие - в определении).
Степень окисления обозначается римскими цифрами со знаком перед ними: +I, - II, +VIII, - III и так далее.
Определим степени окисления атомов в молекуле воды. При этом для указания, к какому из атомов мы в соответствии с определением полностью сместим электроны, будем использовать круглые скобки:
У изолированного атома кислорода было 6 валентных электронов, стало 8 валентных электронов, следовательно, степень окисления кислорода 6 - 8 = - II.
У изолированного атома водорода был 1 валентный электрон, стало 0 валентных электронов, следовательно степень окисления атома водорода 1 - 0 = +I.
Точно так же можно определить степени окисления атомов в молекуле пероксида водорода H2O2, но здесь электроны неполярной связи О-O нужно разделить между атомами кислорода:
| О: | было 6е - | Н: | был 1е - |
| стало 7е - | стало 0е - | ||
| С/О(О) - I | С/О(Н) +I |
В бинарных ионных соединениях все связи между атомами ионные, и, следовательно, степени окисления атомов равны зарядам их простых ионов.
Высшая степень окисления атома элемента равна номеру группы, в которой находятся данный элемент в системе элементов. Это следует из того, что атом может отдать (полностью или частично) только свои валентные электроны, а их число у него как раз и равно номеру группы. Так, высшая степень окисления калия равна +I, алюминия +III, углерода +IV, хлора +VII и так далее.
Низшая степень окисления атома элемента равна номеру группы минус 8 и не может быть по абсолютной величине больше четырех. Это связано с тем, что атом может принимать электроны (полностью или частично) только на валентные подуровни, стремясь дополнить свою электронную конфигурацию до конфигурации благородного газа. Так, низшая степень окисления азота равна - III, кислорода - II, хлора - I и так далее.
Зная степени окисления атомов и помня о электронейтральности веществ, легко составлять простейшие формулы соединений, даже не зная, каков в них характер химических связей (ограничение: все атомы каждого из элементов должны быть в одной и той же степени окисления). Примеры:
1) Na и О: Na +I O -II Na2O;
2) Р и С1: Р +V С1- I PCl5;
3) Cl и О: Cl +VII O- II Cl2O7;
4) Н и S: Н +I S- II H2S;
5) Н и Ca: H- I Ca +II CaH2.
Если в сложном веществе известны степени окисления атомов всех элементов кроме одного, то, зная формулу этого соединения (простейшую или молекулярную), можно определить степень окисления атомов и последнего из элементов. Примеры:
Обозначение степени окисления атома при символе элемента занимает место правого верхнего индекса, но в формуле сложного вещества - может ставиться и над символом соответствующего элемента.
Уметь определять степень окисления атома в сложном веществе особенно важно в тех случаях, когда атомы элементов могут иметь несколько степеней окисления, например:
H +I 2S S- II ; SO- II 2 S +IV ; SO- II 3 S +VI .
Если в аналогичных соединениях атомы одного элемента имеют разную степень окисления, то ее обозначение используется в названиях этих сложных веществ (более подробно об этом в следующей главе):
Fe2O3 - оксид железа(III) и FeO - оксид железа(II);
PCl3 - хлорид фосфора(III) и PCl5 - хлорид фосфора(V).
В этом случае знак " +" в обозначении степени окисления не ставится.
ОКИСЛЕНИЕ, ВОССТАНОВЛЕНИЕ, ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ, СТЕПЕНЬ ОКИСЛЕНИЯ.
1.Составьте структурные формулы следующих молекулярных веществ:
а) SO3, Wк(S) = 6; б) SCl2O, Wк(S) = 4; в) N2O3, Wк(N) = 3; г) H2S2O7, Wк(S) = 6; д) H2CrO4, Wк(Cr) = 6; е) H3BO3, Wк(B) = 3. Определите степени окисления атомов, входящих в состав каждого из этих соединений.
2.Определите степени окисления атомов :
а) углерода в гексахлорэтане и этане
б) серы и кислорода в тиосерной и пероксодисерной кислотах
в) натрия и кислорода в оксиде и пероксиде натрия;
г) хлора и кальция в хлориде кальция.
3.Определите высшую и низшую степени окисления атомов элементов третьего периода. Приведите примеры соединений.
4.Составьте простейшие формулы оксидов азота, в которых степени окисления азота а) +I, б) +II, в) +III, г) +IV, д) +V и назовите эти оксиды. Как вы думаете, для каких из этих оксидов простейшая формула может не совпадать с молекулярной?
5.Составьте простейшие формулы оксидов марганца со степенью окисления а) +II, б) +III, в) +IV, г) +VII и назовите эти оксиды. Как вы думаете, каков тип связи в каждом из этих оксидов?
6.Используя обозначения степеней окисления, назовите соединения: а) СО и CO2; б) SiO и SiO2; в) SF4 и SF6; г) CrCl2 и CrCl3; д) CuBr и CuBr2.
1. Составление шаростержневых моделей молекул.
2. Простейшие окислительно-восстановительные реакции.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору

Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .

Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А : В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь , образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о , поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108 о 28′.

Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4 + , в ионах органических аминов, например, в ионе метиламмония CH3-NH2 + ;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;

– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.

В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.

Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Длина связи, нм
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Длина связи, нм
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4 + , сульфат-ион SO4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na2 + SO4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи:

Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы . Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе , создавая таким образом достаточно прочную металлическую кристаллическую решетку . При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом , а также к ислорода с водородом , в меньшей степени азота с водородом .

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Валентность элементов зависит от электронной структуры атома и проявляется только при образовании химических соединений. Рассмотрим, например, как образуется из двух атомов водорода молекула водорода. Как известно, атом водорода имеет один s-электрон. Если сталкиваются два атома водорода, имеющие s-электроны с антипараллельными спинами, то эти электронные облака могут частично перекрывать друг друга, образуя электронную пару,
принадлежащую двум атомам водорода одновременно, что прочно связывает оба атома в единую молекулу (рис. 4). При образовании химической связи происходит взаимное перекрывание орбиталей. Условно обобществление электронной пары при образовании химической связи изображают следующим образом:
Точки обозначают два обобществленных электрона. Такая химическая связь, образованная посредством общих электронных пар, носит название ковалентной связи.
Однако ковалентная связь, образованная при помощи пары s-электронов, встречается только у водорода. В других молекулах она обычно бывает образована либо двумя р-электронами, облака которых имеют гантелевидную форму, либо одним s— и одним р-электроном.
Например, рассмотрим образование молекулы фтора F2. Атом фтора имеет на внешнем электронном слое один неспаренный р-электрон. Образование молекулы фтора приводит к взаимному перекрыванию двух р-электронных облаков. Условно это можно изобразить так:
В этом случае оказывается завершенным до октета внешний электронный слой каждого атома. Каждый атом фтора имеет 6 собственных электронов (принадлежащих как к s-так и к р-оболочкам) и 2 обобществленных и того 8 электронов.
Может быть также случай, когда обобществляется не одна, а несколько электронных пар. Например, при образовании молекулы азота
В этом случае каждый атом азота имеет на внешнем слое по 2 собственных и 6 (3 пары) обобществленных электронов.
■ 35. Объясните образование ковалентной связи в молекуле хлора Сl2, кислорода O2. (См. Ответ)
До сих пор мы рассматривали ковалентную связь, образованную электронами двух одноименных атомов. Однако значительно чаще бывают случаи, когда такая связь возникает между разноименными атомами. Например, в молекуле метана СН4 она возникает между атомом углерода и четырьмя водородными атомами:

В молекуле двуокиси углерода СO2 между двумя атомами кислорода и атомом углерода:

и т. д.
Валентность элементов в такого рода соединениях называется ковалентностью. Например, углерод в составе молекулы двуокиси углерода четырехковалентен, а кислород — двухковалентен. Величина ковалентности каждого атома определяется числом образованных им электронных пар.
Одновременно не свойства образованной разноименными атомами ковалентной связи оказывает влияние разная эдектроотрицательность элементов. Атом, обладающий большей электроотрицательностью, с большей силой притягивает к себе общие электронные пары, вызывая их смешение. Например, в молекуле метана СН4 общие электронные пары смещены в центр молекулы к атому углерода как к более электроотрицательному, в молекуле двуокиси углерода — к атомам кислорода. Естественно ожидать возникновения около атомов кислорода

избыточного отрицательного, а около атомов водорода избыточного положительного заряда. Однако, благодаря тому, что молекулы СН4 и СО2 симметричны, явление смещения электронных пар при химических процессах не проявляется. Иначе обстоит деда, если молекула не симметрична, как, например, HCl хлористый водород. Ковалентная связь образуется здесь за счет взаимного перекрывания одного непарного s-электронного облака водорода и одного непарного p-электронного облака хлора (рис. 5). Все остальные орбита ли внешнего электродного слоя хлора парные. Условно это обозначается так:
Однако электроотрицательность хлора значительно выше, чем водорода, поэтому общая электронная пара сильно смещается к хлору, в результате у хлора возникает отрицательный заряд, а на другом конце молекулы (у атома водорода) — положительный заряд ядра. В молекуле обнаруживаются как бы два полюса — положительный и отрицательный. Такая молекула носит название полярной молекулы, или диполя.
Ковалентная связь, при которой происходит смещение электронных пар к более электроотрицательному атому, называется полярной связью. Полярная связь не всегда приводит к образованию диполя. Например, в случае
формирования молекулы двуокиси углерода смещение электронных пар происходит, но диполь не возникает, так как молекула симметрична. Несимметричными являются полярные молекулы воды, аммиака, сероводорода и т. д.
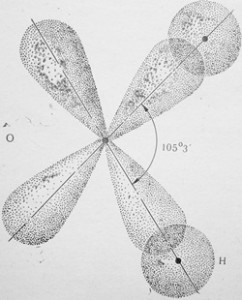
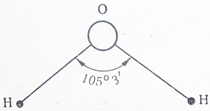
Молекула воды образована одним атомом кислорода, имеющим 6 электронов на внешнем слое (из них два непарных р-электрона), и двумя атомами водорода, имеющими по одному непарному s-электрону. Как известно, р— орбитали располагаются вокруг ядра во взаимно перпендикулярных плоскостях под прямым углом. При образовании связи происходит взаимное перекрывание р-орбиталей кислорода и s-орбиталей водорода. При этом s-орбитали двух водородных атомов слегка отталкиваются, увеличивая угол между р-орбиталями кислорода до 105°3′ (рис. 6). Возникший угол называют валентным углом.
Смещение общих электронных пар к сильно отрицательному кислороду также приводит к образованию диполя.
Электроны, участвующие в образовании химической связи, носят название валентных электронов. Чаще всего валентными являются электроны внешнего электронного слоя. Однако в образовании химической связи могут принимать участие и электроны более глубокого предвнешнего слоя.
■ 36. Объясните образование полярной ковалентной связи в молекулах НВr, H2S. (См. Ответ)
Нередко, если различие в электроотрицательности элементов достаточно велико, может произойти не просто смещение электронов в сторону более электроотрицательного элемента, а полная передача электронов от одного атома к другому. Например, при возникновении химической связи между атомами натрия и хлора валентный электрон натрия полностью переходит на внешний электронный слой хлора, достраивая его до восьми-электронной структуры

При этом атом хлора приобретает избыточный отрицательный заряд — 1, превращаясь из нейтрального атома в отрицательно заряженный ион. Атом натрия, лишившись одного электрона, приобретает положительный заряд +1, превращаясь из нейтрального атома в положительный ион. Разноименно заряженные ионы, притягиваясь друг к другу силой электростатического притяжения, образуют молекулу хлорида натрия. Записать этот процесс можно следующим образом:

Такая молекула называется ионной, так как она образована ионами. Химическая связь в этом случае также называется ионной или электровалентной. Валентность элементов в таких соединениях называют электровалентностью.
Молекулы с ионным типом химической связи возникают в том случае когда соединяются атомы элементов с резко различной электроотрицательностью — типичного металла и типичного неметалла. Это могут быть элементы начала и конца периода.
■ 37. Объясните образование ионной связи в молекулах бромида калия KBr, сульфида натрия Na2S, нитрида магния Mg3N2.(См. Ответ)
Ковалентная неполярная связь характерна для простых веществ — неметаллов, молекулы которых состоят из одноименных атомов, например Cl2, O2,N2 и т. д.
Когда соединяются разноименные атомы неметаллов, электроотрицательность которых различна, тогда неминуемо возникает полярная связь. Однако, в зависимости от взаимного пространственного расположения атомов, молекула в целом может быть полярной или неполярной.
Например, молекула НСl полярна, так как имеет линейный характере Молекула воды Н2О также полярна — она плоская с валентным углом 105°3′ (рис. 7). Молекула аммиака NH3 также полярна, так как имеет форму трехгранной пирамиды с атомом азота на вершине. Валентный угол 108° (рис. 8). Молекула СН4 неполярна, так как имеет форму тетраэдра с атомом углерода в центре. Валентный угол 109°28′ (рис. 9). Таким образом, полярность молекулы в целом зависит от ее состава и взаимного пространственного расположения атомов.
В сложных молекулах часто сочетаются разные типы химической связи. Например, в молекуле сульфата натрия Na2SO4 атомы натрия соединены с кислородом посредством ионной связи, а сера с кислородом — посредством ковалентной связи
Таких примеров можно привести очень много.
■ 38. Среди перечисленных ниже формул веществ иайд!псе вещества с ионными, полярными и неполярными молекулами и объясните, как они построены: НВr, H2O, СО, РН3, CaS, ZnCl2, SiH4, CCl4 (См. Отв ет)
Другие типы химических связей (металлическая, во-дородная, донорно-акцепторная) будут рассмотрены ниже.
Кристаллические решетки
Все до сих пор сказанное о химической связи между атомами касалось только отдельно взятых молекул. Но говоря о вещество, было бы неправильно рассматривать только отдельные молекулы так как не даёт целостного представления о веществе.
Почти все твердые вещества в обычных условиях находятся в виде кристаллов. Структуру кристаллов называют кристаллической решеткой. Она может быть образована как одинаковыми, так и разными частями.
У хлорида натрия NaCl кристаллическая решетка образована ионами Na + и Сl — (рис. 10), поэтому она называется ионной. В ее узлах поочередно располагаются ионы натрия и хлора. Они связаны друг с другом силами электростатического притяжения. Кристалл представляет собой как бы единое целое.
Таким образом, в твердом агрегатном состоянии (в кристаллах) мы находим только ионы Na + и Сl — . Лишь в газообразном состоянии (в парах) NaCl существует в виде молекул.
Кристаллическая решетка может быть образована не ионами, а атомами. Например, в узлах кристаллической решетки алмаза (рис. 11) или графита находятся атомы углерода, связанные между собой ковалентной химической связью. Таким образом, кристалл представляет собой как бы гигантскую молекулу.
■ 39. Почему температура плавления воды намного ниже температуры плавления углерода?
40. Как можно, зная температуру плавления и другие физические свойства вещества, прийти к заключению о характере его кристаллической решетки?
41. В чем различие ионных, атомных и молекулярных кристаллических решеток?(См. Ответ)
Определение с помощью периодической системы элементов валентности элементов и формул их высших окислов
Периодическая система элементов позволяет по положению в ней того или иного элемента находить формулу его соединений с другими элементами, определять характер химической связи в их молекулах и их свойства.
Номер группы в периодической системе численно равен высшей валентности любого элемента данной группы в соединениях с кислородом. Например, для серы, элемента VI группы, она равна 6, для фосфора, элемента V группы, — 5, стронция, элемента II группы, — 2. На основе теории строения атома это легко объяснимо. Внешний электронный слой этих элементов имеет соответственно 6, 5 и 2 валентных электрона. При соединении с более электроотрицательным элементом, например с кислородом, образуется столько валентных связей, сколько имеется валентных электронов. При этом электроны сильно смещаются в сторону наиболее электроотрицательного атома (например, SO3, P2O5), а иногда (при образовании электровалентной связи) и совсем отрываются и переходят к последнему, в результате чего возникают такие соединения, как высшие окислы SrО, Na2O и т. д.
Высшую валентность в соединениях с кислородом, численно равную номеру группы, проявляют элементы не только главных подгрупп, но и побочных, несмотря на то что на внешнем электронном слое их атомов чаще всего бывает 1 — 2 электрона, независимо от того, в какой группе они находятся. Например, хорошо известен окисел Mn2O7, где валентность марганца (элемента VII группы) равна 7, несмотря на то что внешний электронный слой атома марганца имеет 2 электрона. Ванадий (элемент V группы) в высшем окисле V2O5 проявляет валентность 5, хотя внешний электронный слой ванадия имеет лишь 2 электрона. Это объясняется тем, что в образовании химической связи принимают участие не только электроны внешнего слоя, но и предвнешнего, электронные оболочки которого не полностью застроены. Правда, для вовлечения в процесс электронов более глубокого слоя нужна большая энергия, поэтому такие соединения обычно поручить труднее.
■ 42. Какова высшая валентность в соединениях с кислородом элементов ниобия, галлия, технеция?
43. Какова высшая валентность в соединениях с кислородом элементов олова, сурьмы, таллия?
44. Напишите формулы высших окислов кадмия, галлия, гафния.
45. Напишите формулы высших окислов азота, углерода, лития.
Пользуясь периодической системой элементов, можно определить характер свойств окисла того млн иного элемента и формулу его гидроокиси. Для того чтобы суметь определить это по периодической системе элементов, нужно хорошо знать как они классифицируются и свойства для них типичны. (См. Ответ)
Статья на тему Валентность элементов
Похожие страницы:
Валентность химических элементов С точки зрения современных представлений валентность элемента определяется числом не спаренных электронов в его атомах. Однако если.
Переменная валентность это способность некоторых элементов получать или отдовать различное количество электронов. Это означает, что эти соединения имеют одинаковые элементы.
Что такое строение вещества Атомы и молекулы Атомная теория Дальтона Гипотеза Авогадро Теория химического строения Периодический закон и система элементов.
Содержание статьи1 Что такое ковалентная связь1.1 Квантовомеханическое рассмотрение ковалентной связи1.2 Образования ковалентной связи Что такое ковалентная связь Существование таких молекул.
Содержание статьи1 Химическая связь Строение молекул1.1 Образование молекулы водорода1.1.1 Образование многоатомных молекул Химическая связь Строение молекул Это взаимодействие атомов которая.
СТРОЕНИЕ МОЛЕКУЛЫ HNO3 Атомы элементов второго периода не имеют свободных d-подуровней. Поэтому фтор проявляет только одну валентность, равную единице, кислород.
Читайте также:

