Углерод и кремний кратко
Обновлено: 01.07.2024
Сегодня разберем урок химии 17 — Подгруппа углерода. Общая характеристика. Углерод и кремний. Физические и химические свойства углерода, кремния и их соединений.
Главную подгруппу элементов четвертой группы периодической системы составляют: углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (Рb). На внешнем уровне у них по четыре электрона, электронные конфигурации имеют вид: nS 2 nP 2 . Они в соединениях проявляют степени окисления от –4 до +4. Сверху вниз в подгруппе металлические свойства усиливаются, а неметаллические ослабевают. Углерод и кремний являются типичными неметаллами, германий проявляет амфотерные свойства, а олово и свинец являются типичными металлами.
Углерод существует в следующих аллотропных модификациях: алмаз, графит, карбин. В 1990 г. из сажи, образованной при испарении графита в электрической дуге в атмосфере гелия, была выделена новая форма С – фуллерен С60.
Алмаз – самое твердое вещество, найденное в природе. Алмаз имеет кристаллическое строение тетраэдра, где один атом углерода находится в центре, а в четырех вершинах тоже по атому углерода. Каждый атом углерода связан с четырьмя соседними прочными ковалентными связями. Такое строение обусловливает высокую твердость алмаза. Он не проводит электрический ток.
Графит – кристаллическое вещество серого цвета с металлическим блеском. Графит имеет строение слоистой гексагональной кристаллической решетки. Он проводит электрический ток, мягок, легко измельчается.
Карбин представляет собой линейный полимер с чередующимися простыми и тройными связями, проявляет полупроводниковые свойства.
Химические свойства.
- Реакция с кислородом. При окислении в избытке кислорода образуется СО2 (углекислый газ) а в недостатке кислорода – СО (угарный газ): С + О2 → СО2; 2С + О2 → 2СО. металлов из оксидов: 2СuO + C → 2Cu + CO2.
- Образование карбидов с металлами: Са + 2С → СаС2.
- Реакция с водородом: С + 2Н2 → СН4.
- Взаимодействие с концентрированными растворами серной и азотной кислот: С + 2Н2SO4 → CO2 + 2SO2 + 2H2O; 3C + 4HNO3 → 3CO2 + 4NO + 2H2O.
- Реакция с водяным паром при высокой температуре с образованием водяного газа: С + Н2О → СО + Н2.
Оксид углерода (II) CO – угарный газ, без цвета и запаха, сильно ядовит. Между атомами углерода и кислорода имеется тройная связь, состоящая из двух ковалентных и одной донорно-акцепторной связи, поэтому его строение изображают: :С ≡ О:. Оксид углерода восстанавливает металлы из их оксидов: Fe2O3 + 3CO → 2Fe + 3CO2↑. На воздухе горит синим пламенем: 2СО + О2 → 2СО2. С парами воды дает СО2 и Н2: СО + Н2О → СО2 + Н2. С хлором соединяется с образованием очень ядовитого газа фосгена: СО + Сl2 → COCl2.
Оксид углерода (IV) и угольная кислота. Оксид углерода (IV) CO2 – углекислый газ. Представляет собой газ без цвета и запаха, растворимый в воде. Получают по реакциям: СаСО3 → СаО + СО2↑. СаСО3 + 2НСl → CaCl2 + CO2↑.
Химические свойства. Является типичным кислотным оксидом и проявляет все их свойства.
2. Реакция с основаниями: СО2 + NaOH → NaHCO3,
3. C водой дает слабую, неустойчивую угольную кислоту:
Угольная кислота дает два ряда солей: средние (карбонаты, например карбонат кальция СаСО3) и кислые (гидрокарбонаты, например гидрокарбонат кальция Са(НСО3)2).
Карбонат кальция СаСО3 в природе встречается в виде минерала кальцита. Является главной составной частью мела, мрамора, известняка.
Карбонат натрия Na2CO3·10H2O. Используют практически во всех отраслях химического производства. Безводную соль называют кальцинированной содой.
Карбонат калия К2СО3, (поташ) используют в производстве тугоплавкого стекла.
Гидрокарбонат натрия NaHCO3 (питьевая сода) находит применение в производстве пекарского порошка, медицине, кулинарии.
Кремний представляет собой темно-серые блестящие непрозрачные кристаллы; хрупок, тугоплавок. Существует в виде двух аллотропных модификаций: кристаллического и аморфного. Проявляет полупроводниковые свойства и находит применение в производстве полупроводниковых приборов.
Кремний получают восстановлением оксида кремния избытком магния при нагревании: SiO2 + 2Mg → Si + 2MgО.
Химические свойства.
Аморфный кремний реагирует с кислородом при нагревании с образованием оксида кремния: Si + O2 → SiO2, а также с галогенами, например: Si + 2Cl2 → SiCl4. При высокой температуре кремний взаимодействует с углеродом с образованием карборунда : Si + C → SiC. С активными металлами кремний реагирует с образованием силицидов: Si + 2Mg → Mg2Si. Взаимодействует с растворами щелочей: Si + 2KOH + Н2О → K2SiO3 + 2H2↑
Оксид кремния SiO2 – твердое тугоплавкое вещество, широко распространено в природе. Встречается в виде двух модификаций – кристаллического и аморфного кварца. Оксид кремния является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой: xSiO2·yН2О, где х и у – целые числа. Самой простой из кремниевых кислот является H2SiO3, которую называют просто кремниевой кислотой.
Оксид кремния растворим в плавиковой кислоте: SiO2 + 4 HF → SiF4 + 2H2O
При сплавлении с основными оксидами, основаниями и карбонатами образует силикаты – соли кремниевой кислоты: SiO2 +BaO → BaSiO3 ; SiO2 + 2NaOH → Na2SiO3 + H2O ; SiO2 + CaCO3 → CaSiO3 + CO2↑.
Кремниевая кислота – твердое вещество, нерастворимое в воде. При нагревании разлагается с выделением воды: H2SiO3 → H2O + SiO2. Концентрированные растворы силикатов натрия и калия называют жидким стеклом. Оно используется в строительстве в качестве связующего. Соединения кремния широко используются при производстве стекла, цемента, керамики.
Стекло получают из смеси песка SiO2, соды Na2CO3 и известняка CaCO3, которую нагревают до 1500 °С. При этом протекают реакции:
Затем силикаты натрия и калия сплавляют с песком и получают стекло Na2O·CaO·6SiO2.
Если же вместо соды брать поташ К2CO3, то образуется тугоплавкое стекло К2O·CaO·6SiO2.
Чтобы придать стеклу нужную окраску, в него добавляют соответствующие оксиды металлов: оксиды железа придают стеклу зеленый цвет, кобальта – синий, меди – голубой, серебра – желтый и т.д. Если в состав стекла входит оксид свинца, то получают хрусталь – ценное стекло, обладающее большой лучепреломляющей способностью. Хрусталь хорошо шлифуется, после чего приобретает сильный блеск.
Это был урок химии 17 — Подгруппа углерода. Общая характеристика. Углерод и кремний. Физические и химические свойства углерода, кремния и их соединений.
Ключевые слова конспекта: углерод, кремний, элементы IVA-группы, свойства элементов, алмаз, графит, карбин, фуллерен.
Элементы IV группы – это углерод, кремний, германий, олово и свинец. Более подробно рассмотрим свойства углерода и кремния. В таблице приведены важнейшие характеристики этих элементов.
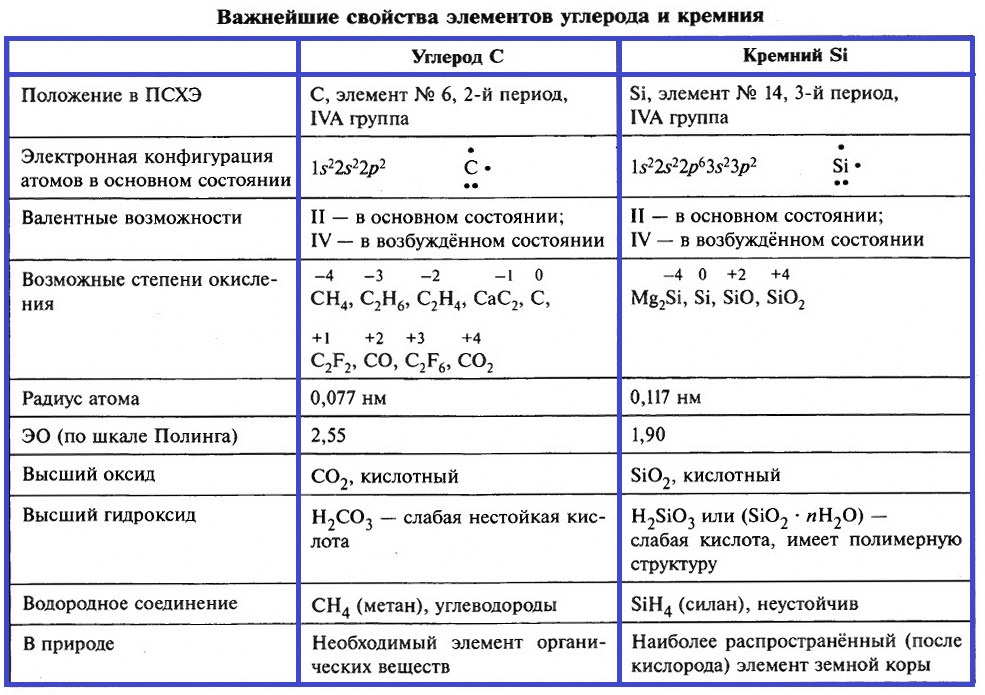

Почти во всех своих соединениях, углерод и кремний четырёхвалентны, их атомы находятся в возбуждённом состоянии. Конфигурация валентного слоя атома углерода при возбуждении атома меняется:

Аналогично меняется конфигурация валентного слоя атома кремния:
На внешнем энергетическом уровне атомов углерода и кремния находится 4 неспаренных электрона. Радиус атома кремния больше, на его валентном слое имеются вакантные 3d–орбитали, это обусловливает отличия в характере связей, которые образуют атомы кремния.
Степени окисления углерода меняются в интервале от –4 до +4.
Характерной особенностью углерода является его способность образовывать цепи: атомы углерода соединяются друг с другом и образуют устойчивые соединения. Аналогичные соединения кремния неустойчивы. Способность углерода к цепеобразованию обусловливает существование огромного числа органических соединений.
К неорганическим соединениям углерода относятся его оксиды, угольная кислота, карбонаты и гидрокарбонаты, карбиды. Остальные соединения углерода являются органическими.
Для углерода–элемента характерна аллотропия, его аллотропными модификациями являются алмаз, графит, карбин, фуллерен. Сейчас известны и другие аллотропные модификации углерода.
Уголь и сажу можно рассматривать как аморфные разновидности графита.
Кремний образует простое вещество – кристаллический кремний. Существует аморфный кремний – порошок белого цвета (без примесей).
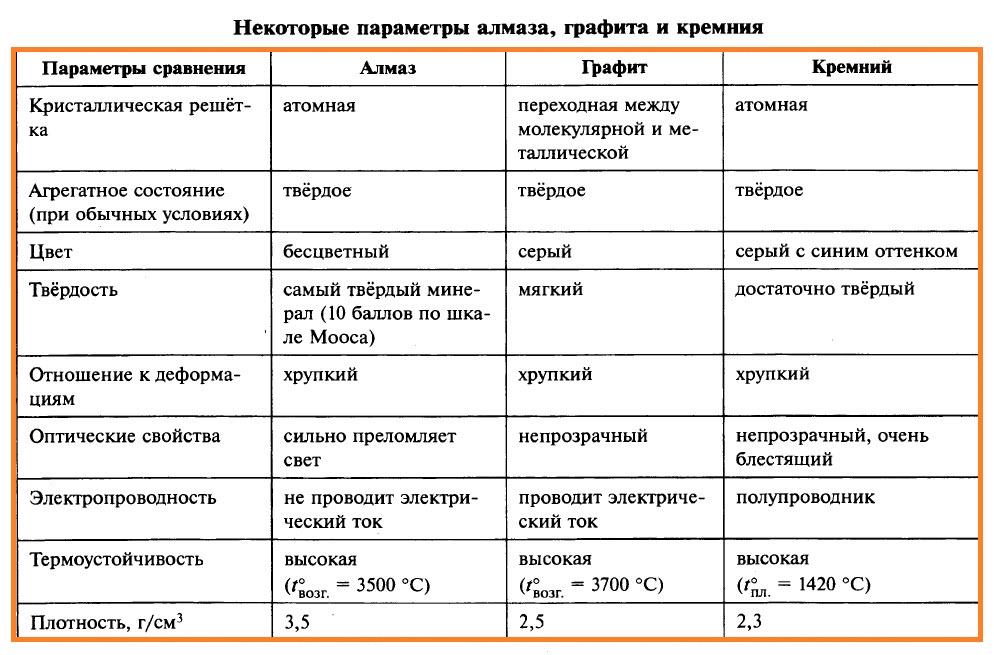
Свойства алмаза, графита и кристаллического кремния приведены в таблице.
Причина явных отличий в физических свойствах графита и алмаза обусловлена различным строением кристаллической решётки. В кристалле алмаза каждый атом углерода (исключая те, которые находятся на поверхности кристалла) образует четыре равноценные прочные связи с соседними атомами углерода. Эти связи направлены к вершинам тетраэдра (как в молекуле СН4). Таким образом, в кристалле алмаза каждый атом углерода окружён четырьмя такими же атомами, располагающимися в вершинах тетраэдра. Симметричность и прочность С–С-связей в кристалле алмаза обусловливают исключительную прочность и отсутствие электронной проводимости.
В кристалле графита каждый атом углерода образует три прочные равноценные связи с соседними атомами углерода в одной плоскости под углом 120°. В этой плоскости образуется слой, состоящий из плоских шестичленных колец.
Кроме того, каждый атом углерода имеет один неспаренный электрон. Эти электроны образуют общую электронную систему. Связь между слоями осуществляется за счёт относительно слабых межмолекулярных сил. Слои расположены один относительно другого таким образом, что атом углерода одного слоя находится над центром шестиугольника другого слоя. Длина связи С–С внутри слоя составляет 0,142 нм, расстояние между слоями – 0,335 нм. В результате связи между слоями гораздо менее прочны, чем связи между атомами внутри слоя. Это обусловливает свойства графита: он мягок, легко расслаивается, имеет серый цвет и металлический блеск, электропроводен и химически более активен, чем алмаз. Модели кристаллических решёток алмаза и графита изображены на рисунке.

Возможно ли превратить графит в алмаз? Такой процесс осуществим в жёстких условиях – при давлении примерно 5000 МПа и при температуре от 1500 °С до 3000 °С в течение нескольких часов в присутствии катализаторов (Ni). Основную массу продукции составляют небольшие кристаллы (от 1 до нескольких мм) и алмазная пыль.
Карбин – аллотропная модификация углерода, в которой атомы углерода образуют линейные цепи типа:
–С≡С–С≡С–С≡С– (α–карбин, полиин) или =С=С=С=С=С=С= (β–карбин, полиен)
Расстояние между этими цепями меньше, чем между слоями графита, за счёт более сильного межмолекулярного взаимодействия.
Карбин представляет собой чёрный порошок, является полупроводником. Химически он более активен, чем графит.
Фуллерен – аллотропная модификация углерода, образованная молекулами С60, С70 или С84. На сферической поверхности молекулы С60 атомы углерода располагаются в вершинах 20 правильных шестиугольников и 12 правильных пятиугольников. Все фуллерены представляют собой замкнутые структуры из атомов углерода. Кристаллы фуллерена относятся к веществам с молекулярным строением.
Кремний. Существует только одна устойчивая аллотропная модификация кремния, кристаллическая решётка которой подобна решётке алмаза. Кремний – твёрдое, тугоплавкое (t°пл = 1412 °С), очень хрупкое вещество тёмно-серого цвета с металлическим блеском, при стандартных условиях – полупроводник.
Общая характеристика элементов 4 группы главной подгруппы
От С к Pb (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 4 электрона на внешнем слое ns 2 np 2 :
С – 2s 2 2p 2
Si – 3s 2 3p 2
Ge – 4s 2 4p 2
Sn – 5s 2 5p 2
Pb – 6s 2 6p 2
Углерод и кремний

Нахождение в природе углерода и кремния
Углерод в природе распространен и в виде простых веществ (алмаз, графит), и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).

Кремний — второй по распространенности элемент на Земле после кислорода. Чаще всего в природе кремний встречается в виде соединений на основе SiO2 (речной и кварцевый песок, кварц и кварциты, кремень, полевые шпаты), силикатов и алюмосиликатов.

Углерод
Химические свойства углерода
Качественные реакции
- Обнаружить карбонат-ионы CO3 2- — можно при помощи взаимодействия солей-карбонатов с сильными кислотами. При этом выделяется углекислый газ — газ без цвета и запаха, не поддерживающий горение:
- Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок CaCO3 растворяется:
- Углекислый газ СО2не поддерживает горение.
- Угарный газ CO горит голубым пламенем.

Взаимодействие углерода с простыми веществами
С кислородом
Горит в недостатке кислорода с образованием угарного газа:
в избытке кислорода – с образованием углекислого газа:
С галогенами (F, Cl, Br, I)
Углерод реагирует со фтором при нагревании до 900ºС с образованием фторида углерода (IV):
Раскаленный углерод реагирует с другими галогенами:
С водородом
При нагревании в присутствии катализатора (Ni) углерод взаимодействует с водородом с образованием метана:
С серой
При сильном нагревании углерод взаимодействует с серой с образованием сероуглерода:
С азотом
С азотом углерод реагирует при действии электрического разряда, образуя дициан:
С углеродом
При нагревании около 2000 о С кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами углерод выступает в качестве окислителя, образуя карбиды:
Взаимодействие со сложными веществами
С водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
С кислотами
Углерод как восстановитель взаимодействует с кислотами-окислителями:
С концентрированной азотной кислотой
C концентрированной серной кислотой:
С солями
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает:
С оксидами
Углерод взаимодействует с многими основными и амфотерными оксидами, с образованием металла и угарного газа:
C + 2ZnO → 2Zn + CO
Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
При взаимодействии углерода с оксидами активных металлов образуются карбиды:
3С + СаО → СаС2 + СО
Кремний
Способы получения кремния
В промышленности основным сырьем для получения кремния служит кремнезем (диоксид кремния):
- Восстановление SiO2 углеродом в электропечах при температуре 1800ºС:
SiO2 + 2C → Si + 2CO
Таким способом получают технический кремний.
- Особо чистый кремний из технического продукта получают следующим образом:
В лаборатории кремний можно получить:
- при прокаливании смеси металлического магния с мелко измельченным кремнеземом:
SiO2 + 2Mg → Si + 2MgO
- восстановление кремния из его оксида алюминием:
Химические свойства кремния
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами.
При этом выделяется белый гелеобразный осадок:

Взаимодействие кремния с простыми веществами
С кислородом
Взаимодействует с кислородом при температуре более 400°С с образованием диоксида кремния:
С галогенами (F, Cl, Br, I)
При обычных условиях кремний реагирует только со фтором с образованием фторида кремния (IV):
С остальными галогенами реакция идет при нагревании до 300-500ºС:
С водородом
Не взаимодействует
С серой
При температуре выше 600°С кремний взаимодействует с серой с образованием сульфида кремния:
С азотом
С азотом кремний реагирует в очень жестких условиях:
С углеродом
При нагревании около 2000 о С кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами кремний выступает в качестве окислителя, образуя силициды:
Взаимодействие кремния со сложными веществами
С водой
Непосредственно с водой не взаимодействует, однако аморфный кремний реагирует с перегретым водяным паром при температуре 400-500°С:
С кислотами
- Кремний не взаимодействует с водными растворами кислот.
- Аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
- При обработке кремния безводным HF комплекс не образуется:
- Кремний растворяется в смеси концентрированных азотной и плавиковой кислот (травление кремния кислотами):
С водными растворами щелочей
В водных растворах щелочей при нагревании выше 60ºС кремний растворяется с образованием солей силикатов (травление щелочами):
С оксидами
При восстановлении SiO2 кремнием при температурах свыше 1200 ºC образуется оксид кремния (II) — SiO.
Главная подгруппа IV группа образованна углеродом (С), кремнием (Si), германием (Ge), оловом (Sn) и свинцом (Pb). Все относятся к p-элементам. Внешний энергетический уровень всех элементов данной подгруппы заполнен 4 электронами. Углерод и кремний типичные неметаллы. Оба элемента очень значимы в природе и быту человека. Их подробно изучим далее.
План урока:
Углерод и кремний
Строение углерода. Углерод представитель четвертой группы, главной подгруппы. Обозначение в периодической системе – С. Находится он, в системе элементов под номером 6, атомный вес равен 12. Заряд ядра +6. Внешний слой представлен 4 электронами, двумя спаренными s-электронами и двумя неспаренным и р-электронам.
группы, главной подгруппы.Но в отличие от углерода он в третьем периоде. Что наделяет его несколько иными свойствами.
Кремний так же образует множество соединений (второй по распространению в земной породе элемент после кислорода). Состав земной породы можно описать так: соединения кремния и кислорода с другими элементами. Химический знак - Si. Порядковый номер – 14, заряд ядра +14. В свободной форме вещество имеет металлический блеск.
Внешний слой атома кремния такой же, как внешний слой атома углерода. Так же 4 атома, но разница в радиусе, расстоянии до ядра. Оно больше, чем у углерода, а значит атомы менее связаны с ядром.
Нахождение кремния в природе в виде минералов Источник
Строение атома кремния Источник
Аллотропия углерода и кремния
Аллотропные формы углерода
Углероду свойственно явление аллотропии. Например, у углерода 4 аллотропные формы: графит, алмаз, карбин, фуллерен. По составу это все тот же углерод, но ввиду особенностей строения молекулы каждого из них, имеются различия в физических и химических свойствах.
Открытие фуллерена произошло относительно недавно, в 1985 г, их особенность в строении молекулы, похожей на футбольный мяч. Наиболее распространены молекулы фуллерена С60, состоящего из 60 атомов углерода,и фуллерена С70, состоящего из 70 атомов углерода.
Благодаря своему строению, обладает уникальными свойствами, который открывает широкий спектр применений. Начиная применениями в физике, заканчивая медициной. Молекула является мощнейшим антиоксидантом, используемая даже в борьбе с ВИЧ.
Аллотропные модификации углерода Источник
Графит и алмаз нам хорошо знакомы. Первый используется как грифель для простого карандаша, второй является драгоценным камнем, но ввиду своей прочности используется и в строительстве, и в медицине и т.д. Отличны они по своим физическим свойствам, в силу различий строений графических решеток.
Графит вещество темно-серого цвета, не поддается плавлению, обладает металлическим блеском и достаточно мягкий. Его кристаллическая решетка атомная. Это означает, что в узлах таких решеток атомы, связаны ковалентной полярной или неполярной связью. Такая кристаллическая решетка влияет и на свойства вещества, придавая тугоплавкость, нерастворимость в воде.
Изображение графита при нахождении в природе и графит в грифеле карандаша.
Алмазы до и после огранки
Аллотропия кремния
Аллотропия кремния выражена двумя видами кремния: аморфным и кристаллическим. Это два вещества,одинаковых по составу, но различные построению молекул. Эти отличия наделяют их разными физическими и химическими свойствами, а также различиями во внешнем виде.
Цвет кристаллического кремния темный, почти черный. Присутствует металлический блеск. Твердый на ощупь, при этом хрупкий. Обладает свойствами полупроводником. Полупроводники – вещества, способные проводить электричество. Но по своей способности проводить последнее они находятся между проводниками, хорошо проводящими электрический ток, и диэлектриками, веществами, плохо проводящими электрический ток.
Кипит и плавится при больших температурах, реакционно не активен. Структуру имеет подобную алмазу.
Аморфный кремний буро-красный по цвету, порошкообразен. Хорошо впитывает воду, но структура такая же как у кристаллического.
Свойства углерода и кремния
Химические свойства углерода
Для углерода нередко характерны разные степени окисления. Но самые распространённые степени окисления: +4, +2. Мало реакционноспособен углерод при комнатной температуре. Но нагревание увеличивает реакционную способность и углерод взаимодействует с некоторыми металлами и кислотами, а также с кислородом, азотом, галогенами и водородом.
Однако для углерода характерны реакции, в которых он проявляет восстановительные и окислительные свойства.
Химические свойства кремния
Неметалл, мало реакционноспособен. Характерные степени окисления: от -4 до +4. Элемент, очень распространенный в земной коре, уступает первенство лишь кислороду. Значительное распространение получил именно оксид этого элемента, входя состав разных пород, а главное песка, кварца и глины. Большое значение имеет в жизни человека, т.к. из оксида делают стекло, цемент. В чистом виде представляется в виде минерала – горного хрусталя. Так же входит в состав драгоценных и полудрагоценных камней.
Особое внимание уделяется влиянию кремния на свойства стали. Кремний, при добавлении к стали, изменяет атомную решетку железа (сталь состоит из железа, углерода и других элементов). Это влияет на свойства стали: увеличиваются магнитная проницаемость, упругость и сопротивляемость к коррозии, прочность.
Оксид углерода (II) СО
Называемый иначе угарным газом. Вещество бесцветное, не имеющее запаха. В мире часто происходят отравления угарным газом животных и людей.В воде не растворяется, но в органических растворителях, напротив, хорошо растворимо t°кип = -192°C; t пл = -205°C.
Известны два вида получения. В промышленности и лабораторных условиях. Первый необходим для получения в больших объёмах, ведь данный газ активно используется в химической промышленности как сырье для синтеза других веществ, на основе углерода.
Свойства оксида. При обычных условиях CO мало активен. При повышении температуры вступает в реакцию. Солей не образует.
Химические свойства:
Оксид углерода (IV) СO2
Получение
Свойства (углекислого газа) СO2
Углекислый газ - кислотный оксид,реагирует с основными оксидами и основаниями, образуя соли угольной кислоты. Качественной реакцией (реакция для обнаружения вещества) является помутнение известковой воды.
Так как оксид обладает свойством предотвращать горение,его используют в противопожарных условиях. А также углекислый газ используют при изготовлении газированных напитков.
Химические свойства
Отдельно отметим значение углекислого газа в фотосинтезе. Коротко эту реакции можно описать следующим образом:
Фотосинтез - химический процесс образования органических веществ и кислорода зелеными растениями из углекислого газа, под действием солнечного света.
Рисунок процесса фотосинтез Источник
Угольная кислота
Угольная кислота образуется при растворении оксида углерода (IV) в воде. А если быть еще точнее, то раствор углекислого газа и является угольной кислотой. Очень нестабильная кислота, после получения сразу разлагается на воду и газ.
Реакция разложения угольной кислоты:
Угольная кислота взаимодействуя с щелочами. Образует средние (соли, в состав которых входят металлический химический элемент и кислотный остаток) и кислые соли (в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода) угольной кислоты. Последние называют гидрокарбонатами, первые – карбонаты.
Такие понятия, встречаемые в природе и в повседневной жизни, как временная жесткость воды и постоянная жесткость объясняется наличием в воде гидрокарбонатов кальция и магния и другими солями этих же элементов. Общая жесткость воды определяется суммой постоянной и временной жесткости.
Устранить жесткость воды можно различными содами. Например, кальцинированной содой (Na2CO3), т.е. карбонатом натрия, или же пищевой содой (NaHCO₃).Так же в быту для борьбы с накипью используют лимонную кислоту.
Если, к примеру, мы хотим очистить чайник от накипи, то зальем в него воды, добавим немного соды или лимонной кислоты, на выбор. Прокипятим и тщательно промоем. Не рекомендуется использовать уксус, т.к. он слишком летуч при кипячении и в воздухе окажутся вредные пары.
И чем жесткость выше, тем больше содержания в воде солей кальция и магния, а значит при кипячении такой воды образуется большое количество накипи. Накипь, систематически попадающая в организм, вредна. Она откладывается в организме человека, отрицательно влияя на функциональность органов и здоровье в целом. Так же этот процесс уменьшает срок службы бытовых электроприборов. Например, стиральных машин.
Накипь в чайнике
Оксид кремния (IV)
Данный оксид известен как кремнезём SiO2. Диоксид кремния является песком, содержание в котором кремния прямо влияет на свойства песка, улучшая их. Вещество твердое, плохо растворяется в воде, тугоплавкое. Отличительной особенностью можно назвать немолекулярное строение.
В естественной природной среде оксид данный встречается в виде песка, кварца и горного хрусталя, а также входит в состав глины и многих других элементов.
Данный оксид является кислотным, и при его взаимодействии с щелочами и амфотерными оксидами образуются силикаты, соли кремневой кислоты. Не реагирует с водой.
Кремневая кислота – это одна из слабых кислот. А слабыми называют кислоты, плохо растворяющиеся в воде.Нагревание разлагает эту кислоту на воду и диоксид кремния (SiO₂).
Силикаты — это соли кремниевой кислоты. Природные силикаты являются сложными соединениями. Среди них растворимы в воде только соли калия и натрия. Соли калия и натрия еще называют растворимыми стеклами, а их раствор – жидким стеклом.
Природные силикаты, это варианты соединения кремния с кислородом и другими элементами, среди которых: натрий, магний, кальций, алюминий, литий, бор, железо, калий, водород и т.д. Кристаллические решетки данной группы соединений составлены из тетраэдров кремния и кислорода, в соотношении 1:4 соответственно. И именно на основе этих комбинаций происходит следующая классификация типов силикатов.
Таблица классификация силикатов
Стекло – материал, активно используемый в быту. По своим свойствам хрупкий и прозрачный. Получают при варке сырьевой смеси (шихты) из песка, соды и известняка в специально приспособленных печах.
Процесс производства стекловолокна Источник
Вывод
Кремний - основа большинства неорганических соединений, а содержание его в земной коре, в виде оксида, составляет 12%. Растениям атомы данного элемента придают особу прочность, входя в состав. Благодаря чему последние растут вверх, а не расползаются по земле.
Соединения этих элементов тоже очень значимы. Например, соединения кремния получили широкое применение в силикатной промышленности. А соединения углерода очень востребованы как топливо.
Читайте также:

