Трибохимическая коррозия это кратко
Обновлено: 05.07.2024
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная

Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов

Классификация видов коррозии

Неравномерная атмосферная коррозия
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
- газовая коррозия;
- атмосферная коррозия;
- коррозия в неэлектролитах;
- коррозия в электролитах;
- подземная коррозия;
- биокоррозия;
- коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
- контактная коррозия;
- щелевая коррозия;
- коррозия при неполном погружении;
- коррозия при полном погружении;
- коррозия при переменном погружении;
- коррозия при трении;
- межкристаллитная коррозия;
- коррозия под напряжением.
По характеру разрушения:
- сплошная коррозия, охватывающая всю поверхность:
- равномерная;
- неравномерная;
- избирательная;
- пятнами;
- язвенная;
- точечная;
- сквозная;
- межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида:
- химическую коррозию;
- электрохимическую коррозию.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
![подземная коррозия металлов]()
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
![химическая коррозия металлов]()
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
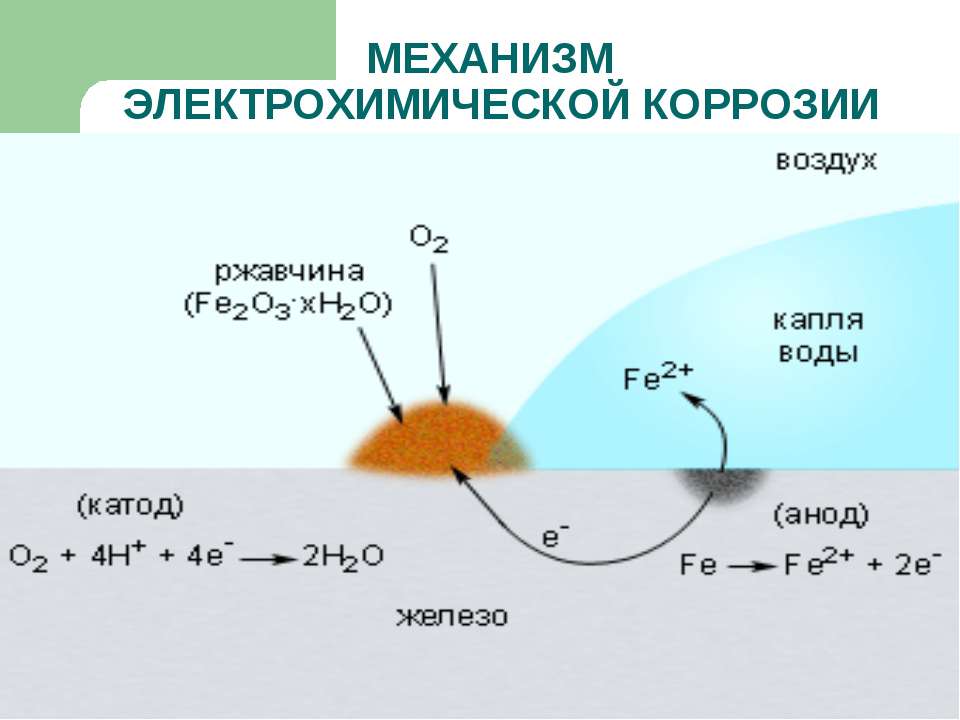
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
![схема электрохимической коррозии]()
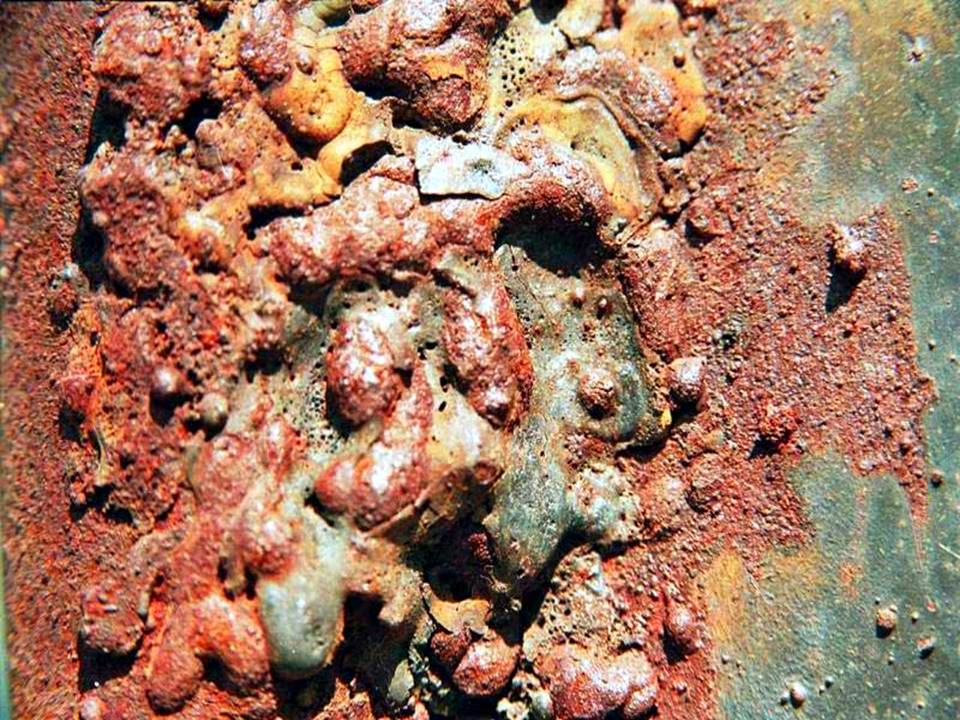
Трибохимическая коррозия
![трибохимическая коррозия металлов]()
Химическая коррозия в жидкостях-неэлектролитах
Жидкости-неэлектролиты — это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется. Если вдобавок увеличится температура, в жидкости окажется растворенный кислород — химическая коррозия усилится.
Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий:
— подход окислителя к поверхности металла;
— хемосорбция реагента на поверхности;
— реакция окислителя с металлом (образование оксидной пленки);
— десорбция оксидов с металлом (может отсутствовать);
— диффузия оксидов в неэлектролит (может отсутствовать).
Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.
Устранение коррозии
Для борьбы с коррозией используется правильная подготовка поверхности для защиты от коррозии (обеспечивается 80% защита), многое зависит от используемых лакокрасочных материалов, а также способов их нанесения на металл (обеспечивается 20% защита). Самый производительный и эффективный метод подготовки поверхности перед дальнейшей защитой субстрата — абразивоструйная очистка.
Существуют три основных метода защиты металла от коррозии: конструкционный, пассивный и активный.
При использовании конструкционных материалов применяют нержавеющие стали, кортеновские стали и цветные металлы. При проектировании металлических конструкций стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки.
Когда в качестве защиты от коррозии применяется нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента, то такой метод защиты от коррозии называют пассивным.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя: применяется наложение постоянного электрического поля с помощью источника постоянного тока. В других случая используется жертвенный анод, который разрушаясь, предохраняет защищаемое изделие от последующей коррозии.
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами (цинк, хром, олово, никель…). Используются для предотвращения коррозии такие методы и технологии как: газотермическое напыление, термодиффузионное цинковое покрытие, кадмирование, хромирование и т.д.
![Коррозия металла (фото)]()
Примеры коррозии металла (фото)
Технология очистки поверхностей металла сухим льдом
Материалы для очистки поверхностей металла
Несколько слов о коррозии металла и тионовых бактериях
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Борьба с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка.
Обычно выделяют три направления методов защиты от коррозии:
- Конструкционный
- Активный
- Пассивный
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы.
При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка. Содержание хрома в нержавеющей стали — более 12 процентов.
При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод — использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
![]()
Кислородная коррозия оцинкованного железа
![]()
Кислородная коррозия железа, покрытого оловом
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты. Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки.
Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии. Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование).
Газотермическое напыление
Для борьбы с коррозией используют также методы газотермического напыления. С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла. Суть метода такова: газовой струей на поверхность изделия на огромной скорости наносят частицы металлической смеси, например цинк, в результате чего образуется защитный слой толщиной от десятков до сотен микрон. Газотермическое напыление также применяется для продления жизни изношенных узлов оборудования: от восстановления рулевой рейки в автосервисе до агрегатов нефтедобывающих компаний.
Термодиффузионное цинковое покрытие
Для эксплуатации металлоизделий в агрессивных средах необходима более стойкая антикоррозионная защита поверхности металлоизделий. Термодиффузионное цинковое покрытие является анодным по отношению к чёрным металлам и электрохимически защищает сталь от коррозии. Оно обладает прочным сцеплением (адгезией) с основным металлом за счет взаимной диффузии железа и цинка в поверхностных интерметаллидных фазах, поэтому не происходит отслаивания и скалывания покрытий при ударах, механических нагрузках и деформациях обработанных изделий.
Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375—850 °C), или с использованием разрежения (вакуума) — при температуре от 250 °C, применяется для покрытия крепёжных изделий, труб, деталей арматуры и др. конструкций. Значительно повышает стойкость стальных, чугунных изделий в средах, содержащих сероводород (в том числе против сероводородного коррозионного растрескивания), промышленной атмосфере, морской воде и др. Толщина диффузионного слоя зависит от температуры, времени, способа цинкования и может составлять 0,01—1,5 мм. Современный процесс диффузионного цинкования позволяет образовывать покрытие на резьбовых поверхностях крепёжных изделий, без затруднения их последующего свинчивания. Микротвёрдость слоя покрытия Hμ = 4000 — 5000 МПа. Диффузионное цинковое покрытие также значительно повышает жаростойкость стальных и чугунных изделий при температуре до 700 °C. Возможно получение легированных диффузионных цинковых покрытий, применяемое для повышения их служебных характеристик.
Кадмирование
Покрытие стальных деталей кадмием производится методами, аналогичными цинкованию, но даёт более сильную защиту, особенно в морской воде. Применяется значительно реже из-за значительной токсичности кадмия и его дороговизны. Также покрывают тонким слоем оксида меди, что предотвращает дальнейшее размножение коррозии.
Хромирование
Покрытие стальных деталей хромом.
Экономический ущерб от коррозии
![]()
Экономические потери от коррозии металлов огромны. В США по последним данным NACE, ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
![]()
Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Пойнт Плезант, штат Западная Виргиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виргинией и Огайо. Причиной обрушения стала коррозия. Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Кол-во блоков: 12 | Общее кол-во символов: 17803
Количество использованных доноров: 4
Информация по каждому донору:![]()
Основные типы атмосферной коррозии
Принято выделять три основных типа атмосферной коррозии: влажная, мокрая, сухая. Жидкая и мокрая, в силу способности проводить электрический ток, протекают по электрохимическим законам, а сухая по химическим.
- Влажная глубокая коррозия металла будет протекать там, где на металле можно наблюдать тонкую влажную пленку. В зависимости от происходящего в окружающей среде, на пленке может образовываться конденсат, после чего начинается процесс коррозийного разрушения.
- Мокрая коррозия начинается на поверхности хорошо увлажненной, при относительной влажности окружающей среды около 100%. Капли, образовавшиеся на поверхности, помогают коррозийному износу.
- Сухая атмосферная коррозия менее агрессивна, потому что процесс разрушения протекает при малой влажности воздуха. Образовавшаяся на изделии пленка замедляет образование ржавчины.
![]()
Классификация видов коррозии
![]()
Неравномерная атмосферная коррозия
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
- газовая коррозия;
- атмосферная коррозия;
- коррозия в неэлектролитах;
- коррозия в электролитах;
- подземная коррозия;
- биокоррозия;
- коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
- контактная коррозия;
- щелевая коррозия;
- коррозия при неполном погружении;
- коррозия при полном погружении;
- коррозия при переменном погружении;
- коррозия при трении;
- межкристаллитная коррозия;
- коррозия под напряжением.
По характеру разрушения:
- сплошная коррозия, охватывающая всю поверхность:
- равномерная;
- неравномерная;
- избирательная;
- пятнами;
- язвенная;
- точечная;
- сквозная;
- межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида:
- химическую коррозию;
- электрохимическую коррозию.
Коррозия неметаллических материалов
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
2H++2e— = H2 разряд водородных ионов
2H3O++2e— = H2 + 2H2O
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
O2 + 4H++4e— = H2O восстановление растворенного кислорода
O2 + 2H2O + 4e— = 4OH—
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
K: O2 + 4H+ + 4e— = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
![]()
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.
![]()
Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
![]()
Трибохимическая коррозия
![]()
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Экономический ущерб от коррозии
![]()
Экономические потери от коррозии металлов огромны. В США по последним данным NACE, ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
![]()
Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Пойнт Плезант, штат Западная Виргиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виргинией и Огайо. Причиной обрушения стала коррозия. Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Литература
- Красноярский В. В., Френкель Г. Я., Носов Р. П. Коррозия и защита металлов. — М.: Металлургия, 1969. — 299 с.
Кол-во блоков: 13 | Общее кол-во символов: 12594
Количество использованных доноров: 4
Информация по каждому донору:Читайте также: