Трансмембранная передача сигнала биохимия кратко
Обновлено: 02.07.2024
1. Биологические мембраны и основы регуляции обмена веществ.
2. Актуальность темы:
АКТУАЛЬНОСТЬ ТЕМЫ:
Механизмы
взаимодействия
клеток друг с другом и с
окружающей средой
(гормоны,
лекарственные
препараты)
невозможно изучать без базовых
знаний
о
строении
и
фукнкционировании
клеточных
мембран.
1
3. Цели лекции
ЦЕЛИ ЛЕКЦИИ
Знать:
1. Строение биологических мембран и их роль
в обмене веществ и энергии.
2. Основные способы переноса веществ через
мембраны.
3.
Молекулярные
механизмы
действия
гормонов и других сигнальных молекул на
органы-мишени.
2
4. План лекции
ПЛАН ЛЕКЦИИ
1. Общая характеристика мембран. Строение и
состав мембран.
2. Транспорт веществ через мембраны.
3. Трансмембранная передача сигналов.
3
5. Функции мембран:
ФУНКЦИИ МЕМБРАН:
• отделяют клетки от окружающей среды и
делят ее на компартменты (отсеки);
• регулируют транспорт веществ в клетки и
органеллы и в обратном направлении;
• обеспечивают специфику межклеточных
контактов;
• воспринимают сигналы из внешней среды.
6. Строение мембран
8. Липиды мембран.
ЛИПИДЫ МЕМБРАН.
В
мембранах присутствуют липиды
трех
главных
типов
фосфолипиды,
гликолипиды
и
холестерол.
Чаще всего встречаются
глицерофосфолипиды производные фосфатидной
кислоты.
14. Роль холестерола в мембранах
РОЛЬ ХОЛЕСТЕРОЛА В МЕМБРАНАХ
Молярное соотношение холестерола и других
липидов в мембранах равно 0,3-0,9. Самое
высокое значение имеет эта величина для
цитоплазматической мембраны.
Увеличение
содержания
холестерола
в
мембранах
уменьшает
латеральную
диффузию.
При
повышении
текучести
мембран,
вызванном действием на них липофильных
веществ или перекисным окислением липидов,
доля холестерола в мембранах возрастает.
15. функции липидов мембран
16. Белки мембран (положение в мембране)
БЕЛКИ МЕМБРАН (ПОЛОЖЕНИЕ В
МЕМБРАНЕ)
По
расположению белки мембраны
делят
на
интегральные
(трансмембранные) и периферические
(поверхностные).
1, 2 - интегральные белки; 3, 4, 5, 6 поверхностные белки.
17. Поверхностные белки разными способами прикрепляются к мембране:
18. Белки мембран (функции)
19. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ МЕМБРАНЫ
Транспорт
ионов или органических
молекул через каналы или белкипереносчики может проходить
по
градиенту концентрации пассивный транспорт
против градиента концентрации активный транспорт.
Функционирование
большинства
каналов регулируется специфическими
лигандами
или
изменением
трансмембранного потенциала.
20. Пассивный транспорт
21. Пассивный транспорт
22. Пассивный транспорт
23. Активный транспорт
АКТИВНЫЙ ТРАНСПОРТ
Первично-активный
транспорт
происходит
против градиента концентрации с затратой
энергии АТФ при участии транспортных АТФаз,
например Na+, К+-АТФаза, Н+-АТФаза, Са2+АТФаза.
Н+-АТФазы функционируют как протонные насосы,
с помощью которых создается кислая среда в
лизосомах клетки.
С помощью Са2+-АТФазы цитоплазматической
мембраны и мембраны эндоплазматического
ретикулума поддерживается низкая концентрация
кальция
в
цитозоле
клетки
и
создается
внутриклеточное депо Са2+ в митохондриях и
эндоплазматическом ретикулуме.
24. Активный транспорт
АКТИВНЫЙ ТРАНСПОРТ
Вторично-активный транспорт происходит
за счет градиента концентрации одного из
переносимых веществ который создается чаще
всего Na+, К+-АТФазой, функционирующей с
затратой АТФ.
Вторично-активный транспорт бывает двух
типов: активный симпорт и антипорт.
25. Активный транспорт
26. Активный транспорт (эндо- и экзоцитоз)
АКТИВНЫЙ ТРАНСПОРТ
(ЭНДО- И ЭКЗОЦИТОЗ)
Перенос из внеклеточной среды в клетку
макромолекул, например белков, нуклеиновых
кислот, полисахаридов или еще более крупных
частиц, происходит путем эндоцитоза.
Связывание веществ или высокомолекулярных
комплексов происходит
в
определенных
участках плазматической мембраны, которые
называются окаймленными ямками.
Эндоцитоз,
происходящий
с
участием
рецепторов, встроенных в окаймленные ямки,
позволяет клеткам поглощать специфические
вещества
и
называется
рецепторзависимым эндоцитозом.
27. Активный транспорт (эндо- и экзоцитоз)
АКТИВНЫЙ ТРАНСПОРТ
(ЭНДО- И ЭКЗОЦИТОЗ)
Макромолекулы,
например
пептидные
гормоны, пищеварительные ферменты, белки
внеклеточного матрикса, липопротеиновые
комплексы, секретируются в кровь или
межклеточное
пространство
путем
экзоцитоза.
Этот способ транспорта позволяет выводить из
клетки вещества, которые накапливаются в
секреторных гранулах.
В большинстве случаев экзоцитоз регулируется
путем изменения концентрации ионов кальция
в цитоплазме клеток.
28. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛОВ
Важное свойство мембран - способность
воспринимать и передавать внутрь клетки
сигналы из окружающей среды. Восприятие
клетками внешних сигналов происходит при
их
взаимодействии
с
рецепторами,
расположенными в мембране клеток-мишеней.
Рецепторы,
присоединяя
сигнальную
молекулу, активируют внутриклеточные пути
передачи информации, это приводит к
изменению
скорости
различных
метаболических процессов.
29. Первичные мессенджеры
ПЕРВИЧНЫЕ МЕССЕНДЖЕРЫ
Сигнальная
молекула,
взаимодействующая
с
рецептором,
называется
мессенджером.
специфически
мембранным
первичным
В
качестве
первичных
мессенджеров
выступают различные химические соединения
- гормоны, нейромедиаторы, эйкозаноиды,
ростовые факторы или физические факторы,
например квант света.
Рецепторы
клеточной
мембраны,
активированные первичными мессенджерами,
передают полученную информацию системе
белков и ферментов, которые образуют каскад
передачи
сигнала,
обеспечивающий
усиление сигнала в несколько сот раз.
Время ответа клетки, заключающееся в
активации или инактивации метаболических
процессов, мышечного сокращения, транспорта
веществ из клеток-мишеней, может составлять
несколько минут.
31. Виды мембранных рецепторов
32. Мембранные рецепторы можно разделить на три группы:
МЕМБРАННЫЕ РЕЦЕПТОРЫ МОЖНО
РАЗДЕЛИТЬ НА ТРИ ГРУППЫ:
1 - содержащие субъединицу, связывающую
сигнальную молекулу и ионный канал,
например
рецептор
ацетилхолина
на
постсинаптической мембране;
2 - проявляющие каталитическую активность
после присоединения сигнальной молекулы,
например рецептор инсулина;
3,
4 - передающие сигнал на фермент
аденилатциклазу (АЦ) или фосфолипазу С
(ФЛС) при участии мембранных G-белков,
например
разные
типы
рецепторов
адреналина,
ацетилхолина
и
других
сигнальных молекул.
33. Вторичные мессенджеры
ВТОРИЧНЫЕ МЕССЕНДЖЕРЫ
Вторичные мессенджеры имеют небольшую
молекулярную
массу,
быстро
изменяют
активность соответствующих белков, быстро
расщепляются или удаляются из цитозоля.
Роль вторичных мессенджеров выполняют:
• цАМФ (циклический аденозин-3',5'монофосфат);
• цГМФ (циклический гуанозин-3',5'монофосфат);
• ИФ3 (инозитол-1,4,5-трифосфат);
• ДАГ (диацилглицерол);
• Са2+.
34. Альтернативные пути
АЛЬТЕРНАТИВНЫЕ ПУТИ
Существуют
гормоны
(стероидные
и
тиреоидные), которые, проходя липидный
бислой,
проникают
в
клетку
и
взаимодействуют
с
внутриклеточными
рецепторами.
Ответ
на
поступающий
сигнал
будет
медленным, но длительным.
35. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы
ПОСЛЕДОВАТЕЛЬНОСТЬ СОБЫТИЙ ПЕРЕДАЧИ
СИГНАЛА ПЕРВИЧНЫХ МЕССЕНДЖЕРОВ С ПОМОЩЬЮ
АДЕНИЛАТЦИКЛАЗНОЙ СИСТЕМЫ
Взаимодействие активатора
аденилатциклазной системы, например
гормона с рецептором (Rs), приводит к
изменению конформации рецептора.
Увеличивается сродство рецептора к G-белку.
Присоединение ГТФ
вызывает изменение
конформации субъединицы α и снижение ее
сродства к субъединицам βγ. Отделившаяся
субъединица α латерально перемещается в
липидном слое мембраны к ферменту
аденилатциклазе.
36. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы
ПЕРЕДАЧИ СИГНАЛА ПЕРВИЧНЫХ
МЕССЕНДЖЕРОВ С ПОМОЩЬЮ
АДЕНИЛАТЦИКЛАЗНОЙ СИСТЕМЫ
Взаимодействие
α-субъединицы
с
регуляторным
центром
аденилатциклазы приводит к его
активации и увеличению скорости
образования вторичного мессенджера циклического
аденозин3',5'монофосфата (цАМФ) из АТФ.
В
клетке повышается концентрация
цАМФ.
37. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы
ПЕРЕДАЧИ СИГНАЛА ПЕРВИЧНЫХ
МЕССЕНДЖЕРОВ С ПОМОЩЬЮ
АДЕНИЛАТЦИКЛАЗНОЙ СИСТЕМЫ
Молекулы цАМФ могут обратимо соединяться
с
регуляторными
субъединицами
протеинкиназы А (ПКА), которая состоит из
двух регуляторных (R) и двух каталитических
(С) субъединиц - (R2С2).
Комплекс R2С2 ферментативной активностью
не
обладает.
Присоединение
цАМФ
к
регуляторным
субъединицам
вызывает
изменение их конформации
и потерю
комплементарности
к
С-субъединицам.
Каталитические субъединицы приобретают
ферментативную активность.
38. Последовательность событий передачи сигнала первичных мессенджеров с помощью аденилатциклазной системы
ПЕРЕДАЧИ СИГНАЛА ПЕРВИЧНЫХ
МЕССЕНДЖЕРОВ С ПОМОЩЬЮ
АДЕНИЛАТЦИКЛАЗНОЙ СИСТЕМЫ
Активная протеинкиназа А с помощью АТФ
фосфорилирует специфические белки по
остаткам серина и треонина.
Фосфорилирование белков и ферментов
повышает или понижает их активность,
поэтому изменяется скорость метаболических
процессов, в которых они участвуют.
40. Инактивация аденилатциклазы и протеинкиназы А
ИНАКТИВАЦИЯ АДЕНИЛАТЦИКЛАЗЫ И
ПРОТЕИНКИНАЗЫ А
α-субъединица в комплексе с ГТФ при
взаимодействии с аденилатциклазой начинает
проявлять ферментативную (ГТФфосфатазную) активность, она гидролизует
ГТФ.
Образующаяся молекула ГДФ остается в
активном центре α-субъединицы, изменяет ее
конформацию и уменьшает сродство к АЦ.
Комплекс АЦ и α-ГДФ диссоциирует, α-ГДФ
включается в G-белок. Отделение α-ГДФ от
аденилатциклазы инактивирует фермент и
синтез цАМФ прекращается.
41. Инактивация аденилатциклазы и протеинкиназы А
42. Инозитолфосфатная система
ИНОЗИТОЛФОСФАТНАЯ СИСТЕМА
Связывание
активатора
инозитолфосфатной
системы с рецептором (R) приводит к изменению
его конформации. Повышается сродство рецептора
к Gфлс-белку.
Отделившаяся субъединица афлс-ГТФ латерально
перемещается
по
мембране
к
ферменту
фосфолипазе С.
Взаимодействие афлс-ГТФ с центром связывания
фосфолипазы С изменяет конформацию и
активность
фермента,
возрастает
скорость
гидролиза фосфолипида клеточной мембраны фосфатидилинозитол-4,5-бисфосфата (ФИФ2)
43. Инозитолфосфатная система
ИНОЗИТОЛФОСФАТНАЯ СИСТЕМА
В ходе реакции образуются два продукта:
диацилглицерол,
который
остается
в
мембране и участвует в активации фермента
протеинкиназы С,
инозитол-1,4,5-трифосфат
(ИФ3),
который, будучи гидрофильным соединением,
уходит в цитозоль.
ИФ3 связывается специфическими центрами
Са2+- канала мембраны эндоплазматического
ретикулума, что приводит к изменению
конформации белка и открытию Са2+-канала.
Са2+ по градиенту концентрации поступает в
цитозоль. В отсутствие ИФ3 в цитозоле канал
закрыт.
При повышении концентрации кальция он
активно
присоединяется
к
белку
кальмодулину,
образуя
комплекс
4Са2+кальмодулин.
Этот
комплекс взаимодействует с Са2+кальмодулинзависимыми протеинкиназами и
повышает их активность.
Диацилглицерол, занимая специфические
центры в протеинкиназе С, в еще большей
степени увеличивает ее сродство к ионам
кальция. На внутренней стороне мембраны
образуется активная форма ПКС (ПКС Са2+
ФС
ДАГ),
которая
фосфорилирует
специфические ферменты, в результате чего
изменяется
их
активность
и
скорость
метаболических процессов, в которых они
участвуют.
49. Каталитические рецепторы.
КАТАЛИТИЧЕСКИЕ РЕЦЕПТОРЫ.
Каталитические рецепторы являются
ферментами. Активаторами этих ферментов
могут быть гормоны, ростовые факторы,
цитокины. В активной форме - рецепторыферменты фосфорилируют специфические
белки по -ОН-группам тирозина, поэтому их
называют тирозиновыми протеинкиназами .
Примером каталитического рецептора может
служить рецептор инсулина.
51. Строение рецептора инсулина
СТРОЕНИЕ РЕЦЕПТОРА ИНСУЛИНА
в состав рецептора входят две α- и две βсубъединицы. α -Субъединицы расположены на
наружной поверхности клеточной мембраны, βсубъединицы пронизывают мембранный бислой.
Центр связывания инсулина образован Nконцевыми доменами а-субъединиц.
Каталитический центр рецептора находится на
внутриклеточных доменах β-субъединиц.
Цитозольная часть рецептора имеет несколько
остатков тирозина, которые могут
фосфорилироваться и дефосфорилироваться.
53. Механизм работы инсулинового рецептора
МЕХАНИЗМ РАБОТЫ
ИНСУЛИНОВОГО РЕЦЕПТОРА
Присоединение инсулина в центр связывания,
образованный а-субъединицами, вызывает
кооперативные конформационные изменения
рецептора.
β-Субъединицы проявляют тирозинкиназную
активность
и
катализируют
трансаутофосфорилирование
(первая
βсубъединица
фосфорилирует
вторую
βсубъединицу, и наоборот) по нескольким
остаткам тирозина.
Тирозиновая-ПК
фосфорилирует
определенные клеточные белки, которые
получили название субстратов рецептора
инсулина.
54. Происходит активация
ПРОИСХОДИТ АКТИВАЦИЯ
фосфопротеинфосфатазы (ФПФ), которая
дефосфорилирует специфические фосфопротеины;
• фосфодиэстеразы, которая превращает цАМФ
в АМФ и цГМФ в ГМФ;
ГЛЮТ 4 - переносчиков глюкозы в
инсулинзависимых тканях, поэтому повышается
поступление глюкозы в клетки мышц и жировой
ткани;
тирозиновой протеинфосфатазы, которая
дефосфорилирует
β-субъединицы
рецептора
инсулина;
регуляторных белков ядра, факторов
транскрипции, повышающих или снижающих
экспрессию генов определенных ферментов.
55. Передача сигнала с помощью внутриклеточных рецепторов
ПЕРЕДАЧА СИГНАЛА С ПОМОЩЬЮ
ВНУТРИКЛЕТОЧНЫХ РЕЦЕПТОРОВ
Гидрофобные по химической природе гормоны
(стероидные гормоны и тироксин) могут
диффундировать через мембраны, поэтому их
рецепторы находятся в цитозоле или ядре
клетки.
Гормон проходит через двойной липидный
слой клеточной мембраны. В цитозоле или
ядре гормон взаимодействует с рецептором.
Комплекс гормон-рецептор проходит в ядро и
присоединяется к регуляторной нуклеотидной
последовательности ДНК – энхансеру или
сайленсеру.
Доступность промотора для РНК-полимеразы
увеличивается
при
взаимодействии
с
энхансером
или
уменьшается
при
взаимодействии с сайленсером.
Соответственно
увеличивается
или
уменьшается
скорость
транскрипции
определенных структурных генов.
Зрелые мРНК выходят из ядра. Увеличивается
или
уменьшается
скорость
трансляции
определенных белков.
Изменяется
количество
белков,
которые
влияют на метаболизм и функциональное
состояние клетки.
60. Самостоятельная работа
САМОСТОЯТЕЛЬНАЯ РАБОТА
Зарисуйте и опишите в рабочих тетрадях
механизм работы гуанилатциклазной системы
61. Вывод:
ВЫВОД:
Согласованное
функционирование
мембранных систем, включающих рецепторы,
ферменты, транспортные системы, помогает
поддерживать гомеостаз клетки и быстро
реагировать на изменения состояния внешней
среды путем регуляции метаболизма внутри
клеток.
62. Литература
ЛИТЕРАТУРА
Список основной литературы
Биологическая химия с упражнениями и задачами :
учебник / ред. С. Е. Северин. - М. : ГЭОТАР-Медиа, 2013.
- 624 с.
Список дополнительной литературы
Биохимия : учебник для вузов / ред. Е. С. Северин. - М. :
ГЭОТАР-Медиа, 2007. - 784 с.
Биологическая химия : учебник для студ.мед.вузов / А.
Я. Николаев. - М. : Мед.информ.агентство, 2007. - 568 с.
Клиническая биохимия : электронное учебное издание /
сост. И. В. Пикалов, Э. Я. Журавская, В. В. Кузьмина [и
др.]. - Новосибирск : Центр очно-заочного образования
ГОУ ВПО НГМУ Росздрава, 2008
Вторично-активный транспорт [Электронный ресурс] /
Ю. И. Савченков, Ю. И. Савченков. - б/м : б/и, 2012
Биохимия / Г. Е. Осипова, . Г. Осипова. - Новосибирск :
НГПУ, 2014. - 182 с.

рис. 1a. Строение колбочки (сетчатка глаза).
1 — мембранные полудиски;
2 — митохондрия;
3 — ядро (эллипс с жировой каплей);
4 — синаптическая область;
5 — связующий отдел (перетяжка);
6 — наружный сегмент;
7 — внутренний сегмент;
8 — граница мембранной части;
9 — пигмент сократимых фибрилл.

Рис. 1t. Трансмембранная передача сигнала — свойство мембран — способность воспринимать и передавать внутрь клетки сигналы из внешней среды. Рецепторы:
E=extracellular — фагоцитоза "засвеченных" полудисков клетками пигментного эпителия, и постоянного образования новых полудисков, в теле фоторецептора);
P=plasma (обработка и передача сигнала) — внутренняя поверхность рецептора;
I=intracellular —
Рис.2. Распространение потенциала действия по аксону

Нейрон состоит из одного аксона, тела и нескольких дендритов
Трансмембранная передача сигнала — важное свойство мембран клеток воспринимать и передавать внутрь клетки сигналы, например, световые из внешней среды. "Узнавание" сигнальных молекул осуществляется с помощью белков — рецепторов, встроенных в клеточную мембрану, например, колбочек, палочек сетчатки глаза как клеток-мишеней или находящихся в клетке, например, колбочке, палочке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Содержание
Процесс поведения фоторецепторов
Если световой сигнал воспринимается мембранами фоторецепторов, то схему передачи, трансдукции световых сигналов можно представить так:

Рис. 7. Фототрансдукция штанги (цепочки) каскада в палочках сетчатки глаза. [1]
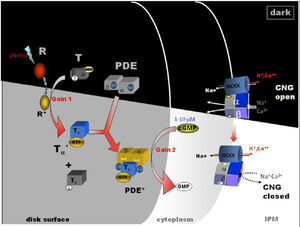
Рис. 6. Активация цепочки фототрансдукционного каскада. [2]
- На Рис. 7. схематически представлена фототрансдукция штанги (цепочки) каскада после поглощения фотона. Активированный родопсин — (Р*) активирует гетеротримерные G-белки, катализирующие обмен ВВП ГТУ, производя активный Gα*-ГТФ. Два Gα*-ГТФ привязываются к двум ингибиторным γ-субъединицам фосфодиэстеразы (ФДЭ), тем самым высвобождая на ингибирование каталитические α и β субъединицы, образующих ФДЭ*, которая в свою очередь катализирует гидролиз цГМФ. [3] Последующее уменьшение концентрации цитоплазматического свободного цГМФ приводит к закрытию цГМФ-закрытого канала на плазматической мембране, а блокада притока катионов в наружном сегменте приводит к снижению циркулирующего темнового тока.
- На Рис. 6. Показана активация штанги (цепочки) каскада стержня phototransduction, что приводит к закрытию цГМФ (циклический Гуанозинмонофосфат (cGMP, Cyclic guanosine monophosphate)) — ворот каналов на плазматической мембране (от темного светового состояния). R — родопсин (неактивный); R * — родопсин (активный); T — transducin; PDE — фосфодиэстераза (неактивная); PDE * — фосфодиэстераза (активная); NCKX, Na/Ca, K теплообменник. IPM — interphotoreceptor матрицы. Здесь цГМФ действует как вторичный посредник и его действие подобно цАМФ, в основном активируя внутриклеточные протеинкиназы в ответ на связывание с клеточной мембраной пептидных гормонов (для которых мембрана непроницаема) с внешней стороны клетки. [4]
(Любезность предстввлена Вольфгангом Баером).
Цепочка фототрансдукции является одним из лучших способов охарактеризовать г-белковые-сигнальне пути. Рецептор родопсин (R) c G-белком transducin (Г), и с эффективным цГМФ фосфодиэстеразы (pde или PDE6). После поглощения фотона родопсином молекулы становятся ферментативно активными (Р*) и катализируют активацию белок G transducin К Г*. Transducin, в свою очередь, активирует эффективные фосфодиэстеразы (ФДЭ) для уравнений в частных производных*. ФДЭ* гидролизует диффузного мессенджера цГМФ. В результате снижения цитоплазматическоq свободной концентрации цГМФ (циклический гуанозинмонофосфат — циклическая форма нуклеотида, образующаяся из гуанозинтрифосфата (GTP) ферментом гуанилатциклазой), приводит к закрытию цГМФ-закрытого канала на плазматической мембране. Закрытие канала приводит к локализованному уменьшению притока катионов в наружный сегмент, который приводит в гиперполяризации мембраны, т. е. внутриклеточное напряжение становится более отрицательным (рис. 6 и 8). Это гиперполяризацию уменьшается или прекращается тёмное высвобождение глутамата в синаптическом терминале. Этот сигнал обрабатывается другими нейронами в сетчатке, прежде чем они передаются в высшие отделы мозга. Эта Фототрансдукция (phototransduction) каскада приведена на рисунках 6 и 7. [5]
Межклеточная сигнализация в иммунной системе осуществляется путем непосредственного контактного взаимодействия клеток или с помощью медиаторов межклеточных взаимодействий.
Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. "Узнавание" сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
-взаимодействие рецептора с сигнальной молекулой (первичным посредником);
-активация мембранного фермента, ответственного за образование вторичного посредника;
-образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+;
-активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказьюают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
К 1ТМС-рецепторам относятся гуанилатциклазы, которые образуют цГМФ из ГТФ.
1й тип: Гуанилатциклаз локализуется в плазматической мембране, активируется внеклеточными Лигандами (Атрионатрийуретический фактор)
2 тип: цитозольный, активируемый оксидом азота, который вызывает расслабление гладкой мускулатуры сосудов, в т.ч. коронарных.
Присоединение гормона активирует 1ТМС рецептор. Гормонорецепторный комплекс проявляет гуанилатциклазную активность, которая помогает добиться получения цГМФ из ГТФ. цГМФ как вторичный посредник активирует протеинкиназу С, которая фосфолирирует (Ф) остатки серина и треонина в белках-мишенях, что активирует белки. цГМФ является активатором фосфодиэстераз, которыее катализируют их распад. цАМФ, тоесть ЦГМФ и цАМФ являются антагонистами. Конечный эффект цГМФ проявляется в изменении транспорта ионов и воды в почках и кишечнике. цГМФ способствует расслаблению миокарда, а в палочках и колбочках стимулирует открытие ионных каналов.
Самая распространенная группа 1ТМС рецепторов являются рецепторные тирозин-киназы, в их структуре имеется 4 домена ( внеклеточный (связывает гормон), трансмембранный, внутриклеточный (с тирозин-киназной активностью), регуляторный)
Важнейшей Т-К являеся рецептор инсулина, его присоединение вызывает автофосфолирирование киназного домена, что приводит к усилению Ф и активации инсулинрецепторного субстрата (IRS-1) Далее включается каскад реакций, усиливается гормональный сигнал, происходит повышение активности протеинкиназ и изменение активности многих ферментов.
Передача сигнала с участие 1ТМС рецепторов, в рецепторе имеются выключатели, это –RAS белки, которые относятся к семейству мономерных ГТФаз, они м.б. активны, если связаны с ГТФ, и дезактивируются при его гидролизе. Активность регулируют белки –БАГ (белок, активирующий ГТФазу) –SOS ( белок, высвобождающий гуаниловые нуклеотиды)
Механизм действия гормонов, взаимодействующих с внутриклеточными рецепторами
Вит Д, ретиноевая к-та, стероидные гормоны и териоидные гормоны взаимодействуют с внутриклеточными рецепторами, поскольку их гидрофобные молекулы свободно диффундируют через плазматическую мембрану
Рецепторы делят на:
-рецепторы стероидных гормонов (минералкортикоидов, андрогенов, прогестерона)
-рецепторы тиреоидных гормонов в т.ч. вит Д и ретиноевой к-ты (находятсяся в цитозоле) они образуют комплексы с белками теплового шока, которые присоединяются к рецептору т.о. что закрывают его ДНК-связывающий домен. Сам рецептор представляет собой комплекс из основного и кислого белка, каждый белок связывает 1 молекулу гормона. Комплекс основного белка и гормона облегчает процесс транскрипции, связываясь с некодирующей цепью ДНК. Рецепторы тиреоидных гормонов находятся в ядре, связанном в хроматиновом состоянии (за исключением рецепторов эстрогенов, которые образуют в ядре комплексы с белками теплового шока) после взаимодействия с рецептором образуется активный комплекс, способный временно блокировать экспрессию генов.
Механизмы действия гормонов
Гормоны оказывают влияние на клетки-мишени.
Клетки-мишени- это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки.
В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору.
Что такое посредники, которые участвуют во внутриклеточной передаче гуморальных сигналов?
Существует два главных способа передачи сигнала в клетки-мишени от сигнальных молекул с мембранным механизмом действия:
-аденилатциклазная (или гуанилатциклазная) системы;
Основные компоненты: мембранный белок-рецептор, G-белок, фермент аденилатциклаза, гуанозинтрифосфат, протеинкиназы.
Кроме того, для нормального функционирования аденилатциклазной системы, требуется АТФ.
Белок-рецептор, G-белок, рядом с которым располагаются ГТФ и фермент (аденилатциклаза) встроены в мембрану клетки. До момента действия гормона эти компоненты находятся в диссоциированнном состоянии, а после образования комплекса сигнальной молекулы с белком-рецептором происходят изменения конформации G-белка. В результате одна из субъединиц G-белка приобретает способность связываться с ГТФ. Комплекс "G-белок-ГТФ" активирует аденилатциклазу. Аденилатциклаза начинает активно превращать молекулы АТФ в ц-АМФ. ц-АМФ обладает способностью активировать особые ферменты - протеинкиназы, которые катализируют реакции фосфорилирования различных белков с участием АТФ. При этом в состав белковых молекул включаются остатки фосфорной кислоты. Главным результатом этого процесса фосфорилирования является изменение активности фосфорилированного белка. В различных типах клеток фосфорилированию в результате активации аденилат-циклазной системы подвергаются белки с разной функциональной активностью. Например, это могут быть ферменты, ядерные белки, мембранные белки. В результате реакции фосфорилирования белки могут становятся функционально активными или неактивными.
Активация аденилатциклазной систтемы длится очень короткое время, потому что G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу. В результате прекращается реакция образования цАМФ.
Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды кофеин, теофиллин), способствуют сохранению и увеличению концентрации цикло-АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, т. е. усиливается действие гормона.
Кроме аденилатциклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат- это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок, на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Принято различать два механизма взаимодействия гормонов с клетками-мишенями:
-мембранный механизм - когда гормон связывается с рецептором на поверхности наружной мембраны клетки-мишени;
-внутриклеточный механизм - когда рецептор для гормона находится внутри клетки, т. е. в цитоплазме или на внутриклеточных мембранах.
Гормоны обладающие мембранным механизмом действия:
-все белковые и пептидные гормоны, а также амины (адреналин, норадреналин).
Внутриклеточным механизмом действия обладают:
-стероидные гормоны и производные аминокислот - тироксин и трийодтиронин.
Передача гормонального сигнала на клеточные структуры происходит по одному из механизмов. Например, через аденилатциклазную систему или с участием Са+2и фосфоинозитидов. Это справедливо для всех гормонов с мембранным механизмом действия. Но стероидные гормоны с внутриклеточным механизмом действия, которые обычно регулируют скорость биосинтеза белков и имеют рецептор на поверхности ядра клетки-мишени, не нуждаются в дополнительных посредниках в клетке.
Важное свойство всех живых существ – способность воспринимать, перерабатывать и передавать информацию. Несмотря на громадное разнообразие систем получения и переработки информации, функционирующих в животных и растительных организмах, все они основаны на едином принципе. Процесс получения информации, как правило, начинается с взаимодействия сигнала (химического агента, кванта света, механического воздействия и т.п.) с рецептором – мембранным белком. Следующий этап – передача информации в центр переработки информации, находящийся внутри клетки. Этот процесс происходит с помощью вторичных мессенджеров (посредников). В ответ на получение сигнала вторичного мессенджера в клетке происходит биохимическая модификация специализированных молекул-эффекторов, через которые и формируется ответ биологической системы (рис. 63).
Именно по такому принципу функционируют нервная, гормональная и иммунная системы животных, на такие же стадии могут быть разложены и фотобиологические процессы, протекающие в организмах как животных, так и в растений. Общий принцип действия всех систем приема и передачи информации связан не только с химической модификацией мембранных белков, но и с изменением концентрации заряженных ионов внутри и вне клетки, формирование трансмембранного потенциала. В последнее время выяснилось, что этот процесс играет важную физиологическую роль не только в нервной ткани, но и при переработке информации в тромбоцитах, лимфоцитах, тучных клетках.
Сигнальные молекулы, включая молекулы большинства гормонов, как правило, не проникают внутрь клетки, а специфически взаимодействуют с рецепторами, локализованными во внешней клеточной мембране и представляющими собой интегральные мембранные белки, полипептидная цепь которых пронизывает толщу мембраны несколько раз и которые могут быть выделены из мембраны только после ее разрушения, например, с помощью детергента. Стероидные и тиреоидные гормоны, будучи гидрофобными по своей природе, способны проникать через плазматическую мембрану внутрь клетки, где они взаимодействуют с растворимыми рецепторными белками, локализованными в цито- и (или) нуклеоплазме. Они представляют, по-видимому, эволюционно более примитивный (но и более гарантированный) способ передачи информации. Разнообразные молекулы, инициирующие трансмембранную передачу сигналов, активируют рецепторы, действуя на них обычно при очень низких концентрациях, порядка 10 -8 -10 -9 М.

Важно помнить, что поверхность животной клетки очень динамична. Внутриклеточные везикулы часто сливаются с плазматической мембраной, а участки плазматической мембраны, в свою очередь, могут отшнуровываться с образованием внутриклеточных везикул. Эти процессы составляют часть эндоцитозного и экзоцитозного путей, в которых рецепторы также играют важную роль.
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ОБОНЯНИЯ И УСИЛЕНИЯ ПЕРВИЧНЫХ ЗАПАХОВЫХ СИГНАЛОВ
В начале 50-х годов ХХ в. Эрл Сёзерленд на примере адреналина, стимулирующего образование глюкозы из гликогена, расшифровал принципы действия адреналинового рецептора, который оказался общим для широкого круга рецепторов. Уже в конце ХХ в. было обнаружено, что восприятие запахов осуществляется аналогичным образом, вплоть до деталей строения белков-рецепторов.
Первичные рецепторные белки – это весьма сложные молекулы, связывание которых со своими субстратами вызывает в них ощутимые структурные изменения, вслед за которыми начинается каскад каталитических (ферментативных) реакций. Для рецептора запаха (одорантного), так же как и для зрительного рецептора, этот процесс завершается нервным импульсом, воспринимаемым нервными клетками соответствующих отделов мозга. На рис. 74 схематически показан механизм действия адреналинового рецептора. Согласно последним данным, строение одорантного рецептора совершенно аналогично.
Как видно на рисунке 74 рецепторный белок включает такую последовательность аминокислот, которая содержит семь гидрофобных регионов от 20 до 28 остатков в каждом. Эти полипептидные участки, свернутые в α-спираль, образуют микротрубочки. Таким образом, рецепторный интегральный белок представляет собой своеобразную пачку из семи микротрубочек, пересекающих биомембрану. Толщина липидного бислоя в мембране составляет 30 Å, а длина одного остатка в α-спирали равна 1,5 Å. Пептидные участки в 20–28 остатков на αспиральном участке белковой молекулы имеют достаточную длину, чтобы пересечь мембранный бислой. Такая структура интегральных белков характерна для рецепторов опсина в сетчатке глаза, рецепторов серотонина, адреналина, гистамина и одорантов.

Рис. 74. Схема строения обонятельного рецептора а – поперечное сечение семидоменной структуры; б – схема взаимодействия одорант (лирал) – рецептор (вид сверху).
С внешней стороны клеточной мембраны белок-рецептор представляет собой розетку, построенную однотипно для разных рецепторных систем. На рис. 74 представлена схема взаимодействия между молекулой лирала (синтетический одорант) и обонятельным рецепторов крысы, представленным пятью гидрофобными доменами. В таких схемах в настоящее время широко используются аналоговые компьютерные модели, поскольку для большинства белков пока еще не имеется точных рентгеноструктурных данных. Рис. 75. Схематическая диаграмма строения обонятельного жгутика и два химических механизма усиления сигнала запаха внутри обонятельного волоска I – мембранный интегральный комплекс – рецептор (R) + ГТФсвязывающий белок (G) + аденилатциклаза (АЦ); II – мембранный интегральный комплекс – рецептор (R) + ГТФ-связывающий белок + фосфолипаза С (ФЛС).

МЕХАНОЧУВСТВИТЕЛЬНЫЕ ИОННЫЕ КАНАЛЫ
Функционирование ионных каналов может зависеть от локального растяжения мембраны и изменения градиента ее кривизны. Канальные структуры, которые изменяют свою активность в зависимости от натяжения мембраны, называются механочувствительными, хотя кроме них описаны каналы, увеличивающие активность и при обратном изменении натяжения. Впервые Ca 2+ -проводящие механочувствительные каналы были показаны на эндотелиальных клетках животных, где они выполняют роль сенсора кровяного давления. Каналы с аналогичными свойствами были обнаружены в бактериях, грибах и высших растениях.
Функционирование механочувствительных каналов происходит в тесном взаимодействии с цитоскелетом. Чувствительность этих каналов к натяжению возрастает, если сила, приложенная к большому участку мембраны, концентрируется на канале посредством элементов цитоскелета. Связь осуществляется набором белков, известных как анкирины (см. выше). Выделяют два типа каналов, чувствительных к натяжению мембраны: SA-каналы (stretch-activated), активирующиеся при растяжении мембраны и SI-каналы (stretch-inactivated), которые при растяжении мембраны инактивируются. В зависимости от объекта и типа клетки встречаются механочувствительные каналы, селективные к К + , Cl – , а также Са 2+ и другим двухвалентным катионам, проницаемые для одно- и двухвалентных катионов, и неселективные (или слабоселективные) для анионов и катионов. Наиболее часто в качестве ингибитора механочувствительных каналов используют гадолиний (Gd 3+), который обратимо блокирует работу каналов в низких концентрациях (10 мкМ), действуя с наружной стороны мембраны.
В отличие от рецептор- и потенциал-зависимых ионных каналов, механочувствительные каналы имеют гораздо меньшую плотность распределения в мембранах (она составляет в среднем 1/мкм 2 ). Тем не менее, при мембранном потенциале -60 мВ кальциевый ток через SA-канал может достигать величин 0,1 нА. Наиболее важное значение механочувствительные ионные каналы имеют в ростовых движениях различного типа и в регуляции работы устьичного аппарата. Механическое взаимодействие клеток в ходе их развития приводит к натяжению (или сдвигам) клеточных мембран, активации механочувствительных каналов и появлению векторных ионных потоков, которые уже непосредственно осуществляют регуляцию процессов роста и дифференцировки. У млекопитающих (в том числе, у человека) функционирование механорецепторов выстилки слизистой желудка обеспечивают ощущение сытости. При генетическом нарушении этих каналов возникают заболевания, приводящие к булимии.
РЕЦЕПТОРЫ, ОТВЕЧАЮЩИЕ ЗА ПЕРЕНОС МАКРОМОЛЕКУЛ В КЛЕТКУ
Существуют три вида эндоцитоза:
- фагоцитоз – захват клеткой больших структурных компонентов, вплоть до целых клеток, например клеток бактерий одноклеточными организмами и макрофагами;
- пиноцитоз – неспецифический захват клетками внеклеточной жидкости и ее содержимого;
- специфический захват молекул, опосредованный специальными рецепторами (рис. 78).

Рис. 78. Схематическое изображение мембранного транспорта между внутриклеточными вакуолями и плазматической мембраной ЭР – эндоплазматический ретикулум, СГ – секреторная гранула, СВ – секреторная везикула, Л – лизосома, Э1 – периферическая эндосома, Э2 – перинуклеарная эндосома, ОВ – окаймленная везикула, ОЯ – окаймленная ямка, РВ – рециклируюшаяся везикула, ФЛ – фаголизосома, Ф – фагосома, Г – аппарат Гольджи.
У млекопитающих по механизму опосредованного специфическими рецепторами эндоцитоза передаются структурные носители иммунитета от материнского организма к плоду. Антитела из кровотока материнского организма связываются с клетками плода, окружающими желточный мешок. На поверхности этих клеток имеются рецепторы, специфически связывающиеся с иммуноглобулинами и переносящие их в кровоток плода.
Клетки иммунной системы также функционируют с помощью эндоцитоза. Макрофаги захватывают антиген, внутри клетки он претерпевает процессинг – расщепление гидролитическими ферментами с вычленением сравнительно небольших фрагментов, несущих отдельные антигенные детерминанты. Заключительный этап этого процесса – экспрессия фрагментов антигена на поверхность макрофага, где они оказываются в комплексе с собственными антигенами гистосовместимости II класса (которые можно рассматривать как своего рода рецепторы). Далее запускается специфическая цепь иммунологических реакций, в которой участвуют лимфоциты различных типов.
Как показано в модельных экспериментах in vitro, после образования эндоцитозных везикул оболочка из клатрина удаляется специфическим белком в ходе АТФ-зависимой реакции. Везикулы без клатрина становятся частью сложной системы трубочек и везикул, называемых периферическими эндосомами; они локализованы вблизи плазматической мембраны. Конечный пункт эндоцитозного пути находится во вторичных лизосомах, где происходит деградация отдельных растворенных веществ (таких, как ЛНП).
Таблица 12. Некоторые рецепторы, интернализуемые при эндоцитозе

ЛНП-рецептор человека – это типичный рецептор группы I, который возвращается к плазматической мембране, в то время как его лиганд, сывороточный ЛНП, попадает в лизосому. По данным об аминокислотной последовательности рецептора он состоит из пяти доменов. Выраженная гомология с другими мембранными рецепторами отсутствует. Рецептор имеет единственный трансмембранный домен и непротяженный цитоплазматический С-концевой домен. Показано, что у лиц с таким генетическим заболеванием, как семейная гиперхолестеролемия, функция ЛНП-рецепторов существенно ослаблена.
Читайте также:

