Теория скользящих нитей кратко
Обновлено: 07.07.2024
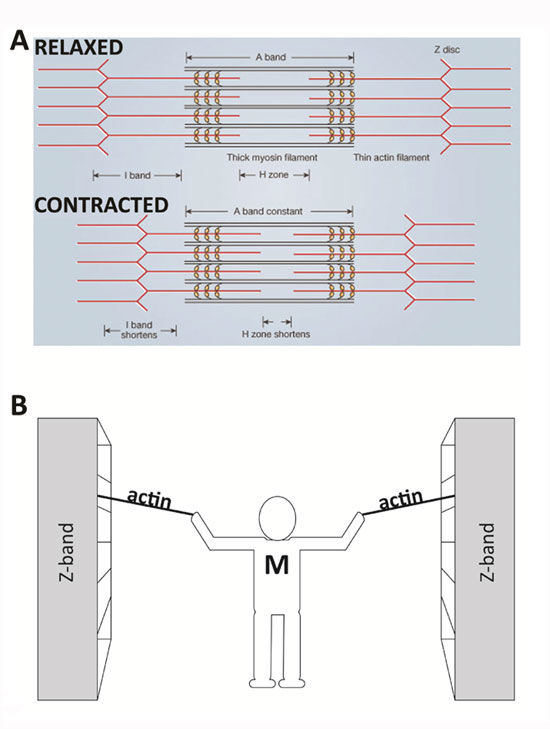
Было установлено, что саркомеры изменяют свою длину при сокращении или растяжении мышцы. При этом ширина Л-дисков в обоих случаях не меняется. В то же время при укорочении мышцы /-диски и //-зона становятся более узкими и, наоборот, при растяжении расширяются. Электронно-микроскопические исследования структуры саркомера при укорочении и растяжении мышцы обнаружили, что миозиновые (Л-диск) и актиновые (/-диск) филаменты не изменяют своей длины при изменении протяженности саркомера (рис. 2.25). Меняется лишь ширина участка взаимного перекрывания актиновых и миозиновых компонентов. Эти факты легли в основу теории, объясняющей мышечное сокращение, предложенной в начале 50-х годов XX в. X. Хаксли и А. Хаксли — теории скольжения нитей. Согласно данной теории укорочение саркомера, а следовательно, и мышечного волокна в момент сокращения происходит благодаря скольжению тонких (актиновых) нитей относительно толстых (миозиновых). Укорочение заканчивается, когда актиновые филаменты максимально втягиваются по направлению к центру Л-диска. При рас-
Н-зона I-диск А-диск Актиновый фи/юмент

Рис. 2.25. Гипотеза скользящих нитей:
А — взаимоотношения миофиламентов в процессе укорочения двух саркомеров; Б — модель функционирования поперечного мостика, согласно которой на миозиновой головке имеется 4 центра связывания. Эти центры от Мх до Щ последовательно (слева направо) взаимодействуют с центрами актинового филамента; В — общая схема цикла работы поперечного мостика
Согласно имеющимся экспериментальным данным механизм цикличности работы миозиновых мостиков представляется следующим образом. В покоящейся мышце мостик обладает определенной энергией, запасенной в результате фосфорилирования миозина, но он не может соединиться с актиновой спиралью, поскольку между ними в продольных бороздках спирали находятся нити белка тропомиозина с глобулой тропонина. При возбужде-80
нии мышцы во внутриклеточном пространстве увеличивается концентрация ионов кальция, который в присутствии АТФ вызывает изменения в конформации тропонина, в результате чего смещается нить тропомиозина и головка миозина получает возможность соединиться с актином. Соединение головки фосфорилированно-го миозина с актином приводит к сгибанию головки и перемещению нити актина на один шаг (20 нм) с последующим разрывом мостика. Энергию на такой единичный акт дает разрыв макро-эргической фосфатной связи, включенной фосфорилактомио-зином. Затем происходит уменьшение локальной концентрации ионов кальция и удаление их от тропонинового комплекса. Тро-помиозин снова блокирует актин, а миозин, в свою очередь, фос-форилируется за счет АТФ. Здесь важно отметить, что АТФ наряду со снабжением энергией системы для ее дальнейшей работы способствует временному разобщению нитей и делает возможным растяжение мышцы под влиянием внешних сил. При исчезновении АТФ из миоплазмы развивается непрерывное сокращение — контрактура.

Взаимодействие мышечных белков лежит в основе нашего нынешнего понимания сокращения саркомера. Как оно происходит? Это как-то связано со скользящим взаимодействием между актином и миозином.
Основные понятия
Перед тем, как углубиться в физиологию, ознакомимся с основной терминологией.
На электронной микрофотографии тонкого среза мышечных волокон изображена группа нитей.
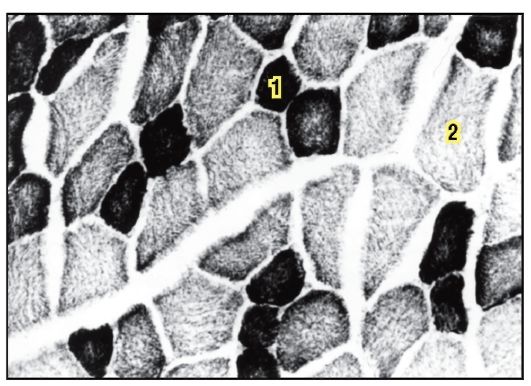
Рисунок 1. 1 — тонкие нити (I тип, красные нити) — не интенсивная, длительная работа.
2 — толстые нити (II тип, белые нити) — интенсивная и кратковременная работа.
Каждый массив нитей — миофибрилла — имеет форму цилиндра, внутри которого чередуются пучки тонких и толстых нитей. Внутри волокна нити находятся в строгом порядке, так что области с одинаковой плотностью находятся рядом друг с другом, за счет чего волокно имеет характерную полосатую окраску в поляризованном световом микроскопе. Единица между двумя темными полосами — саркомер.
В продольном разрезе группы миофибрилл имеется полоса низкой плотности, называемая I-полосой. В центре I-полосы имеется заметная плотная линия, называемая Z-диском. Область между двумя линиями Z — саркомером — может считаться основной структурной и функциональной единицей, непосредственно ответственной за сокращение мышц. Таким образом, миофибриллу можно рассматривать как группу саркомеров.
Группа миофибрилл образует симпласт. На поверхности мышечной клетки плазматическая мембрана (сарколемма) образует впячивания, где формируется система Т-трубочек, обеспечивающая сокращение миоцитов. Представляет собой сеть взаимосвязанных колец, каждое из которых окружает миофибриллу и обеспечивает важный путь коммуникации между наружной частью волокна и миофибриллами, которые расположены глубоко внутри волокна.
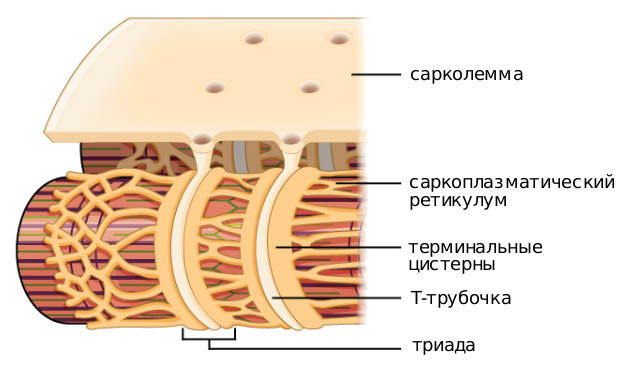
Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый триадой. Количество триад на саркомер зависит от вида. Например, в мышце лягушки есть одна на триаду, а в мышцах млекопитающих — две. У рыб и ракообразных только одна цистерна связана с каждой поперечной трубочкой, образуя диаду.
Мышечные белки
Основной составляющей толстых нитей является миозин. Каждая толстая нить состоит из около 250 молекул миозина. Миозин играет две важные роли: структурную как строительный блок для толстых нитей и функциональную как катализатор распада АТФ во время сокращения и взаимодействия с актином в составе силового генератора мышц. Хвост длиной около 120 нм состоит из двух цепей белка, каждая из которых намотана на так называемую α-спираль, вместе образуя структуру спиральных катушек. На другом конце молекулы две белковые цепи образуют две глобулярные головные области, которые обладают способностью сочетаться с белковым актином и несут ферментативные сайты для гидролиза АТФ.
В средней части толстой нити молекулы собраны в хвост-хвост. Вдоль остальной части нити наматываются с головы до хвоста. Хвостовые части молекул образуют сердцевину нити; головные части выступают из нити.
Тонкие нити содержат три разных белка: актин, тропомиозин и тропонин. Актин, составляющий около 25 % белка миофиламентов, является основным компонентом тонких нитей в мышцах. Актиновые молекулы повторяются каждые 2,75 нм вдоль тонкой нити. Они создают спиральную структуру, которая может рассматриваться как двойная или одинарная спираль.
Тропомиозин представляет собой стержнеобразную молекулу длиной около 40 нм. Имеет структуру, аналогичную структуре хвоста миозина, являющейся спиральным звеном двух белковых цепей. Каждая молекула тропомиозина находится в контакте с семью актиновыми единицами.
Тропонин представляет собой комплекс из трех различных субъединиц белка: I, T и C. Тропонин С может связывается с кальциевыми ионами. Тропонин T присоединяется к тропомиозину, образуя с ним тропонин-тропомиозиновый комплекс. Тропонин I соединяется с актином в тонких филаментах. Один тропониновый комплекс связан с каждой молекулой тропомиозина. Молекула тропонина расположена примерно каждые 40 нм вдоль нити.
Тропонин и тропомиозин участвуют в регуляции сокращения и расслабления мышц. Одной из субъединиц является рецептор для Ca 2+ , высвобождаемый из саркоплазматического ретикулума при активации мышцы. Считается, что связывание кальция затем приводит к дальнейшим структурным изменениям взаимодействия актина, тропомиозина и другой субъединицы тропонина, которые приводят к сокращению путем активации взаимодействия актин-миозин.
Историческая справка

Механизм сжатия
Когда нервный импульс от головного и спинного мозга переносится по двигательному нейрону в мышечное волокно, Ca 2+ ионы высвобождаются в терминальном аксоне.
Увеличение концентрации ионов кальция стимулирует высвобождение нейротрансмиттера ацетилхолина в синаптической щели.
Нейротрансмиттер связывается с рецептором на сарколемме, происходит деполяризация, и генерируется потенциал действия через мышечное волокно для сокращения мышц. Потенциал действия распространяется по всему мышечному волокну и перемещается в соседние волокна вдоль Т-трубочек.
Инициируется выделение ионов кальция из саркоплазматического ретикулума, которые стимулируют сокращение мышц. Последовательность сокращения мышц, объясняемая моделью скользящих нитей, выглядит следующим образом:
1. Блокировка головной части миозина:
Актин и миозин перекрывают друг друга, образуя поперечный мостик. Поперечный мостик активен только тогда, когда головка миозина прикреплена, как крючок, к нити актина. Когда мышца находится в состоянии покоя, перекрытие актиновой нити к головке миозина блокируется тропомиозином. Миофиламент актина находится в положении покоя.
2. Выделение иона кальция:
Нервный импульс, вызывающий деполяризацию и потенциал действия в сарколемме, вызывает выброс ионов кальция. Ион кальция связывается с тропониновым комплексом на нити актина, сдвигая тропомиозин из его места блокировки. Миофиламент актина находится в активном положении.
3. Поперечный мостик:
Поперечный мостик между актином и миозином действует как фермент (миозин АТФ-аза), который гидролизует АТФ, хранящийся в головке миозина, в АДФ, вследствие чего высвобождается энергия. Эта освобожденная энергия используется для перемещения головки миозина в направлении актиновой нити. Головка миозина наклоняется и тянет актиновую нить так, что миозин и актиновая нить скользят друг к другу. Противоположные концы нитей актина в саркомере движутся в направлении друг к другу, что приводит к сокращению мышцы. После сближения поперечный мостик отсоединяется, а актин и миозиновая нить возвращаются в исходное положение.

Аналогия, наглядно иллюстрирующая теорию
Представьте, что вы стоите между двумя большими шкафами с книгами. Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
Регуляция
АТФ поставляет энергию, как и было описано выше, но что делает кальций? Кальций требуется двум белкам (тропонину и тропомиозину), которые регулируют сокращение мышц. В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В 1994 году Уильям Леман и его коллеги продемонстрировали, как тропомиозин вращается, изучая форму актина и миозина в богатых кальцием растворах и растворах, содержащих низкий уровень кальция (Lehman, Craig, & Vibertt, 1994). Сравнивая действие тропонина и тропомиозина в этих двух условиях, они обнаружили, что присутствие кальция является существенным для механизма сжатия. В отсутствие свободного кальция связывание актина и миозина не происходит, поэтому наличие свободного кальция является важным регулятором мышечного сокращения.
Нерешённые вопросы
Лекция 1
Архитектура скелетных мышц человека
1.1. Классификация мышц
Существуют различные классификации скелетных мышц: по форме и размерам, по направлению волокон, по функции, по отношению к суставам.
Классификация по направлению мышечных волокон
Для конечностей наиболее типичны веретенообразные и перистые мышцы. Если волокна проходят параллельно продольной оси мышцы, она называется веретенообразной. Если мышечные волокна располагаются под углом к продольной оси мышцы, она называется перистой.
Из-за существования мышц с различным ходом мышечных волокон в анатомии, физиологии и биомеханике мышц утвердились понятия анатомического и физиологического поперечников.
Если произвести разрез мышцы в плоскости, перпендикулярной линии, соединяющей ее начало и конец (длиннику мышцы), и измерить площадь полученной фигуры (площадь поперечного сечения мышцы), то получим значение анатомического поперечника.
Если произвести разрез мышцы в плоскости, перепендикулярной ходу мышечных волокон, и измерить площадь полученных фигур, то сумма площадей будет характеризовать значение физиологического поперечника мышцы.
Анатомический поперечник у веретенообразной мышцы совпадает с ее физиологическим поперечником, в то время как у мышцы перистой физиологический поперечник больше анатомического.
Классификация по количеству головок
Некоторые мышцы имеют несколько головок. Такие мышцы называют соответственно числу головок двуглавыми, трехглавыми и т.д.
Классификация мышц по их отношению к суставам
Мышцы делят на группы по их отношению к суставам. Односуставные мышцы оказывают действие на один сустав. Если мышца перекидывается через два или более суставов, она называется двусуставной или многосуставной.
Возле двуосного сустава мышцы группируются соответственно двум его осям движения (сгибание — разгибание, приведение — отведение). К шаровидному суставу, имеющему три оси движения, мышцы прилежат с нескольких сторон и действуют на него в разных направлениях. Так, например, у плечевого сустава имеются мышцы-сгибатели и разгибатели, осуществляющие движения вокруг фронтальной оси, отводящие и приводящие мышцы — вокруг сагиттальной оси и мышцы-вращатели – вокруг продольной оси.
Классификация мышц по их функции
В зависимости от функции различают мышцы-синергисты и мышцы-антагонисты. Как правило, на каждый сустав в одном направлении действует две или более мышц. Такие содружественные по направлению действия мышцы называют синергистами. Мышцы, действующие на сустав в противоположном направлении (сгибатели и разгибатели), являются антагонистами.
Классификация мышц по особенностям прикрепления и выполняемой функции
1.2. Макроструктура мышцы
Основными структурными элементами скелетной мышцы являются мышечные волокна и соединительнотканные элементы, выполняющие в мышце вспомогательные функции.
Сухожилия состоят из плотной волокнистой соединительной ткани, богатой коллагеновыми волокнами, формируются как продолжение внутримышечных соединительнотканных элементов и вплетаются в надкостницу. Сухожилие снаружи покрыто футляром из плотной волокнистой соединительной ткани. В соединительнотканных прослойках проходят кровеносные сосуды и нервы. Сухожилие мало растяжимо, обладает значительной прочностью и выдерживает огромные нагрузки. Более подробно о механических свойствах сухожилия будет рассказано в третьей лекции.
Скелетные мышцы имеют определенные особенности прикрепления к костям. Проксимальный отдел мышцы начинается от одной кости – это начало мышцы. Дистальный конец – сухожилие – прикрепляется к другой кости – это прикрепление мышцы. При сокращении мышцы один ее конец остается неподвижным (фиксированная точка), другой изменяет свое положение (подвижная точка). Иногда фиксированная и подвижная точки меняются местами.
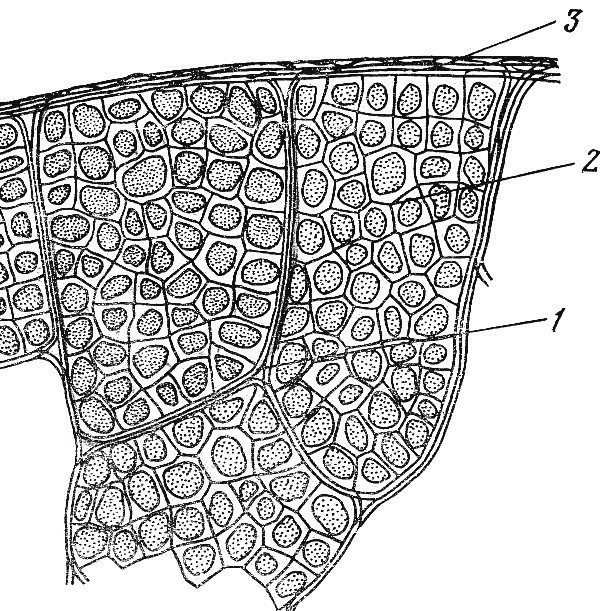
Рис. 1.1. Соединительнотканные структуры мышцы (В.С. Гурфинкель, Ю.С. Левик, 1985): 1 – перимизий; 2 –эндомизий, 3 – эпимизий
Фасции представляют собой соединительнотканные футляры для мышц. Они отделяют мышцы друг от друга, создают опору для мышцы при ее сокращении, служат местом начала для некоторых мышц.
Строение фасций зависит от функций мышц, давления, которое мышцы оказывают на фасции при своем сокращении. В тех местах, где мышцы много работают, фасции хорошо развиты, плотные, подкреплены сухожильными волокнами и по внешнему виду напоминают тонкое, широкое сухожилие (широкая фасция бедра, фасция голени).
Функции соединительной ткани
1. В процессе развития соединительная ткань выполняет функцию каркаса (мягкого скелета мышцы), на котором фиксируются мышечные волокна. После завершения развития мышц соединительная ткань продолжает удерживать их вместе и во многом определяет структуру мышечного брюшка.
3. Соединительная ткань противостоит пассивному растяжению мышцы и обеспечивает такое распределение сил, при котором вероятность повреждения мышечных волокон сводится к минимуму. Кроме того, свойство эластичности, обусловленное эластиновыми фибриллами и коллагеновыми пучками, позволяет брюшку восстановить свою форму после устранения действия пассивных сил.
4. Посредством эндомизия часть силы, развиваемой мышечным волокном передается сухожилию.
1.3. Микроструктура мышцы
Рассмотрим подробно строение основного структурного элемента мышцы – мышечного волокна.
Поперечнополосатая (скелетная) мышца образована расположенными параллельно друг другу мышечными волокнами длиной от 4 см и более и толщиной до 0,1 мм. Каждое волокно имеет цилиндрическую форму, покрыто двумя оболочками: базальной мембраной и сарколеммой. Между оболочками мышечного волокна находятся клетки-сателлиты. Внутри волокно заполнено гелеобразным содержимым — саркоплазмой. В саркоплазме находятся: миофибриллы, ядра, митохондрии, рибосомы, лизосомы и др. Каждая миофибрилла как муфтой окружена саркоплазматическим ретикулумом. В нем находятся ионы Са 2+ . В сарколазме также содержится белок миоглобин, который, подобно гемоглобину, может связывать 02. В зависимости от количества миоглобина в мышечных волокнах различают так называемые красные и белые мышечные волокна.
Миофибриллы являются основными сократительными элементами мышцы. Их внешний вид можно сравнить со стеблем бамбука. Длинные участки — это саркомеры, а промежутки между ними — Z-диски, рис.1.2.
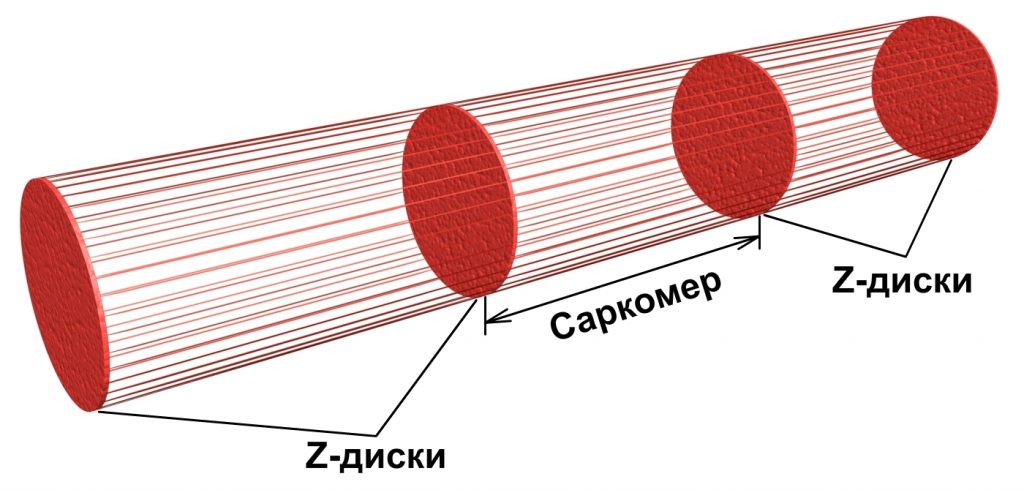
Рис. 1.2. Схема строения миофибриллы
1.4. Строение саркомера
Участок миофибриллы между двумя Z-дисками называется саркомером. В обе стороны от Z-диска отходят тонкие филаменты, а в середине саркомера находятся толстые нити. В определенных участках саркомера толстые и тонкие нити перекрываются. Этому участку соответствует темный диск, в то время, как в районе светлого диска находятся только актиновые нити. Средняя часть диска темного диска более светлая; она называется Н зоной, и, в свою очередь, подразделяется надвое линией М, которая делит миозиновые нити на две равные части. Поперечный разрез миофибриллы свидетельствует о том, что в соте вокруг одного толстого филамента размещаются шесть тонких филаментов. Однако в саркомере таких сот много. Расчеты показывают, что в одном саркомере диаметром 1 мкм содержится 1261 толстый филамент и 5292 тонких филаментов. При увеличении площади саркомера отношение количества тонких филаментов к количеству толстых уменьшается с 12 (12 тонких филаментов на один толстый) до 4,19 (5292 тонких на 1261 толстый), если диаметр саркомера достигает 1 мкм.
Строение толстого филамента

Рис. 1.3. Строение толстого филамента (В.Л. Быков, 1998)
Строение тонкого филамента
Каждый тонкий филамент образован двумя спиральными нитями из молекул актина, закрученными один вокруг другого и двух вспомогательных белков тропомиозина и тропонина. Оба вспомогательных белка (тропомиозин и тропонин) подавляют взаимодействие актина с миозином в отсутствии ионов кальция, рис.1.4.
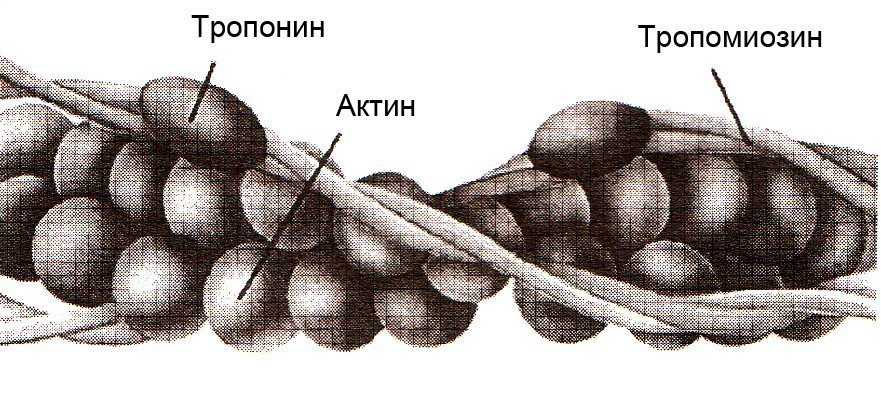
Рис. 1.4. Тонкий филамент, состоящий из молекул актина, тропомиозина и тропонина (Дж.Х. Уилмор, Д.Л. Костилл, 1997)
1.5. Теория скользящих нитей
Способ сокращения волокон скелетной мышцы был определен в результате двух различных исследований, проведенных в начале 1950-х годов при участии ученых Эндрю и Хью Хаксли. В то время, когда Хью Хаксли проводил свои исследования при помощи электронного микроскопа, Эндрю Хаксли использовал интерференционный микроскоп для изучения характеристик мышечных волокон лягушки во время сокращения и расслабления. Он обнаружил, что во время сокращения светлый диск становился короче, тогда как длина темного диска не изменялась; в то же время бледная Н-зона в темном диске сужалась и могла вообще исчезнуть. Оба ученых независимо друг от друга выдвинули предположение, что полученные ими результаты можно объяснить скользящим движением филаментов актина и миозина относительно друг друга. Теория скольжения филаментов сегодня является общепризнанной. Кратко ее сущность состоит в следующем.
Миозин в покое неактивен, так как на его головке находится отрицательно заряженный комплекс Mg, ATФ, не позволяющий белку проявлять АТФ-азные свойства. После поступления ионов Са 2+ происходит нейтрализация заряда на головке, что приводит миозин в возбужденное состояние. После этого миозиновые головки начинают прикрепляться к активным участкам тонкого филамента.
Когда миозиновая головка толстого филамента прикрепляется к тонкому филаменту, между толстым и тонким филаментами образуется поперечный мостик. При взаимодействии с актином каждая миозиновая молекула ежесекундно гидролизует до 10 молекул АТФ. За счет энергии, высвобождающейся при расщеплении АТФ, миозиновая головка поворачивается, что приводит к скольжению толстого и тонкого филаментов относительно друг друга. В конце гребка (поворота) к миозиновой головке присоединяется новая молекула АТФ, что приводит к отделению головки от актина и присоединению к новому активному участку тонкого филамента до тех пор, пока миозиновые головки не достигнут Z-диска. Так как при сокращении саркомера расстояние между Z-дисками уменьшается, происходит уменьшение его длины. Одновременное сокращение всех саркомеров приводит к уменьшению длины миофибриллы и мышечного волокна. Ввиду того, что саркомер представляет собой не плоскую, а объемную структуру, при его сокращении происходит не только уменьшение его длины, но и увеличение его поперечного сечения (когда тонкие нити втягиваются в толстые), поперечного сечения мышечных волокон и всей мышцы. рис.1.5.
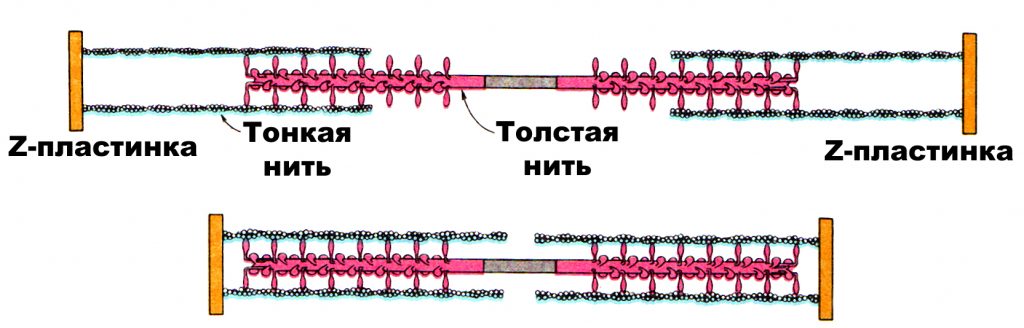
Рис. 1.5. Схема, иллюстрирующая взаимодействие толстого и тонкого филаментов (Л. Страйер, 1985)
Каким образом доставляется энергия к филаментам? Кроме участка для прикрепления к тонкому филаменту, миозиновая головка содержит участок, в котором локализуется АТФ. Освобождающая вследствие реакции гидролиза (расщепления АТФ) энергия используется для прикрепления миозиновой головки к тонкому филаменту, а после осуществления поворота головки – для отделения миозиновой головки от тонкого филамента.
1.6. Типы скелетных мышечных волокон и их морфофункциональная характеристика
Рассматривая макроструктуру скелетных мышц, были выделены три основных элемента: это фасции, мышечные волокна и сухожилия. В этом параграфе мы более подробно рассмотрим типы мышечных волокон, так как от этого во многом зависит способность мышц к проявлению силы, скорости, а также выносливости.
Вначале были выделены два типа скелетных мышечных волокон, каждый из которых имел свои физиологические особенности. Это – медленные (тонические) и быстрые (фазические) волокна. В некоторых мышцах могут быть только быстрые или только медленные волокна, в других – волокна обоих типов в определенном соотношении. В дальнейшем были выделены мышечные волокна промежуточного типа.
Благодаря различным типам волокон организм способен передвигаться и поддерживать позу. Быстрые волокна позволяют мышце сокращаться с высокой скоростью. В большом количестве эти волокна имеются у хищников; они обеспечивают быстроту реакции при ловле добычи. С другой стороны, потенциальная добыча, чтобы не стать жертвой хищников, тоже должна быть способна к быстрому реагированию. В обоих случаях от подвижности животного будут зависеть его шансы на выживание. Когда животное находится в покое, оно поддерживает определенную позу с помощью тонических мышечных волокон. Им свойственно более медленное и длительное сокращение и в то же время энергетические затраты меньше, чем при сокращении быстрых волокон. Сокращение их по своей природе обычно изометрическое, при котором мышцы, противодействуя силе тяжести и удерживая конечности в определенном положении, сохраняют постоянную длину.
У человека все мышцы тела состоят из волокон трех типов, но обычно один из них доминирует. Это имеет физиологическое значение, поскольку тонические мышцы способны к медленному и длительному сокращению и поэтому медленных волокон больше в позных мышцах-разгибателях, тогда как в сгибателях, предназначенных для быстрых реакций, преобладают быстрые фазические волокна.
Согласно современным представлениям, большинство скелетных мышц человека и животных представляют собой гетерогенные морфофункциональные системы, состоящие из мышечных волокон, отличающихся по структуре, метаболизму и функции.
Мышечные волокна I типа в мировой номенклатуре обозначают как красные, окислительные, медленные, устойчивые к утомлению. В мышечных волокнах I типа хорошо выражен Z-диск, который толще, чем в мышечных волокнах других типов, саркоплазмаческий ретикулум развит в меньшей степени, чем в других типах мышечных волокон. В данных структурах выявляется много митохондрий с поперечной ориентацией. В саркоплазме обнаруживаются липидные капли, которые часто контактируют с митохондриями. Мышечные волокна I типа характеризуются также высокой степенью кровообращения. Каждое мышечное волокно I типа контактирует с 5-6 кровеносными капиллярами. В этих волокнах отмечается самое высокое содержание миоглобина. Согласно данным гистохимических исследований, в волокнах I типа обнаруживается более низкая активность креатинфосфокиназы, чем в других мышечных волокнах.
Мышечные волокна IIA типа в мировой номенклатуре обозначают как промежуточные, окислительно-гликолитические, быстрые, устойчивые к утомлению. Z-диск в мышечных волокна IIA типа, по мнению ряда авторов, толще, чем в мышечных волокнах IIВ типа и не отличается от такового в волокнах I типа. По данному показателю волокна типа IIA занимают промежуточное положение между мышечными волокнами I типа и мышечными волокнами IIB типа. В мышечных волокнах IIA типа хорошо развит саркоплазматический ретикулум и системы триад. Мышечные волокна IIА типа богаче митохондриями, чем волокна IIВ типа и практически не отличаются по этому признаку от мышечных волокон I типа. Митохондрии в мышечных волокнах IIA типа имеют преимущественно продольную ориентацию (по длине оси мышечных волокон). Они часто образуют скопления под сарколеммой. В саркоплазме мышечных волокон IIA типа встречается достаточно большое количество липидных капель. Мышечные волокна IIА типа содержат больше миоглобина, чем мышечные структуры IIВ типа. Содержание креатинфосфата в мышечных волокнах IIА типа ниже, чем в волокнах IIВ типа и не отличается от такового в волокнах I типа. Мышечные волокна данного типа представляются универсальными в плане их метаболизма. В связи с тем, что мышечные волокна IIА типа способны длительное время производить работу достаточно большой мощности, они должны рассматриваться как универсальные мышечные волокна в плане их функциональных возможностей.
Рекомендуемая литература
2. Самсонова А.В. Биомеханика мышц: учебно-методическое пособие /А.В.Самсонова, Е.Н. Комиссарова / Под ред А.В.Самсоновой .- СПб., 2008.- 217 с.
В основе сокращения лежит скольжение тонких миозиновых нитей относительно толстых актиновых. При сокращении не меняется длина нитей, но увеличивается область их перекрывания. В процессе сокращения происходит уменьшение ширины J- диска и увеличение А – диска за счёт уменьшения ширины Н -полоски. При расслаблении происходит обратное увеличение Н – полоски, увеличение J-диска.
Показано, что молекула миозина образует так называемые миозиновые мостики. Каждый состоит из головки и шейки. Молекула актина обладает сродством к головке миозинового мостика. Суть сокращения состоит в том, что головка миозинового мостика связывается с актином, затем происходит сокращение шейки.
В дальнейшем связь актина и миозина разрывается и головка перескакивает на последующий мостик, обеспечивая процесс скольжения нитей. Замечено, что головки одной половины толстого миозинового филамента ориентированы в сторону одной Z -мембраны, а второй половины – в противоположную сторону, к другой Z-мембране.
На головке миозинового мостика имеется 4 последовательно рас- положенных центра связывания М1-М4. Сродство к актину возрастает от М1 к М4. В результате поворот головки происходит только в одну сторону. При этом растягивается шейка и нарастает сила сокращения (рис. 27).
Энергообеспечение сокращения связано с энергозатратами со- крашения и разрыва связей актина и миозина. Актин обладают АТФ- азной активностью. АТФ-азная активность миозина слабая. Она возрастает на несколько порядков при образовании актино-миозинового комплекса. Для разрыва связи актина с головкой миозинового мостика необходимы энергия АТФ и магний. После разрыва связи головка перескакивает дальше по молекуле актина.

Регуляция мышечного сокращения. Вне возбуждения взаимодействие миозиовых мостиков и актина практически не происходит. Для сокращения необходимо увеличение концентрации внутриклеточного кальция. При этом кальций является посредником между потенциалом действия ( возбуждением ) и непосредственно сокращением.
Вне возбуждения концентрация внутриклеточного свободного кальция составляет 1х10-8 М. В процессе возбуждения потенциал действия распространяется по сарколеме и переходит на мембраны Т-трубочек, с которых сигнал передается на Т-цистерны ретикулума.
По концентрационному градиенту кальций выходит из саркоплазматического ретикулума, в результате концентрация внутриклеточного кальция возрастает до 1х10-6 М. В дальнейшем кальций связывается с регуляторным белком тропонином, что способствует изменению конформации тропомиозина и молекула актина становитя способной взаимодействовать с миозиновыми мостиками. Начинается процесс скольжения нитей актина относительно миозиновцых.
Расслабление. Для него необходим разрыв связи между актином и миозином. Процесс энергозависимый, происходит в присутствии ионов магния. Условием расслабления является снижение до 1х10-8 М концентрации свободного кальция. Процесс начинается с реполяризации клеточной мембраны и уменьшения проводимости мембран саркоплазматического ретикулума для кальция.
Одновременно с этим усиливается процесс кальциевой инактивации, обеспечивающий обратный перенос кальция в цистерны саркоплазматического ретикулума. Тропонин от связи с кальцием освобождается, а тропомиозин препятствует образованию связей актина и миозина.
Читайте также:

