Свойства кислот и оснований кратко
Обновлено: 05.07.2024
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота - это всё что с H, а основание - c OH. НО! Не всегда. Что бы отличать кислоту от основания необходимо. запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания - это разделение веществ по схожим свойствам. Первая теория кислот и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу - это класс веществ, которые в реакции с водой диссоциируют (распадаются), образовывая катион водорода H + . Основания Аррениуса в водном растворе образуют анионы OH - . Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания, соответственно, - это вещества, способные принять протон в реакции. Актуальная на данный момент теория - теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя аддукты Льюиса (аддукт - это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты - это распад HCl на H + и Cl - .
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион, в водном растворе выделяют анион OH - .
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H + и анионы. Пример сильной кислоты - соляная кислота HCl:
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl - соляная кислота
- HBr - бромоводород
- HI - йодоводород
- HNO3 - азотная кислота
- HClO4 - хлорная кислота
- H2SO4 - серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + H2O(ж) → H3O + (р-р) + F - (р-р) - в такой реакции более 90% кислоты не диссоциирует:
[H3O + ]=[F - ] Сильные основания
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH - :
Большинство слабых оснований - это анионы:
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Слабое основание и слабая кислота
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Диссоциация - это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O + (р-р) + OH - (р-р)
Kc = [H3O + ][OH - ]/[H2O] 2
Константа равновесия воды при t=25°: Kc = 1.83⋅10 -6 , также имеет место следующее равенство: [H3O + ][OH - ] = 10 -14 , что называется константой диссоциации воды. Для чистой воды [H3O + ] = [OH - ] = 10 -7 , откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH - потенциал водорода. Если pH 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр - устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль - это ионное соединение образованное катионом отличным от H + и анионом отличным от O 2- . В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H + , ни OH - в воде. Например, Cl - , NO - 3, SO 2- 4, Li + , Na + , K + .
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F - , CH3COO - , CO 2- 3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:

Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.


1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например , оксид серы (VI) реагирует с водой с образованием серной кислоты:
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например , хлор реагирует с водородом:
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз раствора сульфата меди (II):
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например , соляная кислота диссоциирует почти полностью:
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
Например , сернистая кислота диссоциирует в две ступени:
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами .
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.

Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.

4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например , уксусная кислота взаимодействует с гидроксидом алюминия:

5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например , йодоводород можно окислить хлоридом меди (II):
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода

Например , соляная кислота взаимодействует с нитратом серебра в растворе:
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей .
Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например , гидроксокарбонат меди (II) растворяется в серной кислоте:
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например , гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:

При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:

Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H + ].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH — ]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H + ].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
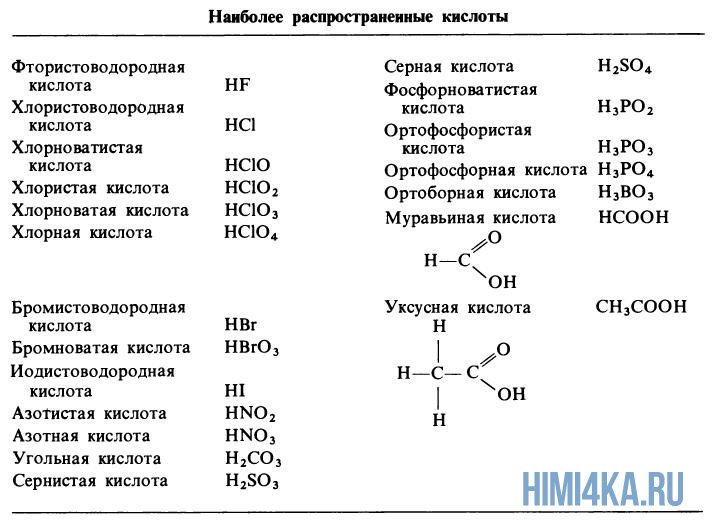
Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H + .
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3 — и CO — ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H + , поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
Органические кислоты, такие как уксусная и муравьиная кислота, дают H + из своих карбоксигрупп –COOH.
Диссоциация оснований
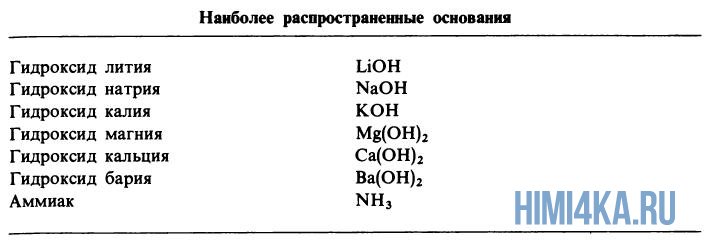
Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH — :
Хотя у аммиака отсутствуют OH — ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:

И опять определять основные химические свойства оснований и кислот мы будем по таблице:
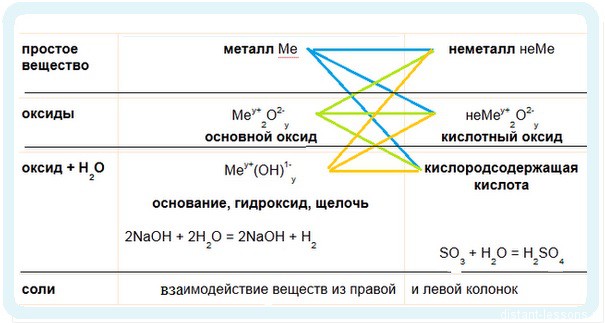
1. Взаимодействие с неметаллами (идем по желтым стрелочкам) :
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение — взаимодействие щелочей с хлором:
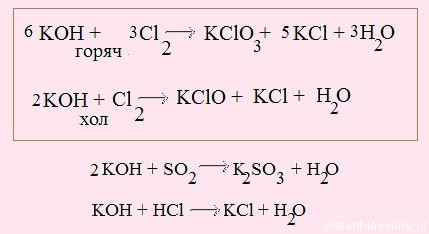
Эту реакцию мы уже рассматривали много раз, например, в контексте свойств простых веществв.
2. Взаимодействие с кислотными оксидами с образованием солей:
3. Взаимодействие с кислотами — реакция нейтрализации:
- с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли — избыток щелочи ; - с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли — избыток кислоты ; - с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли — избыток основания.
4. С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества:
NaOH + NH4Cl = NaCl + NH4OH — малодисс.
Амфотерные гидроксиды:
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
1. Кислоты взаимодействуют с металлами с выделением водорода, если металл стоит в ряду напряжений до водорода H :
2Na + 2HCl =2 NaCl + H2
с металлами после водорода Н взаимодействуют только кислоты — окислители и уже без выделения водорода :
Кислоты — окислители могут взаимодействовать и с неметаллами:
Какие кислоты являются окислителями? Те, в которых элемент кислотного остатка проявляет высшую (или близкую к высшей) степень окисления (соответствует номеру группы элемента) :
2. С основными и амфотерными оксидами и основаниями кислоты дают соли:
3. C солями кислоты реагируют, если образуется осадок, газ или малодиссоциирующее вещество:
Свойства оснований и кислот определяются самыми простыми реакциями обмена и замещения, дополнительно — различные окислительно-восстановительные с участием кислот — окислителей.
Кстати, в нашем вопросе с гидроксидом калия:
1) Осадок. газ или малодиссоциирующее вещество не образуется — не подходит;
2) С гидроксидом алюминия реакция пойдет, а вот с нитратом серебра — нет;
3) С гидроксидом цинка реакция пойдет, с оксидом — нет, т.к. он основной;
4) 2KOH + ZnCl2 = Zn(OH)2 ↓+ 2KCl — выпадает осадок
Читайте также:

