Структура ионных соединений кратко
Обновлено: 05.07.2024
Ключевые слова конспекта: Катионы как продукт окисления атомов металлов. Анионы как продукт восстановления атомов неметаллов. Ионная химическая связь. Ионная кристаллическая решётка. Простые и сложные ионы.
Опираясь на знания из курса основной школы, вы, возможно, предложите следующие способы:
- металлы, атомы которых содержат на внешнем слое 1—3 электрона, могут отдать их, чтобы сделать завершённый предвнешний слой внешним;
- неметаллы, атомы которых содержат на внешнем слое 4—7 электронов, могут принять недостающие чужие электроны для завершения этого слоя.
Однако эти процессы имеют далеко идущие последствия. Во–первых, атомы металлов, отдавая электроны (процесс называется окислением), превращаются в положительно заряженные ионы — катионы, а во–вторых, атомы неметаллов, принимая электроны на внешний слой (процесс называется восстановлением), превращаются в отрицательно заряженные ионы — анионы.
Согласно закону Кулона, между катионами и анионами возникают силы электростатического притяжения, которые удерживают эти частицы в ионном кристалле.
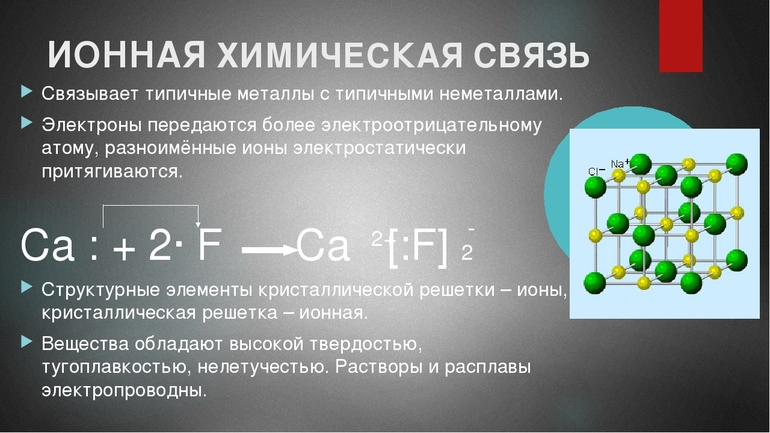
Эта связь характерна для соединений, образованных наиболее активными металлами — щелочными и щёлочноземельными, и наиболее активными неметаллами — галогенами и кислородом. Следовательно, из бинарных, или двухэлементных соединений, к ионным относятся оксиды и галогениды металлов IA- и IIА-групп. Эти соединения построены простыми ионами.

Схематично процесс образования ионной связи между атомами кальция и хлора можно отразить следующим образом:
Два разноимённо заряженных иона, связанных силами взаимного притяжения, взаимодействуют с другими противоположно заряженными ионами, образуя таким образом кристаллические соединения. Что они собой представляют?

Ионы, как и другие частицы, в твёрдом кристалле занимают строго определённое положение в пространстве. Если их соединить воображаемыми линиями, получится совокупность ячеек правильной геометрической формы, называемая кристаллической решёткой. Точки, в которых расположены частицы вещества (в нашем случае ионы), называют узлами кристаллической решётки.
На рисунке представлена модель кристаллической решётки другого ионного соединения — хлорида натрия NaCl. В нём каждый катион натрия окружён шестью хлорид-анионами. Те, в свою очередь, окружены каждый шестью катионами натрия.
Ионы в узлах кристаллической решётки могут колебаться, но перемещаться им мешают другие ионы. Силы взаимного притяжения ионов достаточно велики, поэтому при обычных условиях вещества ионного строения имеют твёрдое агрегатное состояние, высокую температуру плавления, они нелетучие, а потому без запаха. Некоторые из таких веществ хорошо растворимы в воде (гидроксиды щелочных и щёлочноземельных металлов, соли).
Ионные кристаллы хрупкие, поскольку при смещении слоёв одинаково заряженные ионы сближаются друг с другом, что приводит к их взаимному отталкиванию.

При сильном нагревании колебание ионов увеличивается настолько, что порядок нарушается и кристалл плавится. Из каких частиц будет состоять полученная жидкость? Очевидно, из тех, которые были в узлах кристаллической решётки, т. е. из ионов.
В определении ионной связи есть уточнение: ионы образуют не только отдельные атомы, но и группы атомов. Следовательно, существуют и сложные ионы, состоящие из нескольких химических элементов. Например, гидроксид-анион ОН – , анионы кислотных остатков кислородсодержащих кислот — сульфат–анион SO4 2– , нитрат анион NO3 – и др. Логично сделать вывод, что ионными соединениями являются щёлочи и соли.
Ионную связь можно рассматривать как крайнюю степень полярности ковалентных связей. Даже в тех соединениях, которые считаются абсолютно ионными, например в хлориде натрия, отсутствуют ионы с целочисленными значениями зарядов (+1 и –1). Действительный заряд на катионе натрия и хлорид–анионе соответственно равен +0,8 и –0,8.
Не является абсолютно истинным и утверждение о том, что ионная связь возникает между элементами с противоположными свойствами — между активными металлами и неметаллами. Имеются ионные соединения, построенные только из неметаллов. К ним, например, можно отнести соли аммония (сульфат аммония, хлорид аммония и др.), а также соли органических оснований — аминов (хлорид метиаламмония, нитрат этиламмония и др.).
Теорию ионной связи предложил немецкий учёный Вальтер Коссель.

В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
О чем эта статья:
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na + и анион H - .

Между положительным ионом Na + и отрицательным H - возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na + контактирует с шестью ионами H - . Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.

При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.

Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.

Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.

А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.

Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
растворимость в воде,
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
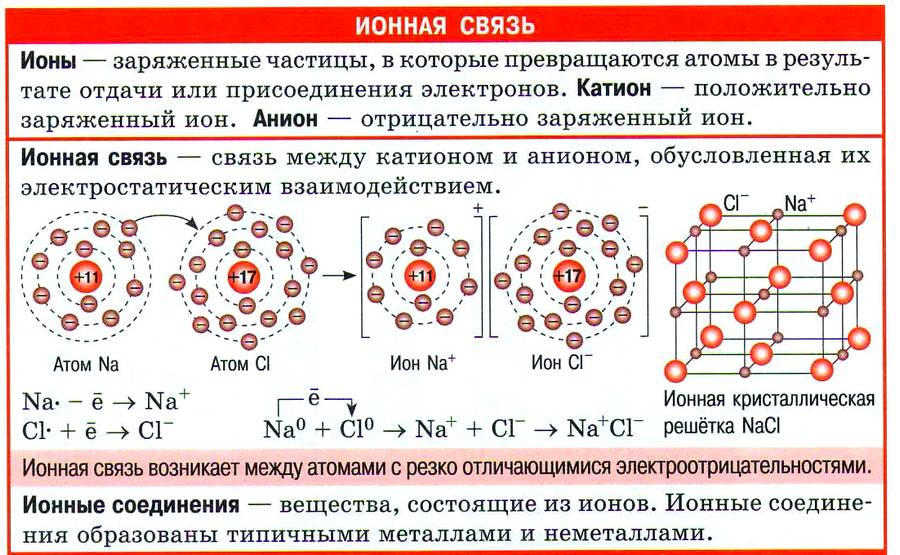
Ионами называются атомы, которые потеряли или, наоборот, получили определенный заряд вместе с электронами. Такие частицы подразделяются на два типа — катионы и анионы. Эти разновидности атомов обладают разноименными зарядами, что и отличает их друг от друга. Электростатическое притяжение анионов и катионов провоцирует возникновение так называемой ионной химической связи. Для нее характерна большая сила соединения атомов элементов.
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
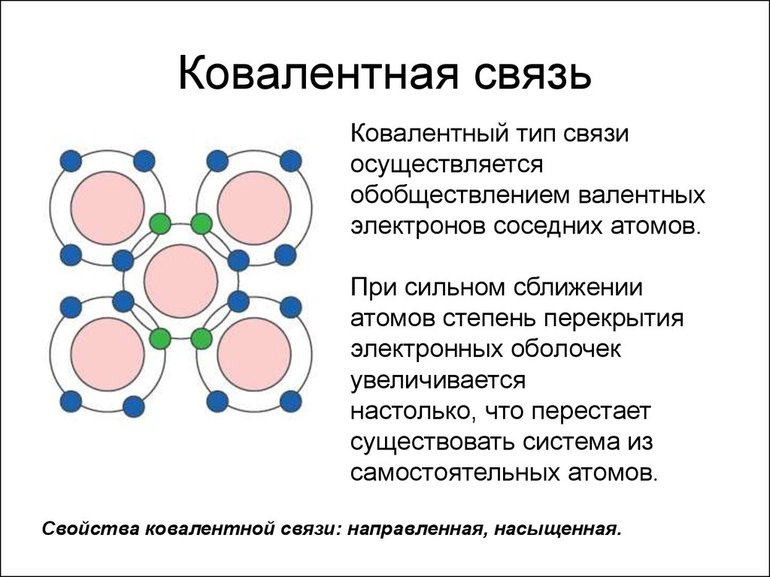
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
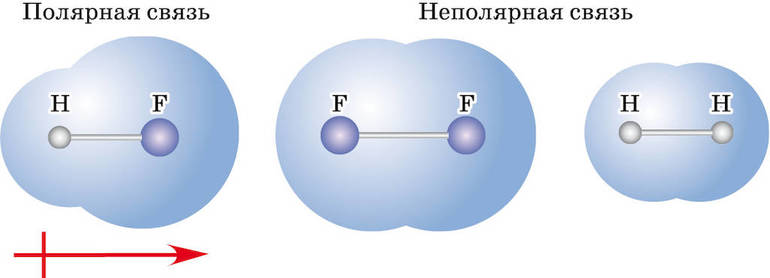
- равны или примерно равны (разница между значениями по шкале Полинга — до 0,4) — это ковалентная неполярная связь (общая электронная пара не смещается ни к одному из атомов);
- отличаются, но не сильно (разница от 0,4 до 1,7) — это ковалентная полярная связь (электронная пара смещается к одному из участвующих атомов);
- отличаются сильно (разница более 1,7) — это ионная связь (один или несколько электронов не просто смещаются, а почти полностью переходят к другому атому, причем всегда к тому, у которого значение электроотрицательности больше, при этом оба атома-участника превращаются в ионы).
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.

Отрицательно заряженные ионы — это анионы. Примеры: Cl- (хлорид-ион), N 3 — (нитрид-ион) и так далее. Образование анионов происходит в результате получения (приобретения) атомом электрона (или электронов). У них ядерный заряд уступает количеству электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
- однозарядную (K+, Cl- и так далее);
- двухзарядную (Ca 2 +, O 2 — и прочие);
- трехзарядную (Al 3 + и другие).
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.

Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
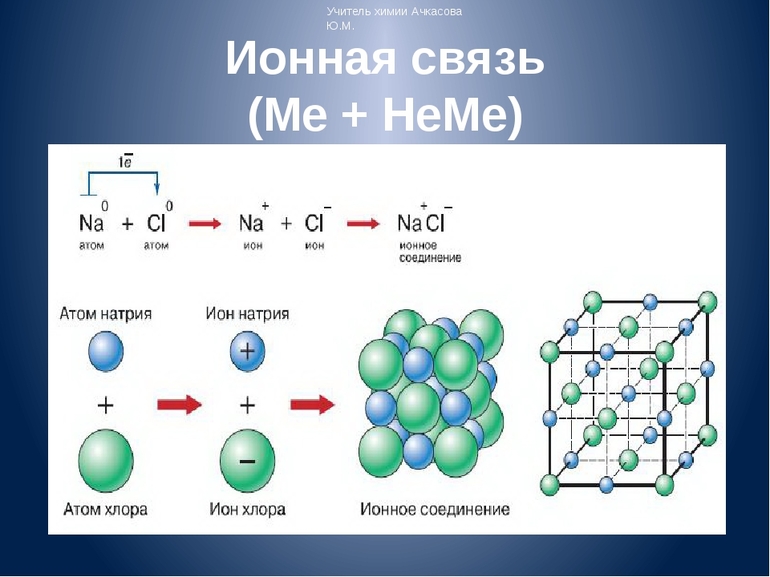
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na 0 )2e)8e)1e + Cl 0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na 0 + Cl 0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
- солей;
- щелочей;
- оксидов некоторых металлов.
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
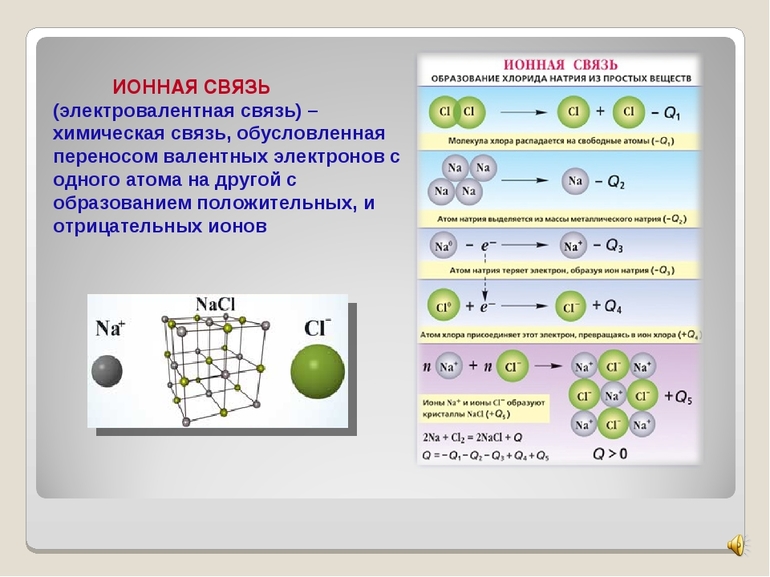
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи

Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
- прочность;
- длина;
- поляризуемость;
- полярность;
- ненасыщаемость;
- ненаправленность.
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Все вещества во Вселенной имеют свою структуру строения, которая объясняет их химические и физические свойства. Помимо агрегатного состояния и строения химических решеток, важное значение в системе строения имеет вид связи, которыми связаны частицы вещества.
Современное знание о химии различает следующие типы связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Ионная связь может рассматриваться в качестве крайней формы ковалентной полярной связи. Это значит, что она происходит только между ионами и только между частицами с разной электроотрицательностью.
Ионная связь — особый вид химической связи между заряженными частицами (ионами), основанное на силах электростатического притяжения.
Ионная связь, образуется между элементами, электроотрицательность которых сильно отличается. При этом один из атомов превращается в положительно заряженный ион — катион, а второй в отрицательно заряженный — анион. Это объясняется тем, что электроны атома с меньшей ЭО практически полностью переходят к атому с большей ЭО.
Ионная связь характерна для соединений элементов-металлов с неметаллами.
Ионная связь характеризуется 2 главными чертами:
Эти качества влияют на растворимость соединений с ионной связью — они хорошо и практически полностью растворяются в полярных растворителях.
Электронное строение, как отличить от ковалентной
В отличие от ковалентной химической связи ионная связь образуется между ионами.
Ионы — частицы веществ, имеющие положительный или отрицательный заряд, но при этом образующиеся из нейтральных частиц.
По сути строения соединений, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной. Более того, в одном соединении одновременно могут существовать несколько видов связи, как это происходит, например, в молекуле фосфата аммония ( N H 4 ) 3 P O 4 .
Однако отличить ковалентную от ионной связи все же можно:
- Ионная связь всегда образуется между положительно и отрицательно заряженными ионами.
- Разница ЭО у химических элементов в ионной связи всегда превышает 1,7-2 по Полингу.
- Электронная пара не просто смещена, а практически полностью переходит к атому с большей ЭО.
- Внешняя электронная оболочка атомов связанных ионной связью будет либо полностью занятой, либо практически пустой.
- Ионная связь не имеет кратности, не направлена и не насыщена.
Механизм формирования ионной связи на примере формирования фторида натрия можно проследить на схеме:
Заряды ионов и их классификация
Классификация ионов происходит по нескольким признакам:
- по заряду;
- по наличию водной оболочки;
- по составу.
Заряды ионов бывают положительными и отрицательными. Положительные ионы называются катионами. Отрицательные — анионами. При ионной связи они соединяются для образования химических соединений.
По второму признаку ионы бывают гидратированными и негидратированными. Первые находятся в растворах и кристаллогидратах. Вторые — в безводных солях.
По составу ионы делятся на простые и сложные. Простые ионы образуются из одного атома. Сложные — состоят из нескольких.
По значению заряда ионы классифицируются на:
- однозарядные ( K + );
- двузарядные ( В а 2 + );
- трехзарядные ( A l 3 + ).
Особенности ионной связи
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Как возникает, процесс взаимодействия, формулы
При формировании соединения с ионной связью одна из частиц отдает электроны, а вторая принимает их на свою электронную орбиталь.
Положительно заряженный ион образуется при отдаче электрона, анион же образуется при присоединении дополнительных электронов к атому. Обычно это атомы металла и неметалла, соответственно.
Пример ионной связи между металлом и неметаллом:
Иногда ионная связь образуется из неметаллов. Тогда электронная пара смещается к элементу с большей ЭО.
Читайте также:

