Строение вещества физика 7 класс кратко
Обновлено: 07.07.2024
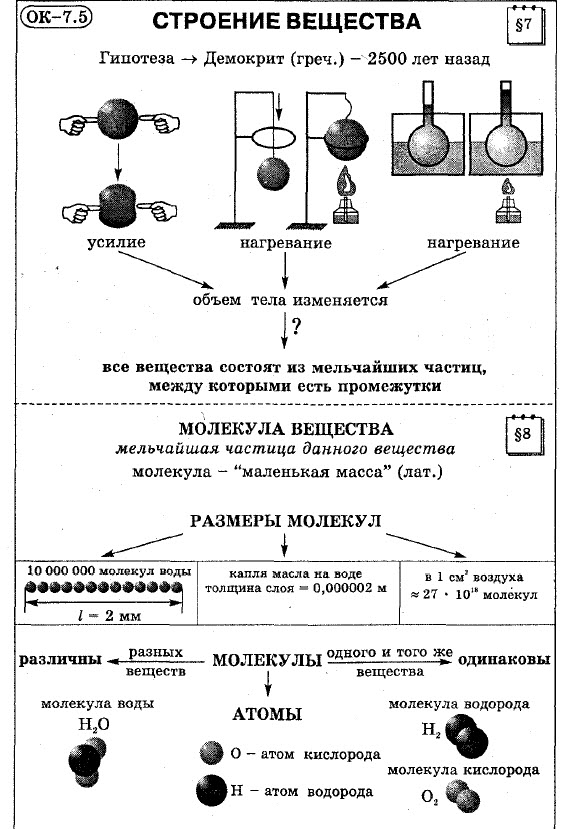
Еще в глубокой древности, 2500 лет назад, некоторые ученые высказывали предположение о строении вещества. Греческий ученый Демокрит ( 460 - 370 лет до н. э.) считал, что все вещества состоят из мельчайших частичек. В научную теорию эта идея превратилась только в 18 в. и получила дальнейшее развитие в 19 в. Появление представлений о строении вещества позволило не только объяснить многие явления, но и предсказать, как они будут протекать в тех или иных условия.
Многие опыты подтверждают представления о строении вещества. Рассмотрим некоторые из них.
Попытаемся сжать теннисный мячик. При этом объем воздуха, который заполняет мяч, уменьшится. Можно уменьшить и объем надувного шарика, и кусочка воска, если приложить некоторое усилие.
Объем тела изменяется также при его нагревании и охлаждении.
Проделаем опыт. Возьмем медный или латунный шарик, который в не нагретом состоянии проходит сквозь кольцо. Если шарик нагреть, то, расширившись, он уже сквозь кольцо не пройдет. Через некоторое время шарик, охладившись (а значит и уменьшившись в размере), и частично нагрев кольцо, (а значит, увеличив его), он вновь пройдет сквозь кольцо.

На этой иллюстрации показано, что в не нагретом состоянии, латунный шарик легко проходит сквозь кольцо.

Здесь мы видим, что в нагретом состоянии, расширившись, он не проходит сквозь кольцо, а задерживается.
С помощью опыта определим, как меняется объем жидкости при нагревании.
Колбу, наполненную доверху водой, плотно закроем пробкой. Сквозь пробку пропускаем стеклянную трубочку. Вода частично заполнит трубочку. Отметим уровень жидкости в трубке. Нагревая колбу, мы заметим, что через некоторое время уровень воды в ней повысится.(иллюстрация к опыту)

Вода находится в не нагретом состоянии, и лишь частично заполнила трубку. Уровень воды в трубке низкий.

Воду нагрели, она стала расширяться и заполнять свободное пространство. Уровень воды в трубке поднялся.
Значит, при нагревании объем тела увеличивается, а при охлаждении уменьшается.
Попытаемся объяснить, почему происходит изменение объема тела.
По-видимому, все вещества состоят из отдельных частичек, между которыми имеются промежутки. Если частицы удаляются друг от друга, то объем тела увеличиваются. И если частички сближаются, объем тела уменьшается.
Тогда возникает вопрос: если тела состоят из мельчайших частичек, почему они кажутся нам сплошными?
Современная наука доказала, что частицы вещества так малы, что мы их не видим.
Для того, чтобы убедиться в том, что частицы вещества малы, проделаем опыт.
В сосуде с водой растворим маленькую крупинку гуаши. Через некоторое время вода в нем станет синей. Отольем немного воды в другой сосуд и дольем в него чистую воду. Раствор во втором сосуде будет окрашен слабее, чем в первом. Потом повторим всю операцию, но уже с водой из второго сосуда. В третьем сосуде вода будет окрашена еще слабее чем во втором, и гораздо слабее, чем в первом.

Поскольку в воде растворили очень маленькую крупинку гуаши и только часть ее попала в третий сосуд, можно предположить, что крупинка состояла из большого числа мельчайших частичек, как, впрочем, и вода, в которой растворили гуашь. Это называется диффузией, но об этом позже.
Этот опыт, как и многие другие подтверждают гипотезу о том, что вещества состоят из очень маленьких частиц.
Все вещества состоят из отдельных частиц - это было доказано современной наукой. Эти частицы были названы молекулами (в переводе с латинского "маленькая масса").

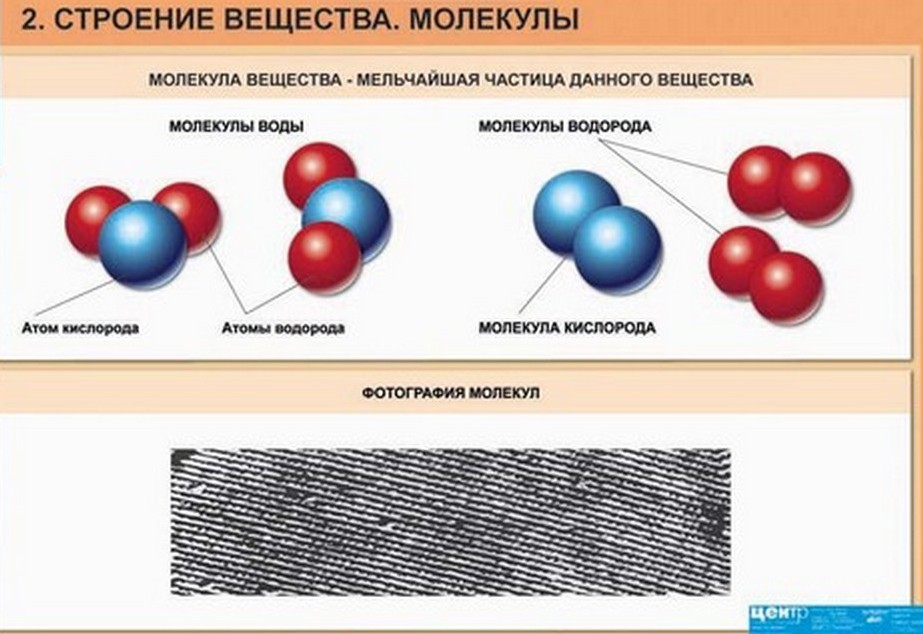
Молекула вещества - это мельчайшая частица данного вещества.
Например, самая маленькая частица воды - это молекула воды. Наименьшая частица соли - это молекула соли.
Попытаемся представить себе, каковы размеры молекул.
Если можно было бы уложить в один ряд вплотную друг к другу 10 000 000 (или 10-7 степени) молекул воды, то получилось бы ниточка всего в 2мм. Малый размер молекул позволяет получить тонкие пленки различных веществ. Капля масла, например, может растекаться по воде слоем толщиной всего в 0,000002 м (или 2 · 10-6 степени).
Даже небольшие тела состоят из огромного вещества молекул. Так, например, в крупинке соли или сахара содержится очень большое число молекул. Подсчитано, что в 1 см³ воздуха находится около 27 · 1018 степени молекул. Чтобы понять, насколько велико это число, представим следующее. Через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдет через отверстие за время 840 000 лет.
Из-за очень малых размеров молекулы невидимы невооруженным глазом или в обычные микроскопы. Но при помощи специального прибора - электронного микроскопа - удалось сфотографировать наиболее крупные из них. На рисунке показано расположение молекул белка.
Окружающие нас тела, даже похожие на первый взгляд, будут различны. В природе вы не встретите двух совершенно одинаковых снежинок или песчинок, людей, животных и пр.
Ученые с помощью опытов доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Например, воду, полученную из сока или молока, нельзя отличить от воды, полученной путем перегонки из морской воды. Молекулы воды одинаковы. Из таких молекул не может состоять никакое другое вещество.
Молекулы, в свою очередь, состоят из еще более мелких частиц - атомов.
Например, наименьшая частица воды - это молекула воды. Она состоит из трех атомов: двух атомов водорода и одного атома кислорода. Из курса химии вы узнаете, что воду обозначают H2O. H - атом водорода, O - атом кислорода.
Молекулы принято изображать схематически, т. е. с помощью моделей молекул. Две молекулы воды показаны на рисунке. Если разделить две молекулы воды, то образуется два атома кислорода и четыре атома водорода. На следующем рисунке показано, что каждые два атома водорода могут соединиться в молекулу водорода, а атомы кислорода - в молекулу кислорода.


Атомы тоже состоят из более мелких частиц, но об этом вы узнаете в курсе химии 8 класса.

Всем хорошо известно, что если в комнату внести какое-либо пахучее вещество, например, духи или нафталин, то запах вскоре будет чувствоваться во всей комнате. Распространение запахов происходит из-за того, что молекулы духов (или нафталина) движутся.
Возникает вопрос, почему же запах в комнате распространяется не мгновенно, а спустя некоторое время.
Дело в том, что движению молекул пахучего вещества в определенном направлении мешает движение молекул воздуха. Молекулы духов (или нафталина) на своем пути сталкиваются с молекулами газов, которые входят в состав воздуха. Они постоянно меняют направление движения и, беспорядочно перемещаясь, разлетаются по комнате.
Проделаем опыт, который можно объяснить только тем, что тела состоят из молекул, которые находятся в непрерывном движении.
Нальем в мензурку (или стакан) немного медного купороса, имеющего темно-голубой цвет. Сверху осторожно добавим чистой воды.

Вначале между водой и медным купоросом будет видна резкая границ, которая через несколько дней станет не такой резкой. Граница, отделяющая одну жидкость от другой, исчезнет через 2-3 недели. В сосуде образуется однородная жидкость бледно-голубого цвета. Это значит, что жидкости перемешались.
Наблюдаемое явление объясняется тем, что молекулы воды и медного купороса, которые расположены возле границы раздела этих жидкостей, поменялись местами. Граница раздела стала расплывчатой. Молекулы медного купороса оказались в нижнем слое воды, а молекулы воды переместились в верхний слой медного купороса.
Если дать мензурке постоять 2-3 недели, то граница между ними будет еще более расплывчатой и постепенно совсем исчезнет. Вся вода окрасится в голубой цвет. Это происходит потому, что молекулы, двигаясь непрерывно и беспорядочно, распространяются по всему объему. Жидкость в сосуде становится однородной.
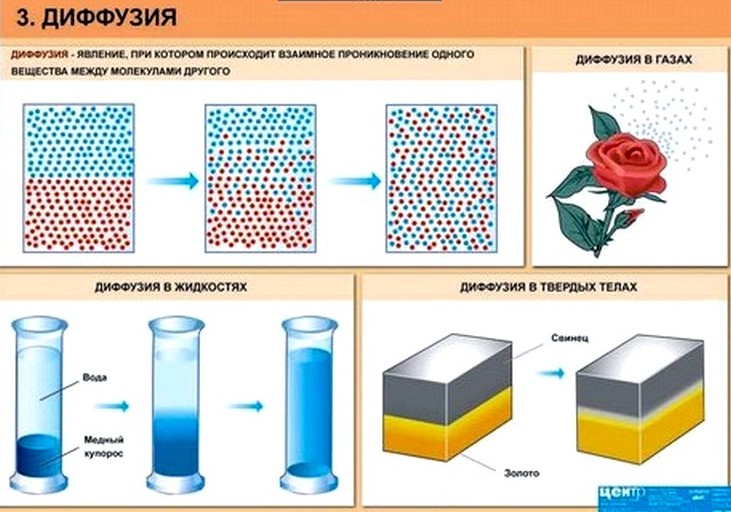
Явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого, называется диффузией.
В твердых телах также происходит диффузия, но только еще медленнее.
Например, очень гладко отшлифованные пластинки свинца и золота кладут одна на другую и ставят на них некоторый груз. (Пластинку золота, как более тяжелую, располагают внизу.) При комнатной температуре (20°С) за 4-5 лет золото и свинец взаимно проникают друг в друга на расстояние около 1мм. Во всех приведенных опытах мы наблюдаем взаимное проникновение молекул веществ, т. е. диффузию.
Явление диффузии играет большую роль в природе. Так, например, благодаря диффузии поддерживается однородный состав атмосферного воздух вблизи поверхности Земли. Диффузия растворов различных солей в почве способствует нормальному питанию растений и т.д.
Если все тела состоят из мельчайших частиц (молекул или атомов), почему же твердые и жидкости не распадаются на отдельные молекулы или атомы? Что заставляет их держаться вместе, ведь молекулы разделены между собой промежутками и находятся в непрерывном беспорядочном движении?

Дело в том, что между молекулами существует взаимное притяжение. Каждая молекула притягивает к себе все соседние молекулы и сама притягивается ими.
Когда мы разрываем нить, ломаем палку или отрываем кусочек бумаги, то преодолеваем силы притяжение между молекулами.
Заметить притяжение между двумя молекулами совершенно невозможно. Когда же притягиваются многие миллионы таких частиц, взаимное притяжение становится значительным. Поэтому трудно разорвать руками веревку или стальную проволоку.
Притяжение между молекулами в разных веществах неодинаково. Этим объясняется различная прочность тел. Например, стальная проволока прочнее медной. Это значит, что частицы стали притягиваться друг к другу сильнее, чем частицы меди.
Притяжение между молекулами становится заметным только тогда, когда они находятся очень близко друг к другу. На расстоянии, превышающем размеры самих молекул, притяжение ослабевает. Две капли воды сливаются друг с другом, если они соприкасаются. Два свинцовых цилиндра сцепляются вместе, если их вплотную прижать друг к другу ровными, только что срезанными поверхностями. При этом сцепление может быть настолько прочным, что цилиндры не удается оторвать друг от друга даже при большой нагрузке.
Однако осколки стекла нельзя срастить, даже плотно прижимая их. Из-за неровностей не удается их сблизить на то расстояние, на котором частица могут притянуться друг к другу. Но если размягчить стекло путем нагрева (плавление), то различные части можно сблизить и стекло в этом случае спаивается.
Это значит, что частицы стекла оказались на таком расстоянии, когда действует притяжение между ними.
Соединение кусков металла при сварке или при спайке, а также склеивание основано на притяжении молекул друг к другу.
Следовательно, между двумя молекулами (атомами) существует взаимное притяжение, которое заметно только на расстояниях, сравнимых с размерами самих молекул (атомов).
Тогда попытаемся выяснить, почему между молекулами имеются промежутки. Если молекулы притягиваются друг к другу, то они должны как-то слипнуться. Этого не происходит потому, что между молекулами (атомами) в то же время существует отталкивание.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении - отталкивание.
Многие наблюдаемые явления подтверждают существование отталкивания между молекулами.
Так, например, сжатое тело распрямляется. Это происходит потому, что при сжатии молекулы оказываются на таком расстоянии друг от друга, когда начинает проявляться отталкивание.
Некоторые явление в природе можно объяснить притяжением молекул друг к другу, например смачивание твердого тела жидкостью.
Опыт. К пружине подвешиваем на нитке стеклянную пластинку так, чтобы ее нижняя поверхность была расположена горизонтально. Эту пластинку подносим к сосуду с водой так, чтобы она легла на поверхность воды. При отрывании пластинки от воды, пружинка заметно растянется. Это доказывает существование притяжения между молекулами. По растяжению пружины, можно видеть насколько оно велико. Оторвав пластинку от воды, можно увидеть, что на ней остается тонкий слой воды, т.е. пластинка смочена водой. Значит, при отрывании пластины, мы преодолеваем притяжение между молекулами воды. Разрыв произошел не там, где соприкасаются молекулы воды с частицами стекла, а там, где молекулы воды соприкасаются друг с другом.


Строение вещества
Мельчайшей частицей вещества, которая определяет все свойства данного вещества, является молекула. Молекула состоит из атомов. Число атомов и их распределение в молекуле является различным. В природе существует немногим более сотни атомов различного вида. Элементы обобщены и расположены в периодической таблице химических элементов, им даны наименования, например, водород, азот, углерод.
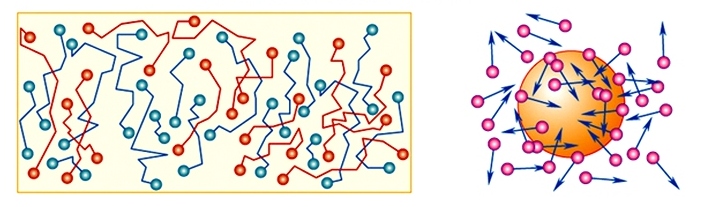
Движение частиц вещества называют тепловым движением.
Броуновское движение — беспорядочное движение микроскопических видимых, плавающих в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа.
Состояние вещества.
Вещества в природе встречаются в трёх состояниях:
Молекулы одного и того же вещества в различных состояниях не отличаются друг от друга. Различные свойства вещества во всех состояниях определяются тем, что его молекулы расположены иначе и движутся по-разному.
Каждому твёрдому телу характерна твёрдость. Твёрдость — способность тела сопротивляться воздействию другого тела. Твёрдость вещества выясняют, царапая его каким-либо другим веществом.
Существуют различные шкалы твёрдости. Одна из них составлена в 1811 году немецким минералогом Фридрихом Моосом. Она состоит из 10 уровней, самым мягким веществом в ней является тальк, а самым твёрдым — алмаз. Алмаз в 58 раз твёрже стоящего на втором месте по твёрдости минерала корунда, из которого изготавливают рубины и сапфиры.
Свойством тел, изготовленных из твёрдого вещества, является их деформация. Деформация — изменение формы или размера тела под воздействием другого тела.
Эластичностью называют возможность тела после деформации возвращать себе первоначальную форму. Пластилин является пластичным, ему легко придать любую форму, которая сохраняется.
Прочность — способность вещества сопротивляться разрушению. У каждого материала имеется свой предел прочности. Стекло нельзя гнуть, т.к. оно хрупкое. Очень прочными являются металлы.
Кристаллы — это твёрдые тела, в которых атомы расположены закономерно, упорядоченно, образуя кристаллическую решётку. Это лёд, соль, металлы, минералы и т.д.
В отличие от кристаллов, стабильно-аморфные вещества не затвердевают с образованием кристаллических граней.
Структуры жидкостей и аморфных тел имеют много общего. По этой причине принято считать аморфные тела очень густыми, вязкими, застывшими жидкостями. Аморфные вещества могут находиться либо в стеклообразном состоянии при низких температурах, либо в состоянии расплава при высоких температурах. Аморфные тела обладают текучестью, хотя и значительно меньшей, чем жидкости. При повышении температуры текучесть аморфных тел увеличивается. Благодаря этому из капли нагретого стекла можно выдуть стеклянный сосуд.

Физика 7 класс Конспект Строение вещества
Первоначальные сведения о строении вещества.
Диффузия. Агрегатные состояния вещества.
Все вещества состоят из мельчайших частиц: атомов, молекул, ионов.
Молекула вещества – это мельчайшая частица данного вещества.
Частицы вещества находятся в непрерывном хаотическом движении.
Броуновское движение молекул
К числу основных опытных доказательств того, что молекулы движутся, относится явление, которое первым наблюдал в 1827 г. английский ботаник Роберт Броун.
Движение очень мелких твердых частиц, находящихся в жидкости, называют броуновским движением. Причина броуновского движения заключается в непрерывном, никогда не прекращающемся движении молекул жидкости (газа), в которой находятся крупинки твердого тела.
Диффузия – это явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого.
В твердых телах также происходит диффузия, но только очень медленно.
Процесс диффузии ускоряется с повышением температуры, т.к. при увеличении температуры увеличивается скорость движения молекул.
Пример диффузии:
распространение запаха духов или кофе

Диффузия в жидкости
Между молекулами вещества существует взаимодействие – взаимное притяжение и отталкивание. Притяжение между молекулами в разных веществах неодинаково.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание.
В природе вещество может находиться в одном из трех агрегатных состояний: твердом, жидком, газообразном.
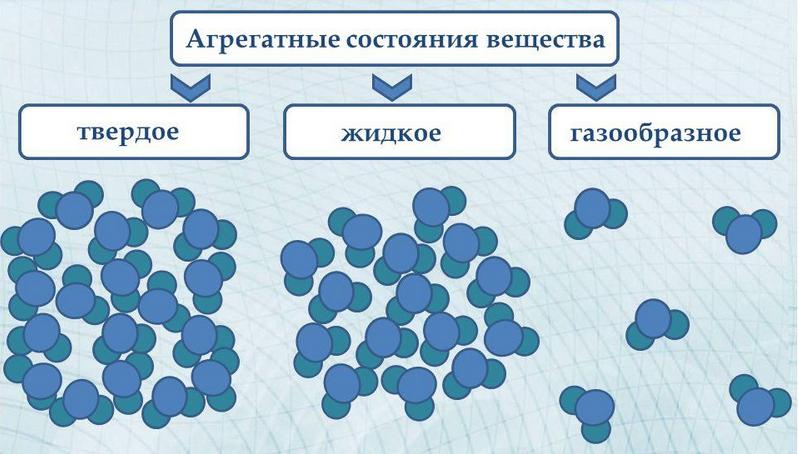
Расположение молекул в разных агрегатных состояниях вещества
Свойства агрегатных состояний веществ
Твердое тело:
- имеет собственную форму и объем
- трудно изменить форму и объем
- молекулы (атомы) расположены в определенном порядке (кристаллы)
- сильное притяжение между молекулами (атомами)
- молекулы (атомы) колеблются около определенной точки.
Жидкость
- принимает форму сосуда, в котором находится
- легко меняет свою форму
- сохраняет объем (трудно изменить)
- молекулы расположены близко друг к другу
- молекулы не расходятся на большие расстояния
- притяжение между молекулами не очень сильное
- жидкости текучи.
Газ
- не имеют собственной формы и постоянного объема
- полностью заполняют предоставленный им объем
- легко изменяют форму и объем
- молекулы расположены далеко друг от друга
- молекулы почти не притягиваются друг к другу.
Одно и то же вещество может находиться в различных агрегатных состояниях.
Пример агрегатных состояний:
вода – лед (твердое), вода (жидкое), пар (газообразное).

Физика
Кратко первоначальные сведения о строении вещества получают на уроках физики в 7 классе при изучении мельчайших частиц, составляющих основные строительные единицы любого тела. Введение в теорию микроструктур, заложенную еще Ломоносовым, дает представление об атомах и молекулах, которые невозможно увидеть невооруженным глазом из-за их размеров.
Исторические сведения
О том, что любое тело состоит из мельчайших частиц, предполагал еще ученый Демокрит, живший в 460−370 годах до н. э., но его предположение на тот момент больше напоминало сказку. Научную базу этой теории подвел только Ломоносов в XVIII веке, который дал в своих конспектах следующее определение мельчайшим частицам:

Тема о строении вещества в физике получила развитие в работах английского ученого Дальтона. В своих исследованиях он попытался определить величину веса атомов.
При этом Дальтон высказывал собственный взгляд на элементарные частицы, считая, что все тела состоят из одних атомов, которые объединяются между собой в сложные структуры.
Только в XIX теория атомно-молекулярное строение вещества приняла официальный характер и начала новую главу в физике.
Атомно-молекулярное строение
Молекула представляет собой мельчайшую частицу, обладающую всеми химическими свойствами этого элемента. Строение вещества определяется расположением элементарных частиц. Каждая молекула состоит из атомов. Их состав и определяет характеристику вещества.
Каждый атом включает в себя положительно заряженное ядро и вращающиеся вокруг него отрицательные электроны.
Научные опыты показывают, что масса молекул колеблется в пределах 10 -23 —10- 26 кг. Это настолько малая величина, что увидеть частицу можно только под электронным микроскопом. При этом молекулы обладают уникальным свойством: они абсолютно одинаковые, если принадлежат одному веществу.
Агрегатные состояния вещества
При изучении основных положений о строении вещества в 7 классе на уроках физики им даются четкие определения, которые затем можно использовать в рефератах на эту тему. Основной принцип: любое из них состоит из элементарных частиц, расположенных на разных расстояниях. Это означает, что между молекулами существуют промежутки. Их величина зависит от агрегатного состояния вещества.

Проще всего понять строение вещества на физике в 7 классе по таблице:
| Агрегатное состояние | Расположение в пространстве молекул | Особенности движения | Расстояние между соседними молекулами |
| Твердое | Существует определенный порядок | Идет колебание без перемещения | Малое расстояние, меньше диаметра молекулы |
| Жидкое | Хаотичное | Идут колебания с перемещением | Расстояние меньше, чем размер молекулы |
| Газообразное | Хаотичное | Постоянно происходят удары и перемещения | Большое расстояние, на этом отрезке может расположиться множество молекул |
В природе вещества встречаются во всех трех агрегатных состояниях. Каждые их них имеют свои характеристики.
Твердые тела
Следует знать, что в твердых телах молекулы расположены близко друг к другу. При этом они лишены возможности перемещения. Твердые вещества разделяются на 2 группы:

- Аморфные. Расположение мельчайших частиц ведется в хаотичном порядке. Здесь не прослеживается четкой структуры.
- Кристаллические. В таких телах расположение молекул идет по определенной схеме.
В зависимости от структуры решетки кристаллические твердые тела разделяются на 4 типа. Их описание носит следующий характер:
- Атомные. Мельчайшие частицы в таких веществах прочно связаны между собой. В итоге тела отличаются повышенной прочностью. Примером может служить алмаз.
- Молекулярные. Здесь связи между частицами ослаблены. В результате тела легко подвергаются плавлению. В качестве примера можно привести сахар.
- Ионные. В узлах кристаллической решетки таких тел находятся положительно и отрицательно заряженные частицы. Связываются они между собой при помощи электростатического притяжения. К таким веществам относятся хорошо растворимые в воде кислоты и щелочи.
- Металлические. Здесь в узлах кристаллической решетки располагаются положительные ионы. Между ними свободно перемещаются отрицательные электроны. Поэтому такие тела хорошо проводят электрический ток и тепловую энергию.
Кристаллическое строение вещества относится к устойчивой структуре. Причина состоит в том, что в ней присутствует небольшое количество потенциальной энергии.
Особенности жидкости
Молекулы жидкости не составляются такую же четкую структуру, какая существует в твердых телах. При этом они располагаются достаточно близко друг к другу. Расстояние между частицами является величиной постоянной. Это обеспечивается достаточно высокой молекулярной связью. Однако ее силы недостаточно, чтобы молекулы находились в статическом положении на протяжении длительного времени. В результате происходит их перескакивание в другие места. Как результат, жидкость обладает свойством текучести.
Самая распространенная в природе жидкость — это вода. Однако в зависимости от типа мельчайших частиц существуют другие разновидности жидких веществ:
- Атомарные. В их состав входят атомы и сферические молекулы. Примером служит метан.
- Двухатомные. Их состав состоит из двух одинаковых атомов. Сюда относится ртуть, жидкий водород.
- Полярные. Состоят из полярных молекул. Пример — жидкий бромводород.
- Ассоциированные. Между частицами присутствуют водородные связи. Это обычная вода.
Благодаря особенностям внутренней структуры жидкости способны растворять в себе некоторые вещества.
Газообразная структура

В газообразных телах молекулы располагаются на больших расстояниях друг от друга. В результате между ними не наблюдается взаимодействия. Если газ поместить в закрытый сосуд, то он быстро распространится по всему объему. Из-за большого расстояния между мельчайшими частицами газообразные тела легко сжимаются.
Некоторые тела обладают возможностью переходить из одного агрегатного состояния в другое. Примером может служить вода, которая при испарении превращается в газ. Особенно быстро этот процесс происходит при ее кипении. В этот период от нее отрываются молекулы, большое количество которых формирует пар.
Существуют твердые тела, растворяющиеся в жидкости. К ним относятся сахар и соль. Все эти процессы происходят благодаря молекулам, которые переходят в другое состояние.
Рассматривая любое тело, находящееся в каком-либо агрегатном состоянии, следует понимать, что основой его являются микроскопические частицы — молекулы и атомы. Только в зависимости от расположения их в пространстве каждое вещество приобретает индивидуальные ему свойства.
Читайте также:

