Стандартный электродный потенциал это кратко
Обновлено: 02.07.2024
Перечень вопросов, рассматриваемых в теме: урок посвящён устройству и принципу работы гальванического элемента и других химических источников тока. Учащиеся получат представление о ряде электродных потенциалов и возможностях его использования.
Гальванический элемент - химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Электрод - электрический проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником — электролитом. В электрохимии — это часть электрохимической системы, включающая в себя проводник и окружающий его раствор
Анод - электрод, на котором происходит процесс окисления
Катод - электрод, на котором происходит процесс восстановления
Аккумулятор - химический источник тока многоразового действия
Топливный элемент - устройство, обеспечивающее прямое преобразования химической энергии в электрическую
Электрохимия - наука, которая изучает закономерности взаимного превращения химической и электрической форм энергии
Ряд стандартных электродных потенциалов - ряд металлов, расположенных в порядке возрастания значения их стандартных потенциалов
Стандартные условия - температура 25 о С, концентрация солей 1моль/л, давление 0,1МПа
Стандартный водородный электрод - электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Химические источники тока
Рассмотрим знакомую нам окислительно-восстановительную реакцию. В раствор сульфата двухвалентной меди опустим цинковую пластинку. Со временем на поверхности цинка образуется красноватая пленка кристаллической меди. Синяя окраска раствора постепенно ослабевает. Это говорит о том, что протекает химическая реакция.
Cu 2+ + Zn = Zn 2+ + Cu
Молекулы воды отрывают ион цинка. Отдавая электроны, цинк является восстановителем. Ион меди – окислитель - принимает электроны. Электроны передаются от цинка к меди в месте соприкосновения металлов.
Давайте немного изменим условия проведения реакции. Цинковую пластинку опустим в сосуд с раствором сульфата цинка. Медную поместим в другой сосуд с раствором сульфата меди. Соединим пластинки с помощью металлического проводника. Теперь на цинковой пластинке идет окисление атомов цинка, а на медной восстанавливаются ионы меди. Электроны для их восстановления передаются теперь не напрямую, а по проводнику. Направленное движение электронов по этой внешней цепи и есть не что иное, как электрический ток.
Таким образом, произошло превращение энергии, полученной в результате химической реакции в электрическую. Устройство, в котором это осуществилось, получило название гальванический элемент.
Металлические пластинки или стержни называются электродами. Электроны перемещаются по внешней цепи от анода (цинка) к катоду (меди).
Образовавшиеся на аноде ионы цинка выходят в раствор и придают ему избыточный положительный заряд. В это же время у катода катионы меди восстанавливаются (принимают электроны), а оставшиеся в растворе анионы SO4 2- заряжают раствор отрицательно. Это препятствует дальнейшему течению процесса.
Чтобы не допустить этого, соединим сосуды стеклянной трубкой, которую заполним раствором хлорида калия с желатином. Теперь анионы будут двигаться в сторону цинка, а катионы – наоборот. Так будет поддерживаться электронейтральность растворов.
Гальванический элемент будет продолжать работу до полного растворения цинкового электрода или до восстановления всех ионов меди.
Теперь наука, которая изучает химические процессы, проходящие под действием электрического тока, а также процессы, в результате которых энергия химических реакций преобразуется в электрическую энергию, называется электрохимия.
Этого недостатка лишены аккумуляторы, которые тоже представляют собой химические источники тока. Они устроены так, что израсходовав в процессе работы материалы электродов и электролит, способны вновь восстановить рабочие свойства после зарядки.
В свинцовом аккумуляторе чередуются решетчатые пластины, заполненные губчатым свинцом и диоксидом свинца. Электролитом служит серная кислота. Во время работы аккумулятора металлический свинец окисляется, а диоксид свинца восстанавливается.
Когда аккумулятор заряжают, то подключают его таким образом, чтобы ток шёл в направлении, противоположном тому, в котором двигались электроны во время работы. Благодаря этому, процессы окисления и восстановления на электродах поворачивают вспять. Теперь протекают обратные реакции, в результате которых снова появляются свинец, диоксид свинца и серная кислота.
Аккумулятор снова готов к работе.
Еще один источник преобразования химической энергии в электрическую – топливный элемент. Он подобен гальваническому элементу с той лишь разницей, что реагенты постоянно поступают в него извне. Поэтому он не разряжается и не требует электричества для повторной зарядки. Примером может служить водородный топливный элемент, перспективный для водородной энергетики.
Ряд стандартных электродных потенциалов
Вернемся к электродам и посмотрим поближе, что происходит там, где металл граничит с раствором.
Молекулы воды поляризованы и способны отрывать ионы металла. Удерживающиеся на поверхности электроны образуют отрицательно заряженный слой. К нему притягиваются из раствора катионы, образуя второй слой - положительный. Возникающую в двойном слое разность потенциалов называют электродным потенциалом, но определить его величину напрямую невозможно.
Однако есть такой электрод, которым пользуются для сравнения электродных потенциалов разных металлов. Он сделан из платины, но называется водородным, потому что водород пропускается через кислоту, в которой находится электрод. Благодаря платине, выступающей как катализатор, часть молекул водорода распадаются на атомы, которые окисляются на границе с кислотой. Одновременно идет и обратная реакция.
Разность потенциалов, возникающая в двойном электрическом слое водородного электрода, условно принимается за ноль.
Потенциал металла, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и температуре раствора, равной 25 о С, называют стандартным электродным потенциалом металла.
Соберём гальванический элемент, соединив электрод из исследуемого металла со стандартным водородным электродом. Электролитом для металлического электрода послужит раствор соли этого металла, а для водородного, как всегда, кислота.
Зная, что электродвижущая сила вычисляется как разность потенциалов двух электродов, и, подставив ноль в случае водородного электрода, мы видим, что измеренная ЭДС и будет потенциалом исследуемого электрода.
Металлы, расположенные в порядке возрастания значений их стандартных потенциалов, составляют электрохимический ряд напряжений металлов или ряд стандартных электродных потенциалов. Еще одно название – ряд активности металлов.
Имея в своем распоряжении ряд напряжений, мы можем характеризовать химические свойства металлов:
- Чем меньше значение электродного потенциала металла, тем больше его восстановительная способность;
- Каждый металл, начиная с магния, вытесняет все следующие за ним металлы из растворов их солей (это касается металлов, не взаимодействующих с водой);
- Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (кроме азотной).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на использование электрохимического ряда напряжений металлов
Условие задачи: Учитель загадал металл и дал ученикам три подсказки:
- из соли ртути он вытеснит ртуть;
- но не вытеснит водород из растворов кислот;
- вам отгадать поможет вполне таблица, висящая на стене.
- Конечно, это ___, - засмеялись ученики, - только один металл подходит под ваше описание.
Вставьте в текст название металла.

Шаг второй: находим металлы левее ртути, т.к. они вытесняют ртуть из растворов солей.
Шаг третий: из выбранных металлов находим те, что расположены правее водорода, т.к. они не вытесняют водород из растворов кислот.
Этим условиям отвечает только один металл – медь.
2. Решение задачи на расчеты по уравнению реакции
Условие задачи: Мастер решил покрыть железную фигурку слоем меди и поместил её в сосуд с раствором медного купороса. Он знал, что на изготовление фигурки было использовано ровно 120 г железа. Когда мастер достал фигурку из раствора, её масса оказалась уже 121,56 г. Сколько граммов меди осело на фигурке?
Шаг первый: Запишем уравнение реакции
Шаг второй: Выразим массу железа через массу меди.
Из уравнения реакции следует, что количество вещества выделившейся меди равно количеству вещества прореагировавшего железа
m(Fe)/56 = m(Cu)/64, тогда
Шаг третий: Рассчитаем массу меди.
Так как масса пластинки уменьшилась на величину массы прореагировавшего железа и увеличилась на величину массы выделившейся меди, можно записать равенство:
В электрохимии стандартный электродный потенциал, обозначаемый E o , E 0 , или E O , является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Содержание
Вычисление стандартных электродных потенциалов
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Fe 3+ + 3e − → Fe(тв) −0.036 В
Fe 2+ + 2e − → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe 3+ + e − → Fe 2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li + имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn 2+ , стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H + (0 В), Cu 2+ (0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H − (−2,23 В), Na + (−2,71 В), Li + (−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔG o должна быть отрицательной, в соответствии со следующим уравнением:
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если E o яч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если E o яч
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:

Величины E 0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Равновесный электродный потенциал
- Электрохимическая ячейка
- Гальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Стандартный электродный потенциал" в других словарях:
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — (нормальный электродный потенциал) потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Стандартный потенциал данного электрода измеряется относительно стандартного (нормального)… … Большая политехническая энциклопедия
стандартный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
Стандартный электродный потенциал — Standard electrode potential Стандартный электродный потенциал. Обратимый потенциал для электродного процесса, где все продукты и реакции находятся на шкале активности, на которой потенциал полуэлемента водорода равен нулю. (Источник: «Металлы и… … Словарь металлургических терминов
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … Википедия
Нормальный электродный потенциал — В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … Википедия
нормальный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
Потенциал электростатический — Классическая электродинамика Магнитное поле соленоида Электричество · Магнетизм Электростатика Закон Кулона … Википедия
СТАНДАРТНЫЙ ЭЛЕКТРОД — (эталонный ЭЛЕКТРОД), в ЭЛЕКТРОХИМИИ ПОЛУЭЛЕМЕНТ, состоящий из других полуэлементов и служащий эталоном. Главным стандартным электродом является водородный электрод платиновый электрод, погруженный в молярный раствор ионов водорода и покрытый… … Научно-технический энциклопедический словарь
Электростатический потенциал — У этого термина существуют и другие значения, см. Потенциал. Классическая электродинамика … Википедия
Окислительно-восстановительный потенциал — (редокс потенциал от англ. redox reduction oxidation reaction, Eh или Eh) мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно восстановительный потенциал выражают в милливольтах (мВ).… … Википедия
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита. Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода). Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом. В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю. В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j 0 )называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙10 5 Па.
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение φ 0 , тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется. Чем больше значение φ 0 , тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Стандартные электродные потенциалы φ 0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li + /Li | –3,05 | Cd 2+ /Cd | –0,40 |
| Rb + /Rb | –2,93 | Co 2+ /Co | –0,28 |
| K + /K | –2,92 | Ni 2+ /Ni | –0,25 |
| Ba 2+ /Ba | –2.90 | Sn 2+ /Sn | –0,136 |
| Ca 2+ /Ca | –2,87 | Pb 2+ /Pb | –0,127 |
| Na + /Na | –2,71 | 2H + /H | 0,00 |
| Mg 2+ /Mg | –2,37 | Sb 3+ /Sb | +0,20 |
| Al 3+ /Al | –1,70 | Bi 3+ /Bi | +0,22 |
| Ti 2+ /Ti | –1,60 | Cu 2+ /Cu | +0,34 |
| V 2+ /V | –1,18 | Ag + /Ag | +0,85 |
| Mn 2+ /Mn | –1,18 | Hg 2+ /Hg | +0,85 |
| Zn 2+ /Zn | –0,76 | Pt 2+ /Pt | +1,19 |
| Cr 3+ /Cr | –0,74 | Au 3+ /Au | +1,5 |
| Fe 2+ /Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
где T – температура, К;
F – число Фарадея, равное 96 500 Кл/моль;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К);
n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
– концентрация ионов металла в растворе, моль/л.
При T = 298 К формула Нернста приобретает вид:
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита. Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода). Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом. В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.

Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю. В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j 0 )называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙10 5 Па.
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение φ 0 , тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется. Чем больше значение φ 0 , тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Стандартные электродные потенциалы φ 0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li + /Li | –3,05 | Cd 2+ /Cd | –0,40 |
| Rb + /Rb | –2,93 | Co 2+ /Co | –0,28 |
| K + /K | –2,92 | Ni 2+ /Ni | –0,25 |
| Ba 2+ /Ba | –2.90 | Sn 2+ /Sn | –0,136 |
| Ca 2+ /Ca | –2,87 | Pb 2+ /Pb | –0,127 |
| Na + /Na | –2,71 | 2H + /H | 0,00 |
| Mg 2+ /Mg | –2,37 | Sb 3+ /Sb | +0,20 |
| Al 3+ /Al | –1,70 | Bi 3+ /Bi | +0,22 |
| Ti 2+ /Ti | –1,60 | Cu 2+ /Cu | +0,34 |
| V 2+ /V | –1,18 | Ag + /Ag | +0,85 |
| Mn 2+ /Mn | –1,18 | Hg 2+ /Hg | +0,85 |
| Zn 2+ /Zn | –0,76 | Pt 2+ /Pt | +1,19 |
| Cr 3+ /Cr | –0,74 | Au 3+ /Au | +1,5 |
| Fe 2+ /Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
где T – температура, К;
F – число Фарадея, равное 96 500 Кл/моль;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К);
n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 10 5 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H 2 [1,01·10 5 Па], Н + [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутся электроны, а в р-ре - положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
-Pt, Н 2 [1,01·10 5 Па]|НС1(а b =l)|AgCl, Ag|Pt +
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
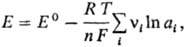
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, а i -термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, v i -стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1 - ). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
С тандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом - по данным о стандартных значениях изменения энергии Гиббса хим. р-ции D G 0 . В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом , а другая-с известным стандартным потенциалом .. Если в условной схеме ячейки 1-й электрод записан слева, то
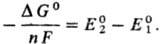

Из ур-ния следует, что стандартные потенциалы, в свою очередь, м.б. использованы для расчета D G 0 и константы равновесия К р-ции (ln К = — D G°/RT). Значения E 0 , рассчитанные на основе значений D G 0 , представлены в таблице; они далеко не всегда м. б. реализованы в электрохим. цепях из-за того, что предполагаемое равновесие электродной р-ции в действительности может не устанавливаться (это характерно для щелочных, щел.-зем. металлов и большинства орг. в-в в водных р-рах).
В неводных р-рителях стандартные потенциалы также определяют по отношению к потенциалу водородного электрода для каждого отдельного р-рителя. Ведется поиск стандартного электрода, потенциал к-рого можно было бы считать практически не зависящим от природы р-рителя, что позволило бы создать единую шкалу электродных потенциалов. В качестве таких электродов предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/ /бис(дифенил)хром(0), потенциалы к-рых из-за большого размера ионов и соотв. малой их сольватации незначительно (по сравнению с потенциалом водородного электрода) зависят от природы р-рителя. Последние два электрода рекомендованы в 1984 ИЮПАК в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения и стандартного состояния исследуемого электрода в системах с расплавами и твердым электролитом в большой мере определяется природой как исследуемого электродного процесса, так и ионного проводника. В широко используемых в качестве электролитов расплавах хлоридов металлов стандартный потенциал берется в хлорной шкале, т. е. в качестве стандартного пользуются хлорным электродом в расплавленном хлориде (графит, Сl 2 [1,01 · 10 5 Па], MC1 z [расплав]), где М-металл (на практике обычно берут смесь хлоридов металла). Активность катионов М z + в индивидуальном расплаве принимается равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый (Pt; Fe, FeO).

ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ,разностьэлектростатич. потенциалов между электродоми находящимся с ним в контактеэлектролитом. Возникновение электродного потенциала обусловлено пространств.

разделениемзарядов противоположного знака на границе раздела фаз и образованиемдвойногоэлектрического слоя. На границе между металлич. электродоми р-ромэлектролитапространств.
разделение зарядов связано со след. явлениями:переносом ионовиз металлав р-р в ходе установления электрохим. равновесия,кулоновской адсорбциейионовиз р-ра на пов-сть металла, смещением электронногогазаза пределы положительно заряженного ионного остова кристаллич.
решетки,специфич. (некулоновской) адсорбциейионовили полярных молекулр-рителяна электродеи др. Последние два явления приводят к тому, что электродный потенциал неравен нулю даже при условиях, когда заряд пов-сти металларавен нулю (см.Потенциалнулевого заряда).Абс.

величину электродного потенциала отдельного электродаопределить невозможно, поэтому измеряют всегда разность потенциалов исследуемогоэлектродаи нек-рого стандартного электрода сравнения.Электродный потенциал равенэдс электрохим. цепи, составленной из исследуемого и стандартного электродов(диффузионный потенциалмежду разными электролитами, обусловленныйразличием скоростей движения ионов, при этом должен быть устранен). Дляводных р-ров в качестве стандартного электродаобычно используют водородныйэлектрод(Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциалк-рого при давленииводорода0,101 МПа и термодинамич.
активностиаионовН+ в р-ре, равной 1, принимают условно равным нулю(водородная шкала электродных потенциалов). При схематич. изображении цепи водородный электродвсегда записывают слева; напр., потенциал медного электродав р-ре солимедиравен эдс цепи Pt, H2|HClCuCl2|Cu|Pt(две штриховые черты означают, что диффузионный потенциална фанице НС1и СuС12устранен).Если исследуемый электроднаходится встандартных условиях, когда активностивсех ионов, определяющих электродный потенциал,равны 1, а давлениегаза(для газовых электродов) равно 0,101 МПа, значениеэлектродного потенциала наз.
стандартным (обозначение E°).Оно связано со стандартным изменениемэнергии Гиббсаи константой равновесияКрэлектрохим. р-ции ур-нием:, где F – число Фарадея; п – число электронов, участвующихв р-ции; R – газовая постоянная; Т – абс. т-ра.

ЗначенияE°электрохим. систем по отношению к водородному электродуи протекающие наэлектродахр-ции сведены в спец. таблицы (подробнее см.
Стандартныйпотенциал).Зависимость электродного потенциала от термодинамич. активностейaiучастников электрохим. р-ции выражаетсяНернстауравнением:
где vi- стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат.

величина, адля продуктов р-ции -положительная.Если через электродпротекает электрич. ток, электродный потенциал отклоняется от равновесного значения из-за конечной скоростипроцессов, происходящих непосредственно на границе электрод- электролит(см. Поляризация).Лит.: Корыта И., Дворжак И., БогачковаВ., Электрохимия, пер.
с чеш., М., 1977; Антропов Л.И., Теоретическаяэлектрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия,М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии,под ред.Б. Б.
Дамаскина, М., 1991.О. А. Петрий.АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ ___ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом.Появление Э. п.

вызвано образованием у поверхности электрода двойного электрического слоя.На практике используют значения так… … Большая политехническая энциклопедияЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— в электрохимии разность электрических потенциалов на границе фаз электрод электролит. На практике пользуются значениями т. н.
относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарьЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарьЭлектродный потенциал— мера способности электрода вступать в реакцию.Между электродом и раствором всегда образуется разность потенциалов.
Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминологияэлектродный потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчикаэлектродный потенциал— [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургииэлектродный потенциал— 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов.

Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документацииЭлектродный потенциал— У этого термина существуют и другие значения, см.Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … ВикипедияЭлектродный потенциал— Electrode potential Электродный потенциал.Потенциал электрода в электролизе измеренный относительно электрода сравнения.
В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи. Он представляет… … Словарь металлургических терминовэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo.atitikmenys: angl. electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynasэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu.
atitikmenys: angl.electrode potential vok. Elektrodenpotential, n rus. потенциал электрода … Penkiakalbis aiškinamasis metrologijos terminų žodynasравновесный (электродный) потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров.Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN equilibrium (electrode) potential … Справочник технического переводчикаНормальный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияСтандартный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияОкислительно-восстановительный потенциал— равновесный Электродный потенциал, характеризующий данную электролитическую среду.

при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду), если… … Большая советская энциклопедияЭЛЕКТРОХИМИЯ— раздел физической химии, изучающий химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока. Предметом электрохимических исследований также являются электролиты и… … Энциклопедия КольераЕ949— Водород / Hydrogenium (H) Атомный номер 1 Внешний вид простого вещества газ без цвета, вкуса и запаха Свойства атома … Википедияцементационный процесс— [electrolitic precipitation] процесс осаждения металлов, основанный на электрохимическом протекании реакции между металлом цементатором и ионом осаждаемого металла, имеющего более положительный электродный потенциал.Цементационный процесс… … Энциклопедический словарь по металлургииЭЛЕКТРООСАЖДЕНИЕ— выделение фазы (металла, сплава, оксида и др.) на пов сти электрода в результате протекания электрохим. р ции.
Э.металлов лежит в основе гидроэлектрометаллургии (см. Электролиз )и гальванотехники. Металлы Au, Ag, Cu, Bi, Pb, Sn, Cd, Co, Ni, Fe,… … Химическая энциклопедияЭЛЕКТРОХИМИЧЕСКИЕ СЕНСОРЫ— устройства, в к рых аналит.

сигнал обеспечивается протеканием электрохим. процесса. Предназначены для качеств.
и количеств. анализа хим. соед.
в жидких и газообразных средах. По сравнению с обычными аналит. приборами отличаются портативностью,… … Химическая энциклопедияВ электрохимиистандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей).

Объёмы чаще всего взяты при 25 °C.Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окислениена аноде (потеря электрона) и восстановлениена катоде (приобретение электрона). Электричествовырабатывается вследствие различия электростатического потенциаладвух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродовпо отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически.

Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Fe3++ 3e−→ Fe(тв) −0.036 В

Fe2++ 2e−→ Fe(тв) −0.44 В
Для получения третьего уравнения:

следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем.

Например, F2имеет 2,87 В, а Li+имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия ГиббсаΔGoдолжна быть отрицательной, в соответствии со следующим уравнением:
где nэто количество молейэлектронов на моль продуктов, а Fявляется постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:

если E o яч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если E o яч
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
-
Таблица стандартных электродных потенциаловВосстановительный потенциалАбсолютный электродный потенциалЭлектрохимический потенциалРавновесный электродный потенциалУравнение НернстаЭлектрохимическая ячейкаГальваническая ячейка
Литература
-
Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry(5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8Atkins, Peter, Jones, Loretta (2005) Chemical Principles(3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-XZu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408Shuttleworth, SJ (1820) Electrochemistry(50th ed.), Harper Collins.
Ссылки
Читайте также:

