Способы получения олова кратко
Обновлено: 07.07.2024
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10-4 до 8·10–3% по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). [1, с. 9]
Получение:[4]
Для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:
SnO2 + 2C → Sn + 2CO
Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
4 Химические и физические свойства [4]
Простое вещество олово полиморфно. Оно существует в двух аллотропных модификациях:
а) β – олово (белое), t > 13,2˚С, мягкое, пластичное, высокая электропроводность, металлический блеск.
б) α – олово (серое), t 2+ /Sn равен –0.136 В, а E пары °Sn 4+ /Sn2 равен + 0.151 В. При комнатной температуре олово устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C.
Диоксид (или двуокись) олова встречается в природе, а также может быть получен искусственно путем сжигания металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта.
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4:
SnCl4 – жидкость, кипящую при температуре 112°С и сильно дымящую на воздухе, растворяется в воде и может быть выделен из раствора в виде различных кристаллогидратов, например, SnCl4∙5H2O.
· Э° + сложные вещества:
Разбавленные соляная и серная кислоты действуют на олово очень медленно, это объясняется большим перенапряжением выделения водорода на поверхности металла. Концентрированные растворы этих кислот, особенно при нагревании, растворяют олово. При этом в соляной кислоте получается хлорид олова (II), а в серной – сульфат олова (IV). Кроме того, при взаимодействии олова с соляной кислотой возможно образование хлороловянных кислот составов HSnCl3.
Концентрированные щелочи также растворяют олово. В таких случаях получаются станниты — соли оловянистой кислоты (H2SnO2):
В водных растворах станниты существуют в гидратированных формах, образуя гидроксостанниты:
Нахождение в природе:
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10-4 до 8·10–3% по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). [1, с. 9]
Получение:[4]
Для добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO2 восстанавливают углем или алюминием (цинком) в электропечах:

SnO2 + 2C → Sn + 2CO
Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
4 Химические и физические свойства [4]
Простое вещество олово полиморфно. Оно существует в двух аллотропных модификациях:
а) β – олово (белое), t > 13,2˚С, мягкое, пластичное, высокая электропроводность, металлический блеск.
б) α – олово (серое), t 2+ /Sn равен –0.136 В, а E пары °Sn 4+ /Sn2 равен + 0.151 В. При комнатной температуре олово устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C.
Диоксид (или двуокись) олова встречается в природе, а также может быть получен искусственно путем сжигания металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта.
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4:
SnCl4 – жидкость, кипящую при температуре 112°С и сильно дымящую на воздухе, растворяется в воде и может быть выделен из раствора в виде различных кристаллогидратов, например, SnCl4∙5H2O.
· Э° + сложные вещества:
Разбавленные соляная и серная кислоты действуют на олово очень медленно, это объясняется большим перенапряжением выделения водорода на поверхности металла. Концентрированные растворы этих кислот, особенно при нагревании, растворяют олово. При этом в соляной кислоте получается хлорид олова (II), а в серной – сульфат олова (IV). Кроме того, при взаимодействии олова с соляной кислотой возможно образование хлороловянных кислот составов HSnCl3.
Концентрированные щелочи также растворяют олово. В таких случаях получаются станниты — соли оловянистой кислоты (H2SnO2):
В водных растворах станниты существуют в гидратированных формах, образуя гидроксостанниты:

В промышленных масштабах оловянные руды добываются лишь в 13 странах мира, где лидирующие позиции занимают Китай и страны Юго-Восточной Азии. Оловоплавильные заводы размещаются, как правило, в непосредственной близости от мест добычи сырья, причём в последние годы резко возросла морская добыча оловянных руд в странах Юго-Восточной Азии.
Общемировое производство металлического олова составляет более 270 тыс. тонн. В 2006 году только на долю пяти стран — Китая, Индонезии, Перу, Боливии и Бразилии приходилось более 90% производства металлического олова.
Свойства олова
При вступлении в химическую реакцию, проявляется полиморфизм. На открытом воздухе и водной среде поверхность олово быстро покрывается оксидной пленкой, которая защищает материал от коррозийного воздействия. Имеет несколько его структурных форм:
- серый порошок, относится к полупроводникам;
- белое олово является модификацией ковкого металла серебристого цвета;
- твердое, белого цвета, достаточно хрупкое.
Олово без проблем вступает в реакции с неметаллами, при этом достаточно проблемно взаимодействует с серной и соляной концентрированными кислотами. Если кислоты разбавляются, то реакции с металлом не произойдет. С азотной кислотой взаимодействует по-разному, результатом реакции может стать нитрат или кислота олова.
На щелочные элементы реагирует только при сильном нагревании. При контакте с кислородом могут быть образованы несколько оксидов, имеющих степени окисления 2 или 4. Металл выступает основой для всего класса оловоорганических соединений.
Роль олова в организме человека
Роль олова на происходящие в организме человека процессы не изучена в полном объеме, но уже понятно, что этот микроэлемент:
- активизирует рост тканей и органов в детском возрасте;
- отвечает за правильное формирование и развитие скелета;
- входит в состав желудочного фермента гастрина;
- принимает участие в выработке желчных кислот;
- участвует в выработке флавиновых ферментов, которые являются переносчиками водорода в цепи окисления.
Концентрация этого элемента у человека происходит в костной ткани, сердце, легких, тонком кишечнике и почках. Этот микроэлемент выводится из организма с мочой и желчью.
Разновидности и марки
Природа насчитывает более 20 видов минералов олова. Основным является касситерит, в нем содержится порядка 78,8 % полезного вещества, а станин выступает минералом с наименьшим содержанием олова — до 27,5 %.
Оловянные сплавы используются как антифрикционные материалы. Баббиты в этой отрасли являются наиболее популярными. С их помощью фиксируют необходимые детали машинного оборудования, тем самым снижая инертные потери с трением отдельных элементов. Готовые изделия производятся в виде чушек, анодов или прутков. Классифицируются согласно химическим составляющим компонента, от содержания которых зависит конечная маркировка:
В сплаве О1пч находится наименьшее количество сторонних примесей. В О4 — наоборот, содержание свинца, сурьмы и меди на порядок выше.
Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.

Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.
Трансформация структуры ведет к следующим изменениям:
- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов. Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:

- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 1020 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Добыча оловянной руды
Методы, при помощи которых добывают руду, напрямую зависят от типа и источника. Гораздо легче разрабатываются аллювиальные месторождения. Такие места богаты содержанием мелкозернистого песка, а главным способом извлечения полезных минералов выступает драгирование. Посредством больших многоковшовых драг, оловоносная россыпь поднимается со дна водоемов. Драга – это плавучее устройство, относящееся к категории горно-обогатительных агрегатов, использующее разнообразные функции для гравитационного обогащения.

Также для добычи могут применяться специальные насосы, закачивающие песок. Подобные работы выполняются по следующей технологии:
- месторождение вскрывается механическими приемами;
- водяные струи под сильным напором размельчают руду и отправляют ее к накопителю, расположенному внизу;
- насос подает грязевую суспензию с водной основой в промывную область, на верхнем уровне;
- суспензия проходит через специальные шлюзы, а тяжелый касситерит оседает на дно для дальнейшего отбора, полученный концентрат может содержать до 76 % олова.
К другим местам разработки относятся коренные месторождения. Некоторые случаи предусматривают добычу открытым методом, но зачастую используется наклоненная штольня с непрерывным дренированием воды. Далее щековые дробящие и измельчающие устройства превращают руду в песок. Последующее концентрирование зависит от содержания олова в добытом материале.
Определенные сульфидные компоненты сначала обжигают, а потом выщелачивают за несколько этапов, для отделения других металлов серебра, меди или свинца. После этого руда подвергается гравитационному обогащению. Концентрация олова в коренных месторождениях значительно ниже — от 18 до 60 процентов.
Суточная норма олова в организме человека
Суточной нормой в день для организма взрослого человека считается 2-10 мг олова, токсичной дозой является 20 мг. Каждый день в организм с едой поступает в среднем 50 мг этого элемента, но усваивается только 5% от этого количества, остальное естественным путем выводится с мочой.
Растения могут абсорбировать олово из воздуха. Употребление ягод, растущих возле дороги, может превысить допустимое для организма содержание этого микроэлемента в 20 раз.
Выплавка
Восстановление происходит путем плавления касситерита с углесодержащими материалами в специализированных печах отражательного или шахтового типа. Шахтные печи принято использовать издавна: в них, чередуя, грузят слоями древесный уголь и касситерит. Отражательные устройства являются более современными и распространенными. Топливом выступает каменный уголь, а руда перемешивается с антрацитом и известняковыми породами.
Результат восстановительных работ — шлаки, обогащенные до 25 % оловом. Полученные материалы подвергают дальнейшей обработке, с последующей переплавкой под более высокими температурными режимами. Весь процесс имеет особый контроль со своей технологией, которая строго соблюдается, во избежание получения слишком больших остатков олова в шлаках после вторичной обработки.
Дефицит и переизбыток олова в организме человека

Дефицит и переизбыток олова может приносить здоровью человека вред, поэтому нужно отслеживать его присутствие в организме. Он должен содержаться лишь в необходимых количествах.
Вам наверняка будет интересно почитать о пользе микроэлементов для организма человека.
Недостаток олова в организме человека
В основном олово поступает в организм с едой, поэтому его недостаток у человека встречается крайне редко. Однако, если он не поступает в организм в достаточном объеме, это чревато определенными осложнениями.
Признаками недостатка этого микроэлемента являются:
- нарушенный баланс минералов во внутренних органах;
- выпадение волос;
- нарушение слуха;
- замедление роста.
Переизбыток олова в организме человека
Этот микроэлемент не является особо токсичным, но все же при переизбытке олова в организме человек может испытывать неприятные ощущения. В этом случае олово будет накапливаться в мышцах, костях, печени и почках.
Основными симптомами избыточного количества этого элемента являются:
- головокружения и мигрень;
- плохой аппетит и снижение веса;
- металлический привкус во рту;
- воспаления кожи;
- приступы агрессии и повышенная возбудимость;
- боль в желудке, понос, тошнота;
- гипергликемия (повышенное содержание сахара в крови);
- увеличение печени.
У женщин наблюдается более выраженная чувствительность к переизбытку этого элемента, чем у мужчин. Избыточное количество олова может разрушать нервные клетки, вследствие чего у женщин может развиваться депрессия. Попадая в больших количествах в организм, этот элемент может вызывать пищевые отравления.
Важно! При употреблении сока в жестяных банках необходимо тщательно проверять срок его изготовления. Разрушающиеся со временем стенки тары и нитраты, содержащиеся в напитке, могут быть губительны для организма.
При расположении жилых домов вблизи проезжей части (не далее чем на 500 метров) происходит накапливание в них избыточного количества олова в виде пыли и паров. При этом у человека могут развиваться злокачественные опухоли, в особенности при ослабленном иммунитете.
Жители таких домов должны использовать в рационе больше магния, который отвечает за предотвращение деления и развития раковых клеток. С возрастом активность выведения этого элемента из организма уменьшается, поэтому у людей преклонного возраста он накапливается, провоцируя заболевания легких и уменьшая годы жизни.
Рафинирование добытого материала
Чистота добываемого ресурса напрямую зависит от исходного качества руды. Для получения наиболее качественного олова выполняется рафинирование материалов следующими способами:
- Термический. Подразумевает использование специализированных котлов, где проходит весь процесс очищения. Температура кипения внутри доводится до 300 градусов. Добавление угля или серы, позволяет добиться расщепления железа и меди.
- Электролитический. Процедура выполняется в отдельных электролизных ваннах, где устанавливается необходимое вспомогательное оборудование. Рабочая температура фиксируется на уровне 35 градусов. Олово, полученное таким способом, наиболее чистое.
Использование полупроводниковой техники подразумевает дополнительную очистку путем зонного плавления.

Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
СТРУКТУРА
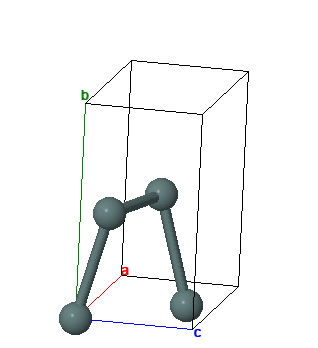
Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок (“оловянная чума”), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
СВОЙСТВА

Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Серое олово является диамагнетиком, а белое – парамагнетиком.
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.
ЗАПАСЫ И ДОБЫЧА

Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
ПРИМЕНЕНИЕ
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Вещество представляет собой пластичный ковкий металл, который легко плавится и поддается пайке. Химический элемент олово — нетоксичное покрытие, трудно поддающееся коррозии. Металл серебристо-белого цвета используется в чистом виде или с примесью других веществ. В основном олово применяется при изготовлении пищевой тары, домашних трубопроводов, припоев в электронике, подшипников и других деталей.

Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.

Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.

Трансформация структуры ведет к следующим изменениям:
- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов. Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:

- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 10 20 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Свойства металла

Олово относится к безопасным для человека веществам. В организм человека оно ежедневно попадает с пищей в минимальных пропорциях (0,25−3,4 мг). В теле содержится около (1−2) . 10 -4 % металла. Самая высокая концентрация выявляется в кишечнике. Регулярное вдыхание паров или воздушных частиц может нанести вред и привести к легочным заболеваниям. Людям, работающим с органическими сплавами олова, рекомендуется надевать защитные костюмы.
Причиной отравления может стать употребление старых консервов, в которых органические продукты реагируют с внутренним покрытием из олова, происходит окисление, при этом выделяется оловянистый водород. Роль вещества в организме человека практически не изучена. Металлическое олово считается нетоксичным для человека, поэтому применяется для покрытия жестяных тар для продуктов.
Физические характеристики
Плотность металла в твердой фракции при обычной температуре (+ 20−22˚С) составляет 7,3 г/см 3 , повышение показателей до температуры плавления олова (+231,8˚С) снижает плотность жидкого металла до 6,97 г/см 3 . Процесс кипения начинается в условиях температуры +2615˚С.
Другие факты:

- Показатель линейного расширения составляет 1,99 . 10 -5 К -1 (при 0˚С), а при температуре +100˚С равняется 2,38 . 10 -5 К -1 .
- Удельная теплоемкость твердого вещества в обычном состоянии — 225 Дж/кг . К, а в жидком —в пределах 269 Дж/кг . К.
- Молярная теплоемкость белого олова — 27,1Дж/моль . К, серой модификации — 25,8 Дж/моль . К.
- Показатель плавления составляет 7,2 кДж/моль.
- Для испарения требуется 296 кДж/моль.
- Удельное сопротивление электричеству — 0,115−0,128 мкОм . м в условиях температуры +25˚С.
Упругость материала снижается при повышении температуры, при 0˚С модуль равен 55 Гпа, а при +100˚С — 48 Гпа. Временное сопротивление на разрыв равняется 20 Мпа, относительное удлинение при этом составляет 40%. Модуль сдвига находится в пределах 16,9−8,2 Гпа.
Химические показатели
Металл проявляет устойчивость к действию окружающего воздуха или влаги в условиях комнатной температуры. Инертность материала объясняется появлением оксидной пленки на поверхности. Олово начинает окисляться на воздухе при увеличении температуры свыше +150˚С. Металл обладает двумя окислительными степенями, +2 и +4. Первая имеет меньшую устойчивость.
Формулы характерных химических реакций:
- Холодная азотистая кислота реагирует с оловом, формула следующая: 4 Sn + 10 HNO 3 = NH 4 NO 3 + 4 Sn (NO 3) 2 + 3 H 2 O).
- В случае нагревания с концентрированной формой HN О 3 используется свойство окисления олова, при этом выделяется осадок с переменной гидратацией — 3 Sn + n H 2 O + 4 HNO 3 = 4 NO + 3 H 2 S n O 3 . n H 2 O.
- Нагревание олова в насыщенном щелочном растворе имеет обозначение по формуле 2 KOH + Sn + 4 H 2 O = 2 H 2 + K 2 (Sn (OH) 6).
Галогенные металлы дают сплавы с содержанием SnX 2 и SnX 4. Первые представляют собой солеобразные растворы с ионами, вторые подлежат водной гидролизации, но могут растворяться в органических жидкостях неполярного типа. При соединении с сухим хлором продуцируется тетрахлорид, который представляет собой жидкость без цвета, растворяющую йод, серу.
Этапы производства
При получении олова рудная порода касситерит дробится в мельницах до появления частиц размером около 1 см. Следующий этап — отделение вещества от пустой породы путем вибрации на гравитационных столах. Затем используется метод очистки и обогащения руды для повышения олова в составе до 45−72%.
Последующий обжиг удаляет мышьяк и серу, а полученный концентрат поступает на обжиг в печи. В жерле древесный уголь укладывается вперемежку с образцами руды и алюминием. Чистый металл полупроводниковой чистоты получают способом расплавления твердых веществ или методом очистки под действием электролиза.
Основные месторождения находятся на юго-востоке Азии и Китае, крупные добычи находятся в Австралии и Америке. Россия славится залежами олова в Хабаровском и Приморском крае, Чукотском АО, Якутии и других регионах.

Нахождение в природе
Чаще всего олово содержится в горных породах в виде рассеянных форм. Но в кислых образованиях руда встречается в виде минеральных вкраплений и залежей касситерита, который является интересным для производства в промышленных масштабах.
Формы содержания вещества в природе:
- минеральные вкрапления;
- окисные соединения;
- коллоидные формы;
- жидкие фазы.

Рассеянные залежи не отличаются конкретной формой содержания. Наблюдается изоморфно разбросанные сульфидные и кислородные сращения. На месторождениях первого вида олово представлено сфалеритами, халькопиритами, пиритами. В результате распада возникают элементы тилита и других минеральных веществ. В России изоморфные рассеивания обнаруживаются в Приморье, например, в Дубровском и Смирновском месторождении.
Минеральные формы
В группу входят самородки и сплавы интерметаллических образований. Концентрации в почве являются низкими, но такие залежи сконцентрированы на широких площадях. Вместе с оловом обнаруживается руда меди, алюминия, железа, не считая характерных самородков серебра, золота и платиноидов.
Эти же элементы участвуют в образовании сплавов олова:
- атакит;
- стистаит;
- звягинцевит;
- штурмылит.
Приведенные образования встречаются в интрузивных породах магния, например, пикритах и траппах в области Сибирской платформы. Габброиды и гипербазиты располагаются в грунтах Камчатки. Гидротермальные и метасоматические породы находятся в составе никелевых и медных руд в бассейнах Урала, Узбекистана, Кавказа. Пелагические осадочные соединения являются результатом Большого Толбачинского извержения.
Окисные соединения
Наиболее распространены в природе в форме касситеритов (Sn O 2), являющихся оксидами олова. Гамма-резонансное исследование показывает присутствие Sn +4 . Соединения включают до 78% олова в форме сплошных вкраплений с отдельными зернами минерала величиной 3−5 мм.
Встречаются формы касситеритов:

- Гидроокисные сплавы представлены в природе осадками полиоловянной кислоты. К ним относят сукулаиты, варламовиты, гидромартиты, гидростаннаты.
- Силикаты находятся в форме малаяитов, стоказитов, пабститов. Первый вид минералов встречается в больших масштабах.
- Сульфидные образования металла представлены серой в сочетании с оловом и являются второй по значению группой для промышленных разработок. Более сложные соединения имеют в составе медь, свинец. В породах чаще других встречаются халькопириты.
- Станнины имеют второе название оловянного колчедана. Минералы широко добываются в Якутии и Приморье. Во многих случаях представляет основу для образования халькопирита.
Касситериты являются отличным материалом для получения чистого олова. В России добываются в Забайкалье, разрабатываются в районах Средней Азии. Мировые бассейны располагаются в Таиланде, Боливии, Малайзии, Китае, Индонезии, Нигерии.
Коллоидные формирования
Кремниево-коллоидные виды играют большую роль в геохимических процессах, хотя их детальное изучение не проводилось. Соединения относятся к вязкой форме выражения коломорфных касситеритов, которые подвергаются кристаллическим преобразованиям. Обнаружена сильная растворимость олова в кремниево-хлористых составах.
Анализ характеристик соединений и их похожесть на Si (OH) 4 показывает способность к получению высокомолекулярного материала (полимера) методом присоединения олигомеров и мономеров к активным молекулам. В результате возникает соединение с замещением анионами хлора и фтора группы ОН. Полимеризация вызывает образование дисперсного геля. Такая форма относится к промежуточным этапам при выделении осадка из гидротермальных веществ.
Жидкая фаза
В газовых и жидких образованиях горных пород выявляются касситериты в категории заключенных минералов. Природные растворы с включением олова почти не анализировались, информация получена после экспериментальных методов исследования.
Виды содержания олова в природных жидкостях делятся на категории:
- Ионные соединения. Их строение изучалось с точки зрения валентных сцеплений и стереохимических сочетаний. Выделяются подкатегории ионов, галогенидов, гидроксильных и сульфидных образований.
- Комплексные формирования. Получаются в результате травления касситеритов в среде с высокой концентрацией фтора или хлора.
Редко встречаются олово — кремниевые и дисперсные гелевые вкрапления в жидкой природной среде. Фундаментом этих форм являются минеральные материалы. Соединения проявляют свойства слабых оснований в кислых породах.
Читайте также:

