Способы получения аминокислот кратко
Обновлено: 02.07.2024
Азотсодержащие соединения – это молекулы, имеющие в строении атомы азота. С помощью инертного газа образуются различные классы органических соединений:
Амины
Амины – аммиачные производные, которые рассматриваются как замещенный продукт водородных атомов на органические радикалы (R).
У аминов так же как и в растворе аммиака проявляются слабые основные свойства. Классифицируются по числу катионов водорода, которые заместили, на:
- первичные (R-NH2);
- вторичные (R-NH-R);
- третичные (N-(R)3).
Амины разделяют по характеру органических заместителей:
- предельные – молекулы без ароматических колец и кратных связей;
- непредельные – в молекулах присутствуют ароматические кольца и кратные связи.
В азоте амина находится внешняя электронная пара, за счет которой способен проявлять себя как основание. Но существуют ионы, являющиеся продуктами замещения на радикал всех водородных атомов – NH4 + .
Когда аминогруппа в ароматических аминах связана с ароматическим ядром, то амины являются более слабыми снованиями по сравнению с аммиаком. Так как неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца, таким образом электронная плотность на атоме азота снижается. Бензольное ядро, обладающее большей энергией ионизации, оттягивает на себя электронную плотность молекулы. В результате основные свойства снижаются в реакциях, например взаимодействия с водой. Так, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Способы получения аминов
Амины сохраняют многие особенности аммиака – запах, растворимость в воде, сильные основные свойства.
- Реакция Гофмана (алкилирование аммиака и его производных)
- R-Hal + NH3 → R-NH2 + HHal
- R-Hal + R ’ -NH2 + NH3 → R-NH-R ’ + NH4Hal
- R-Hal + R-NH-R → N-(R)3 + NH4Hal
- Взаимодействие непредельных аминов со спиртами – способ получения вторичных аминов
- С6H5-NH2 + CH3-OH → С6H5-NH-CH3 + H2O
- Пропускание паров спирта и аммиака над катализатором оксида алюминия при температуре в 30°C
- R-OH + NH3 → R-NH2 + H2O
- Расщепление амидов при взаимодействии с гипохлоридом калия
- R-CONH2 + KBrO → R-NH2 + Cl2 + KBr
- Восстановление нитросоединений в присутствии катализатора в виде никеля, палладия – способ получения первичных аминов
- R-NO2 + H2 → R-NH2 + H2O
Химические реакции аминов
Химические свойства определяются реакционными центрами (РЦ):
- первый РЦ, представляющий собой неподеленную пару электронов на азоте;
- второй РЦ, определяющийся полярностью связи N-H;
- третий РЦ – это бензольное кольцо.
У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия.
I. Основные свойства
Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания.
- Взаимодействие с водой
- R-NH2 + HOH → [R-N + H3]OH -
- Взаимодействие с кислотами
- R-NH2 + HCl → [R-N + H3]Cl -
- R-NH2 + HOSO3H → [R-N + H3]OS - O3H
По сравнению с основностью аммиака, амин проявляет большие основные свойства. Это связано с тем, что индуктивный эффект направлен на аминогруппу и азот становится более активным, т.е. прочнее связывает протон.
Степень проявления основных свойств зависит от величины частичного отрицательного заряда на азоте. Чем он выше, тем сильнее основные свойства.
Предельные первичные амины реагируют с азотистой кислотой с образованием спиртов, азота N2 и воды. Например:
- Признаком этой реакции - выделение азота.
- Реакция является качественной на первичные амины .
- Реакцию проводят поэтапно:
- смешивают амин с раствором соли азотистой кислоты (нитрита)
- добавляют к этой смеси сильную минеральную кислоту. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая потом реагирует с амином:
- R – NH2+ KNO2 + HCl = R – OH + N2 + KCl + H2O
Вторичные амины дают при похожих условиях маслянистые жидкости с характерным запахом, поэтому и название N-нитрозаминами.
Третичные амины с азотистой кислотой не взаимодействуют.
Сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
II. Слабые кислотные свойства
Первичным и вторичным аминам характерен разрыв связи N-H и замещение атома водорода на другие функциональные группы.
- Взаимодействия с металлами
- R-NH2 + Na → R-NH-Na + H2
- Алкилирование (реакция Гофмана) под действием катализатора в виде аммиака
- R-NH2 + R’-Hal → R-NH-R’ + HHal
- Ацилирование
- CH3-COCl + CH3-NH2 → CH3-NH-CO-CH3 + HHal
III. Качественная реакция на амины
Она осуществляется с помощью азотистой кислоты, которую необходимо получить непосредственно в момент реакции.
Амины широко применяют в фармакологической промышленности в препаратах с упрощенной адреналиновой структурой, а также в строительной отрасли в качестве компонента полимерных материалов.
Аминокислоты
Аминокислоты – это органические вещества, которые включают в себя аминогруппу (-NH2) и карбоксигруппу (-COOH). Единая формула аминокислот – (NH2)xR(COOH)y, где x и y принимают значения больше одного.
Аминокислоты – это элементарная структура белков, из которых состоят структуры животного тела. В состав белков входят только α-аминокислоты. На планете Земля 20 аминокислот, общая формула которых H2N-CH(R)-COOH. Эта двадцатка содержит в себе радикалы – углеводородные, кислородсодержащие, серосодержащие, азотсодержащие и ароматические.
Способы получения аминокислот
Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах.
- Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур)
- Cl-R-COOH + NH3 → H2N-R-COOH + HCl
- Воздействие аммиака и цианистого водорода на альдегиды и кетоны
- R-CHO + NH3 → R-CH=NH + H2O
- R-CH=NH + HCN → R-CH(NH2)-CN
- R-CH(NH2)-CN + 2H2O → R-CH(NH2)-COOH + NH3
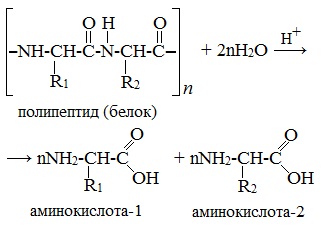
- Взаимодействие белка с водой при добавлении кислоты
- [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-]n + HOH → H2N-CH(R)-COOH + H2N-CH(R’)-COOH
- Добывание аминокислот клеточными организмами
Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.
Химические свойства аминокислот
В составе аминокислот две функциональные группы, поэтому с одной группой веществ они ведут себя как амины, с другой как карбоновые кислоты, а с третьей – проявляют все свойства сразу.
I. Карбоксильная группа – ее химические реакции
Многие химические свойства, характерные для спиртов, встречаются и у аминокислот. Реакции задействуют только группу –COOH.
II. Аминогруппа – ее химические реакции
Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH2.
- Реакции с кислотами
- H2N-CH(R)-COOH + HCl → [H3N + -CH(R)-COOH]Cl -
- Введение ацила в аминокислоту
- H2N-CH(R)-COOH + CH3-COCl → CH3-C(O)-NH-CH(R)-COOH + HCl
- Введение алкильного остатка в состав аминокислоты
- H2N-CH(R)-COOH + 2СH3J → (CH3)2-N(R)-CH(R)-COOH + 2HJ
- Отщепление аминогруппы от аминокислоты под действием температур
- COOH-CH2-CH(NH2)-COOH → COOH-CH2-CH2-COOH + NH3
III. Реакции по обеим группам
Ряд химических свойств связан с действием реактивов на все функциональные группы.
Аминокислоты – это звенья, из которых составляются нити белка. Из них строятся живые ткани на планете. Почти все аминокислоты организм использует для построения органики тела. Некоторые играют роль медиаторов в нервных импульсах, другие используются в химической промышленности для проведения синтезов, третьи – в пищевой отрасли.

Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу — NH 2 и карбоксильную группу —СООН, связанные с углеводородным радикалом.Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа — NH 2 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения. Со щелочами они реагируют как кислоты:

С сильными кислотами- как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:

Ионизация молекул аминокислот зависит от кислотного или щелочного характера среды:

Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R— они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым , т. к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин. Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки —NH—СО—, например:


Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полимамидов.
К ним, кроме названного выше синтетического волокна капрона, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды альфа-аминокислот называются пептидами . В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды . В таких соединениях группы —NH—СО— называют пептидными.
Изомерия и номенклатура аминокислот
Изомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы, например:

Широко распространены также названия аминокислот, в которых положение аминогруппы обозначается буквами греческого алфавита: α, β, у и т. д. Так, 2-аминобутановую кислоту можно назвать также α-аминокислотой:
Большинство аминокислот можно получить в результате химических реакций или при гидролизе белков.
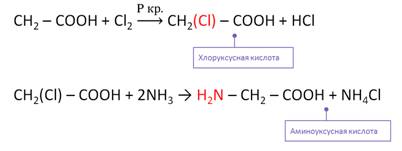
1. Из карбоновых кислот через их галогенопроизводные в радикале
Галогенирование карбоновых кислот
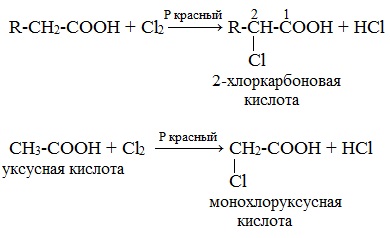
Взаимодействие α-галогенкарбоновых кислот с избытком аммиака (аммонолиз)
На второй стадии происходит замещение атома галогена в галогенкарбоновых кислотах на аминогруппу. Выделяющийся при этом хлороводород связывается избытком аммиака в хлорид аммония:
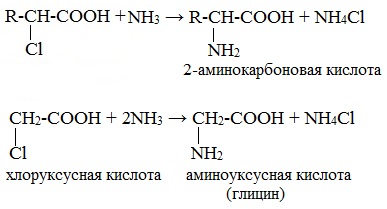
2. Гидролиз пептидов и белков
α-Аминокислоты образуются при гидролизе пептидов и белков.
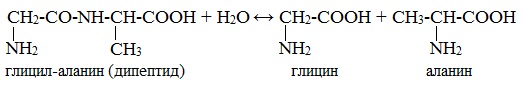
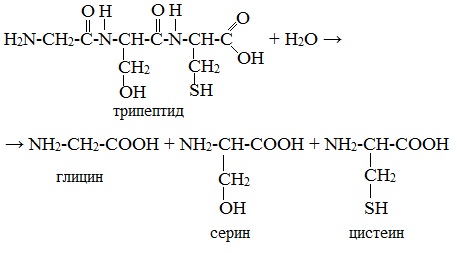
При гидролизе белков обычно образуются сложные смеси α-аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
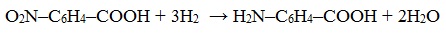
4. Микробиологический синтез
Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде в процессе жизнедеятельности определенную α-аминокислоту.
Природные аминокислоты можно разделить на следующие основные группы:

- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| α-Аминомасляная кислота | β-Аминомасляная кислота |
 |  |
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |

1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |

3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |

5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |

6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
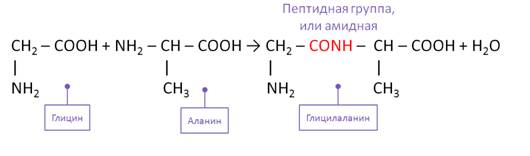
| Например, г лицин реагирует с аланином с образованием дипептида (глицилаланин): |

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.

В данном видеоуроке рассматриваются основные физические и химические свойства аминокислот, способы получения аминокислот.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Аминокислоты: свойства и получение"
Рассмотрим физические свойства аминокислот. Аминокислоты – это бесцветные кристаллические вещества; имеют высокие температуры плавления, они хорошо растворимы в воде, но малорастворимы в органических растворителях. Аминокислоты бывают сладковатыми, горьковатыми и безвкусными. Аминокислоты хорошо кристаллизуются и имеют высокую плотность.
Получают α-аминокислоты из α-галогензамещённых карбоновых кислот при взаимодействии с аммиаком. Причём эту реакцию проводят в две стадии. Сначала получают α-галогензамещённую карбоновую кислоту, а на второй стадии при взаимодействии с аммиаком галоген замещается на аминогруппу.
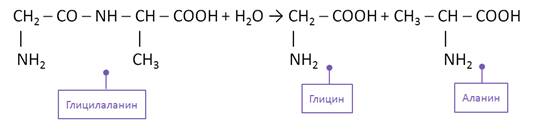
Второй способ получения аминокислот – это гидролиз полипептидов – белков. При этом получается смесь аминокислот. Например, при гидролизе глицил-аланина образуются аминокислоты глицин и аланин.
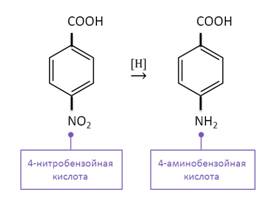
Ароматические аминокислоты получают при восстановлении нитропроизводных ароматических кислот по реакции Зинина. Так, при восстановлении 4-нитробензойной кислоты получается 4-аминобензойная кислота.
Аминокислоты можно получить и микробиологическим синтезом. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α-аминокислоты.
Так как аминокислоты – это бифункциональные соединения, у которых есть карбоксильная и аминогруппы, то для них характерны кислотно-основные свойства. Карбоксильная группа обуславливает кислотные свойства, а аминогруппа – основные. То есть аминокислоты обладают амфотерными свойствами.
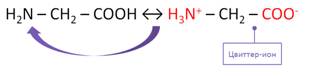
Для аминокислот характерна внутримолекулярная нейтрализация, при этом образуется биполярный, цвиттер-ион.
Аминокислоты электропроводны за счёт образования внутренних солей, при котором происходит перенос протона от карбоксильной группы к аминогруппе.
Рассмотрим химические свойства аминокислот по карбоксильной группе. Аминокислоты будут реагировать со щелочами. Так, в реакции глицина с гидроксидом натрия образуется натриевая соль 2-аминоуксусной кислоты и вода.
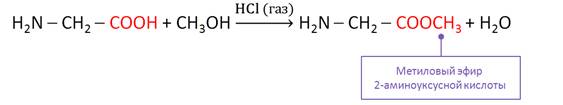
Аминокислоты реагируют со спиртами, при этом образуются сложные эфиры, которые представляют собой летучие вещества. Так, в реакции глицина с метанолом в присутствии газоообразного хлороводорода образуется сложный эфир – метиловый эфир 2-аминоуксусной кислоты.
В реакции аминокислот с аммиаком образуются амиды.
Рассмотрим химические свойства аминокислот по аминогруппе.
Аминокислоты реагируют с минеральными кислотами. Так, в реакции глицина с соляной кислотой образуется соль аминоуксусной кислоты.
Аминокислоты реагируют с азотистой кислотой подобно аминам, при этом образуется гидроксокислота.
Для аминокислот характерны реакции поликонденсации с образованием полипептидов – белков. Так, при взаимодействии двух α-аминокислот образуется дипептид. Например, в реакции глицина и аланина образуется глицил-аланин, который является дипептидом. В результате взаимодействия образуется пептидная группа или амидная группа.
Для аминокислот характерны реакции разложения. Так, при разложении глицина образуются метиламин и углекислый газ.
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам – продукт для получения капрона.

С ионами тяжёлых металлов α-аминокислоты образуют комплексные соли. Например, соли меди двухвалентной имеют голубую окраску и используются для обнаружения α-аминокислот.

Большинство аминокислот являются биологически активными веществами. Так, трипептид глутатион является гормоном, который отвечает за детоксикацию чужеродных соединений в организме человека, а гормон окситоцин – нонапептид, вызывает сокращение мышц.
Таким образом, аминокислоты – это органические соединения, которые содержат карбоксильную группу с кислотными свойствами и аминогруппу с основными свойствами. Аминокислоты взаимодействуют как с кислотами, так и с основаниями, являясь амфотерными веществами. Аминокислоты реагируют друг с другом, образуя пептиды с различным числом остатков аминокислот. Аминокислоты и их производные имеют важное биологическое значение для жизнедеятельности человека.
Читайте также:

