Соли карбоновых кислот кратко
Обновлено: 05.07.2024
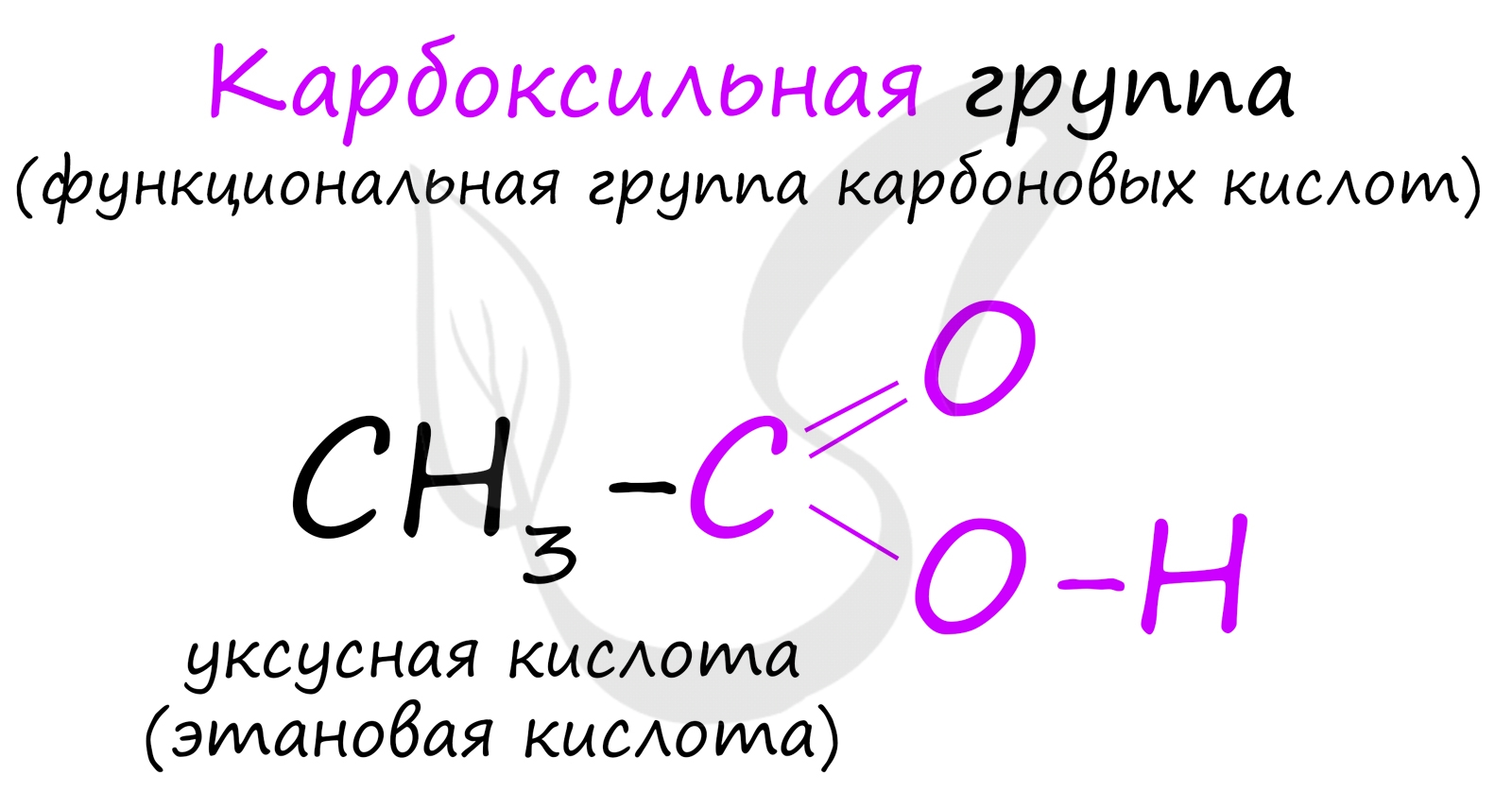
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
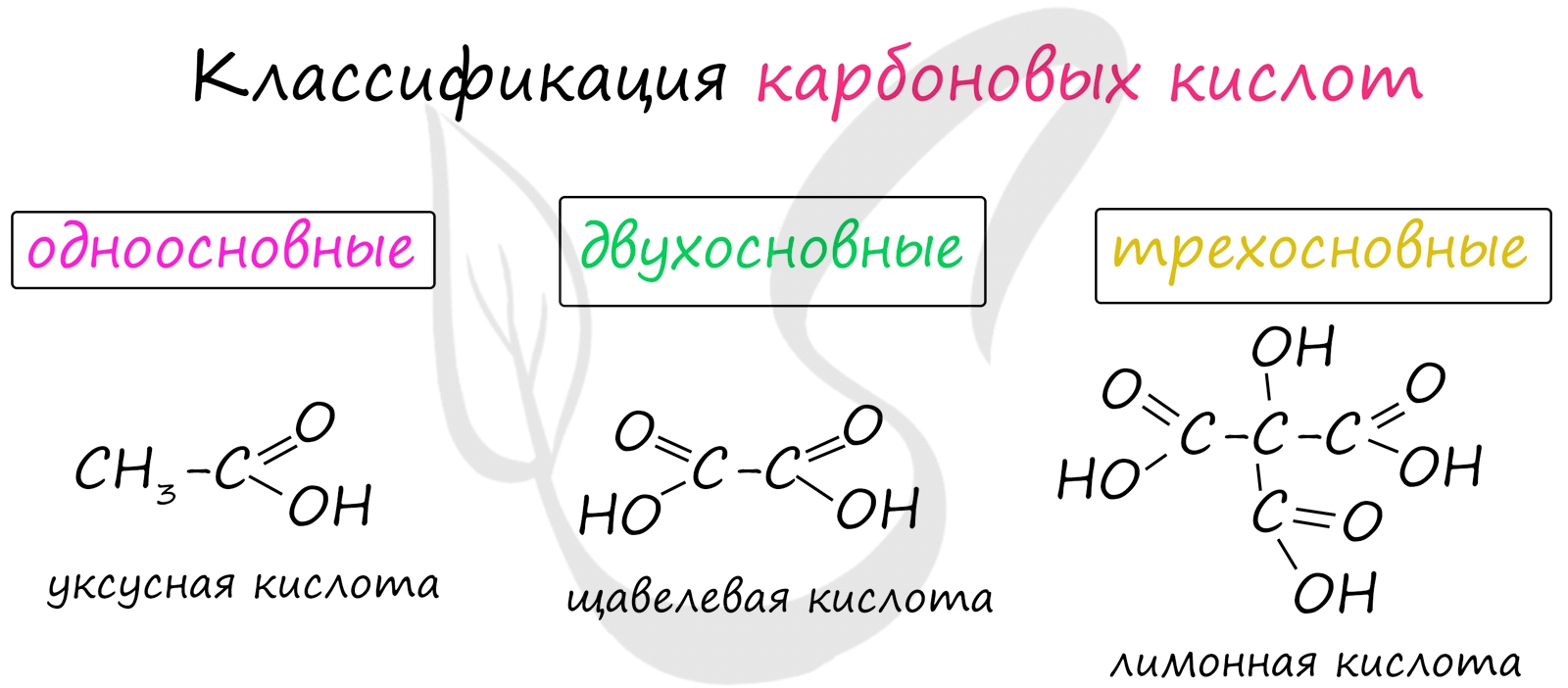
Классификация карбоновых кислот
- Одноосновные - 1 карбоксильная группа
- Двухосновные - 2 карбоксильных группы
- Трехосновные - 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
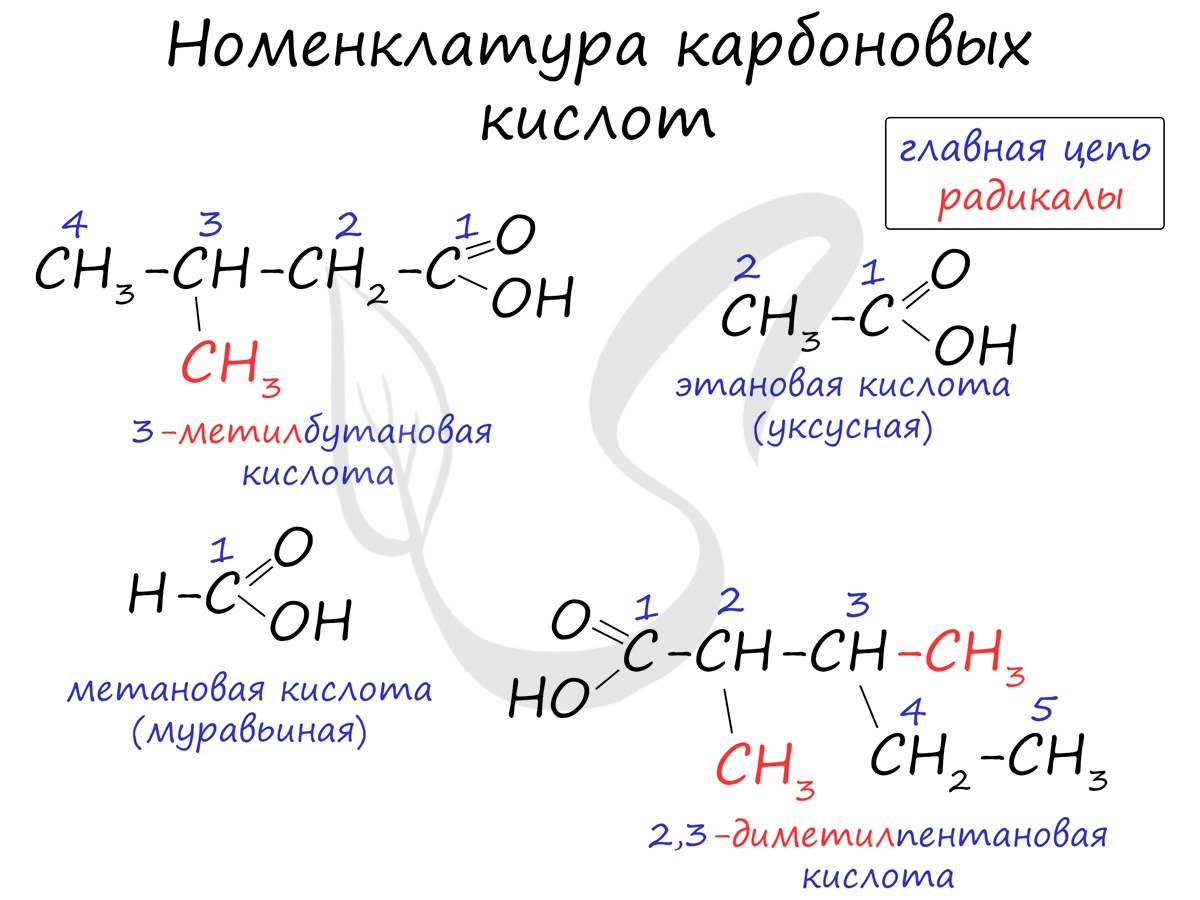
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса "овая" к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
- Метановая - HCOOH - муравьиная кислота
- Этановая - CH3-COOH - уксусная кислота
- Пропановая - C2H5-COOH - пропионовая кислота
- Бутановая - C3H7-COOH - масляная кислота
- Пентановая - C4H9-COOH - валериановая кислота
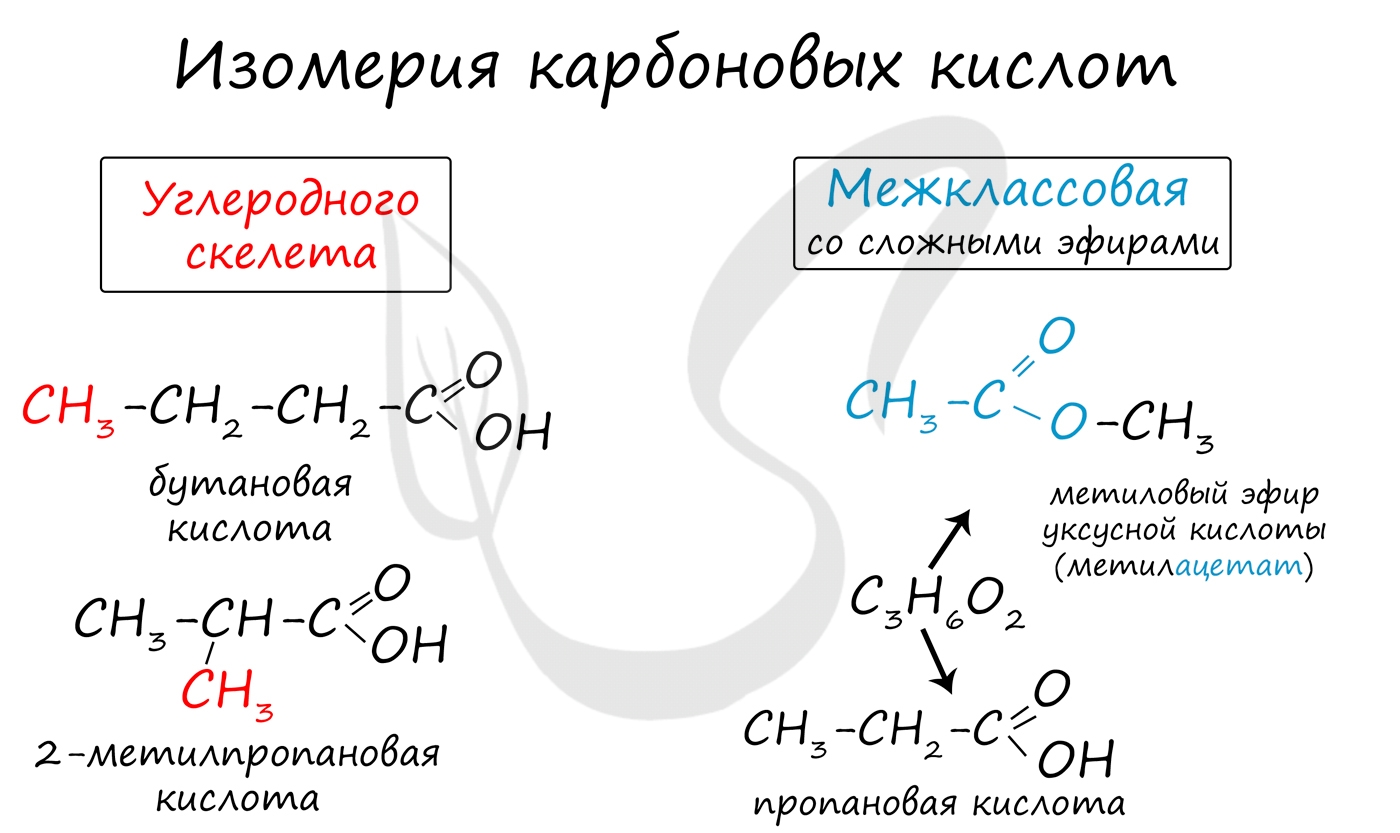
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
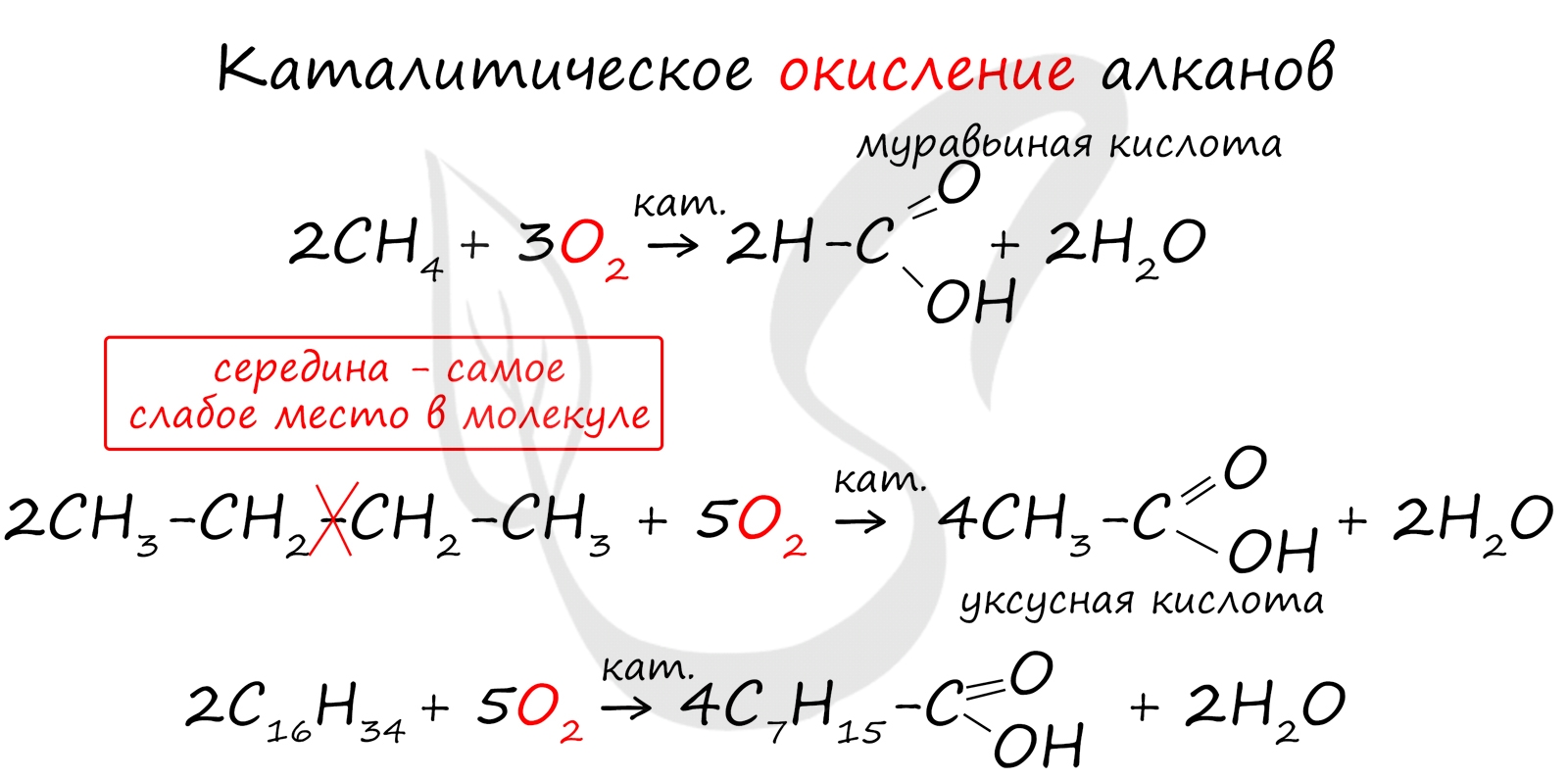
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
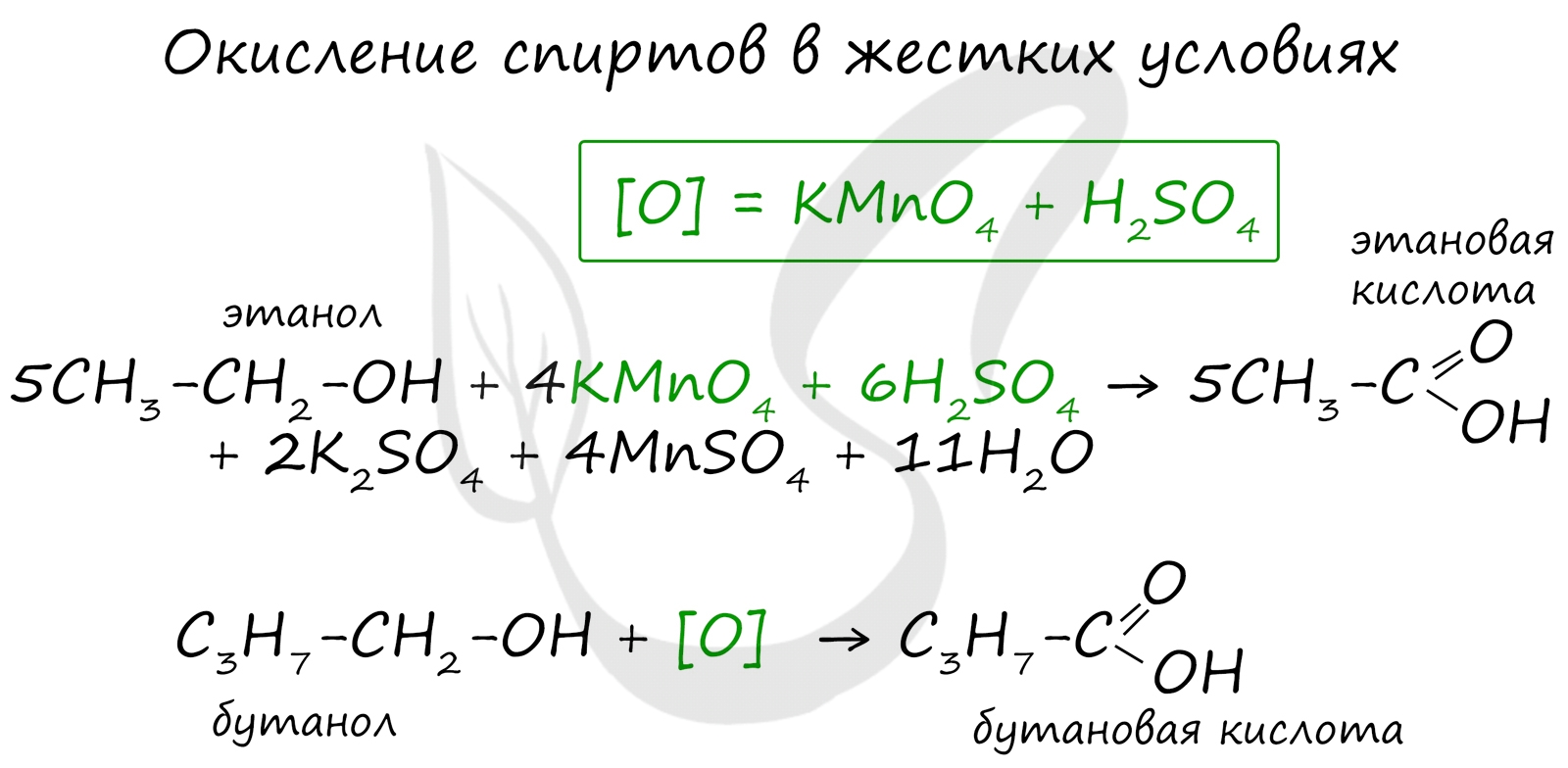
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
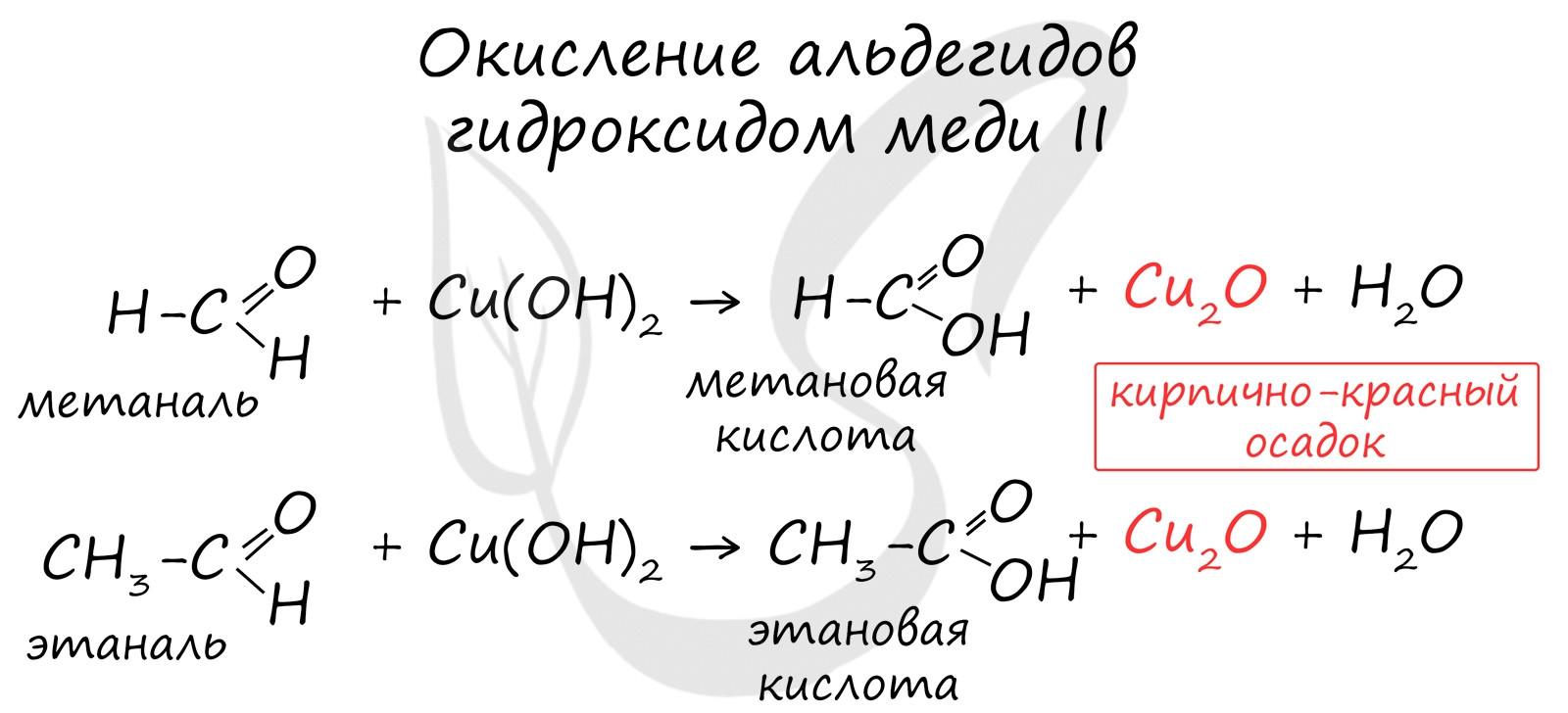
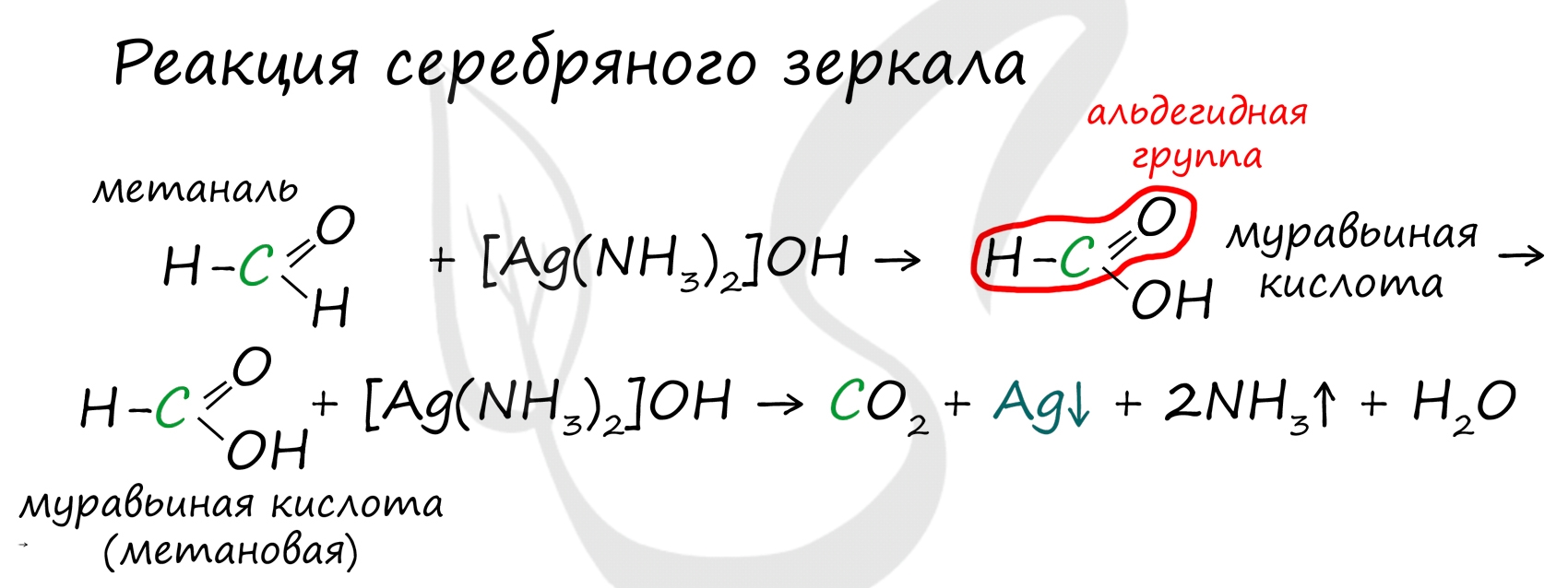
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды - реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом - свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
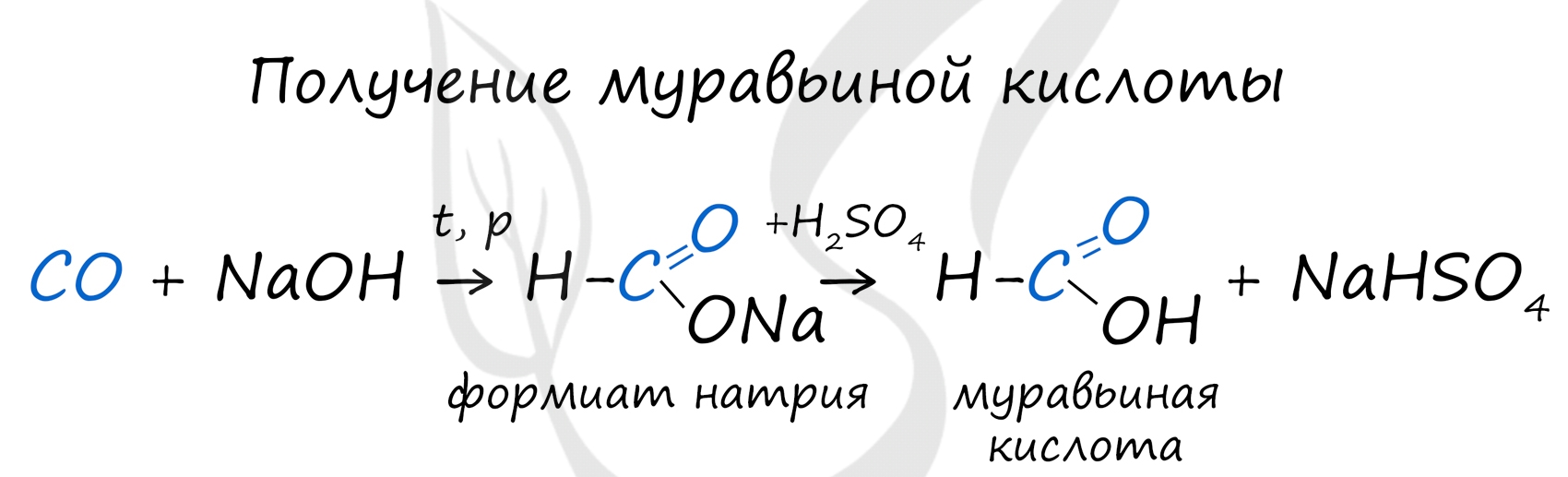
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С - образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
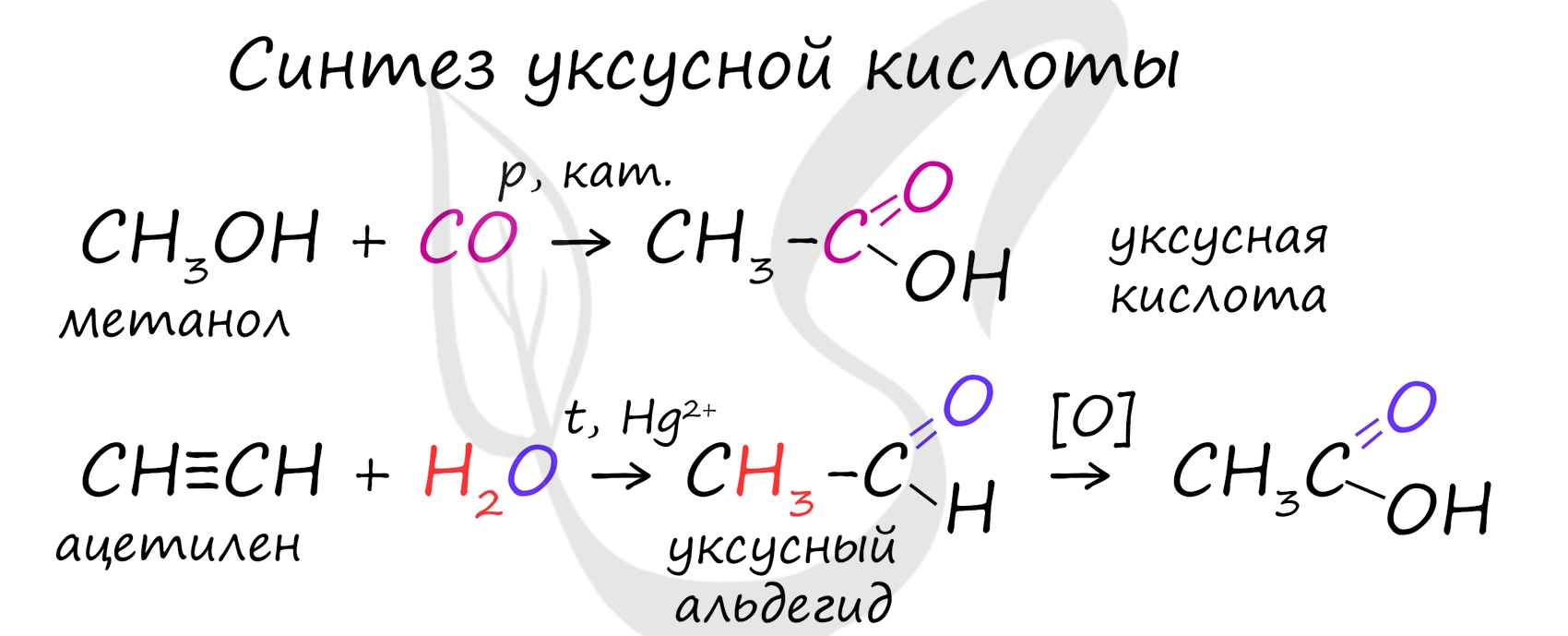
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
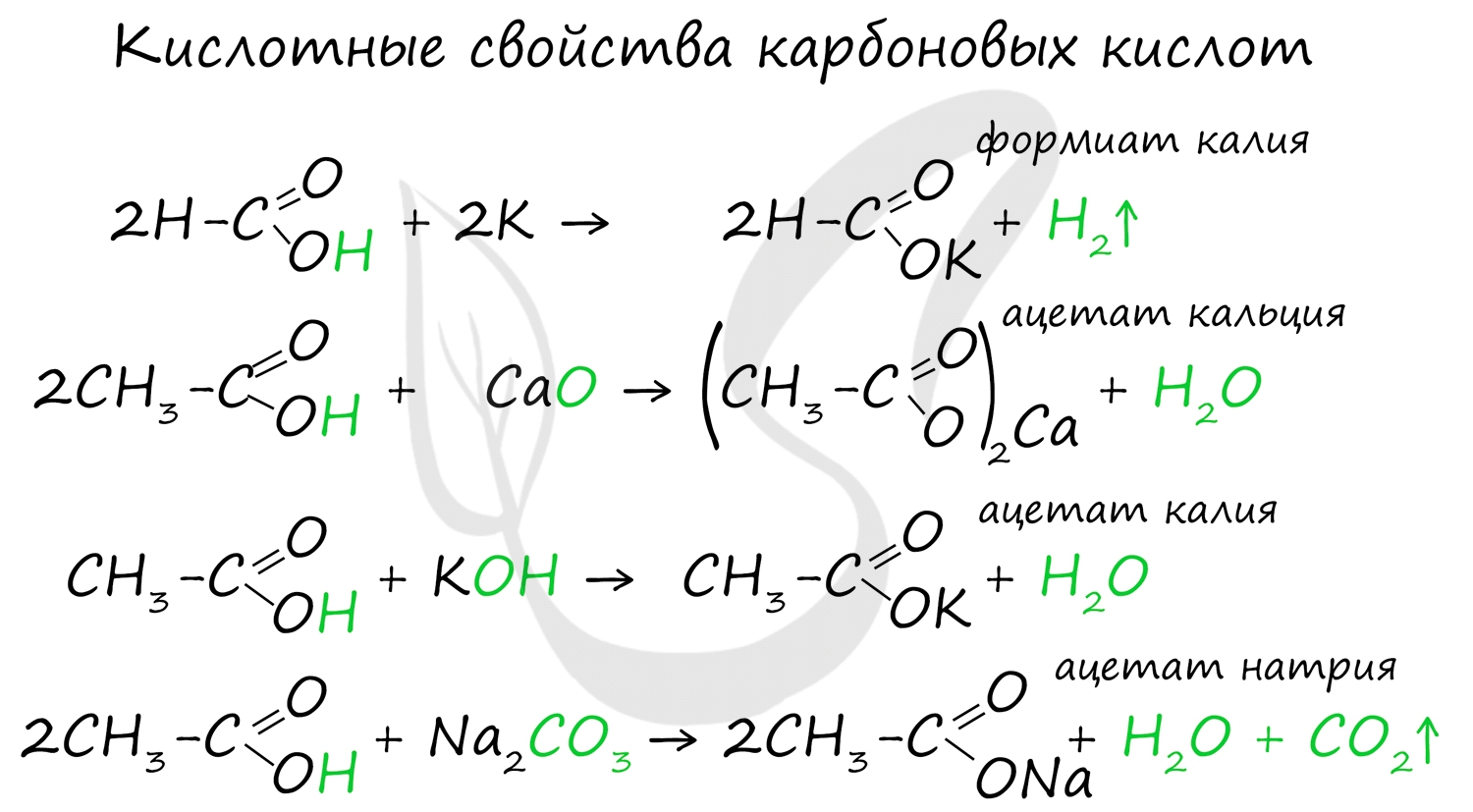
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
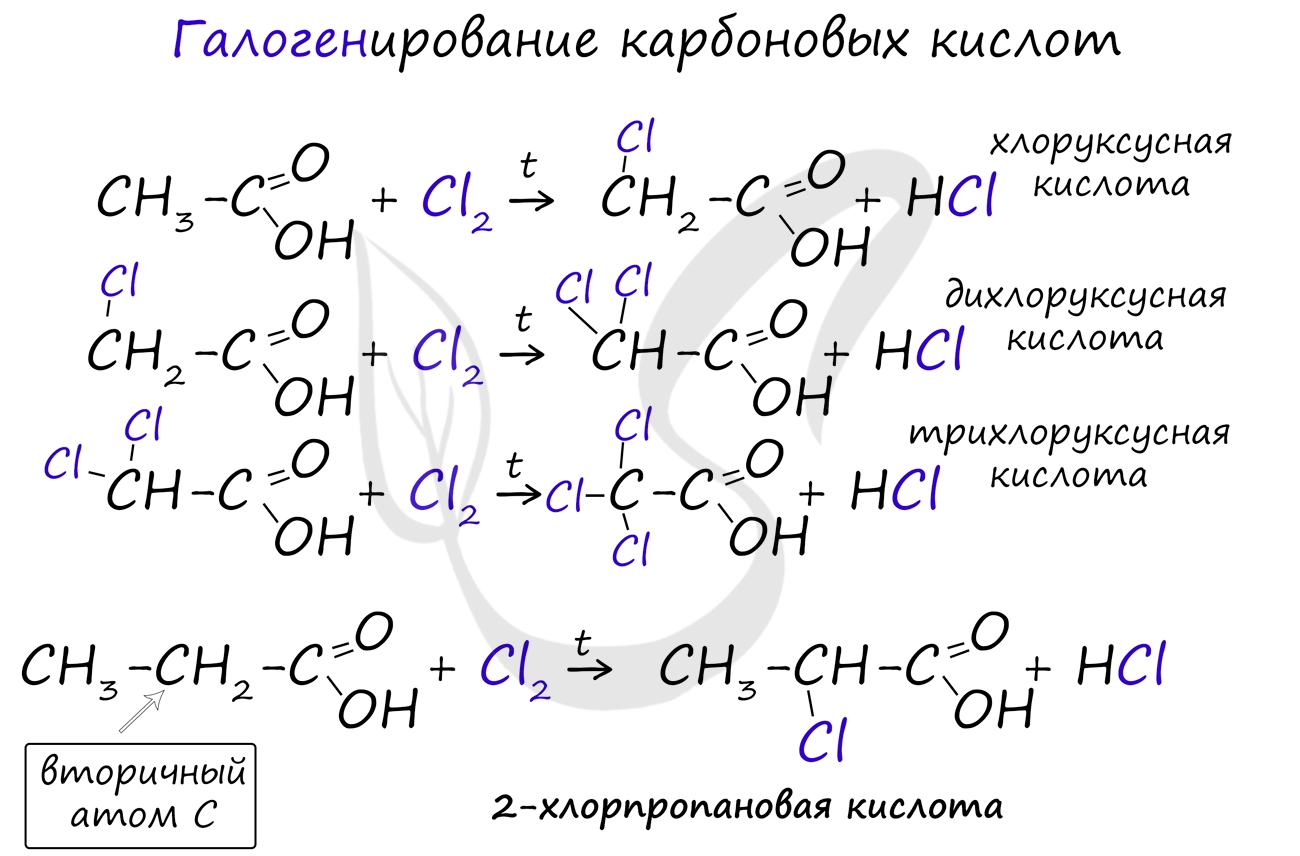
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее - у вторичного, и значительно сложнее - у первичного атома углерода.
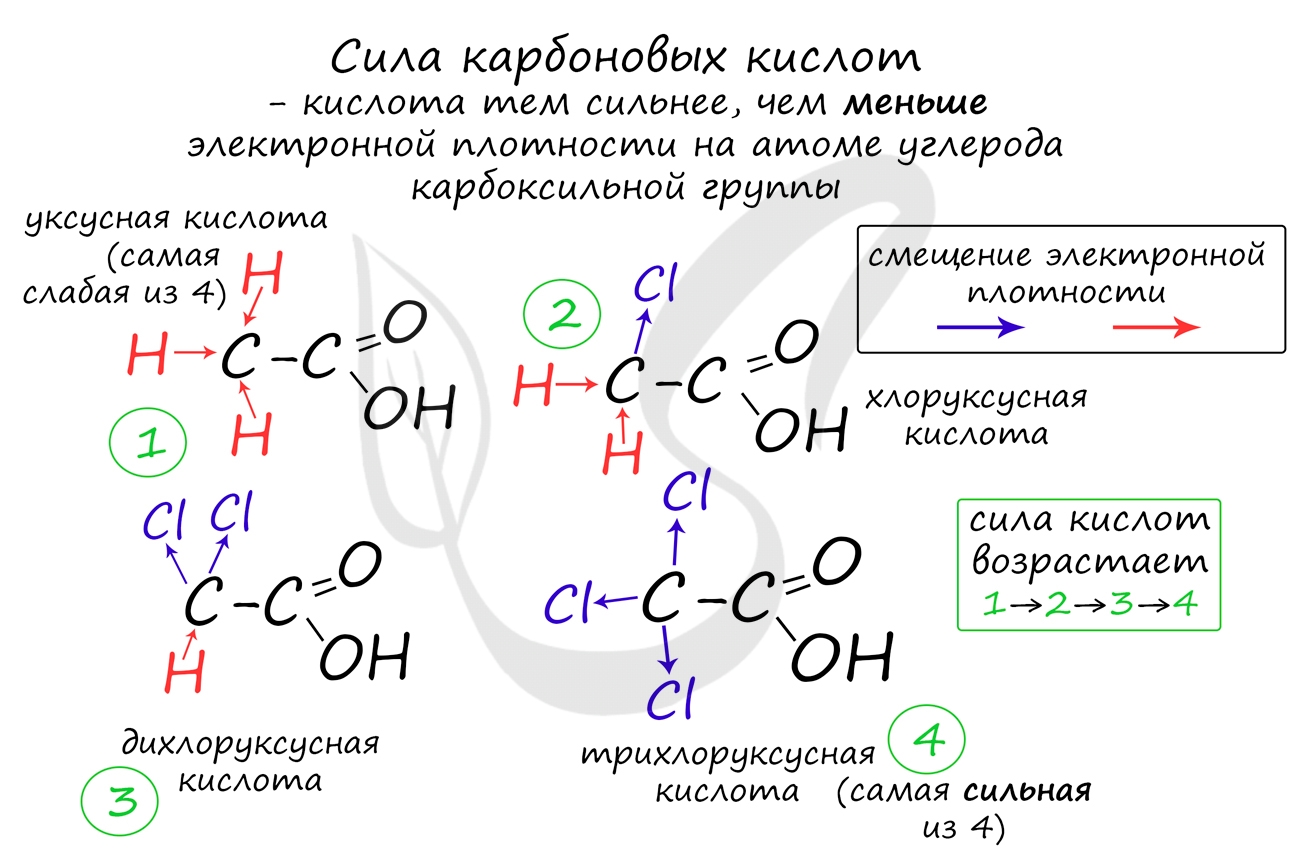
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот - уксусная, чуть сильнее - хлоруксусная, за ней - дихлоруксусная и самая сильная - трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
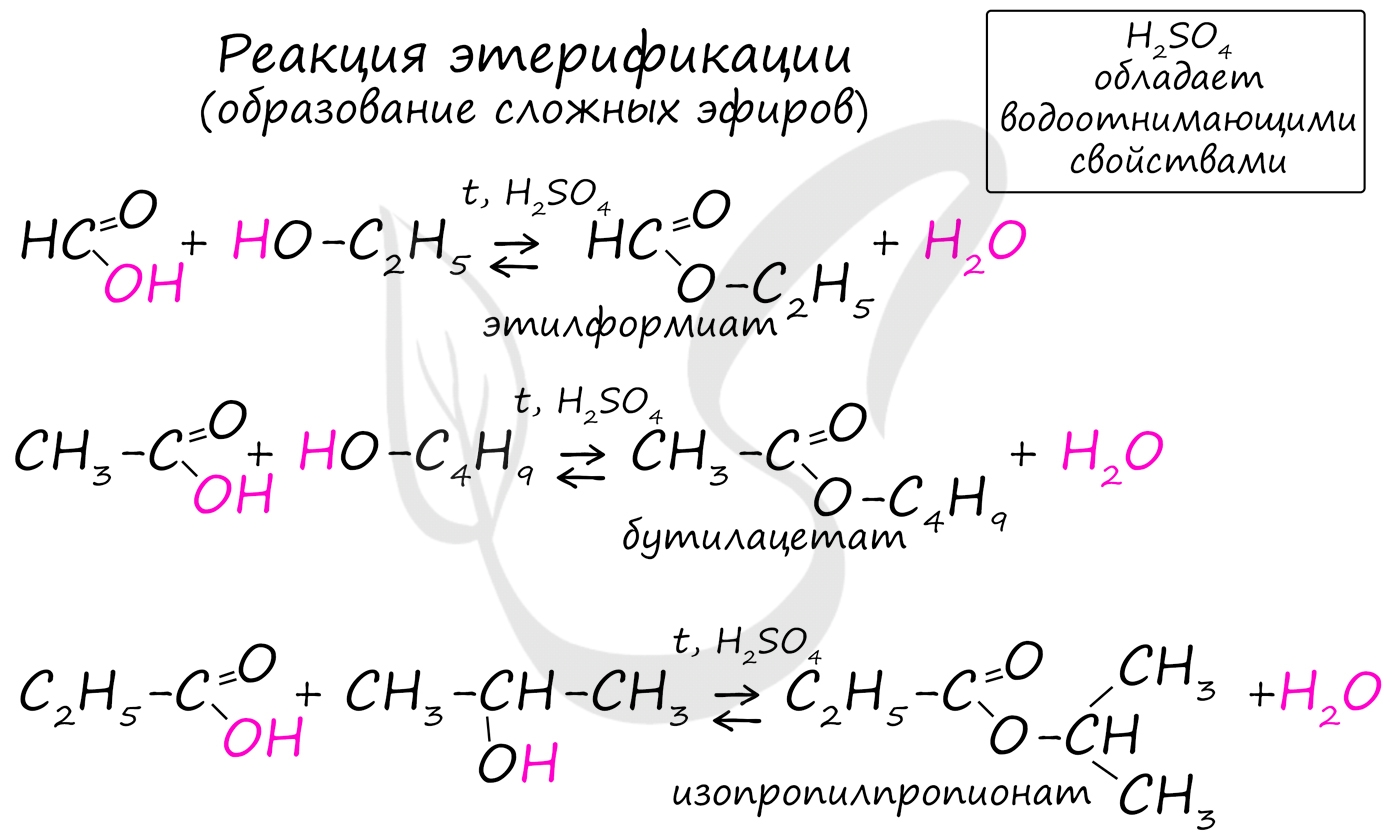
Получение сложных эфиров происходит в реакции этерификации (лат. aether - эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
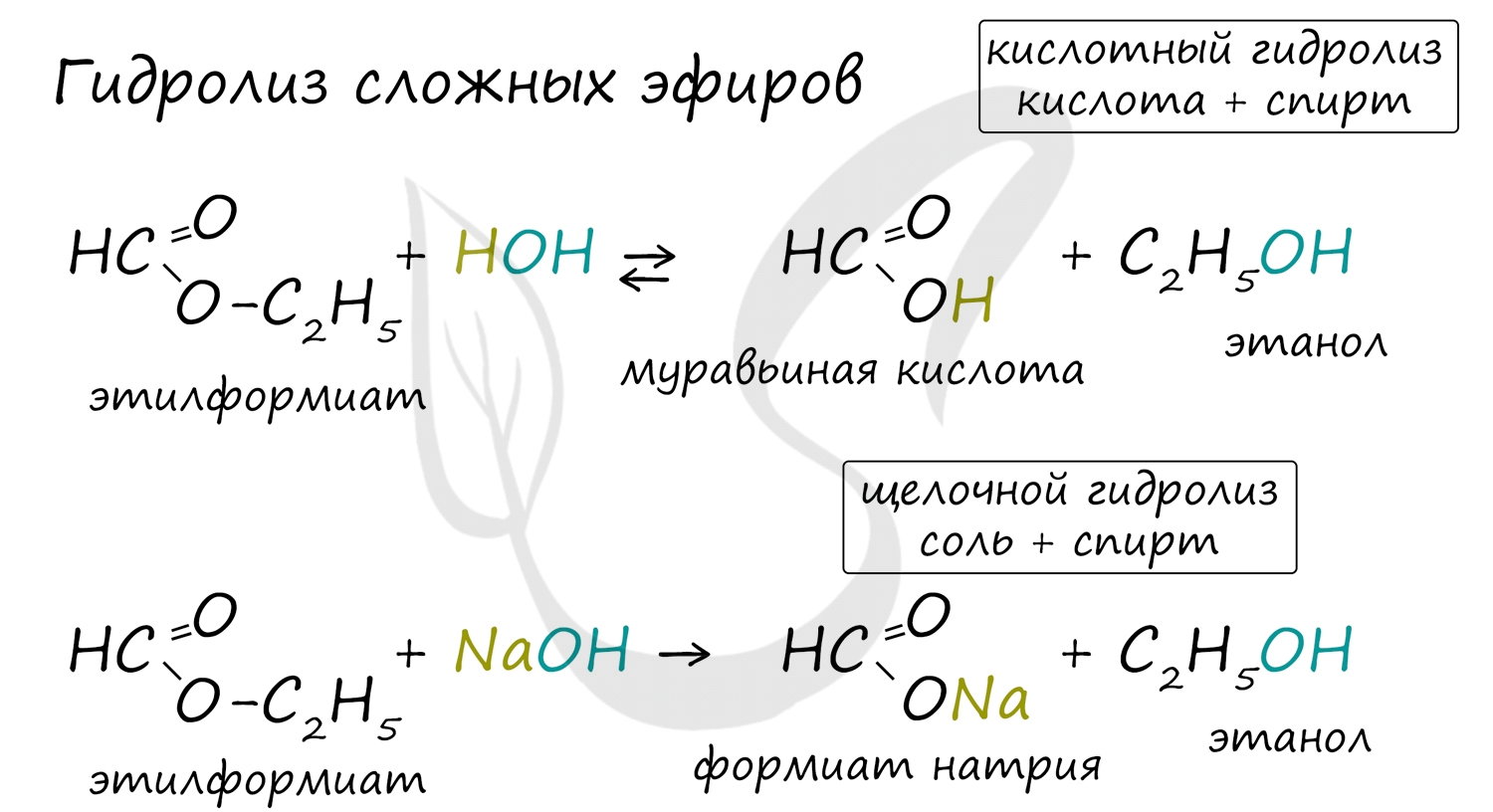
Для сложных эфиров характерной реакцией является гидролиз - их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной - необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды - химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
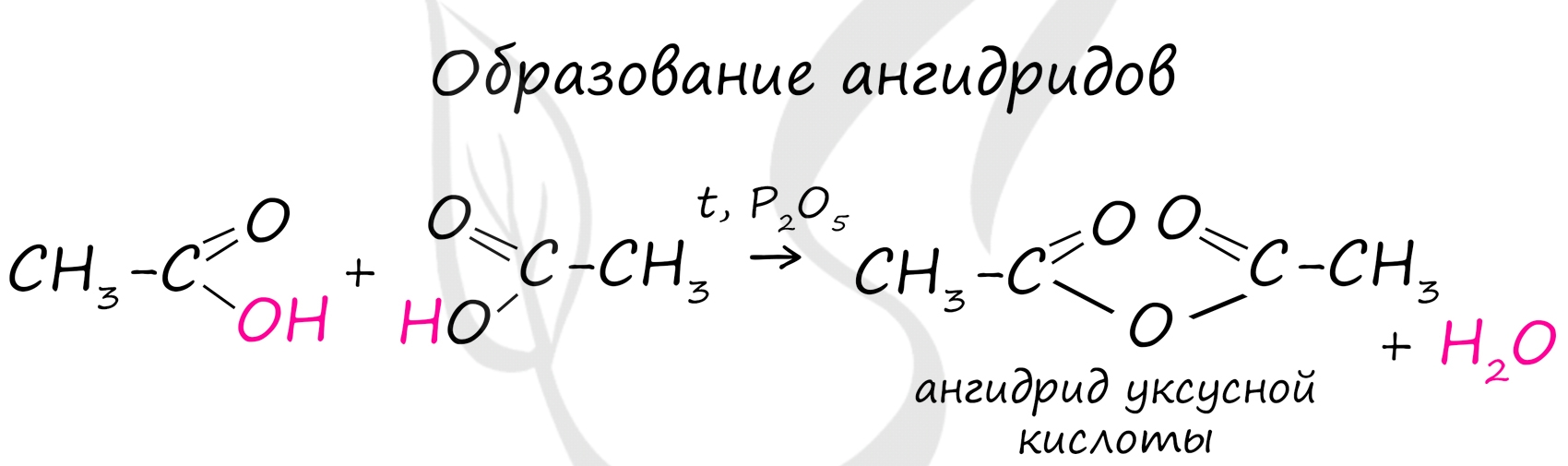
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
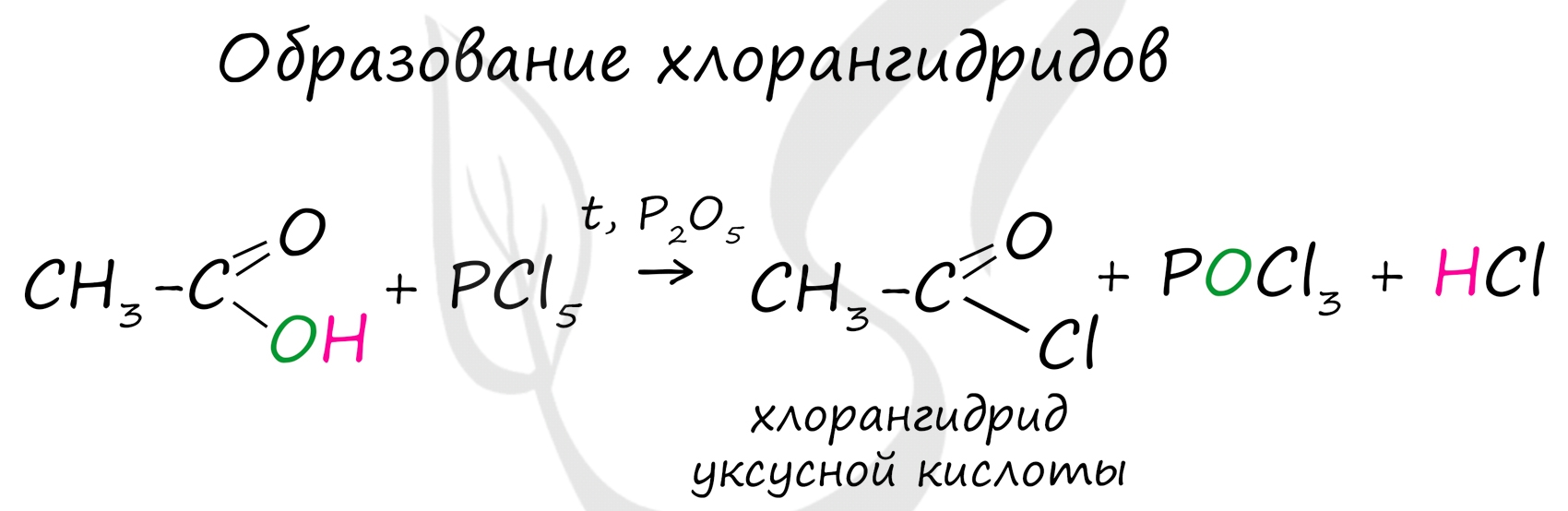
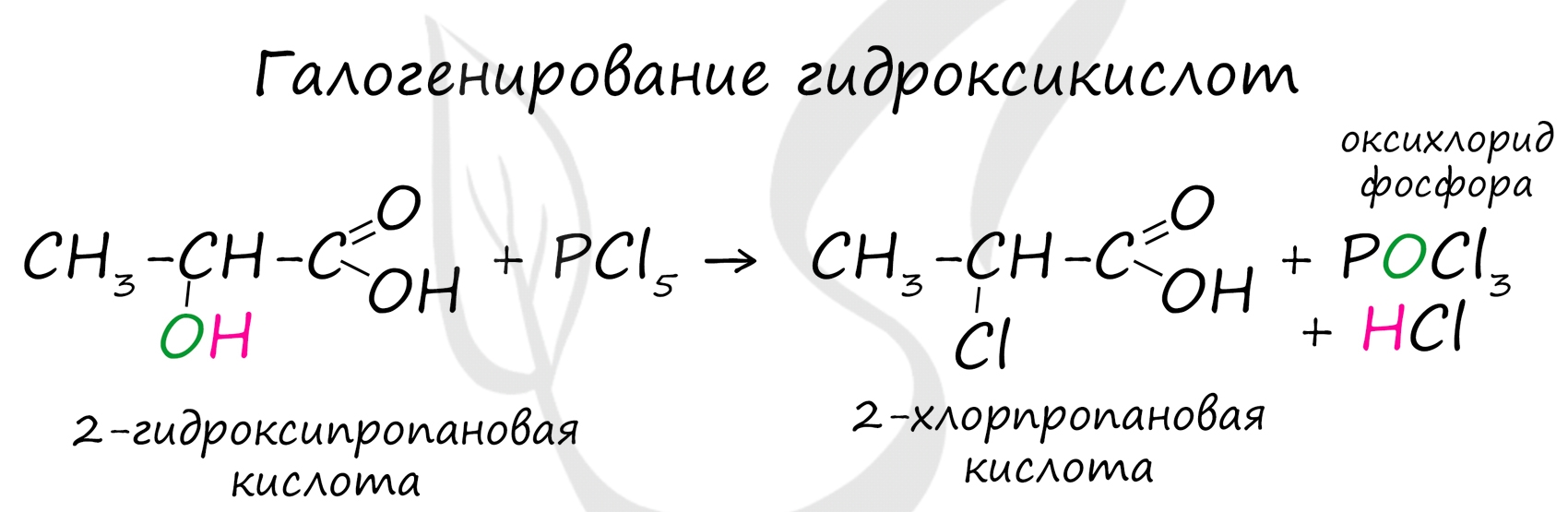
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
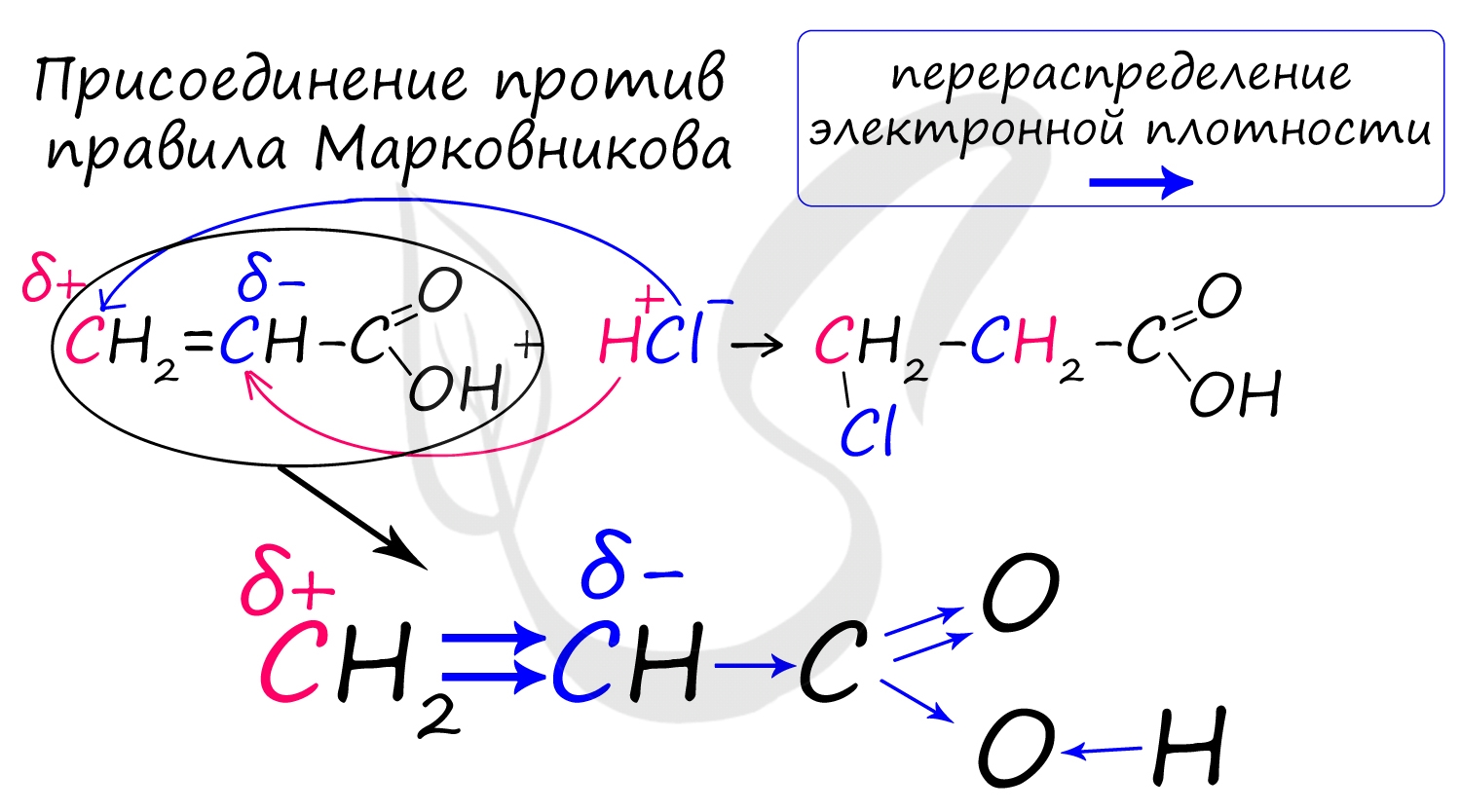
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Практически у всех дома есть уксус. И большинство людей знают, что его основу составляет уксусная кислота. Но что она представляет собой с химической точки зрения? Какие еще органические соединения этого ряда существуют и каковы их характеристики? Попробуем разобраться в этом вопросе и изучить предельные одноосновные карбоновые кислоты. Тем более что в быту применяется не только уксусная, но и некоторые другие, а уж производные этих кислот вообще частые гости в каждом доме.
Класс карбоновых кислот: общая характеристика
С точки зрения науки химии, к данному классу соединений относят кислородсодержащие молекулы, которые имеют особенную группировку атомов - карбоксильную функциональную группу. Она имеет вид -СООН. Таким образом, общая формула, которую имеют все предельные одноосновные карбоновые кислоты, выглядит так: R-COOH, где R - это частица-радикал, которая может включать любое количество атомов углерода.
Согласно этому, определение данному классу соединений можно дать такое. Карбоновые кислоты - это органические кислородсодержащие молекулы, в состав которых входит одна или несколько функциональных группировок -СООН - карбоксильные группы.
То, что данные вещества относятся именно к кислотам, объясняется подвижностью атома водорода в карбоксиле. Электронная плотность распределяется неравномерно, так как кислород - самый электроотрицательный в группе. От этого связь О-Н сильно поляризуется, и атом водорода становится крайне уязвимым. Он легко отщепляется, вступая в химические взаимодействия. Поэтому кислоты в соответствующих индикаторах дают подобную реакцию:
- фенолфталеин - бесцветный;
- лакмус - красный;
- универсальный - красный;
- метилоранжевый - красный и прочие.

Благодаря атому водорода, карбоновые кислоты проявляют окислительные свойства. Однако наличие других атомов позволяет им восстанавливаться, участвовать во многих других взаимодействиях.
Классификация
Можно выделить несколько основных признаков, по которым делят на группы карбоновые кислоты. Первый из них - это природа радикала. По этому фактору выделяют:
- Алициклические кислоты. Пример: хинная.
- Ароматические. Пример: бензойная.
- Алифатические. Пример: уксусная, акриловая, щавелевая и прочие.
- Гетероциклические. Пример: никотиновая.
Если говорить о связях в молекуле, то также можно выделить две группы кислот:
- предельные - все связи только одинарные;
- непредельные - в наличии двойные, одна или несколько.

Также признаком классификации может служить количество функциональных групп. Так, выделяют следующие категории.
- Одноосновные - только одна -СООН-группа. Пример: муравьиная, стеариновая, бутановая, валериановая и прочие.
- Двухосновные - соответственно, две группы -СООН. Пример: щавелевая, малоновая и другие.
- Многоосновные - лимонная, молочная и прочие.
Далее в данной статье речь пойдет только о предельных одноосновных карбоновых кислотах алифатического ряда.
История открытия
Виноделие процветало с самой древности. А, как известно, один из его продуктов - уксусная кислота. Поэтому история известности данного класса соединений берет свои корни еще со времен Роберта Бойля и Иоганна Глаубера. Однако при этом химическую природу этих молекул выяснить долгое время не удавалось.
Ведь долгое время господствовали взгляды виталистов, которые отрицали возможность образования органики без живых существ. Но уже в 1670 году Д. Рэй сумел получить самого первого представителя - метановую или муравьиную кислоту. Сделал он это, нагревая в колбе живых муравьев.
Позже работы ученых Берцелиуса и Кольбе показали возможность синтеза этих соединений из неорганических веществ (перегонкой древесного угля). В результате была получена уксусная. Таким образом были изучены карбоновые кислоты (физические свойства, строение) и положено начало для открытия всех остальных представителей ряда алифатических соединений.
Физические свойства
Сегодня подробно изучены все их представители. Для каждого из них можно найти характеристику по всем параметрам, включая применение в промышленности и нахождение в природе. Мы рассмотрим, что собой представляют карбоновые кислоты, физические свойства их и другие параметры.
Итак, можно выделить несколько основных характерных параметров.
- Если число атомов углерода в цепи не превышает пяти, то это резко пахнущие, подвижные и летучие жидкости. Выше пяти - тяжелые маслянистые вещества, еще больше - твердые, парафинообразные.
- Плотность первых двух представителей превышает единицу. Все остальные легче воды.
- Температура кипения: чем больше цепь, тем выше показатель. Чем более разветвленная структура, тем ниже.
- Температура плавления: зависит от четности количества атомов углерода в цепи. У четных она выше, у нечетных ниже.
- В воде растворяются очень хорошо.
- Способны образовывать прочные водородные связи.

Такие особенности объясняются симметрией строения, а значит, и строением кристаллической решетки, ее прочностью. Чем более простые и структурированные молекулы, тем выше показатели, которые дают карбоновые кислоты. Физические свойства данных соединений позволяют определять области и способы использования их в промышленности.
Химические свойства
Как мы уже обозначали выше, данные кислоты могут проявлять свойства разные. Реакции с их участием важны для промышленного синтеза многих соединений. Обозначим самые главные химические свойства, которые может проявлять одноосновная карбоновая кислота.
- Диссоциация: R-COOH = RCOO - + H + .
- Проявляет кислотные свойства, то есть взаимодействует с основными оксидами, а также их гидроксидами. С простыми металлами взаимодействует по стандартной схеме (то есть только с теми, что стоят до водорода в ряду напряжений).
- С более сильными кислотами (неорганические) ведет себя как основание.
- Способна восстанавливаться до первичного спирта.
- Особая реакция - этерификации. Это взаимодействие со спиртами с образованием сложного продукта - эфира.
- Реакция декарбоксилирования, то есть отщепления от соединения молекулы углекислого газа.
- Способна взаимодействовать с галогенидами таких элементов, как фосфор и сера.

Очевидно, насколько многогранны карбоновые кислоты. Физические свойства, как и химические, достаточно разнообразны. Кроме того, следует сказать, что в целом по силе как кислоты все органические молекулы достаточно слабы по сравнению со своими неорганическими коллегами. Их константы диссоциации не превышают показателя 4,8.
Способы получения
Существует несколько основных способов, которыми можно получать предельные карбоновые кислоты.
1. В лаборатории это делают окислением:
- спиртов;
- альдегидов;
- алкинов;
- алкилбензолов;
- деструкцией алкенов.
- сложных эфиров;
- нитрилов;
- амидов;
- тригалогеналканов.
3. Декарбоксилирование - отщепление молекулы СО2.
4. В промышленности синтез осуществляют окислением углеводородов с большим числом атомов углерода в цепи. Процесс осуществляется в несколько стадий с выходом множества побочных продуктов.
5. Некоторые отдельные кислоты (муравьиная, уксусная, масляная, валериановая и прочие) получают специфическими способами, используя природные ингредиенты.
Основные соединения предельных карбоновых кислот: соли
Соли карбоновых кислот - важные соединения, используемые в промышленности. Они получаются в результате взаимодействия последних с:
- металлами;
- основными оксидами; ;
- щелочами;
- амфотерными гидроксидами.

Особенно важное значение среди них имеют те, что образуются между щелочными металлами натрием и калием и высшими предельными кислотами - пальмитиновой, стеариновой. Ведь продукты подобного взаимодействия - мыла, жидкие и твердые.
Так, если речь идет о подобной реакции: 2C17H35-COOH + 2Na = 2C17H35COONa + H2,
то образующийся продукт - стеарат натрия - это есть по своей природе обычное хозяйственное мыло, используемое для стирки белья.
Если заменить кислоту на пальмитиновую, а металл на калий, то получится пальмитат калия - жидкое мыло для мытья рук. Поэтому можно с уверенностью заявлять, что соли карбоновых кислот - это на самом деле важные соединения органической природы. Их промышленное производство и использование просто колоссально в своих масштабах. Если представить, сколько мыла тратит каждый человек на Земле, то несложно вообразить и эти масштабы.
Эфиры карбоновых кислот
Особая группа соединений, которая имеет свое место в классификации органических веществ. Это класс сложных эфиров. Образуются они при реакции карбоновых кислот со спиртами. Название таких взаимодействий - реакции этерификации. Общий вид можно представить уравнением:
R , -COOH + R"-OH = R , -COOR" + H2O.
Продукт с двумя радикалами и есть сложный эфир. Очевидно, что в результате реакции карбоновая кислота, спирт, сложный эфир и вода претерпели значительные изменения. Так, водород от молекулы кислоты уходит в виде катиона и встречается с гидроксо-группой, отщепившейся от спирта. В итоге формируется молекула воды. Группировка, оставшаяся от кислоты, присоединяет к себе радикал от спирта, образуя молекулу сложного эфира.

Чем же так важны эти реакции и в чем промышленное значение их продуктов? Все дело в том, что сложные эфиры используются, как:
- пищевые добавки;
- ароматические добавки;
- составной компонент парфюма;
- растворители;
- компоненты лаков, красок, пластмасс;
- медикаментов и прочее.
Понятно, что области их использования достаточно широки, чтобы оправдать объемы производства в промышленности.
Этановая кислота (уксусная)
Это предельная одноосновная карбоновая кислота алифатического ряда, которая является одной из самых распространенных по объемам производства во всем мире. Формула ее - СН3СООН. Такой распространенности она обязана своим свойствам. Ведь области ее использования крайне широки.
- Она является пищевой добавкой под кодом Е-260.
- Используется в пищевой промышленности для консервации.
- Применяется в медицине для синтеза лекарственных средств.
- Компонент при получении душистых соединений.
- Растворитель.
- Участник процесса книгопечатания, крашения тканей.
- Необходимый компонент в реакциях химических синтезов множества веществ.
В быту ее 80-процентный раствор принято называть уксусной эссенцией, а если разбавить его до 15%, то получится просто уксус. Чистая 100% кислота называется ледяной уксусной.
Муравьиная кислота
Самый первый и простой представитель данного класса. Формула - НСООН. Также является пищевой добавкой под кодом Е-236. Ее природные источники:
- муравьи и пчелы;
- крапива;
- хвоя;
- фрукты.
Основные области использования:
- для консервации и подготовки животного корма;
- применяется для борьбы с паразитами;
- для крашения тканей, протравки деталей;
- как растворитель;
- отбеливатель;
- в медицине - для дезинфекции приборов и оборудования;
- для получения монооксида углерода в лаборатории.
Также в хирургии растворы данной кислоты используют как антисептические средства.
Практически у всех дома есть уксус. И большинство людей знают, что его основу составляет уксусная кислота. Но что она представляет собой с химической точки зрения? Какие еще органические соединения этого ряда существуют и каковы их характеристики? Попробуем разобраться в этом вопросе и изучить предельные одноосновные карбоновые кислоты. Тем более что в быту применяется не только уксусная, но и некоторые другие, а уж производные этих кислот вообще частые гости в каждом доме.

Класс карбоновых кислот: общая характеристика
С точки зрения науки химии, к данному классу соединений относят кислородсодержащие молекулы, которые имеют особенную группировку атомов - карбоксильную функциональную группу. Она имеет вид -СООН. Таким образом, общая формула, которую имеют все предельные одноосновные карбоновые кислоты, выглядит так: R-COOH, где R - это частица-радикал, которая может включать любое количество атомов углерода.
Согласно этому, определение данному классу соединений можно дать такое. Карбоновые кислоты - это органические кислородсодержащие молекулы, в состав которых входит одна или несколько функциональных группировок -СООН - карбоксильные группы.
То, что данные вещества относятся именно к кислотам, объясняется подвижностью атома водорода в карбоксиле. Электронная плотность распределяется неравномерно, так как кислород - самый электроотрицательный в группе. От этого связь О-Н сильно поляризуется, и атом водорода становится крайне уязвимым. Он легко отщепляется, вступая в химические взаимодействия. Поэтому кислоты в соответствующих индикаторах дают подобную реакцию:
- фенолфталеин - бесцветный;
- лакмус - красный;
- универсальный - красный;
- метилоранжевый - красный и прочие.

Благодаря атому водорода, карбоновые кислоты проявляют окислительные свойства. Однако наличие других атомов позволяет им восстанавливаться, участвовать во многих других взаимодействиях.
Классификация
Можно выделить несколько основных признаков, по которым делят на группы карбоновые кислоты. Первый из них - это природа радикала. По этому фактору выделяют:
- Алициклические кислоты. Пример: хинная.
- Ароматические. Пример: бензойная.
- Алифатические. Пример: уксусная, акриловая, щавелевая и прочие.
- Гетероциклические. Пример: никотиновая.
Если говорить о связях в молекуле, то также можно выделить две группы кислот:
- предельные - все связи только одинарные;
- непредельные - в наличии двойные, одна или несколько.

Также признаком классификации может служить количество функциональных групп. Так, выделяют следующие категории.
- Одноосновные - только одна -СООН-группа. Пример: муравьиная, стеариновая, бутановая, валериановая и прочие.
- Двухосновные - соответственно, две группы -СООН. Пример: щавелевая, малоновая и другие.
- Многоосновные - лимонная, молочная и прочие.
Далее в данной статье речь пойдет только о предельных одноосновных карбоновых кислотах алифатического ряда.
История открытия
Виноделие процветало с самой древности. А, как известно, один из его продуктов - уксусная кислота. Поэтому история известности данного класса соединений берет свои корни еще со времен Роберта Бойля и Иоганна Глаубера. Однако при этом химическую природу этих молекул выяснить долгое время не удавалось.
Ведь долгое время господствовали взгляды виталистов, которые отрицали возможность образования органики без живых существ. Но уже в 1670 году Д. Рэй сумел получить самого первого представителя - метановую или муравьиную кислоту. Сделал он это, нагревая в колбе живых муравьев.
Позже работы ученых Берцелиуса и Кольбе показали возможность синтеза этих соединений из неорганических веществ (перегонкой древесного угля). В результате была получена уксусная. Таким образом были изучены карбоновые кислоты (физические свойства, строение) и положено начало для открытия всех остальных представителей ряда алифатических соединений.
Физические свойства
Сегодня подробно изучены все их представители. Для каждого из них можно найти характеристику по всем параметрам, включая применение в промышленности и нахождение в природе. Мы рассмотрим, что собой представляют карбоновые кислоты, физические свойства их и другие параметры.
Итак, можно выделить несколько основных характерных параметров.
- Если число атомов углерода в цепи не превышает пяти, то это резко пахнущие, подвижные и летучие жидкости. Выше пяти - тяжелые маслянистые вещества, еще больше - твердые, парафинообразные.
- Плотность первых двух представителей превышает единицу. Все остальные легче воды.
- Температура кипения: чем больше цепь, тем выше показатель. Чем более разветвленная структура, тем ниже.
- Температура плавления: зависит от четности количества атомов углерода в цепи. У четных она выше, у нечетных ниже.
- В воде растворяются очень хорошо.
- Способны образовывать прочные водородные связи.

Такие особенности объясняются симметрией строения, а значит, и строением кристаллической решетки, ее прочностью. Чем более простые и структурированные молекулы, тем выше показатели, которые дают карбоновые кислоты. Физические свойства данных соединений позволяют определять области и способы использования их в промышленности.
Химические свойства
Как мы уже обозначали выше, данные кислоты могут проявлять свойства разные. Реакции с их участием важны для промышленного синтеза многих соединений. Обозначим самые главные химические свойства, которые может проявлять одноосновная карбоновая кислота.
- Диссоциация: R-COOH = RCOO - + H + .
- Проявляет кислотные свойства, то есть взаимодействует с основными оксидами, а также их гидроксидами. С простыми металлами взаимодействует по стандартной схеме (то есть только с теми, что стоят до водорода в ряду напряжений).
- С более сильными кислотами (неорганические) ведет себя как основание.
- Способна восстанавливаться до первичного спирта.
- Особая реакция - этерификации. Это взаимодействие со спиртами с образованием сложного продукта - эфира.
- Реакция декарбоксилирования, то есть отщепления от соединения молекулы углекислого газа.
- Способна взаимодействовать с галогенидами таких элементов, как фосфор и сера.

Очевидно, насколько многогранны карбоновые кислоты. Физические свойства, как и химические, достаточно разнообразны. Кроме того, следует сказать, что в целом по силе как кислоты все органические молекулы достаточно слабы по сравнению со своими неорганическими коллегами. Их константы диссоциации не превышают показателя 4,8.
Способы получения
Существует несколько основных способов, которыми можно получать предельные карбоновые кислоты.
1. В лаборатории это делают окислением:
- спиртов;
- альдегидов;
- алкинов;
- алкилбензолов;
- деструкцией алкенов.
- сложных эфиров;
- нитрилов;
- амидов;
- тригалогеналканов.
3. Декарбоксилирование - отщепление молекулы СО2.
4. В промышленности синтез осуществляют окислением углеводородов с большим числом атомов углерода в цепи. Процесс осуществляется в несколько стадий с выходом множества побочных продуктов.
5. Некоторые отдельные кислоты (муравьиная, уксусная, масляная, валериановая и прочие) получают специфическими способами, используя природные ингредиенты.
Основные соединения предельных карбоновых кислот: соли
Соли карбоновых кислот - важные соединения, используемые в промышленности. Они получаются в результате взаимодействия последних с:
- металлами;
- основными оксидами; ;
- щелочами;
- амфотерными гидроксидами.

Особенно важное значение среди них имеют те, что образуются между щелочными металлами натрием и калием и высшими предельными кислотами - пальмитиновой, стеариновой. Ведь продукты подобного взаимодействия - мыла, жидкие и твердые.
Так, если речь идет о подобной реакции: 2C17H35-COOH + 2Na = 2C17H35COONa + H2,
то образующийся продукт - стеарат натрия - это есть по своей природе обычное хозяйственное мыло, используемое для стирки белья.
Если заменить кислоту на пальмитиновую, а металл на калий, то получится пальмитат калия - жидкое мыло для мытья рук. Поэтому можно с уверенностью заявлять, что соли карбоновых кислот - это на самом деле важные соединения органической природы. Их промышленное производство и использование просто колоссально в своих масштабах. Если представить, сколько мыла тратит каждый человек на Земле, то несложно вообразить и эти масштабы.
Эфиры карбоновых кислот
Особая группа соединений, которая имеет свое место в классификации органических веществ. Это класс сложных эфиров. Образуются они при реакции карбоновых кислот со спиртами. Название таких взаимодействий - реакции этерификации. Общий вид можно представить уравнением:
R , -COOH + R"-OH = R , -COOR" + H2O.
Продукт с двумя радикалами и есть сложный эфир. Очевидно, что в результате реакции карбоновая кислота, спирт, сложный эфир и вода претерпели значительные изменения. Так, водород от молекулы кислоты уходит в виде катиона и встречается с гидроксо-группой, отщепившейся от спирта. В итоге формируется молекула воды. Группировка, оставшаяся от кислоты, присоединяет к себе радикал от спирта, образуя молекулу сложного эфира.

Чем же так важны эти реакции и в чем промышленное значение их продуктов? Все дело в том, что сложные эфиры используются, как:
- пищевые добавки;
- ароматические добавки;
- составной компонент парфюма;
- растворители;
- компоненты лаков, красок, пластмасс;
- медикаментов и прочее.
Понятно, что области их использования достаточно широки, чтобы оправдать объемы производства в промышленности.
Этановая кислота (уксусная)
Это предельная одноосновная карбоновая кислота алифатического ряда, которая является одной из самых распространенных по объемам производства во всем мире. Формула ее - СН3СООН. Такой распространенности она обязана своим свойствам. Ведь области ее использования крайне широки.
- Она является пищевой добавкой под кодом Е-260.
- Используется в пищевой промышленности для консервации.
- Применяется в медицине для синтеза лекарственных средств.
- Компонент при получении душистых соединений.
- Растворитель.
- Участник процесса книгопечатания, крашения тканей.
- Необходимый компонент в реакциях химических синтезов множества веществ.
В быту ее 80-процентный раствор принято называть уксусной эссенцией, а если разбавить его до 15%, то получится просто уксус. Чистая 100% кислота называется ледяной уксусной.
Муравьиная кислота
Самый первый и простой представитель данного класса. Формула - НСООН. Также является пищевой добавкой под кодом Е-236. Ее природные источники:
- муравьи и пчелы;
- крапива;
- хвоя;
- фрукты.
Основные области использования:
- для консервации и подготовки животного корма;
- применяется для борьбы с паразитами;
- для крашения тканей, протравки деталей;
- как растворитель;
- отбеливатель;
- в медицине - для дезинфекции приборов и оборудования;
- для получения монооксида углерода в лаборатории.
Также в хирургии растворы данной кислоты используют как антисептические средства.
По систематической номенклатуре названия солей карбоновых кислот образуют путем добавления окончания –оат к названию соответствующего алкана и названия противоиона (металла или аммония). Используют также тривиальные названия карбоксилат-анионов, добавляя к ним название металла:

Методы получения солей рассмотрены выше.
С химическими свойствами солей знакомились при рассмотрении методов получения алканов (электролиз по Кольбе и декарбоксилирование), альдегидов и кетонов (пиролиз кальциевых и бариевых солей).
ДВУХОСНОВНЫЕ НАСЫЩЕННЫЕ КИСЛОТЫ
Двухосновные предельные (насыщенные) кислоты имеют общую формулу СnН2n(СООН)2- Из них важнейшими являются:
HOOC-COOH – щавелевая, этандикарбоновая кислота
HOOC-СН2-COOH – малоновая, пропандикарбоновая кислота
HOOC-СН2-СН2-COOH – янтарная, бутандикарбоновая кислота
HOOC-СН2-СН2-СН2-COOH – глутаровая, пентандикарбоновая кислота
HOOC-СН2-СН2-СН2-СН2-COOH – адипиновая, гександикарбоновая кислота
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№20). Существуют и специфические способы получения двухосновных карбоновых кислот
1. Окисление оксикислот:

2. Окисление циклоалканов. Это промышленный способ получения адипиновой кислоты

Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Физические свойства
Дикарбоновые кислоты – твердые вещества. Низшие кислоты хорошо растворимы в воде, но плохо в органических растворителях.
Химические свойства
Двухосновные кислоты более сильные, чем одноосновные, они характеризуются двумя константами диссоциации Ка1 и Ка2

Диссоциация первой карбоксильной группы протекает легче. Это особенно заметно для щавелевой и малоновой кислот и связано с тем, что неионизированная карбоксильная группа проявляет электроноакцепторный индуктивный эффект по отношению к ионизированной карбоксильной группе и стабилизирует тем самым образующийся карбоксилат-анион.
Дикарбоновые кислоты, в которых две карбоксильные группы разделены цепью из шести и более атомов проявляют свойства, аналогичные монокарбоновым кислотам. Механизм реакций образования диамидов, сложных диэфиров и др., для дикарбоновых кислот тот же, что и для монокарбоновых кислот.
1. Отношение к нагреванию. Примером необычного поведения дикарбоновых кислот, обусловленного наличием двух карбоксильных групп, могут служить реакции, протекающие при нагревании.
Так, щавелевая кислота при нагревании до 150°С отщепляет диоксид углерода с образованием муравьиной кислоты:
НООС–СООН ® НСООН + СО2
Малоновая кислота и ее моно- и дизамещенные гомологи, при нагревании несколько выше их температур плавления отщепляет СО2 с образованием уксусной кислоты или ее моно- и дизамещенных гомологов:
Дикарбоновые кислоты, содержащие четыре или пять атомов углерода между карбоксильными группами (янтарная и глутаровая кислоты) при нагревании отщепляют воду и образуют циклические ангидриды:

Подобные циклические соединения получают и из амидов:

2. Пиролиз кальциевых и бариевых солей. При пиролизе кальциевых или бариевых солей адипиновой, пимелиновой и пробковой кислот происходит отщепление СО2 и образуются циклические кетоны:

3. Синтезы на основе малонового эфира. Имеют большое значение в органической химии.
Атом водорода метиленовой группы, находящейся между ацильными группами диэтилового эфира малоновой кислоты (малоновый эфир), обладает кислотными свойствами и дает натриевую соль с этилатом натрия. Эту соль - (натрий – малоновый эфир) алкилируют галогеналканами по механизму нуклеофильного замещения SN2. На основе натрий - малонового эфира получают одно- и двухосновные кислоты:

Синтез на основе малонового эфира является одним из лучших способов получения карбоновых кислот. Планирование синтеза карбоновых кислот с использованием малонового эфира сводится к выбору подходящего алкилгалогенида. Для этого получаемую кислоту рассматривают как моно- или диалкилуксусную кислоту. При действии галогенангидридов карбоновых кислот с последующим гидролизом и декарбоксилированием из натрий - малонового эфира получают кетоны:
Читайте также:

