Скорости движения молекул и их измерение кратко
Обновлено: 02.05.2024
В физике выделяют 2 скорости, характеризующие движение молекул: средняя скорость движения молекул и средняя квадратичная скорость.
Средняя скорость движения молекул
Средняя скорость движения молекул называется также скоростью теплового движения молекул.
Формула средней относительной скорости молекул в физике представлена следующим выражением:
υ o t n = 2 8 k T πm 0 = 2 υ .
Средняя квадратичная скорость
Средняя квадратичная скорость движения молекул газа это следующая величина:
υ k υ = 1 N ∑ i = 1 N υ i 2
Формулу средней квадратичной скорости можно переписать так:
υ k υ 2 = ∫ 0 ∞ υ 2 F υ d υ .
Проводя интегрирование, аналогичное интегрированию при получении связи средней скорости с температурой газа, получаем:
υ k υ = 3 k T m 0 = 3 R T μ
Именно средняя квадратичная скорость поступательного движения молекул газа входит в состав основного уравнения молекулярно-кинетической теории:
p = 1 3 n m 0 υ k υ ,
где n = N V – это концентрация частиц вещества, N – это количество частиц вещества, V – это объем.
Необходимо определить, как изменяется средняя скорость движения молекул идеального газа с увеличением давления в процессе, изображенном на графике (рисунок 1 ).

Решение
Запишем выражение для средней скорости движения молекул газа следующим образом:
Из графика видно, что p ~ ρ или p = C ρ , где C – это некоторая константа.
m 0 = ρ n , p = n k T = C ρ → k T = C ρ n
Подставив m 0 = ρ n , p = n k T = C ρ → k T = C ρ n в υ = 8 k T πm 0 , получаем:
υ = 8 k T πm 0 = 8 C ρ π n n ρ = 8 C π
Ответ: В процессе, представленном на графике, с увеличением давления средняя скорость движения молекул не меняется.
Можно ли найти среднюю квадратичную скорость молекулы идеального газа, если известно: давление газа ( p ) , молярная масса газа ( μ ) , а также концентрация молекул газа ( n ) ?
Решение
Применим выражение для υ k υ :
Помимо этого, из уравнения Менделеева-Клайперона и зная, что m μ = N N A :
p V = m μ R T = N N A R T .
Поделим правую и левую части p V = m μ R T = N N A R T на V , и зная N V = n , получаем:
p = n N A R T → R T = p N A n
Подставляем p = n N A R T → R T = p N A n в выражение для среднеквадратичной скорости υ k υ = 3 R T μ , получаем:
υ k υ = 3 p N A μ n
Ответ: По заданным в условии задачи параметрам среднеквадратичная скорость движения молекул газа вычисляется при помощи формулы υ k υ = 3 p N A μ n .

Этот урок посвящен изучению того, каким способом можно измерить скорость молекул газа. Мы рассмотрим один из самых известных экспериментов в этой области – опыт Штерна.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Измерение скоростей молекул газа"
На прошлых уроках мы вывели уравнение, позволяющее связать среднюю кинетическую энергию молекул и температуру.
Как вы знаете, средняя кинетическая энергия молекул равна половине произведения массы молекулы и среднего значения квадрата скорости молекул:

Таким образом, зная температуру газа, мы можем найти среднее значение квадрата скорости его молекул:

Расчеты говорят о том, что при 0 о С, средняя скорость молекул азота достигает 500 м/с, а средняя скорость молекул водорода — 1800 м/с. Во второй половине 19 века это привело некоторых физиков в замешательство. Ведь всем хорошо известно, что запахи распространяются сравнительно медленно. Как же тогда получается, что молекулы газа двигаются с огромными скоростями, а само облако газа двигается в сотни раз медленнее?
Ответ на этот вопрос достаточно простой: молекулы двигаются беспорядочно, а потому их перемещения в сотни раз меньше пройденного пути. В качестве аналогии мы опять можем привести футбол. За один матч футболисты пробегают более десяти километров, однако, все это время они остаются в пределах футбольного поля, размеры которого равны 120 х 60 м.
Кроме расчетов скоростей молекул газа с помощью теории, существуют экспериментальные методы измерения скоростей. На сегодняшнем уроке, мы рассмотрим опыт Штерна, проведенный в 1920 году. Этот опыт был одним из первых экспериментальных подтверждений состоятельности молекулярно-кинетической теории.

Прибор Штерна представляет собой два коаксиальных цилиндра (то есть эти цилиндры обладают общей осью симметрии).
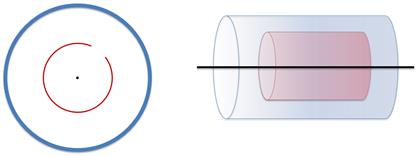
Из цилиндров откачан весь воздух. Вдоль оси малого цилиндра натянута тонкая платиновая проволока, покрытая серебром, а также в малом цилиндре имеется небольшая щель.
По проволочке пропускают электрический ток, с целью заставить серебро испаряться. В результате испарения, малый цилиндр заполняется газом из атомов серебра.
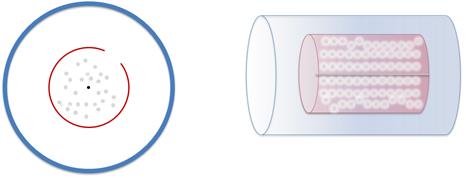
Разумеется, часть этих атомов пролетают через щель и оседают на внутренней стенке большого цилиндра. Этот слой серебра имеет определенное положение — прямо напротив щели в малом цилиндре.
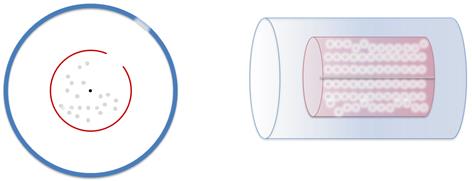
После этого, цилиндры приводят во вращение с одинаковой угловой скоростью и большой частотой (около 1500 об/с). Теперь атомы будут осаждаться не прямо напротив щели, поскольку за то время, пока они проходят расстояние от стенки малого цилиндра до стенки большого цилиндра, цилиндры поворачиваются на некоторый угол. Более того, слой серебра будет немного размытый из-за того, что не все атомы серебра двигаются с одинаковыми скоростями.
Обозначим за R радиус большого цилиндра, а радиус малого цилиндра — за r. Обозначим за d расстояние от конца радиуса, проходящего через центр щели до наибольшей концентрации атомов серебра после начала вращения. (Дело в том, что не все атомы имеют одинаковую скорость, поэтому, не все они попадают в одну и ту же точку). Поэтому, расстоянию d будет соответствовать средняя скорость атомов серебра:

Запишем теперь, что расстояние d равно:

Изучая криволинейное движение, мы убедились, что скорость вращения можно выразить через радиус вращения и частоту:

Из полученного выражения выразим время:

А теперь, это время подставим в формулу для средней скорости:

Таким образом, получили выражение, в котором средняя скорость задана через радиусы цилиндров, частоту вращения и расстояние d. Конечно же, радиусы цилиндров и расстояние d можно измерить. Частоту вращения задает сам экспериментатор, поэтому, она тоже известна. Модули скоростей, измеренные подобным способом, совпадают с теоретическим значением в пределах экспериментальной ошибки. Это говорит о том, что теоретическая формула, по которой мы вычисляли скорость, оказалась верна. Следовательно, верно и уравнение, связывающее среднюю кинетическую энергию молекул и температуру тела по абсолютной шкале Кельвина:
Квадратный корень из этой величины называется средней квадратичной скоростью:

Средняя квадратичная скорость мало отличается от наибо лее вероятной скорости, определяемой выражением (4.6.9). Так как постоянная Больцмана равна отношению универсальной газовой постоянной к постоянной Авогадро а массу молекулы можно выразить через ее молярную массу то из формулы (4.7.2) получается

Вычисленные по этой формуле скорости для различных газов при t = 0 °С (Т = 273 К) приведены в таблице 1.
Таблица 1

Как видно из таблицы, скорости молекул очень велики — порядка скорости артиллерийских снарядов — и несколько больше скорости звука в соответствующем газе. На первых порах такой результат вызвал замешательство среди физиков. Ведь если скорости молекул столь велики, то как объяснить, например, что запах духов, пролитых в комнате, распространяется довольно медленно; должно пройти несколько секунд, чтобы запах распространился по всей комнате. Однако объяснить этот факт оказалось довольно просто.
Молекулы газа, несмотря на свои малые размеры, непрерывно сталкиваются друг с другом. Из-за большой скорости движения молекул число столкновений молекул воздуха в 1 с при нормальных атмосферных условиях достигает нескольких миллиардов. Средняя длина свободного пробега молекулы оказывается равной 10 -5 —10 -5 см. Поэтому траектория каждой молекулы представляет собой очень запутанную ломаную линию (рис. 4.14). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Перемещение же молекулы в каком-либо направлении в среднем невелико даже за время порядка нескольких секунд. При перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо больше расстояния АВ.

Экспериментальное определение скоростей молекул
Опыты по определению скорости молекул доказали справедливость формулы (4.7.3). Один из опытов был осуществлен немецким физиком О. Штерном в 1920 г.
Схема опыта показана на рисунке 4.15. Прибор состоит из сосуда 1, системы диафрагм 2, 3 и цилиндра 4, вращающегося с большой угловой скоростью ω.

В сосуде 1 натянута тонкая платиновая проволочка 5, покрытая слоем серебра. По проволочке пропускают электрический ток. При прохождении тока слой серебра испаряется и сосуд заполняется газом из атомов серебра. Газ находится в равновесном состоянии при температуре Т, которую можно измерить.
В стенке сосуда 1 имеется маленькое отверстие, через которое небольшое количество атомов серебра вылетает из сосуда в пространство, где создан высокий вакуум. Здесь атомы практически не сталкиваются друг с другом.
С помощью диафрагм 2, 3 выделяется пучок атомов, направленный вдоль диаметра вращающегося цилиндра. В цилиндре имеется узкая щель. В момент, когда щель оказывается на пути пучка, небольшая порция атомов попадает внутрь цилиндра и движется к его противоположной стенке. Расстояние, равное диаметру цилиндра D, эти атомы пролетают за время , где — среднее значение скорости. Зa это время цилиндр повернется на угол φ = ωτ = .

Если бы цилиндр был неподвижен, то атомы осаждались бы на его внутренней поверхности прямо против щели. Но при вращении цилиндра атомы попадают на участок цилиндра, смещенный на расстояние s = от точки, лежащей на одном диаметре со щелью 3 (см. рис. 4.15).
На внутренней поверхности цилиндра образуется след от осажденного серебра в виде темного пятна. Толщина пятна не везде одинакова. На определенном участке толщина слоя серебра максимальна. Измерив длину дуги s, соответствующую наибольшей толщине слоя серебра, и зная диаметр цилиндра и его угловую скорость, можно определить среднюю скорость молекул по формуле

Согласие со значением средней квадратичной скорости, вычисленной по формуле (4.7.3), оказывается вполне удовлетворительным. Это служит экспериментальным доказательством справедливости формулы (4.7.3), а значит, и выражения (4.5.5), из которого следует, что средняя кинетическая энергия прямо пропорциональна абсолютной температуре.
Измеряя толщину пятна серебра в разных местах, можно приблизительно подсчитать число атомов, скорости которых лежат в тех или иных интервалах. Таким образом осуществляется опытная проверка максвелловского распределения молекул по скоростям. Согласие с экспериментом для распределения Максвелла также оказывается удовлетворительным.
Средняя скорость броуновской частицы
Формула (4.7.2) позволяет понять, почему интенсивность броуновского движения возрастает с повышением температуры жидкости и уменьшается при увеличении массы частицы. Ведь броуновская частица участвует в тепловом движении молекул. Поэтому ее средняя кинетическая энергия также определяется формулой (4.5.5), а средняя квадратичная скорость — формулой

где mб — масса броуновской частицы. Если масса частицы велика, то средняя скорость ее движения настолько мала, что движение частицы практически обнаружить нельзя.
Скорость броуновской частицы в жидкости измерить непосредственно невозможно из-за крайней нерегулярности броуновского движения.
Средние скорости молекул превышают скорость звука и достигают сотен метров в 1 с. Эти скорости удалось измерить благодаря тому, что макроскопическому телу (цилиндру в опыте Штерна) можно сообщить столь большую угловую скорость, что за время пролета молекул внутри цилиндра он поворачивается на заметную величину.
Можно ли, зная температуру, вычислить среднюю кинетическую энергию молекул газа? среднюю скорость молекулы?
А можно ли эту скорость измерить?
Средняя скорость теплового движения молекул.

Уравнение (9.16) даёт возможность найти средний квадрат скорости движения молекулы. Подставив в это уравнение получим выражение для среднего значения квадрата скорости:

Средней квадратичной скоростью называется величина


Вычисляя по формуле (9.19) скорость молекул, например азота при t = 0 °С, получаем Молекулы водорода при той же температуре имеют среднюю квадратичную скорость Эти скорости велики, но так как молекулы газа движутся хаотично, непрерывно сталкиваясь друг с другом, и время между двумя столкновениями мало, то расстояние, которое пролетают молекулы также невелико. Из-за столкновения траектория каждой молекулы представляет собой запутанную ломаную линию (рис. 9.6). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Как видно из рисунка, при перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо больше расстояния АВ. При атмосферном давлении это расстояние порядка 10 -5 см.
Когда впервые были получены эти числа (вторая половина XIX в.), многие физики были ошеломлены. Скорости молекул газа по расчётам оказались больше, чем скорости артиллерийских снарядов! На этом основании высказывали даже сомнения в справедливости кинетической теории. Ведь известно, что запахи распространяются довольно медленно: нужно время порядка десятков секунд, чтобы запах духов, пролитых в одном углу комнаты, распространился до другого угла.
Экспериментальное определение скоростей молекул. Опыты по определению скоростей молекул доказали справедливость формулы (9.19). Один из опытов был предложен и осуществлён О. Штерном в 1920 г.
Что определяет среднюю кинетическую энергию теплового движения молекул и от чего зависит средняя квадратичная скорость этого движения.
Прибор Штерна состоит из двух коаксиальных цилиндров А и В, жёстко связанных друг с другом (рис. 9.7, а). Цилиндры могут вращаться с постоянной угловой скоростью. Вдоль оси малого цилиндра натянута тонкая платиновая проволочка С, покрытая слоем серебра.
Как вы думаете, почему проволочка сделана из платины?

По проволочке пропускают электрический ток. В стенке этого цилиндра имеется узкая щель О. Воздух из цилиндров откачан. Цилиндр В находится при комнатной температуре. Вначале прибор неподвижен. При прохождении тока по нити она нагревается и при температуре 1200 °С атомы серебра испаряются. Внутренний цилиндр заполняется газом из атомов серебра. Некоторые атомы пролетают через щель О и, достигнув внутренней поверхности цилиндра В, осаждаются на ней. В результате прямо против щели образуется узкая полоска D серебра (рис. 9.7, б).
Затем цилиндры приводят во вращение с большим числом оборотов n в секунду (до 1500 1/c).
Теперь за время t, необходимое атому для прохождения пути, равного разности радиусов цилиндров RB - RА, цилиндры повернутся на некоторый угол φ. В результате атомы, движущиеся с постоянной скоростью, попадают на внутреннюю поверхность большого цилиндра не прямо против щели О (рис. 9.7, в), а на некотором расстоянии s от конца радиуса, проходящего через середину щели (рис. 9.7, г): ведь атомы движутся прямолинейно.
Если через υB обозначить модуль скорости вращения точек поверхности внешнего цилиндра, то

В действительности атомы серебра имеют разные скорости. Поэтому расстояния s для различных атомов будут несколько различаться. Под s следует понимать расстояние между участками на полосках D и D' с наибольшей толщиной слоя серебра. Этому расстоянию будет соответствовать средняя скорость атомов, которая равна
Подставляя в эту формулу значение времени t из выражения (9.20), получаем

Зная n, RA и RB и измеряя среднее смещение полоски серебра, вызванное вращением прибора, можно найти среднюю скорость атомов серебра.
Модули скоростей, определённые из опыта, совпадают с теоретическим значением средней квадратичной скорости. Это служит экспериментальным доказательством справедливости формулы (9.19), а следовательно, и формулы (9.16), согласно которой средняя кинетическая энергия молекулы прямо пропорциональна абсолютной температуре.
Основные положения МКТ. Тепловые явления - Физика, учебник для 10 класса - Класс!ная физика
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

Измерение скоростей молекул газа
Федоров А.М. – учитель физики Кюкяйской СОШ Сунтарского улуса Республики Саха

Средняя скорость теплового движения молекул
Уравнение 𝑬 = 𝟑 𝟐 kT даёт возможность найти средний квадрат скорости движения молекулы. Подставив в это уравнение 𝑬 = 𝒎 𝟎 𝒗 𝟐 𝟐 , получим выражение для среднего значения квадрата скорости:
𝒗² = 3 kT 𝒎₀ .
Средней квадратичной скоростью называется величина

Вычисления по этой формуле…
Вычисляя по этой формуле скорость молекул, например азота при t=0°C получаем 𝒗 кв =500 м/с. Молекулы водорода при той же температуре имеют скорость 1800 м/с. Эти скорости велики, но так как молекулы газа движутся хаотично, непрерывно сталкиваясь друг с другом, и время между двумя столкновениями мало, то расстояние, которое пролетают молекулы также невелико.
Из-за столкновения траектория каждой молекулы представляет собой запутанную ломаную линию. Как видно из рисунка, при перемещении молекулы из точки А в В пройденный ею путь оказывается гораздо больше расстояния АВ. При атмосферном давлении это расстояние ~ 10⁻⁵ см.

Опыт Штерна
Опыт Штерна — физический эксперимент, впервые поставленный немецким физиком Отто Штерном в 1920 году, и ставший одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Исследуемым газом в опыте служили разреженные пары серебра, которые получались при испарении слоя серебра, нанесённого на платиновую проволоку, нагревавшуюся электрическим током. Проволока располагалась в сосуде, из которого воздух был откачан, поэтому атомы серебра беспрепятственно разлетались во все стороны от проволоки.

Схема устройства
Исследуемым газом в опыте служили разреженные пары серебра, которые получались при испарении слоя серебра, нанесённого на платиновую проволоку, нагревавшуюся электрическим током. Проволока располагалась в сосуде, из которого воздух был откачан, поэтому атомы серебра беспрепятственно разлетались во все стороны от проволоки. Для получения узкого пучка летящих атомов на их пути была установлена преграда со щелью, через которую атомы попадали на латунную пластинку, имевшую комнатную температуру. Атомы серебра осаждались на ней в виде узкой полоски, образуя серебряное изображение щели.

Результаты опыта
Специальным устройством весь прибор приводился в быстрое вращение вокруг оси, параллельной плоскости пластинки. Вследствие вращения прибора атомы попадали в др. место пластинки: пока они пролетали расстояние l от щели до пластинки, пластинка смещалась. Наибольшая плотность соответствует наиболее вероятной скорости атомов. Полученные в Ш. о. значения наиболее вероятной скорости хорошо согласуются с теоретическим значением, полученным на основе Максвелла распределения молекул по скоростям.

Распределение Максвелла
Распределе́ние Ма́ксвелла — общее наименование нескольких распределений вероятности, которые описывают статистическое поведение параметров частиц идеального газа.


Упражнения
Найти среднюю квадратичную скорость молекул воздуха при температуре t = 17°C. Молярная масса воздуха м = 0,029 кг/моль.
Найти отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах.

Упражнения
3. В момент взрыва атомной бомбы развивается температура Т ~10 в степени 7 К. Считая, что при такой температуре все молекулы полностью диссоциированы на атомы, а атомы ионизированы, найти среднюю квадратичную скорость иона водорода.
4. Плотность некоторого газа ρ = 0,06 кг, средняя квадратичная скорость его молекул = 500 м/с. Найти давление р, которое газ оказывает на стенки сосуда.(самостоятельно)

Домашнее задание
Вычислить среднюю квадратичную скорость молекул углекислого газа при температуре 223 К.
Вычислить среднюю квадратичную скорость молекул газа, если его масса m = 6 кг, объем V= 4,9 м3 и давление p = 200 кПа.
Чему равна средняя квадратичная скорость молекул газа, если его масса m = 6 кг, объем и давление р = 200 кПа?
Определить среднюю квадратичную скорость Vкв молекулы газа, заключенного в сосуд вместимостью V = 2 л под давлением P = 200 кПа. Масса газа m = 0,3 г.
Вычислить среднеквадратичную скорость молекул кислорода при 20°С.
Читайте также:

