Синтез гемоглобина биохимия кратко
Обновлено: 05.07.2024
Гемоглобин — это белок красных кровяных телец или эритроцитов, который содержит железо. Функция гемоглобина состоит в том, чтобы осуществлять обмен кислорода между тканями и органами. Гемоглобин — это белковая молекула, которая состоит из последовательности аминокислот - глобин, и гемовой части, которая содержит железо. В клинической диагностике определяется количество гемоглобина, которое содержится непосредственно в белке эритроцитов. Транспорт кислорода осуществляется к тканям и органам, а углекислый газ, наоборот от тканей и органов к легким, где он выделяется. Насыщение гемоглобина железом происходит на раннем этапе формирования красных кровяных телец. В капиллярах легочной ткани с одной молекулой гемоглобина может прореагировать четыре молекулы кислорода. В ходе этого взаимодействия образуется оксигемоглобин. Далее с потоком крови эритроциты, несущие комплекс “гемоглобин+кислород” доставляют его к тканям и органам. В процессе окислительной реакции гемоглобин отдает кислород и присоединяет небольшое количество углекислого газа. Гемоглобин важен в поддержании и стабилизации кислотно – щелочного баланса в организме. В норме рН крови равно интервалу 7,35-7,40.
Какой бывает гемоглобин?
HbA - молекула гемоглобина, представлена двумя α- и двумя β- цепями. Этой формой представлен основной гемоглобин взрослого человека.
HbF – фетальная форма гемоглобина. Формируется в первые три месяца жизни новорожденного. Также представлен двумя α- и две β- цепями, но содержит большее сродство к кислороду, для лучшего снабжения плода кислородом. До трех лет HbF составляет 50-80%, а после снижается до 2%.
- Оксигемоглобин – в состав молекулы входит двухвалентное железо. Может осуществлять перенос кислорода к тканям и органам.
- Метгемоглобин – соединение содержит трехвалентное железо, не осуществляет обратимую реакцию с кислородом.
- Карбоксигемоглобин – молекула обладает высокой степенью сродства с окисью углерода. Образует соединение с угарным газом. За счет этого взаимодействия происходит медленный распад комплекса.
- Миоглобин – молекула близкая по структуре с гемоглобином, локализована в мышечной ткани и сердце. Образует депо кислорода в них, при снижении кислородной емкости крови.
Показания к назначению исследования
- Определение уровня гемоглобина в крови назначают при общем обследовании, ежегодных профилактических осмотрах и диспансеризации.
- Для оценки эффективности назначенной терапии, и отслеживания реакций организма на лекарственные препараты.
- Гемоглобин — это один из базовых показателей при любом обследовании и диагностике патологических состояний организма.
- Особо важное значение имеет определение гемоглобина в период беременности.
- Хроническая усталость и апатия;
- Повышенная утомляемость и сонливость;
- Рассеянное внимание;
- Бледный оттенок кожи;
- Плохо заживающие раны, ссадины и синяки;
- Ощущение сухости во рту;
- Сильная жажда.
Подготовка к исследованию
- Забор крови осуществляют в утренние часы натощак (не менее 4-5 часов после последнего приема пищи);
- Разрешается пить воду без газа;
- Исключить физическую активность и стресс за 30 минут до анализа;
- Запрещается употреблять алкоголь и жирную пищу за сутки до исследования;
- За 30 минут до взятия крови воздержаться от курения.
Интерпретация результата
Уровень гемоглобина у мужчин должен быть не ниже 130 г/л, поскольку андрогены стимулируют выработку эритроцитов. А для женщин не менее 120 г\л. С возрастом эти показатели могут стать ниже. Важно помнить, что нормальный уровень эритроцитов не означает что концентрация гемоглобина будет в норме.
- Врожденный порок сердца, препятствующий нормальной циркуляции крови и доставки кислорода;
- Дегидратация, недостаток жидкости приводит к увеличенному количеству эритроцитов;
- Нарушения работы почек. В случае патологии почки начинают вырабатывать больше эритропоэтина - гормона, активирующего синтез эритроцитов;
- Заболевания легких. При недостаточном объеме легких и затрудненном дыхании организм включает компенсаторный механизм и производит больше красных кровяных телец, чтобы восстановить недостаток кислорода;
- Истинная полицитемия — это хроническое новообразование, продуцирующее избыточное количество эритроцитов в костном мозге;
Низкий уровень гемоглобина
- Дефицитные состояния железа и витамина В12 или фолиевая анемия;
- Патологии костного мозга. Лейкемия, лимфома, апластическая анемия;
- Почечная недостаточность. В таком состоянии происходит дефицит гормона эритропоэтина, который стимулирует выработку эритроцитов;
- Миома матки. Это доброкачественные опухолевые образования матки, но они могут вызывать обильные кровотечения, что отражается на количестве эритроцитов;
- Патологии и состояния разрушающие эритроциты. К ним относятся серповидная анемия, талассемия, некоторые аутоиммунные заболевания.
- Циррозы печени;
- Хронические инфекции;
- Острое или хроническое кровотечение, но сразу после или в течение кровотечения показатель гемоглобина может быть повышен.
Если в организме наблюдается пониженный уровень гемоглобина, то это приводит к развитию анемии. Анемия встречается при ряде заболеваний и отклонений. Чем ниже концентрация гемоглобина в крови, тем сложнее протекает анемия. Для лечения необходимо определить степень заболевания и причины возникновения. В качестве терапии врачи назначают железосодержащие препараты. Лечение анемии заключается в восполнении дефицита недостающих факторов для роста и развития красных кровяных телец с помощью препаратов железа, витамина В6, В12, фолиевой кислоты, синтетических аналогов эритропоэтина.
Для устранения дефицитных состояний при анемии также назначается диета с высоким содержанием железа, витаминов, белков и микроэлементов. Только 10% от необходимого количества железа для восполнения потерь организмом поступает в организм с продуктами питания. В продуктах железо представлено двумя типами - гемовое и негемовое. Для более легкого усвоения подходит гемовое железо, источником служат продукты животного происхождения. Негемовое железо содержится в растительных продуктах. Для улучшения его биодоступности для организма его лучше употреблять совместно с витамином С и В12.
- Фрукты (яблоки, курага, гранат, персики, виноград);
- Овощи (морская капуста, шпинат, томаты, петрушка и укроп, топинамбур);
- Продукты животного происхождения (свиная и говяжья печень, почки, морепродукты, мидии, устрицы, мясо кролика);
- Крупы (чечевица, перловая крупа, киноа, гречка, полба);
Продукты богатые железом и необходимыми витаминами не могут стать полноценной заменой медикаментозной терапии, но помогут в качестве дополнительного фактора поддержания нормального уровня гемоглобина. Для улучшения доступности железа организму нужны дополнительные факторы. Фолиевая кислота и витамины группы B – это естественные стимуляторы синтеза гемоглобина и эритропоэза. Процесс созревания эритроцитов происходит под действием фолиевой кислоты. Это может привести к анемии и низкому уровню гемоглобина. Восполнить дефицит фолиевой кислоты можно с помощью употребления в пищу печени, говядины, свинины, баранины, яиц, трески, морепродуктов, молочных продуктов.
Для составления правильного рациона необходимо учитывать нормы железа для определенного возраста и знать реальный уровень гемоглобина. Особенно это необходимо учитывать для детей и женщин в период беременности.
Для профилактики дефицитных состояний необходимо, чтобы железо, поступающее с продуктами питания хорошо усваивалось. С целью повышения биодоступности железа для организма необходимо обогатить свой рацион аскорбиновой кислотой, которая препятствует окислению железа и поддерживает его в двухвалентной форме. Рекомендуется использовать в качестве заправки для салатов лимонный сок, увеличить употребление листовой зелени, яблок и цитрусовых. Витамин А также влияет на степень усвоения железа. Витамин А содержится в основном в продуктах животного происхождения — рыбе и морепродуктах, печени. Кальций негативно влияет на биодоступность железа. Но не стоит отказываться от молочных продуктов. Необходимо разделить их употребление от добавок железа, назначенных врачом. Для профилактики и лечение железодефицитных состояний рекомендуется применять железосодержащие добавки и препараты. Выбор необходимо производить индивидуально по назначению врача, в зависимости от степени тяжести заболевания и с учетом индивидуальных особенностей организма.
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом - гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент - порфобилиногенсинтаза - ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.

Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 - 2×10 11 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.

Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Тема 3 (вопрос 4 и 5).
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом - гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент - порфобилиногенсинтаза - ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.

Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 - 2×10 11 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
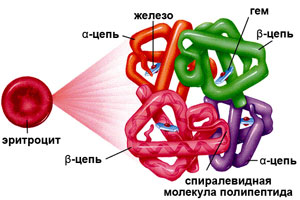
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
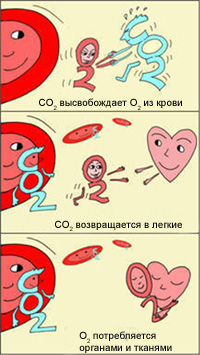
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
Учитывая, что белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные белки, далее подробно рассмотрен биосинтез его простетической группы, т.е. синтез тетрапиррольного соединения – гема (см. главу 2).
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Благодаря исследованиям Д. Шемина и др. выяснены основные пути синтеза гема. С помощью меченых предшественников было показано, что в синтезе гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают глицин, уксусная и янтарная кислоты. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода – янтарная кислота (сук-цинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
На I стадии, протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ-АЛК).
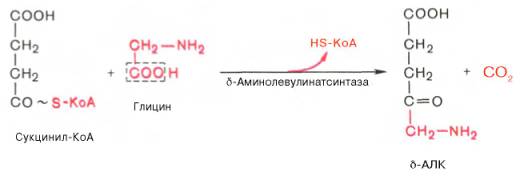
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза – гемом.
На II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения – порфо-билиногена (ПБГ).
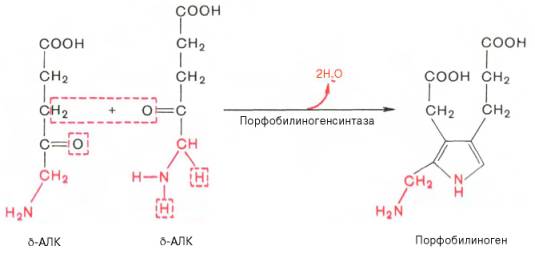
Фермент, катализирующий эту стадию,– порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы δ-аминолевулиновой кислоты и δ-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником гема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопро-теинов.
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза гема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
Читайте также:

