Синтез фосфолипидов биохимия кратко
Обновлено: 05.07.2024
У млекопитающих КЛ локализуется главным образом в сердечной ткани на внутренней мембране митохондрий, где он составляет не менее 20% от всех фосфолипидов. КЛ не выявляется на плазменных мембранах, на которых около 50—60% от общего пула фосфолипидов составляют сфингомиелин и ФХ, 20—30% — ФЭ, 10—15% ФС и менее 5% — ФИ. Сфингомиелин и ФХ адаптируют преимущественно ламелларную конфигурацию и, следовательно, вносят основной вклад в стабильность клеточной мембраны. Хотя ФЭ принимает преимущественно гексагональную фазу, он стабилизируется в клеточной мембране в присутствии других липидов. Однако некоторые специализированные функции клеточных мембран, например, экзоцитоз, требуют транзиторного перехода в другую, гексагональную фазу, и в этом процессе ФЭ, вероятно, играет важную роль.
Мембранная асимметрия фосфолипидов — универсальный феномен, характерный практически для всех клеток [Schroit A. J. и Zwaal R. F. A., 1991]. В настоящее время установлено, что поддержание асимметрии является активным процессом, реализующимся за счет активности АТФ и сульфгидрил-зависимого липидного насоса (аминофосфолипидтранслоказы), который перемещает аминофосфолипиды по направлению к внутренней мембране [Schroit A. J. и Zwaal R. F. A., 1991; Devaux P. F., 1992]. Активация приводит к увеличению движения фосфолипидов между слоями, что сопровождается потерей асимметрии. В частности, тромбоциты при стимуляции утрачивают нормальную асимметрию мембраны, что приводит к увеличению экспансирования анионного ФС. Этот процесс играет важную физиологическую роль в развитии локальной реакции свертывания крови. Кроме того, поверхностная экспозиция ФС (по крайней мере, на эритроцитах) является сигналом для быстрого выведения этих клеток из кровяного русла.
Отрицательно заряженные фосфолипиды создают поверхность, на которой происходит сборка ферментных комплексов двух основных реакций коагуляционного каскада. В одном из них (теназный комплекс) фактор X активируется комплексом фактора IXa и VIIIa, а в другом — протромбиназная реакция, происходит конверсия протромбина в тромбин ферментным комплексом, состоящим из фактора Xa и Va (протромбиназный комплекс). Взаимодействие факторов IXa, Xa и протромбина с липидной поверхностью происходит посредством образования кальций-зависимого мостика между остатками гамма-карбоксиглютаминовой кислоты этих белков и отрицательно заряженными полярными группами фосфолипидов. Связывание с липидной поверхностью приводит к увеличению локальной концентрации и эффективного расположения коагуляционных факторов, что способствует максимальной скорости протекания реакции. Любые вещества, мешающие сборке этих комплексов на фосфолипидной поверхности, в том числе антитела к фосфолипидам потенциально способны повышать уровень образования тромбина и нарушать свертывание крови.
Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина.
1 путь – "спасательный"
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.
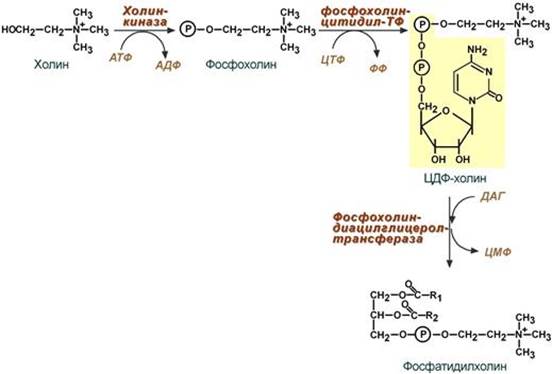
Путь – основной, синтез de novo
Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида.
Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин.
Путь – обратное превращение
Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина.
Липотропные вещества
Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся:
1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин.
2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина.
- пиридоксин (В6), способствующий образованию ФЭА из ФС.
- цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина.
35. Трансаминирование. Ферменты. Коферменты. Роль этого процесса для жизнедеятельности клетки. Диагностическое значение определения активности трансаминаз в сыворотке кровип
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат(активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
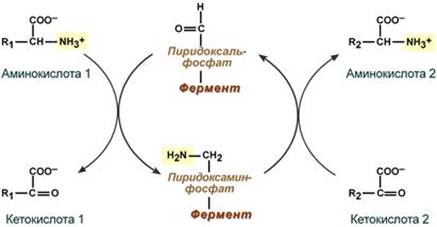
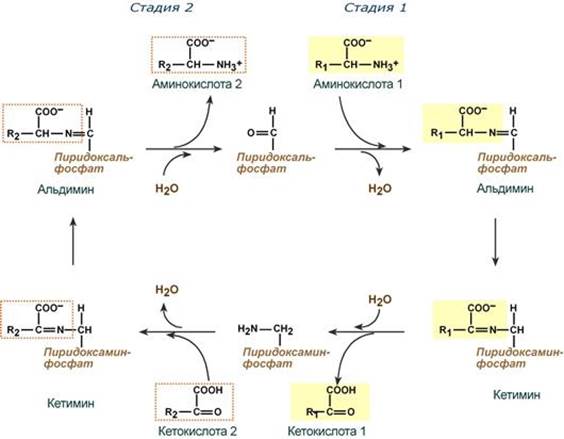
Весь перенос аминогруппы совершается в две стадии:
- к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
- на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований(альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
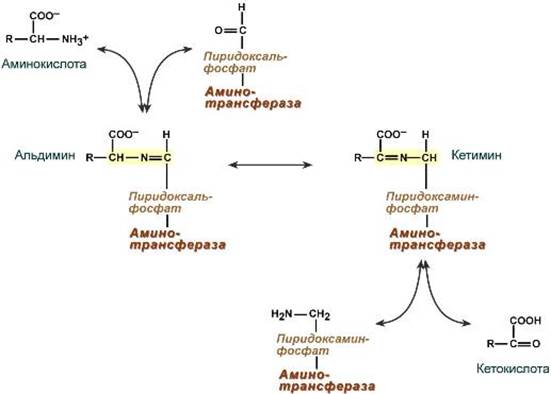
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
- пировиноградной с образованием аланина,
- щавелевоуксусной с образованием аспартата,
- α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.

Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Синтез фосфолипидов
Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина.
1 путь – "спасательный"
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.

Путь – основной, синтез de novo
Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида.
Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин.
Путь – обратное превращение
Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина.
Липотропные вещества
Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся:
1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин.
2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина.
- пиридоксин (В6), способствующий образованию ФЭА из ФС.
- цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина.
35. Трансаминирование. Ферменты. Коферменты. Роль этого процесса для жизнедеятельности клетки. Диагностическое значение определения активности трансаминаз в сыворотке кровип
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат(активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
- к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
- на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.

Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований(альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.

После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.

Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
- пировиноградной с образованием аланина,
- щавелевоуксусной с образованием аспартата,
- α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазма-тической сети клетки.
Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. В качестве примера рассмотрим синтез отдельных представителей фосфолипидов.
Биосинтез фосфатидилэтаноламина. Первоначально этаноламин при участии соответствующей киназы фосфорилируется с образованием фосфоэтаноламина:
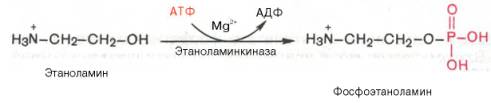
Затем фосфоэтаноламин взаимодействует с ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и пирофосфат (PPi):
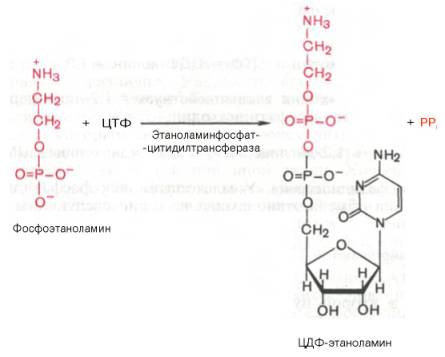
В следующей реакции ЦДФ-этаноламин, взаимодействуя с 1,2-дигли-церидом, образующимся при дефосфорилировании фосфатидной кислоты, превращается в фосфатидилэтаноламин. Реакция катализируется ферментом этаноламинфосфотрансферазой:
ЦДФ-этаноламин + 1,2-диглицерид –> Фосфатидилэтаноламин + ЦМФ.
Биосинтез фосфатидилхолина (лецитина). Фосфатидилэтаноламин является предшественником фосфатидилхолина. В результате последовательного переноса трех метальных групп от трех молекул S-аденозилметионина (донор метальных групп, см. главу 6) к аминогруппе остатка этаноламина образуется фосфатидилхолин:
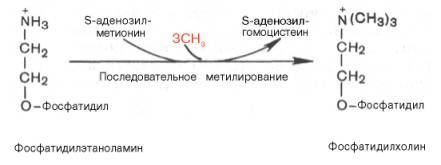
Существует еще один путь синтеза фосфатидилхолина в клетках животных. В этом случае, как и при синтезе фосфатидилэтаноламина, используется ЦТФ в качестве переносчика, но уже не фосфоэтаноламина, а фос-фохолина. На первом этапе синтеза свободный холин активируется под действием холинкиназы с образованием фосфохолина:
Затем фосфохолин реагирует с ЦТФ, образуя цитидиндифосфатхолин (ЦДФ-холин):
Фосфохолин + ЦТФ –> ЦДФ-холин + РРi.
В дальнейшем ЦДФ-холин взаимодействует с 1,2-диглицеридом, в результате чего образуется фосфатидилхолин:
ЦДФ-холин + 1,2-диглицерид –> Фосфатидилхолин + ЦМФ.
Биосинтез фосфатидилсерина. У млекопитающих фосфатидилсерин образуется в реакции обмена этаноламина на серин следующим путем:
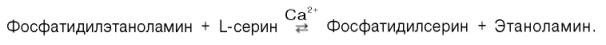
Существует и второй путь образования фосфатидилсерина, который связан с предварительным вовлечением фосфатидной кислоты в синтез фосфоглицеридов:
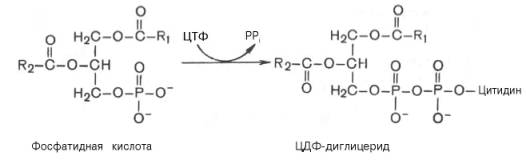
Затем происходит перенос серина на фосфатидильный остаток с образованием фосфатидилсерина:
ЦДФ-диглицерид + L-серин –> Фосфатидилсерин + ЦМФ.
Таким же путем образуется фосфатидилинозитол.
Биосинтез сфингомиелина. Интермедиатом в биосинтезе сфингомиелина является церамид (N-ацилсфингозин), который образуется при взаимодействии сфингозина с ацил-КоА. Сфингомиелин синтезируется в результате взаимодействия (реакции) церамида с ЦДФ-холином:

Следует отметить, что различие в синтезе холин- и этаноламинсодер-жащих фосфолипидов, с одной стороны, и инозитсодержащих фосфоли-пидов – с другой, заключается в том, что в первом случае при участии ЦТФ образуется ЦДФ-холин или ЦДФ-этаноламин – реакционноспособные азотистые основания, а во втором случае при участии ЦТФ образуется ЦДФ-диглицерид – реакционноспособная форма диглицерида.
В клетках эукариот синтез фосфолипидов происходит прежде всего на поверхности гладкого эндоплазматического ретикулума и на внутренней мембране митохондрий. Часть вновь синтезированных фосфолипидов остается в месте синтеза, но большинство предназначено для других отделов клетки. Процесс, при котором нерастворимые в воде фосфолипиды передвигаются от места синтеза к месту их последующего функционирования, не вполне понятен, но мы завершим этот раздел обсуждением некоторых механизмов, выясненных в последние годы.
Первые стадии синтеза глицерофосфолипи- дов те же, что при синтезе триацилглицеринов (рис. 21-17): два остатка жирной кислоты образуют сложноэфирные связи при атомах С-1 и С-2 L-глицерин-3-фосфата, давая фосфатидную кислоту. Обычно считают, что при С-1 — насыщенная жирная кислота, а при С-2 — ненасыщенная. Второй путь, приводящий к фосфатидной кислоте, — фосфорилирование диацилглицеринов специфической киназой.
Юджин П. Кеннеди


Рис. 21-24. Две главные стратегии образования фосфодиэфирной связи в фосфолипидах. В обеих стратегиях фосфатную группу для фосфодиэфирной связи предоставляет СDР.

Для синтеза фосфолипидов у Е. coli служат CDP-диацилглицерины
Эукариоты синтезируют анионные фосфолипиды из CDP-диацилглицеринов
У эукариот фосфатидилглицерин, кардиолипин и фосфатидилинозит (все анионные фосфолипиды; см. рис. 10-9, т. 1) синтезируются по той же стратегии, по которой осуществляется синтез фосфолипидов у бактерий. Фосфатидилглицерин образуется в точности так же, как у бактерий. Синтез кардиолипина у эукариот слегка отличается: фосфатидилглицерин конденсируется с CDP-диацилглицерином (рис. 21-26), а не с другой молекулой фосфатидилглицерина, как в случае Е. coli (рис. 21-25).
Фосфатидилинозит синтезируется путем конденсации CDP-диацилглицерина с инозитом (рис. 21-26). Специфические фосфатидилинозиткиназы затем превращают фосфатидилинозит в его фосфорилированные производные (см. рис. 10-17, т. 1). Фосфатидилинозит и его фосфорилированные продукты в плазматической мембране эукариот играют центральную роль в передаче сигналов (см. рис. 12-10,12-16, т. 1).

Рис. 21-26. Синтез кардиолипина и фосфатидилинозита у эукариот. Эти глицерофосфолипиды синтезируются по стратегии 1 (рис. 21-24). Фосфатидилглицерин синтезируется так же, как у бактерий (см. рис. 21-25). РI — фосфатидилинозит.

У эукариот метаболические пути образования фосфатидилсерина, фосфатидилэтаноламина и фосфатидилхолина взаимосвязаны
Рис. 21-27. Главный метаболический путь от фосфатидилсерина к фосфатидилэтаноламину и фосфатидилхолину у всех эукариот. А (AdoMet — S-аденозилметионин; adoHcy — S-аденозилгокоцистеин.

Рис. 21-28. Пути синтеза фосфатидилсерина и фосфатидил- холина у млекопитающих, а — фосфатидилсерин синтезируется в обменной Са 2+ -зависимой реакции, катализируемой фосфатидилсеринсинтазой 1 (РSS2) или фосфатидилсерин- синтазой 2 (РSS2). Фермент первого типа использует в качестве субстрата фосфатидилэтаноламин или фосфатидилхолин. Метаболические пути у бактерий и дрожжей соответствуют рис. 21-27. б — та же стратегия, что продемонстрирована для синтеза фосфатидилхолина (стратегия 2 на рис. 21-24), используется и для усвоения этаноламина в синтезе фосфатидил- этаноламина.
Пока не до конца понятно, каково влияние липидного состава на функции мембран, однако установлено, что этот фактор может оказывать серьезные эффекты. Исследователи получили плодовых мушек с мутациями в гене, который кодирует этаноламинкиназу (аналогична холинкиназе; рис. 21-28, б). Недостаток этого фермента выключает один из путей синтеза фосфатидилэтаноламина, уменьшая таким образом количество этого липида в клеточных мембранах. У мушек с такой мутацией (легко стрес- сируемый генотип) наблюдается временный паралич после электрической стимуляции или механического шока, хотя эти воздействия на дикий тип не влияют.

Синтез плазмалогенов требует образования связанного простой эфирной связью жирного спирта
Метаболический путь биосинтеза эфирных липидов, в том числе плазмалогенов и фактора активации тромбоцитов (см. рис. 10-10, т. 1), включает замещение этерифицированной жирноацильной группы на длинноцепочечный спирт с образованием простой эфирной связи (рис. 21-30). За этим следует присоединение головной группы по механизму, очень похожему на механизм образования обычных фосфолипидов со сложноэфирной связью. Наконец, характерная двойная связь в плазмалогенах (выделена голубым на рис. 21-30) вводится действием оксидазы со смешанной функцией, сходной с оксидазой десатурации жирных кислот (рис. 21-13). Пероксисомы являются главным участком синтеза плазмалогенов.

В синтезах сфинголипидов и глицерофосфолипидов некоторые предшественники и некоторые механизмы общие

Полярные липиды локализуются в специальных клеточных мембранах
После синтеза на гладком эндоплазматическом ретикулуме (ЭР) полярные липиды, в том числе глицерофосфолипиды, сфинголипиды и гликолипиды, включаются в специфические клеточные мембраны в определенных соотношениях по непонятным до сих пор механизмам. Мембранные липиды нерастворимы в воде, так что они не могут просто диффундировать от места их синтеза (ЭР) к месту внедрения в мембрану. Они поступают в мембранные пузырьки, которые отпочковываются от комплекса Гольджи, затем перемещаются и сливаются с мембраной-мишенью (см. рис. 11-22, т. 1). Нельзя сказать, что все детали этих метаболических путей полностью известны, хотя многое уже прояснилось. Белок с молекулярной массой 68 кДа, названный CERT (от англ. ceramide transport), переносит церамид от эндоплазматического ретикулума к аппарату Гольджи.
Цитозольные белки также связывают фосфолипиды и стерины и переносят их между клеточными мембранами, благодаря всем этим механизмам мембраны разных органелл имеют характерный для них липидный состав (см. рис. 11-2, т. 1).
Краткое содержание раздела 21.3 Биосинтез мембранных фосфолипидов
■ Диацилглицерины — главные предшественники глицерофосфолипидов.
■ У бактерий фосфатидилсерин образуется путем конденсации серина с СDР-диацилглицерином; при декарбоксилировании фосфатидилсерина получается фосфатидилэтаноламин. Фосфатидилглицерин образуется при конденсации СDР-диацил глицерина с глицерин-3-фосфатом, после чего следует отщепление фосфата от сложноэфирной связи.
■ У дрожжей пути синтеза фосфатидилсерина, фосфатидилэтаноламина и фосфатидилглицерина похожи на пути у бактерий; фосфатидилхолин образуется путем метилирования фосфатидилэтаноламина.
■ В клетках млекопитающих существуют некоторые пути, сходные с бактериальными, но пути синтеза фосфатидилхолина и фосфатидилэтаноламина до некоторой степени отличаются. Спирт головной группы (холин или этаноламин) активируется в виде СDР-производного, затем конденсируется с диацилглицерином. Фосфатидилсерин получается только из фосфатидилэтаноламина.
■ Синтез плазмалогенов включает образование характерной для них двойной связи с помощью оксидазы со смешанной функцией. Головные группы сфинголипидов присоединяются посредством специфических механизмов.
■ Фосфолипиды перемещаются к местам их назначения внутри клетки в виде транспортных везикул или с помощью специфических белков.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:

