Сигма и пи связи в химии кратко
Обновлено: 02.07.2024
ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующих атомов. Результирующее электронное облако σ-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующих атомов. Простые связи в химических соединениях обычно являются (т-связями (см. Простая связь). Электронное облако π-связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. Употребление греческих букв σ и π связано с соответствием их латинским буквам s и р в обозначении электронов атома, при участии которых впервые появляется возможность для образования σ- и π-связей соответственно. Поскольку облака атомных р-орбиталей (px, ру, pz) симметричны относительно соответствующих осей декартовых координат (х, у, z), то, если одна р-орбиталь, например pz, принимает участие в образовании σ-связи (ось z — линия связи), две оставшиеся р-орбитали (px, py) могут принять участие в образовании двух π-связей (их узловые плоскости будут yz и xz соответственно; см. рис. 2). В образовании σ и π-связей могут принять участие также d- (см. рис. 1) и f-электроны атома.
Если между атомами в молекуле возникают одновременно как σ-, так и π-связи, то результирующая связь является кратной (см. Кратные связи, Двойная связь, Тройная связь, а также Валентность).
Лит.: Пиментел Г., Спратли Р., Как квантовая механика объясняет химическую связь, пер. с англ., М., 1973; Шусторович Е. М., Химическая связь, М., 1973.
Рис. 1. Схематическое изображение пространственной ориентации орбиталей при образовании σ-связи в результате s — s-, s — pσ-, pσ — pσ-взаимодействий (а) и π-связи в результате pπ — , pπ — , dπ — dπ — взаимодействий (б).
Рис. 2. Схематическое изображение облаков px-, ру-, pz- электронов. Показаны оси декартовых координат и узловые плоскости px- и ру-орбиталей.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:

В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):

В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:

Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.

σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
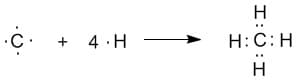
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp 2 , sp 3 ).
Типы гибридизации атомных орбиталей
sp 3 -гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp 3 -гибридизацией.

sp 3 -гибридизация орбиталей в молекуле метана
Как видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp 3 -гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.

Гибридизация орбиталей молекул метана, аммиака, воды
sp 2 -гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
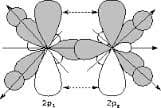
sp 2 -гибридизация атомов этилена
Плоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp 2 -гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
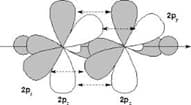
sp-гибридизация атомов ацетилена
Ниже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp 2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp 3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4 — , TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp 2 d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4] 2 — |
| s,p,p,p,d | sp 3 d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp 3 d 2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)6 3- , CoF6 3- |
Гибридные орбитали в пространстве располагаются различным образом:

Пространственное расположение гибридных орбиталей различных типов
Объектами изучения биоорганической химии являются белки и пептиды, нуклеиновые кислоты, углеводы, липиды, биополимеры, алкалоиды, терпеноиды, витамины, антибиотики, гормоны, токсины, а также синтетические регуляторы биологических процессов: лекарственные препараты, пестициды и др.
Изомерия органических соединений, ее виды. Характеристика видов изомерии, примеры.
Различают два вида изомерии: структурную и пространственную (т.е. стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Например: молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан. С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы
Межклассовая изомерия- изомерия веществ, принадлежащих к разным классам органических соединений.
Современная классификация и номенклатура органических соединений.
В настоящее время широко используется систематическая номенклатура- IUPAC- международная единая химическая номенклатура. Правила ИЮПАК основываются на несколько систем:
1) радикально-функциональная ( в основе названия лежит название функц-й группы),
2) соединительная (названия составляют из нескольких равноправных частей),
3) заместительная (основой названия служит углеводородный фрагмент).


Ковалентные связи. Пи- и сигма- связи.
Ковалентная связь являетсся основным типом связи в органических соединениях.
Это связь, образованная перекрытием пары валентных электронных облаков.
Пи-связь- это ковалентная связь, образующаяся путем перекрывания р-атомных орбиталей.
Сигма-связь- это ковалентная связь, образующаяся при перекрывании s-атомных орбиталей.
Если между атомами в молекуле образуются как s-, так и р-связи, то образуется кратная (двойная или тройная) связь.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, лежащая в основе современных представлений о структуре орг. соединений,которая состоит из следующих основных положений:
1.В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
2.Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
3.Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
4.Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
5.Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Конфигурация — относительное пространственное расположение атомов или групп атомов в молекуле химического соединения.
Конформация — пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей
Сигма связь-ковалентная связь образованная при перекрывании атомных s-электронных облаков, происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т.е. вблизи оси связи)
В образовании сигма-связи могут принимать участие p-электронные облака, ориентированные вдоль оси связи. в молекуле HF ковалентная сигма-связь возникает вследствие перекрывание 1s-электронного облака атома водорода и 2p-электронного облака атома фтора.
Химическая связь в молекуле F2 тоже сигма связь, она образована 2p-элект. облаками двух атомов фтора.
Сигма -связи -прочные, одинарные и простые связи
Пи-связь — ковалентная связь, при взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуются не одна, а две области перекрывания, расположенные по обе стороны от этой связи.
Примеры:
в молекуле N2 атомы азота связаны в молекуле тремя ковалентными связями, но связи неравноценны одна из них сигма, две другие пи-связи.
вывод о неравноценности связей в молекуле подтверждается тем, что энергия их разрыва различна; пи-связь является непрочной
Общая химия
3. Химическая связь
3.5. Сигма — и пи-связь
Пространственно различают два типа связи — сигма — и пи-связь.
1. Сигма-связь (σ-связь) — простой (одинарный) ковалентная связь, образующаяся перекрыванием электронных облаков по линии, соединяющей атомы.
Связь характеризуется осевой симметрией:

В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
Пи-связь (π-связь). Если у атома после образования σ-связи остались неспаренные электроны, он может использовать их на образование второго типа связи, который называют π-связью. Рассмотрим его механизм на примере образования молекулы кислородаO2.

Электронная формула атома Кислорода -8O1s22s22p2, или
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:

Одна пара идет на образование σ-связи:

Другая, перпендикулярная к ней, — на образование π-связи:

Еще однаp-орбиталь (рв), как иs-орбиталь, на которой находятся по две спаренные электроны, участия в связи не берут и не обобществляются.
Аналогичным образом при образовании органических соединений (алкенов и алкадієнів) послеsp2-гибридизации у каждого из двух атомов Углерода (между которыми образуется связь) остается по одной негібридизованій р-орбитали.

которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:

В сумме σ — и π-связи дают двойную связь.
Тройная связь образуется аналогично и состоит из одной σ-связи (рх) и двух я-связей, которые образованы двумя взаимноперпендикулярными парамиp-орбиталей (ру,pz):

Пример: образование молекулы азотаN2.

Электронная формула атома Азота-7N 1s22s22p3или Триp-электроны в атоме Азота является неспареними и могут образовать три совместные ковалентные пары с электронами второго атома Азота:

В результате образования трех общих электронных парN≡Nкаждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2s22p6(октет электронов).
Тройная связь возникает и при образовании алкінів (в органической химии).
В результатеsг-гибридизации внешней электронной оболочки атома Углерода образуется двеsр-орбитали, расположенные по оси 0Х. Одна из них идет на формирование в-связи с другим атомом Углерода (вторая — на формирование σ-связи с атомом Водорода). А две не гібридизовані р-орбитали (ру,pz) размещаются перпендикулярно друг к другу и к оси соединения атомов (0Х).
С помощью π-связи формируется молекула бензену и других аренов.
Все шесть атомов Углерода имеют общую π-электронное облако, плотность которой локализована над и под плоскостью ароматического ядра и равномерно распределена (делокалізована) между всеми атомами Углерода. По современным представлениям она имеет форму тороида:

Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или -типу.
- σ-Связь – ковалентная связь, образованная при перекрывании s-, p— и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
- π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи).
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите "Нет".
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Подготовка к Единому Государственному экзамену по химии 2021 г.

Дорогие друзья! Если Вы готовитесь к ЕГЭ по химии, то можете воспользоваться этим курсом. Курс является бесплатным и предназначен для самообучения.
Курс состоит из разделов, каждый из которых соответствует вопросам ЕГЭ. Названия разделов Вы можете увидеть в левом, навигационном меню. В каждом разделе есть соответствующие тренировочные онлайн-тесты для закрепления знаний.
Если Вам потребуются консультации по вопросам, вызывающим наибольшие затруднения, то Вы всегда можете обратиться ко мне за помощью.
С уважением, преподаватель высшей квалификационной категории, почетный работник среднего профессионального образования Российской Федерации, Вера Васильевна Быстрицкая.

Демо - 2017 Пройди тест - проверь свои знания
Читайте также:

