Рилизинг гормоны это кратко
Обновлено: 05.07.2024
РИЛИ́ЗИНГ-ГОРМО́НЫ, рилизинг-факторы (от англ. release – освобождать, выпускать), пептидные нейрогормоны многих позвоночных животных и человека. Синтезируются гл. обр. в гипоталамусе. Секретируются в ответ на нервные или химич. стимулы. С током крови переносятся в переднюю долю гипофиза (аденогипофиз), где стимулируют (либерины) или угнетают (статины) образование или выделение т. н. тропных гормонов. Напр., кортиколиберин и тиролиберин способствуют соответственно выработке кортикотропина и тиреотропина , а пролактостатин и соматостатин препятствуют образованию пролактина и соматотропина . Благодаря Р.-г. обеспечивается взаимодействие высших отделов ЦНС с эндокринной системой. Некоторые Р.-г. синтезируются и секретируются в клетках др. органов. Так, соматостатин обнаруживается в желудке и поджелудочной железе и участвует в локальных механизмах регуляции функции этих органов.
Гипоталамус. Гонадотропный рилизинг гормон (ГнРГ) - функции
Гипоталамус и гипофиз объединены в систему, управляющую многими эндокринными органами, в том числе половыми железами (гонадами). В этой и несколких последующих статьях будет описана гипоталамо-гипофизарно-яичниковая система и механизмы регуляции менструального цикла, на которые оказывают влияние также центральная нервная система (ЦНС), другие эндокринные системы и окружающая среда. Важнейшие гормоны гипоталамо-гипофизарно-яичниковой системы — гонадотропный рилизинг-гормон (ГнРГ), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), эстрадиол и прогестерон. Остальные гормоны (ингибин, активин, фоллистатин и эндорфины) играют вспомогательную роль.
Гипоталамус заполняет собой нижнюю часть боковой стенки и дна III желудочка головного мозга, масса его составляет около 10 г. Обычно выделяют восемь основных специфических ядер (постоянных скоплений групп нейронов) и три области гипоталамуса (менее четко отграниченных скоплений нейронов). С точки зрения репродуктивной функции наиболее важны из них дугообразное ядро и преоптическая область — именно здесь расположены нейроны, синтезирующие люлиберин. Дугообразное ядро находится в медиобазальных отделах гипоталамуса, оно расположено ближе остальных ядер к зрительному перекресту и воронке. Оно также содержит дофаминергические нейроны, угнетающие секрецию пролактина гипофизом, и нейроны, синтезирующие соматолиберин (рилизинг-фактор соматотропина).
Вещества, синтезируемые нейросекреторными клетками гипоталамуса, в том числе гонадотропный рилизинг-гормон (ГнРГ), поступают в портальную систему из срединного возвышения, выступа воронки гипофиза, расположенного на дне III желудочка. Портальная система выступает основным связующим звеном между гипоталамусом и аденогипофизом (передней частью гипофиза). В свою очередь, воронка непосредственно соединяет тела гипоталамических нейронов с нейрогипофизом (задней частью гипофиза). Она расположена сразу же позади зрительного перекреста.
Гонадотропный рилизинг гормон (ГнРГ)
Гонадотропный рилизинг гормон (ГнРГ) — гипоталамический регулятор репродуктивной функции первого порядка. Описано два типа гонадотропного рилизинг гормона (ГнРГ) человека (ГнРГ-1 и ГнРГ-2). Оба они представляют собой пептиды, состоящие из 10 аминокислот, их синтез кодирован разными генами. По меньшей мере 20 других типов ГнРГ обнаружено у рыб, амфибий и других хордовых животных; ни один из них не найден у человека.
Гонадотропный рилизинг гормон-1 был впервые описан и синтезирован в 1971 г. Эндрю Шалли и Роже Гийменом, получившими впоследствии за это Нобелевскую премию. Строение гонадотропного рилизинг гормона-1 общее у всех млекопитающих, а его действие одинаково как у самцов, так и у самок. Гонадотропный рилизинг гормон-1 синтезируется из более сложного белка-предшественника, в своем составе имеющего 92 аминокислоты и содержащего гонадотропный рилизинг гормон-ассоциированный пептид. Затем гонадотропный рилизинг гормон-1 транспортируется по аксональному пути, именуемому тубероинфундибулярным трактом, к срединному возвышению гипоталамуса, откуда дозированно поступает в циркуляцию портальной системы гипофиза. Период полужизни гонадотропного рилизинг гормона-1 очень короткий (2-4 мин), так как он быстро расщепляется в участках между аминокислотами 5 и 6, 6 и 7, 9 и 10. Из-за столь короткого периода полужизни и быстрого разведения в периферическом кровотоке определить концентрацию гонадотропного рилизинг гормона-1 в крови достаточно трудно, к тому же она не коррелирует с активностью гипофиза.
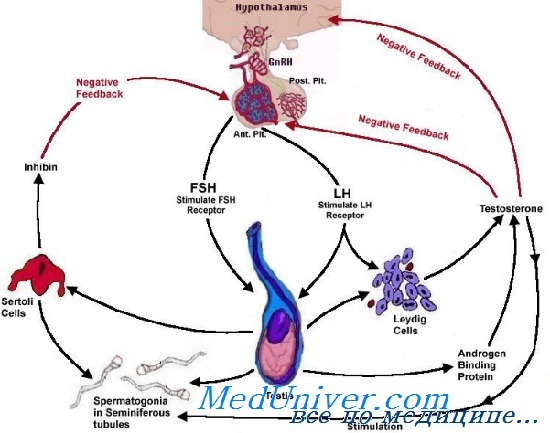
Основные эффекты гонадотропного рилизинг гормона-1 по отношению к гонадотропинам аденогипофиза таковы:
• синтез и накопление гонадотропинов;
• перемещение гонадотропинов из резервного пула к участку, где может произойти их быстрое высвобождение;
• непосредственная секреция гонадотропинов.
Выбросы гонадотропного рилизинг гормона-1 происходят в соответствии с внутренней ритмической активностью соответствующих нейронов дугообразного ядра. Импульсный выброс ГнРГ-1 из срединного возвышения в пределах пограничных значений частоты и амплитуды обеспечивает нормальную секрецию гонадотропинов. Непрерывное, а не импульсное воздействие ГнРГ-1 приводит к угнетению секреции ФСГ и ЛГ и супрессии транскрипции генов, ответственных за синтез гонадотропинов.
В отсутствие обратной связи с половыми железами частота пика ГнРГ составляет 1 раз в час. Во время менструального цикла частота и амплитуда пика ГнРГ варьирует в зависимости от обратной связи с гипоталамусом. В целом фолликулярная фаза характеризуется частыми низкоамплитудными пиками, а лютеиновая — редкими высокоамплитудными пиками. Однако как у разных индивидуумов, так и у одного и того же индивидуума в разное время существуют большие различия в частоте и амплитуде пиков. У человека оценить частоту и амплитуду пиков ГнРГ можно, измерив частоту и амплитуду колебаний содержания ЛГ в крови.
Синтез гонадотропного рилизинг гормона-2 происходит в основном за пределами головного мозга, в тканях почек, костного мозга и предстательной железы. Этим он отличается от ГнРГ-1, который за пределами головного мозга образуется в незначительном количестве. Хотя ГнРГ-2 и способен индуцировать высвобождение ФСГ и ЛГ, по-видимому, у него есть множество других функций в организме, например регуляция клеточной пролиферации и способствование секреции яичниковых и плацентарных гормонов. Попытки в середине 90-х годов прошлого века идентифицировать эстрогеновые рецепторы (ЭР) на нейронах, синтезирующих ГнРГ, сначала были безуспешными. Однако в последующем, с появлением более совершенных технологий, такие рецепторы все же были обнаружены в дугообразном ядре.
Активность гипоталамуса регулируется также нервными импульсами из высших мозговых центров. Нейроны, синтезирующие ГнРГ, имеют обширные связи как друг с другом, так и с прочими нейронами. Эффекты этих нейротранс-миттеров позволяют понять механизмы влияния на менструальный цикл некоторых физиологических или патологических состояний.
Клетки, синтезирующие гонадотропный рилизинг гормон, эмбриологически происходят из обонятельной области. Нейроны, вырабатывающие ГнРГ, так же как и обонятельные клетки эпителия носовой полости, снабжены ресничками. В процессе эмбриогенеза нейроны, синтезирующие ГнРГ, мигрируют из медиальной обонятельной плакоды в дугообразное ядро гипоталамуса. Общее происхождение нейронов, выделяющих ГнРГ, и обонятельных клеток можно проиллюстрировать на примере синдрома Кальманна, при котором дефицит ГнРГ сочетается с аносмией. Считают, что синдром Кальманна вызван множественными дефектами генов, ответственных за миграцию нервных клеток.
Общее происхождение нейронов, синтезирующих гонадотропный рилизинг гормона, и обонятельных клеток предполагает связь между феромонами и цикличностью менструаций. Феромоны — переносимые по воздуху химические вещества с малой молекулярной массой, которые организм индивидуума синтезирует и выделяет во внешнюю среду. Их могут воспринимать другие индивидуумы того же вида, что влияет на сексуальное и социальное поведение воспринимающих. Хорошо известно, что у женщин, работающих или живущих вместе, зачастую постепенно синхронизируются менструальные циклы. Более того, показано, что не обладающие запахом компоненты отделяемого подмышечных желез менструирующих женщин могут изменять характеристики менструального цикла у женщин, подвергающихся воздействию этих компонентов. Предположительные механизмы этих изменений опосредованы взаимодействием обонятельных нейронов и нейронов, синтезирующих гонадотропного рилизинг гормона.

Кортикотропин-рилизинг-гормон — это основной элемент, определяющий реакцию организма на стресс. Он также присутствует при заболеваниях, вызывающих воспаление. Слишком много или слишком мало кортикотропин-рилизинг-гормона может иметь ряд негативных эффектов.
Альтернативные названия кортикотропин-рилизинг-гормона:
- кортикотропин-рилизинг-гормон;
- фактор высвобождения кортикотропина;
- кортикотропин-рилизинг-фактор;
- кортиколиберин;
- CRH;
- CRF.
Что такое кортикотропин-рилизинг-гормон?
Кортикотропин-рилизинг-гормон, секретируемый паравентрикулярном ядра в гипоталамусе, он помимо других функций, высвобождает гормоны. Кортикотропин-рилизинг-гормон имеет несколько важных действий.
Его основная роль в организме — это центральная движущая сила гормональной системы стресса, известная как ось гипоталамус-гипофиз-надпочечники. Кортикотропин-рилизинг-гормон получил такое название, потому что он вызывает высвобождение адренокортикотропного гормона из гипофиза. Адренокортикотропный гормон, в свою очередь, перемещается с кровотоком в надпочечники, где вызывает секрецию гормона стресса кортизола.
Кортикотропин-рилизинг-гормон также действует на многие другие области мозга, подавляя аппетит, усиливая тревожность и улучшая память и избирательное внимание. Вместе эти эффекты координируют поведение, развивая и настраивая реакцию организма на стрессовые ситуации.
Кортикотропин-рилизинг-гормон также вырабатывается во время беременности в увеличивающихся количествах плодом и плацентой, что приводит к увеличению кортизола. В конечном итоге считается, что высокие уровни высвобождающего кортикотропин гормона, наряду с другими гормонами, вызывают роды.
Наконец, в меньших количествах кортикотропин-рилизинг-гормон также вырабатывается некоторыми белыми кровяными тельцами, где он стимулирует отек или болезненность, известную как воспаление, особенно в кишечнике.
Как контролируется кортикотропин-рилизинг-гормон?

Как контролируется кортикотропин-рилизинг-гормон?
Секреция кортикотропин-рилизинг-гормона стимулируется нервной деятельностью мозга. Он следует естественному 24-часовому ритму в условиях отсутствия стресса, когда он достигает максимума около 8 часов утра и минимума в ночное время.
Тем не менее, уровень высвобождающего гормона кортикотропина также может быть выше нормального дневного уровня из-за стрессового опыта, инфекции или даже физических упражнений. Повышение уровня кортикотропин-рилизинг-гормона приводит к повышению уровня гормона стресса кортизола, мобилизующего энергетические ресурсы, необходимые для устранения причины стресса. Высокий уровень гормонов стресса в течение длительного периода может иметь негативные последствия для организма. Из-за этого кортизол блокирует непрерывное высвобождение кортикотропин-рилизинг-гормона и выключает ось гипоталамус-гипофиз-надпочечники, что известно как отрицательная обратная связь. петля
Некоторые эффекты кортикотропин-рилизинг-гормона в головном мозге также могут быть заблокированы лептином, гормоном, вырабатываемым жировой тканью. Отчасти поэтому кортикотропин-рилизинг-гормон может контролировать аппетит.
Что произойдет, если у меня будет слишком много кортикотропин-рилизинг-гормона?
Аномально высокий уровень кортикотропин-рилизинг-гормона связан с множеством заболеваний. Поскольку он стимулирует беспокойство и подавляет аппетит, предполагается, что слишком много кортикотропин-рилизинг-гормона вызывает нервные проблемы, такие как:
- клиническая депрессия;
- беспокойство;
- нарушения сна;
- нервная анорексия.
Кроме того, высокий уровень кортикотропин-рилизинг-гормона также может усугубить некоторые воспалительные проблемы:
- ревматоидный артрит;
- псориаз;
- язвенный колит;
- болезнь Крона.
Поначалу это может показаться неожиданным, потому что повышенный уровень кортикотропин-рилизинг-гормона в головном мозге может привести к увеличению выработки глюкокортикоидов, а глюкокортикоиды обладают противовоспалительным действием.
Однако, исследования показали, что когда высокие уровни высвобождающего гормона кортикотропина возникают в тканях за пределами мозга, они действительно могут оказывать мощное воспалительное действие. Поэтому, повышенный уровень кортикотропин-рилизинг-гормона в суставах, коже или кишечнике может усугубить эти воспалительные состояния или даже сыграть роль в их развитии.
Что произойдет, если у меня будет слишком мало кортикотропин-рилизинг-гормона?
Исследования показали, что у людей с болезнью Альцгеймера особенно низкий уровень кортикотропин-рилизинг-гормона. Ученые также подозревают, что недостаток кортикотропин-рилизинг-гормона может вызвать синдром хронической усталости, иногда называемый миалгическим энцефаломиелитом. При нем у больных возникают проблемы со сном, памятью и концентрацией. Однако, прежде чем это будет подтверждено, необходимы дальнейшие исследования по обоим этим вопросам.
Во время беременности низкая выработка кортикотропин-рилизинг-гормона плодом или плацентой может привести к выкидышу.

Рис. 1 Функционирование ГГН-оси в норме

Стимул, вызвавший стрессор, достигает ГГН-ось из миндалевидного тела. В ответ на это в паравентрикулярном ядре гипоталамуса высвобождается вазопрессин и кортикотропин-рилизинг гормон (КРГ) – главный регулятором ГГН-оси. Он состоит из 41 аминокислотного остатка, а его синтез регулируется геном CRF. Вместе с вазопрессином КРГ по системе портальных вен попадает в передние доли гипофиза и стимулирует продукцию прогормона проопиомеланокортина (ПОМК), который затем перерабатывается в аденокортикотропный гормон (АКТГ), опиоиды и меланокортин. АКТГ, в свою очередь, стимулирует высвобождение в пучковой зоне коркового вещества надпочечников глюкокортикоидов ( кортизола у людей и кортикостерона у мышей), которые в дальнейшем оказывают отрицательную обратную связь на гипофиз и гипоталамус посредством воздействия на минералкортикоидные (МР) и глюкокортикоидные рецепторы (ГР), из-за чего уменьшается степень активации ГГН-оси (Marni N. Silverman, 2012).
Несмотря на распространённое мнение, что главные проявления гиперактивации ГГН-оси связаны только лишь с гиперкортизолемией, появляется всё больше данных, что повышенный уровень кортикотропин-рилизинг гормона (КРГ), являющимся главным регулятором ГГН-оси, обладает, куда большим негативным эффектом на функциональные системы головного мозга.
Эффекты, проявляемые КРГ, зависят от зон его синтеза и мест наибольшей концентрации его рецепторов. Так, помимо гипоталамуса, он выделяется также в нейронах миндалевидного тела, гиппокампа и голубого пятна. Данный нейропептид оказывает локальное нейромодулирующие воздействие на нейроны в течение нескольких секунд после высвобождения, действуя через два специфических рецептора КРГ 1 и 2 типов (КРГР1, КРГР2), которые широко распространены в различных отделах головного мозга. Стоит также отметить, что к семейству КРГ-нейропептидов, помимо самого КРГ, относятся ещё и урокортины (UCN 1, 2 3), которые также как и возопрессин, орексин и динорфин влияют на гомеостаз мозга.
В зависимости от дозы и времени воздействия КРГ на мишени различаются и его эффекты. Например, высвобождение КРГ в оптимальных дозах при остром стрессе в центральном ядре миндалевидного тела способствуют консолидации памяти, а в гиппокампе – увеличению пластичности синапсов. Однако при воздействии высоких доз КРГ в течение длительного времени происходит ухудшение функции гиппокампа, что проявляется повреждением нейронов и уменьшением числа синапсов.
Так, в течение всего эпизода меланхоличной депрессии у пациентов обнаруживается повышенный уровень КРГ в плазме и церебро-спинальной жидкости. В патологоанатомических исследованиях умерших людей, страдавших депрессией, найдены доказательства гиперактивности КРГ в паравентрикулярных ядрах гипоталамуса, корковых областях, ядрах моста и голубом пятне. В то же время, повышенный уровень КРГ у лиц с депрессией снижался после курса электросудорожной или антидепрессивной терапии.
Более того, у здоровых индивидов, в семьях которых высок генетический риск развития депрессии, результаты комбинированного ДЕКС/КРГ теста (DEX/CRH: dexamethasone-suppression/corticotropin-releasinghormone-stimulationtest), который сочетает супрессию дексаметазоном со стимуляцией КРГ, оказываются в промежутке между результатами пациентов с депрессией и контрольной группой здоровых добровольцев. Данные результаты указывают на то, что даже небольшие изменения в функционировании ГГН-оси имеют генетический бэкграунд, который с возрастом повышает риск развития депрессии или других опосредованных стрессом заболеваний. В другом исследовании показано, что у лиц с депрессией значительно повышена частота G-аллеля полиморфизма (rs242939) гена КРГР1 в сравнении с контрольной группой. В совокупности, эти наблюдения поддерживают концепцию того, что дисрегуляция ГГН-оси, которая проявляется в том числе повышенным уровнем КРГ, возможно, связана с генетической предрасположенностью и представляет фактор риска развития депрессии.
При депрессии также наблюдается снижение активности нейротрофических факторов. Это приводит к снижению синаптических связей в гиппокампе и префронтальной коре, что коррелирует с депрессивной симптоматикой. Обнаружено наличие тесной связи между нейротрофическими факторами, в частности нейротрофическим фактором мозга (BDNF), и КРГ, который модулирует их продукцию, выработку и активность.
Интересно и то, что изменения в рецепторном аппарате КРГ так же влияют на формирование определенных симптомокомплексов. Так, повторные воздействия стресса приводят к изменение соотношения КРГР1 и КРГР2 в сторону увеличения КРГР1в областях, связанных с депрессией. КРГР1 способен модулировать тревожное поведение и независимо от ГГН-оси, а его недостаток защищает человека от формирования негативных последствий стресса не зависимо от возраста. Это связано с тем, что КРГР1 контролируют глутаматергические, норадренолинергические и дофаминергические нейронные контуры, внося значимый вклад в проявления расстройств, связанных со стрессом.
Это подтверждают и обширные данные, свидетельствующие о том, что три основные нейромедиаторные системы (серотониновая, норадренолиновая и дофаминовая) тесно взаимодействуют и влияют на уровнь КРГ. Так, в голубом пятне (важнейшее ядро норадреналинергической системы в головном мозге), дорсальных ядрах шва (важнейшее ядро серотонинергической системы) и в вентральной области покрышки (важнейшее ядро мезокортиколимбической дофаминергической системы) обнаруживается высокий уровень экспрессии КРГР1 и КРГР2, а общий уровень экспрессии этих рецепторов и их соотношение – важный показатель индивидуальной переносимости стресса и риска развития депрессии.
Например, в дорсальном ядре шва КРГ имеет противоположные эффекты на серотонинергическую систему в зависимости от того на какие рецепторы (КРГР1 или КРГР2) он действует. Так, активация КРГР1 в этой области приводит к усилению ГАМК-ергических тормозящих воздействий на серотониновую систему, а активация КРГР2 оказывает, наоборот, потенцирующие действие.
Дисбаланс в нейромедиаторных системах затрагивает и саму ГГН-ось, так как ацетилхолин, дофамин и норадреналин содействуют секреции КРГ в гипоталамусе, а серотонин, в свою очередь, ингибирует секрецию КРГ в гипоталамусе и АКТГ в гипофизе, что тоже вносит свой вклад в дисфункцию ГГН-оси.
Рис. 2 Нарушение сна при депрессии

Нарушение сна при депрессии характеризуется нарушением медленно-волнового сна и увеличением REM-фазы сна в результате дисбаланса между КРГ и СРГ (Steiger, 2003).
Обобщённые результаты позволяют предположить, что растормаживание REM-фазы сна вероятно, может рассматриваться как специфический показатель, отражающий центральную активность КРГ, с помощью которого возможно выделение пациентов с депрессией, у которых целесообразно проведение терапии антагонистами КРГР1, широко использующихся для терапии эндокринологических заболеваний.
Источник: Касьянов Е.Д., Мазо Г.Э. Функционирование гипоталамо-гипофизарно-надпочечниковой оси при депрессии: актуальное состояние проблемы. // Журнал Психическое здоровье. – 2017. – №8. – С. 27 – 34.
Читайте также:

