Регуляция клеточного цикла кратко
Обновлено: 07.07.2024
Описание клеточного деления базируется на данных световой микроскопии в сочетании с микрокиносъемкой и на результатах световой и электронной микроскопии фиксированных и окрашенных клеток.
1.1. Интерфаза G0
Клетки вступают в G0-фазу с контрольной точки в G1-фазе, например, точки рестрикции у животных и стартовой точки у дрожжей. Это обычно происходит в ответ на нехватку факторов роста или питательных веществ. В течение G0-фазы аппарат клеточного цикла разобран, исчезают циклины и циклин-зависимые киназы. Клетка пребывает в G0-фазе до тех пор, пока не появится повод начать деление. Клетки некоторых типов в зрелом организме, как, например, паренхимные клетки печени и почек, вступают в G0-фазу почти навсегда, и побудить их вновь начать делиться могут лишь особые обстоятельства. Другие типы клеток, как, например, эпителиальные клетки, продолжают делиться в течение всей жизни организма и редко входят в G0-фазу.
Хотя многие клетки в G0-фазе могут умереть вместе со всем организмом, не все клетки, вступающие в G0-фазу, обречены в скором времени умереть. Это часто является результатом отсутствия стимула для клетки вновь вступить в клеточный цикл.
Старение клеток отличается от состояния покоя тем, что старение клеток — это состояние, вызванное повреждением ДНК или деградацией, делающей размножение клетки невозможным. Кроме того, старение, в отличие от покоя, часто служит биохимической альтернативой саморазрушению — апоптозу для сильно повреждённых клеток. Наконец, покой — обратимое состояние, а старение — нет
1.2. Митоз
Продолжительность митоза в среднем составляет 1—2 часа[1][4]. Митоз клеток животных, как правило, длится 30—60 минут, а растений — 2—3 часа.[5] За 70 лет в теле человека суммарно осуществляется порядка 1014 клеточных делений[6].
Аппарат клеточного деления
Деление всех эукариотических клеток сопряжено с формированием специального аппарата клеточного деления. Активная роль в митотическом делении клеток зачастую отведена цитоскелетным структурам. Универсальным как для животных, так и для растительных клеток является двухполюсное митотическое веретено, состоящее из микротрубочек и связанных с ними белков. Веретено деления обеспечивает строго одинаковое распределение хромосом между полюсами деления, в области которых в телофазе образуются ядра дочерних клеток.
Ещё одна не менее важная структура цитоскелета отвечает за разделение цитоплазмы (цитокинез) и, как следствие, за распределение клеточных органелл. В животных клетках за цитокинез отвечает сократимое кольцо из актиновых и миозиновых филаментов. В большинстве клеток высших растений из-за наличия жёсткой клеточной стенки цитокинез протекает с образованием клеточной пластинки в плоскости между двумя дочерними клетками. При этом область образования новой клеточной перегородки определяется заранее предпрофазным пояском из актиновых микрофиламентов, а поскольку актин участвует также в формировании клеточных септ у грибов, возможно, что он направляет цитокинез у всех эукариот [19] .
Веретено деления
Поздняя метафаза митоза в клетке лёгкого тритона (использованы иммунофлуоресцентные красители). Четко просматривается веретено деления, образованное микротрубочками (зелёные), и хромосомы (синие)
По морфологии различают два типа митотического веретена: астральный (или конвергентный) и анастральный (дивергентный) [~ 1][24] .
Астральный тип митотической фигуры, характерный для животных клеток, отличают благодаря небольшим зонам, на полюсах веретена, в которых сходятся (конвергируют) микротрубочки. Зачастую центросомы, располагающиеся в области полюсов астрального веретена, содержат центриоли. От полюсов деления также расходятся во всех направлениях радиальные микротрубочки, не входящие в состав веретена, а образующие звездчатые зоны — цитастеры.
Анастральный тип митотической фигуры отличается широкими полярными областями веретена, так называемыми полярными шапочками, в их состав не входят центриоли. Микротрубочки при этом расходятся широким фронтом (дивергируют) от всей зоны полярных шапочек. Этот тип митотической фигуры также отличает отсутствие цитастеров. Анастральный тип митотического веретена наиболее характерен для делящихся клеток высших растений, хотя иногда наблюдается и в некоторых клетках животных.
Микротрубочки
Микротрубочки — динамичные структуры, принимающие активное участие в построении веретена деления во время митоза. Химически они представляют собой биополимеры, состоящие из субъединиц белка тубулина. Количество микротрубочек в клетках различных организмов может значительно отличаться. В метафазе веретено деления в клетках высших животных и растений может содержать до нескольких тысяч микротрубочек, тогда как у некоторых грибов их всего около 40 [22] .
Центромеры и кинетохоры
Основные статьи: Центромера, Кинетохор
Центромеры — специализированные последовательности ДНК, необходимые для связывания с микротрубочками веретена деления и для последующего расхождения хромосом. В зависимости от локализации различают несколько типов центромер. Для голоцентрических центромер характерно образование связей с микротрубочками веретена по всей длине хромосомы (некоторые насекомые, нематоды, некоторые растения). В противоположность голоцентрическим моноцентрические центромеры служат для связи с микротрубочками в единственной области хромосомы [24] .
В центромерной области обычно располагаются кинетохоры хромосом — сложные белковые комплексы, морфологически очень сходные по своей структуре для различных групп эукариот, как, например, для диатомовых водорослей, так и для человека [25] . Обычно на каждую хроматиду (хромосому) приходится по одному кинетохору. На электронных микрофотографиях кинетохор обычно выглядит как пластинчатая трёхслойная структура [26] . Порядок слоев следующий: внутренний плотный слой, примыкающий к телу хромосомы; средний рыхлый слой; внешний плотный слой, от которого отходит множество фибрилл, образуя т.н. фиброзную корону кинетохора.
К основным функциям кинетохора относят: закрепление микротрубочек веретена деления, обеспечение движения хромосом во время митоза при участии микротрубочек, связывание между собой сестринских хроматид и регуляцию их последующего разделения в анафазе митоза [27] . Минимально достаточно одной микротрубочки (например, для дрожжей) ассоциированной с кинетохором, чтобы обеспечить движение хромосомы. Однако с одним кинетохором могут быть связаны целые пучки, состоящие из 20—40 микротрубочек (например, у высших растений или человека), чтобы обеспечить расхождение хромосом к полюсам клетки [26][27] .
1.3. Циклины и циклин-зависимые киназы
Циклины — семейство белков-активаторов циклин-зависимых протеинкиназ (CDK) (англ. CDK, cyclin-dependent kinases) — ключевых ферментов, участвующих в регуляции клеточного цикла эукариот. Циклины получили своё название в связи с тем, что их внутриклеточная концентрация периодически изменяется по мере прохождения клеток через клеточный цикл, достигая максимума на его определенных стадиях.
Каталитическая субъединица циклин-зависимой протеинкиназы частично активируется в результате взаимодействия с молекулой циклина, которая образует регуляторную субъединицу фермента. Образование этого гетеродимера становится возможным после достижения циклином критической концентрации. В ответ на уменьшение концентрации циклина происходит инактивация фермента. Для полной активации циклин-зависимой протеинкиназы должно произойти специфическое фосфорилирование и дефосфорилирование определенных аминокислотных остатков в полипептидных цепях этого комплекса. Одним из ферментов, осуществляющих подобные реакции, является киназа CAK (CAK — CDK activating kinase).
Рис. Концентрация циклинов в клеточном цикле
| циклин | Cdk | фаза клеточного цикла |
|---|---|---|
| циклин Е | Cdk2 | вход в S-фазу |
| циклин A | Cdk2 | вход в G2-фазу |
| циклин B | Cdk1 | вход в M-фазу |
2. Регуляция клеточного цикла
Закономерная последовательность смены периодов клеточного цикла осуществляется при взаимодействии таких белков, как циклин-зависимые киназы и циклины. Клетки, находящиеся в G0 фазе, могут вступать в клеточный цикл при действии на них факторов роста. Разные факторы роста, такие как тромбоцитарный, эпидермальный, фактор роста нервов, связываясь со своими рецепторами, запускают внутриклеточный сигнальный каскад, приводящий в итоге к транскрипции генов циклинов и циклин-зависимых киназ. Циклин-зависимые киназы становятся активными лишь при взаимодействии с соответствующими циклинами. Содержание различных циклинов в клетке меняется на протяжении всего клеточного цикла. Циклин является регуляторной компонентой комплекса циклин-циклин-зависимая киназа. Киназа же является каталитическим компонентом этого комплекса. Киназы не активны без циклинов. На разных стадиях клеточного цикла синтезируются разные циклины. Так, содержание циклина B в ооцитах лягушки достигает максимума к моменту митоза, когда запускается весь каскад реакций фосфорилирования, катализируемых комплексом циклин-В/циклин-зависимая киназа. К окончанию митоза циклин быстро разрушается протеиназами.

2.1. Контрольные точки клеточного цикла
3. Ингибиторы циклин-зависимой киназы
Ингиби́тор цикли́н-зави́симой кина́зы (англ. Cdk inhibitor protein, CKI, CDI, CDKI) — белок, блокирующий активность циклин-зависимой киназы отдельно или циклин-зависимой киназы в комплексе с циклином. Обычно сдерживающая активность CKI приурочена к фазе G1 клеточного цикла. К тому же, активация CKI может происходить в ответ на провреждения ДНК или может быть вызвана внеклеточными ингибирующими сигналами[2].
Большинство эукариотических организмов обладают ингибиторами циклин-зависимых киназ. В животных клетках выделяют два семейства CKI: Cip/Kip и INK4.
Ингибиторы семейства Cip/Kip блокируют циклин-зависимую киназу в комплексе с циклином, а ингибиторы семейства INK4 блокируют отдельные циклин-зависимые киназы Cdk4 и Cdk6. В животных клетках ингибиторы циклин-зависимых киназ разделяются на два основных семейства: Cip/Kip и INK4. Семейство Cip/Kip включает ингибиторы CDK белки p21, p27, p57. К основным субстратам Cip/Kip-ингибиторов относятся циклин-киназные комплексы G1/S-Cdk и S-Cdk, отвечающие, соответственно, за G1/S-переход и вступление в S-фазу. Ингибиторы семейства INK4 блокируют циклин-зависимые киназы Cdk4 и Cdk6 регулирующие G1-фазу клеточного цикла.
| Рис. Схема ингибирования Cdk6 с участием INK4. Белок INK4 соединяется с циклин-зависимой киназой Cdk6 и смещает аминоконцевую долю киназы примерно на 15° относительно оси вращения. В итоге, деформируется каталитическая область Cdk6, а также снижается способность циклин-зависимой киназы к связыванию циклина. |
На протяжении фазы G1 в растущей клетке блокируется активность циклин-зависимых киназ (англ. Cdk) до момента вступления клетки в очередной клеточный цикл. Сдерживание активности Cdk обеспечивается тремя контрольными механизмами. Во-первых, снижением экспрессии генов циклинов. Во-вторых, увеличением степени деградации циклинов. Наконец, к третьему типу сдерживания активности Cdk относятся ингибиторы CKI. Помимо обеспечения стабильного роста клетки в фазе G1 ингибиторы циклин-зависимых киназ участвуют в аресте клеточного цикла на стадии G1 в ответ на неблагоприятные внешние условия. К тому же события клеточного цикла могут блокироваться с участием CKI при повреждениях ДНК[2].
Ингибиторы циклин-зависимых киназ: Sic1 у почкующихся дрожжей, Rum1 у делящихся дрожжей и Rux у Drosophila — несмотря на структурные различия обладают как минимум тремя сходными функциональными особенностями. Во-первых, основными мишенями данных CKI являются митотические циклин-киназы (англ. M-Cdk) и циклин-киназы синтетической фазы клеточного цикла (англ. S-Cdk). В то же время указанные ингибиторы CKI не могут блокировать циклин-зависимые киназы, обеспечивающие переход клетки из фазы G1 в S-фазу (англ. G1/S-Cdk). Наконец, третьей характерной особенностью всех перечисленных ингибиторов CKI является способ их деактивации. Все они разрушаются после фосфорилирования со стороны активных циклин-зависимых киназ[2].
Семейство Cip / Kip (p21, p27, p57) регулирует динамику актина посредством ингибирования пути Rho-ROCK-LIMK [2]

3.1. CDKN1A или P21
CDKN1A (англ. cyclin-dependent kinase inhibitor 1A, p21, Cip1) — внутриклеточный белок-ингибитор циклин-зависимой киназы 1A, играет критическую роль в клеточном ответе на повреждение ДНК. Уровень белка повышен в клетках, находящихся в стадии покоя, таких как дифференцированные клетки организма. Один из 9 известных белковых ингибиторов циклин-зависимой киназы.
p21 обеспечивает устойчивость гематопоэтических клеток к инфицированию ВИЧ за счёт связывания с вирусной интегразой, предотвращая таким образом встраивание провируса в хромосомный аппарат клетки.

Ген CDKN1A как правило не инактивируется полностью в злокачественных опухолях. Точная роль p21 в канцерогенезе до конца пока не установлена. Исследования показывают, что при некоторых типах опухолей потеря p21 является признаком плохих шансов на выживание. Однако известны ситуации, когда повышенная концентрация этого белка в клетках положительно коррелирует с агрессивностью опухоли и её способностью к метастазированию. Это особенно относится к тем случаям, когда p21 накапливается в цитоплазме, а не в ядре клетки
Ген р21 и регенерация.
Исследовательская группа профессора Эллен Хэбер-Катц (Ellen Heber-Katz) выяснила, что выключение гена р21 активирует у мышей способность к восстановлению тканей.
В природе регенеративные способности (восстановление тканей, органов и конечностей) наиболее выражены у амфибий, полипов, иглокожих, губок, гидр, дождевых червей, саламандр и нек. др., в то время как у млекопитающих они существенно ограничены.
В лаборатории молекулярного биолога Хэбер-Катц регенерацией у млекопитающих заинтересовались в 1996 году, когда во время изучения одного из аутоиммунных заболеваний зафиксировали у лабораторных мышей линииMurphy Roths Large (MRL) восстановление хрящевой ткани ушей после пожизненной маркировки (перфорации). У животных других линий такой регенерации не происходило. Ученые исследовали восстановленные участки и зафиксировали в них синтез ДНК, пролиферацию клеток и появление новых волосяных фолликулов.
Последующие эксперименты на мышах MRL показали, что после нанесенных им повреждений в области сердечной мышцы и спинного мозга, эти ткани так же успешно регенеририруют без образования рубцов.
Чтобы с наибольшей вероятностью вычислить гены, ответственные за процессы регенерации у мышей MRL, было решено картировать их геном. Так же под прицел ученых попал феномен влияния изменений в ДНК на цикл деления клеток.
Исследования показали, что у животных MRL линии неактивен ген р21, играющий важную роль в регуляции клеточного деления и в торможении процесса деления клеток при повреждении ДНК.
В новой работе ученые показали, что мыши без гена p21 демонстрируют регенеративные характеристики, наблюдаемые у мышей MRL линии. У генноинженерных мышей фиксировалось быстрое деление клеток, восстанавливающее ткани и быстрый апоптоз - механизм клеточного самоуничтожения, включающийся, если ДНК повреждена. Сочетание этих процессов свойственно видам, обладающим регенеративными способностями. Ученые считают, что такое совокупное воздействие позволяет клеткам данных видов делиться быстро, не выходя из-под антиракового контроля.
В научной публикации, опубликованной в Трудах Национальной академии наук, коллектив Эллен Хэбер-Катц предоставляет веские доказательства, что тканевая регенерация связана с контролем клеточного деления.
Клеточный цикл — это период жизни клетки от одного деления до другого или от деления до смерти. Клеточный цикл состоит из интерфазы и митоза.
Интерфаза состоит из 3-х периодов:
- пресинтетического или G1-периода,
- синтетического или S-периода и
- постсинтетического или G2-периода.
После G2-периода клетка вступает в митоз.
Если клетка не делится, то она вступает в период покоя, или G0-период. Если клетка, находящаяся в G0-периоде, снова будет делиться, то она выходит из G0-периода и вступает в G1-период. Таким образом, если клетка находится в G1-периоде, то она обязательно будет делиться. Если клетка находится в S- и G2-периодах, то в ближайшее время она обязательно вступит в митоз.
G1-период может продолжаться от 2–4 ч до нескольких недель или даже месяцев. Продолжительность S-периода варьирует от 6 до 8 ч, а G2-периода — от нескольких часов до получаса. Длительность митоза — от 40 до 90 минут. Самой короткой фазой митоза является анафаза.
G1-период характеризуется высокой синтетической активностью (происходит активная транскрипция и трансляция), благодаря которой клетка вырастает до объема материнской клетки и выполняет свои функции. В конце G1-периода клетка проходит специальный этап (точка рестрикции, R-пункт), после которого клетка в течение нескольких часов вступает в S-период. Период времени между R-точкой и началом S-периода можно рассматривать в качестве подготовительного для перехода в S-период.
В S-периоде происходит репликация ДНК. Все остальные реакции, происходящие в это время, направлены на обеспечение синтеза ДНК — синтез гистоновых белков, синтез ферментов, регулирующих и обеспечивающих синтез новых нитей ДНК.
В G2-период происходит синтез белков микротрубочек веретена деления и АТФ, необходимых для процесса митоза.
Прохождение клетки по всем периодам клеточного цикла строго контролируется специальными регуляторными белками, которые обеспечивают следующие этапы:
- прохождение клетки по определенному периоду клеточного цикла,
- переход из одного периода в другой.
Регуляцию клеточного цикла осуществляют специальные белки-ферменты — циклин-зависимые протеинкиназы (cdk). Они регулируют активность генов, ответственных за прохождение клетки по тому или иному периоду клеточного цикла. Все они присутствуют в клетке постоянно независимо от периода клеточного цикла. Для работы циклин-зависимых протеинкиназ требуются специальные белки циклины. Циклины присутствуют в клетках не постоянно. Синтез каждого типа циклинов происходит в строго определенный период клеточного цикла.
Клеточный цикл регулируется как внутриклеточными, так и внеклеточными факторами.
Генетический контроль цикла обеспечивается семейством генов, которые обозначаются как гены клеточного деления – cdc (cell division control). Продукты этих генов представляют собой киназы - ферменты, фосфорилирующие белки по определенным аминокислотам. Поэтому гены клеточного цикла могут обозначаться также cdk (cell division kinase). Основной принцип регуляции клеточного цикла состоит в фосфорилировании и дефосфорилировании участвующих в пролиферации структурных и регуляторных белков.
Последовательность активации киназ клеточного деления определяется циклинами – регуляторными белками, концентрация которых закономерно изменяется в клеточном цикле. Например, концентрация циклина А нарастает к концу G1-периода и снижается по завершению S-периода, причем подавление репликации ДНК оксимочевиной не влияет на этот процесс. К настоящему времени обнаружено 12 циклинов, которые демонстрируют различную динамику концентрации в клеточном цикле. Наряду с комплексами Cyc/Cdk (циклин/циклинзависимая киназа) в регуляции цикла участвуют фосфатазы PP1 и PP2a, которые дефосфорилируют белки, фосфорилированные ранее киназами, циклин-активирующие киназы CAK и ингибиторы киназ CDI.
Важная роль в регуляции клеточного цикла принадлежит белку p53. Он способен узнавать специфические последовательности в ДНК и регулировать активность контролирующих пролиферацию генов. Концентрация p53 в ядре увеличивается к концу G1-периода, но резко снижается при переходе клетки в S-период. Если в клетке возникли повреждения ДНК, концентрация p53 остается на высоком уровне, клетка задерживается в конце G1-периода и не приступает к репликации ДНК до тех пор, пока повреждения не будут исправлены. Если повреждения ДНК репарировать не удалось, p53 выключает гены, блокировавшие апоптоз. Переход G1/S является первой контрольной точкой клеточного цикла (точкой рестрикции R1), в которой клетка принимает решение о репликации ДНК.
Кроме R1 в клеточном цикле есть и вторая контрольная точка - R2. Она соответствует переходу G2/M, когда клетка принимает решение о начале митоза. Главными молекулами, регулирующими начало митоза, являются фосфатаза Cdc25, а также киназы CycB/Cdk1 и weel. Фосфатаза Cdc25 способна активировать киназу CycB/Cdk1, тогда как киназа weel, наоборот, ингибирует ее. Поэтому начало митоза определяется балансом активности ферментов Cdc25 и weel.
События митоза также регулируются циклинами. В частности, циклин B (CycB) контролирует образование митотического веретена, циклин A (CycA) влияет на расхождение хроматид, а циклин B3 (CycB3) контролирует конденсацию хромосом. Для завершения митоза необходима не только определенная последовательность активации циклинзависимых киназ и фосфатаз, но также их своевременная деградация. Она контролируется APC (anaphase promoting complex) - комплексом протеаз с участием убиквитина.
Клеточный цикл регулируется также внешними по отношению к клетке молекулярными сигналами. К ним относятся гормоны, медиаторы, факторы роста, лимфокины, митогены, а также их ингибиторы.
Пролиферирующие клетки отвечают на молекулярные сигналы двух типов. Первый из них усиливает пролиферацию, вызывая переход клеток из состояния G0 в G1 и их прогрессию в клеточном цикле (так действуют многие факторы роста, например, фактор роста фибробластов ФРФ). Второй тип регуляторных белков позволяет клеткам подавлять рост их соседей (как это происходит, например, при секреции макрофагами фактора некроза опухолей ФНО).
Таким образом, в управление клеточным циклом и митозом вовлечено большое число генов. Если функция каких-либо из них утрачивается из-за мутации или нарушения экспрессии, клетки становятся нечувствительными к подавляющим их рост молекулярным сигналам, переходят в режим автономной пролиферации и могут сформировать в итоге опухоли.
Клеточный цикл регулируется как внутриклеточными, так и внеклеточными факторами.
Генетический контроль цикла обеспечивается семейством генов, которые обозначаются как гены клеточного деления – cdc (cell division control). Продукты этих генов представляют собой киназы - ферменты, фосфорилирующие белки по определенным аминокислотам. Поэтому гены клеточного цикла могут обозначаться также cdk (cell division kinase). Основной принцип регуляции клеточного цикла состоит в фосфорилировании и дефосфорилировании участвующих в пролиферации структурных и регуляторных белков.

Последовательность активации киназ клеточного деления определяется циклинами – регуляторными белками, концентрация которых закономерно изменяется в клеточном цикле. Например, концентрация циклина А нарастает к концу G1-периода и снижается по завершению S-периода, причем подавление репликации ДНК оксимочевиной не влияет на этот процесс. К настоящему времени обнаружено 12 циклинов, которые демонстрируют различную динамику концентрации в клеточном цикле. Наряду с комплексами Cyc/Cdk (циклин/циклинзависимая киназа) в регуляции цикла участвуют фосфатазы PP1 и PP2a, которые дефосфорилируют белки, фосфорилированные ранее киназами, циклин-активирующие киназы CAK и ингибиторы киназ CDI.
Важная роль в регуляции клеточного цикла принадлежит белку p53. Он способен узнавать специфические последовательности в ДНК и регулировать активность контролирующих пролиферацию генов. Концентрация p53 в ядре увеличивается к концу G1-периода, но резко снижается при переходе клетки в S-период. Если в клетке возникли повреждения ДНК, концентрация p53 остается на высоком уровне, клетка задерживается в конце G1-периода и не приступает к репликации ДНК до тех пор, пока повреждения не будут исправлены. Если повреждения ДНК репарировать не удалось, p53 выключает гены, блокировавшие апоптоз. Переход G1/S является первой контрольной точкой клеточного цикла (точкой рестрикции R1), в которой клетка принимает решение о репликации ДНК.
Кроме R1 в клеточном цикле есть и вторая контрольная точка - R2. Она соответствует переходу G2/M, когда клетка принимает решение о начале митоза. Главными молекулами, регулирующими начало митоза, являются фосфатаза Cdc25, а также киназы CycB/Cdk1 и weel. Фосфатаза Cdc25 способна активировать киназу CycB/Cdk1, тогда как киназа weel, наоборот, ингибирует ее. Поэтому начало митоза определяется балансом активности ферментов Cdc25 и weel.
События митоза также регулируются циклинами. В частности, циклин B (CycB) контролирует образование митотического веретена, циклин A (CycA) влияет на расхождение хроматид, а циклин B3 (CycB3) контролирует конденсацию хромосом. Для завершения митоза необходима не только определенная последовательность активации циклинзависимых киназ и фосфатаз, но также их своевременная деградация. Она контролируется APC (anaphase promoting complex) - комплексом протеаз с участием убиквитина.
Клеточный цикл регулируется также внешними по отношению к клетке молекулярными сигналами. К ним относятся гормоны, медиаторы, факторы роста, лимфокины, митогены, а также их ингибиторы.
Пролиферирующие клетки отвечают на молекулярные сигналы двух типов. Первый из них усиливает пролиферацию, вызывая переход клеток из состояния G0 в G1 и их прогрессию в клеточном цикле (так действуют многие факторы роста, например, фактор роста фибробластов ФРФ). Второй тип регуляторных белков позволяет клеткам подавлять рост их соседей (как это происходит, например, при секреции макрофагами фактора некроза опухолей ФНО).
Таким образом, в управление клеточным циклом и митозом вовлечено большое число генов. Если функция каких-либо из них утрачивается из-за мутации или нарушения экспрессии, клетки становятся нечувствительными к подавляющим их рост молекулярным сигналам, переходят в режим автономной пролиферации и могут сформировать в итоге опухоли.
Сайт использует файлы cookie. Продолжая пользоваться нашим сайтом, вы соглашаетесь на использование нами ваших данных.
Узнать больше

Вступление
В статье о контрольных точках клеточного цикла мы рассмотрели причины, которые влияют на переход к различным фазам клеточного цикла, факторы, которые клетка учитывает при принятии решения о том, следует ли продвигаться дальше по клеточному циклу. К таким факторам относятся как внешние сигналы (например, молекулярные сигналы), так и внутренние сигналы (например, повреждение ДНК).
Подобные сигналы действуют путем изменения активности регуляторов клеточного цикла ядра внутри клетки. Регуляторы клеточного цикла клетки могут запускать ключевые процессы, такие как репликация ДНК или разделение хромосом. Они также контролируют правильный порядок выполнения событий клеточного цикла и то, что одна фаза (например, G1) запускает начало следующей фазы (например, S).
В этой статье мы рассмотрим некоторые из наиболее важных регуляторов основного клеточного цикла: белки, называемые циклинами, ферменты - циклин-зависимые киназы (Cdks), и комплекс ферментов - анафаза стимулирующего комплекса (APC/C).
Циклины
Циклины — это группа родственных белков, одни из наиболее важных регуляторов клеточного цикла ядра. И у людей, и у большинства других эукариот существует четыре основных типа: G1-циклины, G1/S-циклины, S-циклины и М-циклины.
Как следует из названия, каждый циклин связан с определенной фазой, переходом или набором фаз в клеточном цикле и помогает управлять событиями этой фазы или периода. Например, M-циклин способствует событиям фазы M, таким как разрушение ядерной оболочки и конденсация хромосом [1,2].
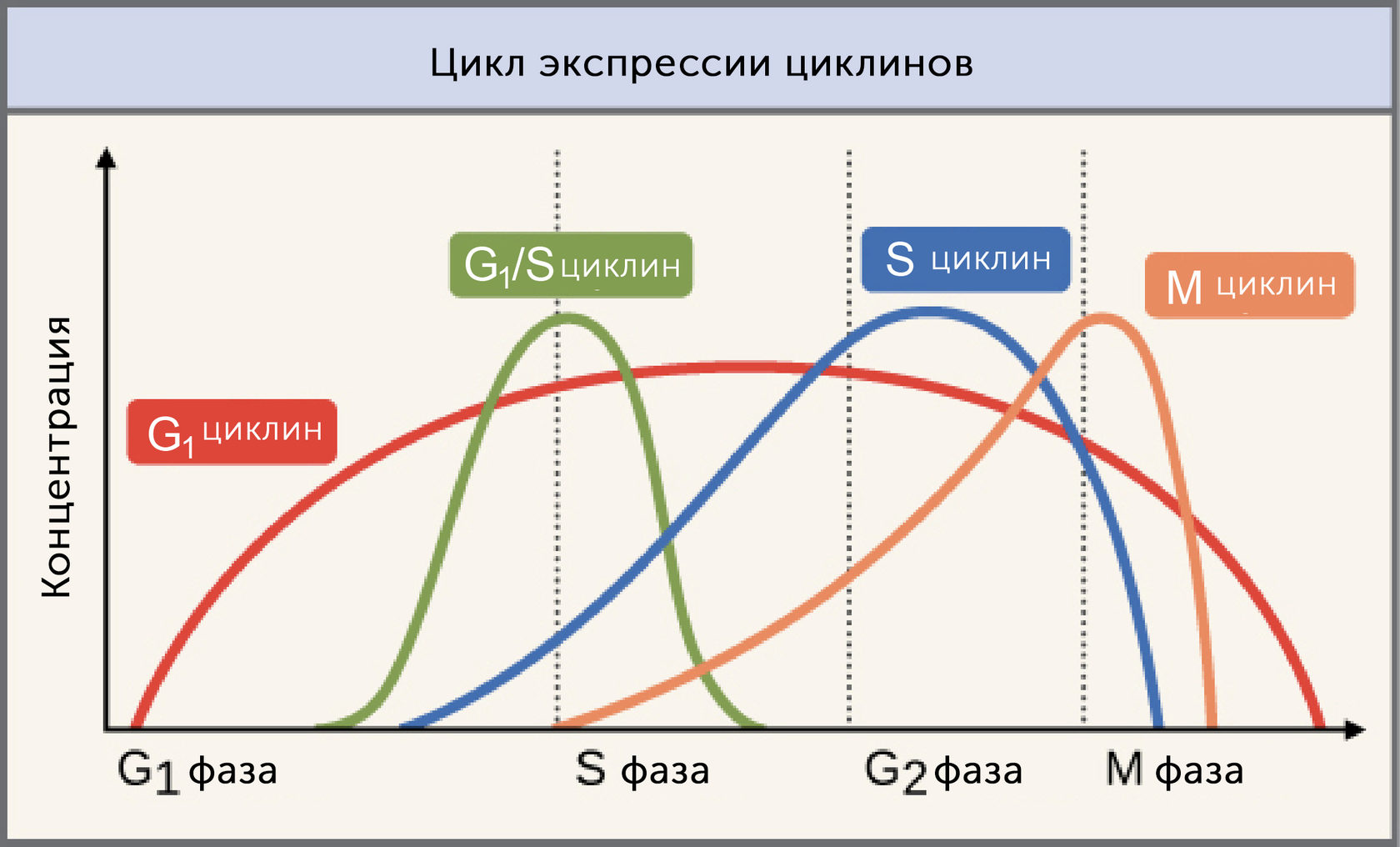
Уровни разных циклинов значительно различаются в зависимости от фазы клеточного цикла, как показано на диаграмме выше. Так, концентрация циклинов остается низкой в течение большей части цикла, но сильно возрастает на стадиях, где они необходимы. М циклин, например, резко достигает пика при переходе от G2 в фазу М1. Циклины необычны тем, что они необходимы для большей части клеточного цикла.
Циклин-зависимые киназы (Cdks)
Чтобы продвигать клеточный цикл вперед, циклин должен активировать или инактивировать многие целевые белки внутри клетки. Циклины управляют событиями клеточного цикла, сотрудничая с семейством ферментов, называемых циклин-зависимыми киназами (Cdks). Сам по себе Cdk неактивен, но, связавшись с циклином, активируется, становясь функциональным ферментом, и приобретает способность модифицировать целевые белки.
Как это работает? Cdks — это киназы, ферменты, которые фосфорилируют (присоединяют фосфатные группы) к специфическим белкам-мишеням. Присоединенная фосфатная группа действует как переключатель, делая целевой белок более или менее активным. Когда циклин присоединяется к Cdk, он создает два важных эффекта: активирует Cdk в качестве киназы, и направляет Cdk к определенному набору белков-мишеней, разному для разных фаз клеточного цикла, контролируемого каждым конкретным циклином. Например, G1/S-циклины посылают Cdks к мишеням S-фазы (например, стимулируя репликацию ДНК), тогда как M-циклины посылают Cdks к мишеням M-фазы (например, разрушая ядерную мембрану).
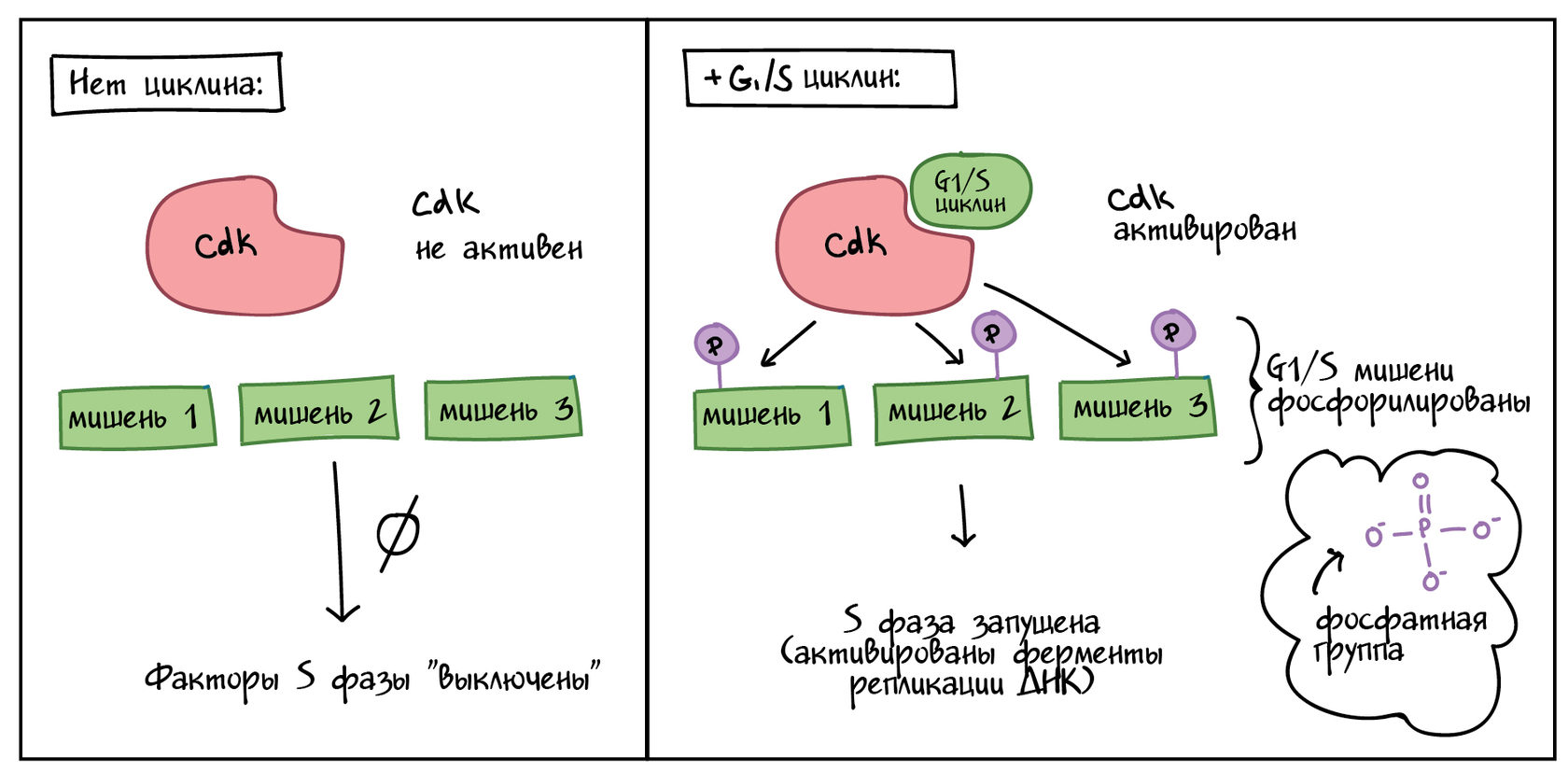
В целом, уровни Cdk остаются относительно постоянными по всему клеточному циклу, но активность Cdk и целевые белки изменяются по мере того, как уровни различных циклинов растут и падают. В дополнение к тому, что Cdks нуждается в связывании с циклином, он также должен быть фосфорилирован на определенном сайте, чтобы активироваться (не показано на диаграммах в этой статье), и может также негативно регулироваться фосфорилированием других сайтов [3,4].
Фактор, способствующий созреванию (MPF)
Известный пример того, как циклины и Cdks работают вместе, контролируя переходы клеточного цикла, — это фактор, способствующий созреванию (MPF). Название восходит к 1970-м годам, когда исследователи обнаружили, что клетки в фазе М содержат неизвестный фактор, который может заставить яйцеклетки лягушки (которая остановилась в G2, фазе) перейти в фазу М. Эта загадочная молекула, названная MPF, была открыта в 1980-х годах как Cdk, связанная со своим партнером M-циклином [7].
MPF — это хороший пример того, как циклины и Cdks могут работать вместе, чтобы управлять переходом клеточного цикла. Как и типичный циклин, M-циклин остается на низком уровне в течение большей части клеточного цикла, но его концентрация увеличивается, когда клетка приближается к G2/М-переходу. По мере накопления M-циклина он связывается с Cdks, уже присутствующими в клетке, образуя комплексы, которые готовы запустить M-фазу. Как только эти комплексы получают дополнительный сигнал (по сути, полностью четкое подтверждение того, что ДНК клетки не повреждены), они становятся активными и приводят в движение события фазы М [7].
Комплексы MPF добавляют фосфатные метки к нескольким различным белкам в ядерной оболочке, что приводит к ее расщеплению (ключевое событие ранней М-фазы), а также активируют мишени, способствующие конденсации хромосом и другим событиям М-фазы. Роль MPF в разрушении ядерной оболочки показана в упрощенной форме на диаграмме ниже.
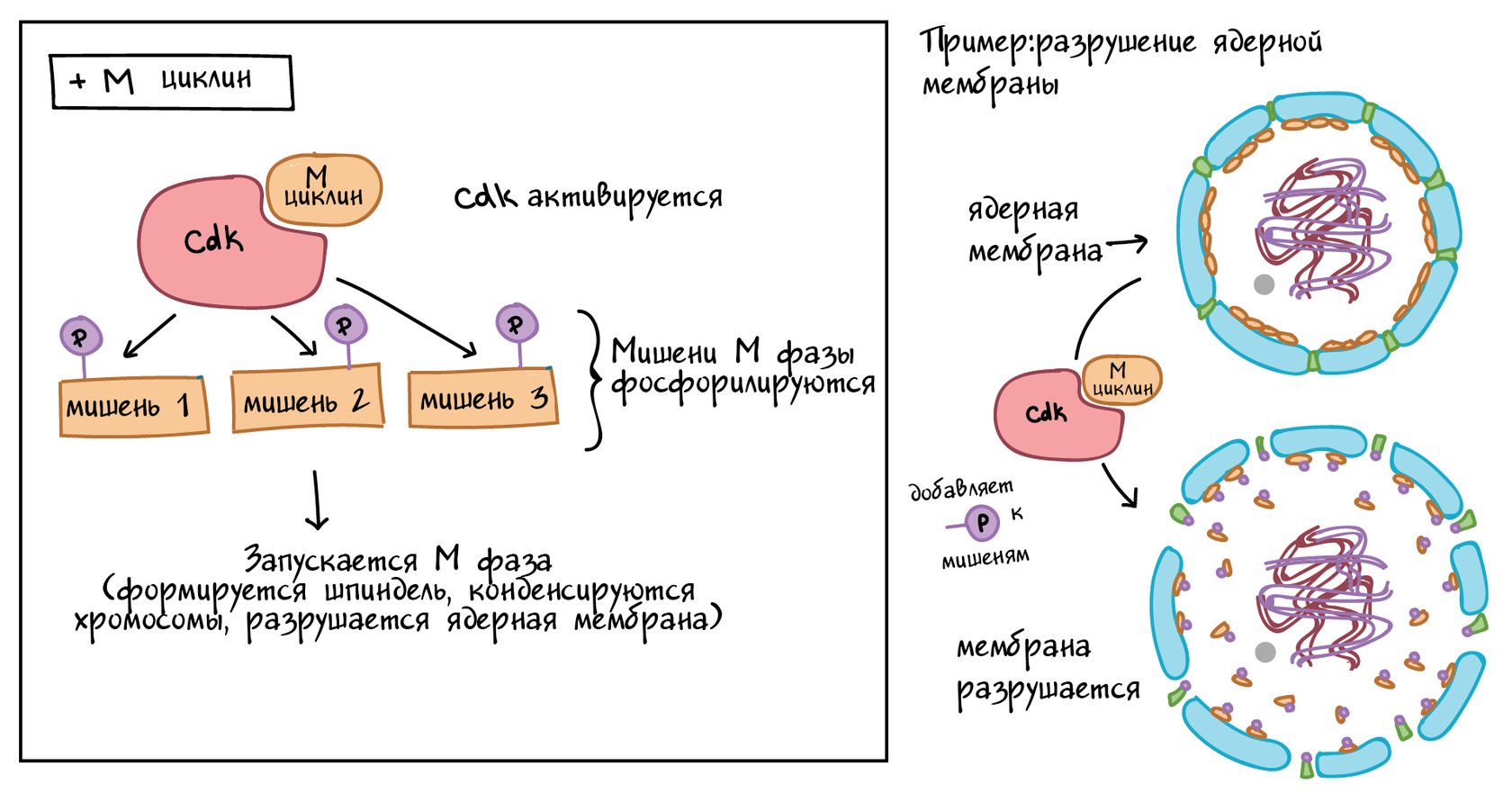
Упрощенная схема, показывающая, как Cdk и M cyclin объединяются в MPF.
Левая панель: комплекс MPF фосфорилирует различные мишени, специфичные для М-фазы, а фосфорилированные мишени вызывают образование веретена, конденсацию хромосом, разрушение ядерной мембраны и другие события ранней М-фазы.
Правая панель: конкретный пример MPF, вызывающего разрушение ядерной оболочки. Комплекс MPF фосфорилирует белки в ядерной оболочке, что приводит к фрагментации ядерной мембраны на везикулы (и высвобождению некоторых белков из мембраны).
Анафаза-стимулирующий комплекс/циклосома (APC/C)
В дополнение к управлению событиями М-фазы, MPF также запускает собственное разрушение, активируя комплекс, стимулирующий анафазу/циклосому (APC/C), белковый комплекс, который вызывает разрушение М-циклинов во время начала анафазы. Разрушение М-циклинов выводит клетки из митоза, позволяя новым дочерним клеткам войти в фазу G1. APC/C также вызывает разрушение белков, которые удерживают сестринские хроматиды вместе, позволяя им разделится в анафазе и переместиться к противоположным полюсам клетки.
Как APC/C выполняет свою работу? Как и Cdk, APC/C является ферментом, но имеет другой тип функций, чем Cdk. Вместо того, чтобы прикреплять фосфатную группу к своим мишеням, он добавляет небольшую белковую метку под названием убиквитин (Ub). Когда цель помечена убиквитином, она отправляется в протеасому (которую можно рассматривать как мусорную корзину клетки) и уничтожается. Например, APC/C прикрепляет метку убиквитина к М-циклинам, вызывая их расщепление протеасомой и позволяя вновь образующимся дочерним клеткам входить в G1-фазу [8].
APC/C также использует убиквитиновые метки для запуска отделения сестринских хроматид во время митоза. Если APC/C получает правильные сигналы в метафазе, он запускает цепь событий, которая разрушает когезин, белковый клей, который удерживает сестринские хроматиды вместе [8,9].
APC/C сначала добавляет метку убиквитина к белку, называемому секурин, и отправляет его на переработку. Секурин обычно связывает и инактивирует белок, называемый сепараза(сепарин).
Когда секурин отправляется на переработку, сепараза становится активной и может выполнять свою работу. Сепараза в свою очередь измельчает когезин — белок, который удерживает сестринские хроматиды вместе, таким образом сепараза разделяет сестринские хроматиды.

Контрольные точки и регуляторы
Cdks, cyclins и APC/C являются прямыми регуляторами клеточных циклов, но они не всегда управляют процессом. Вместо этого они реагируют на сигналы внутри и снаружи клетки. Эти сигналы влияют на активность регуляторов ядра, чтобы определить, можно ли клетке двигаться вперед в клеточном цикле. Положительные сигналы, такие как факторы роста, обычно увеличивают активность Cdks и циклинов, в то время как отрицательные сигналы, такие как повреждение ДНК, обычно уменьшают или блокируют их активность.
р53 работает на нескольких уровнях, чтобы гарантировать, что клетки не передадут свою поврежденную ДНК дочерним клеткам после деления [3].
Во-первых, он останавливает клеточный цикл в контрольной точке G1, запуская производство белков-ингибиторов Cdk (CKI). Белки CKI связываются с комплексами Cdk-циклинов и блокируют их активность (см. диаграмму ниже), выигрывая время для восстановления ДНК.
Вторая задача p53 — активировать ферменты репарации ДНК.
Если повреждение ДНК не поддается устранению, р53 приступает к исполнению своей третьей и последней роли — запуску программируемой клеточной гибели, чтобы поврежденная ДНК не передавалась дальше.
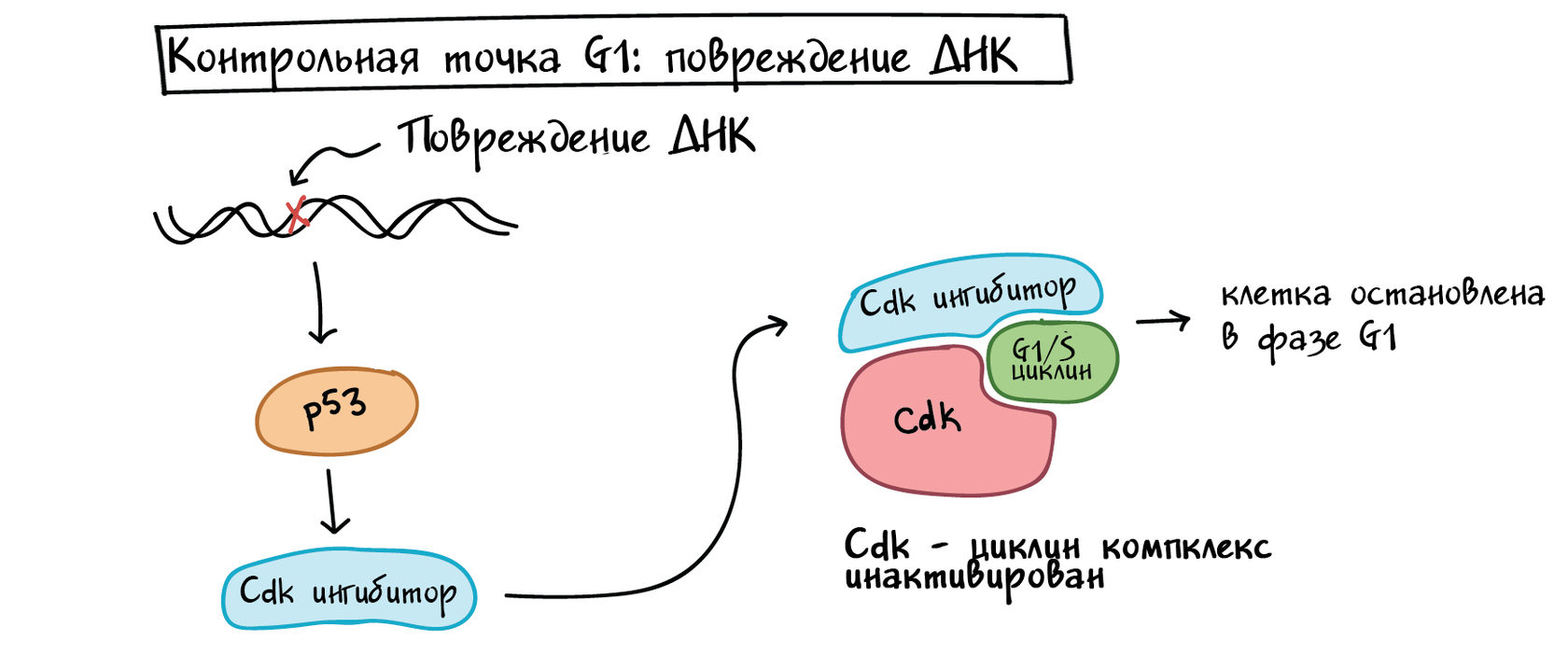
Упрощенная схема того, как p53 останавливает клеточный цикл на контрольной точке G1/S. Р53 активируется повреждением ДНК и вызывает выработку ингибитора Cdk, который связывается с циклиновым комплексом Cdk-G1/S и инактивирует его. Это останавливает клетку в фазе G1 и не позволяет ей войти в S-фазу, давая время для устранения повреждения ДНК.
Гарантируя, что клетки не делятся, когда их ДНК повреждена, p53 предотвращает передачу мутаций (изменений в ДНК) дочерним клеткам. Когда p53 дефектен или отсутствует, мутации могут быстро накапливаться, что может привести к раку. Действительно, из всего человеческого генома р53 является единственным геном, наиболее часто мутирующим при раке [11]. p53 и регуляция клеточного цикла являются ключевыми объектами изучения для исследователей, работающих над новыми методами лечения рака.
Читайте также:

