Регенерация скелетной мышечной ткани гистология кратко
Обновлено: 30.04.2024
В мышечной, как в других тканях, различают два вида регенерации — физиологическую и репаративную. Физиологическая регенерацияпроявляется в форме гипертрофии мышечных волокон, что выражается в увеличении их толщины и даже длины, увеличение числа органелл, главным образом миофибрилл, а также нарастании числа ядер, что в конечном счете проявляется увеличением функциональной способности мышечного волокна. Радиоизотопным методом установлено, что увеличение числа ядер в мышечных волокнах в условиях гипертрофии достигается за счет деления клеток миосателлитов и последующего вхождения в миосимпласт дочерних клеток.
Увеличение числа миофибриллосуществляется посредством синтеза актиновых и миозиновых белков свободными рибосомами и последующей сборки этих белков в актиновые и миозиновые миофиламенты параллельно с соответствующими филаментами саркомеров. В результате этого вначале происходит утолщение миофибрилл, а затем их расщепление и образование дочерних миофибрилл. Кроме того возможно образование новых актиновых и миозиновых миофиламентов не параллельно, а встык предшествующим миофибриллам, чем достигается их удлинение. Саркоплазматическая сеть и Т-канальцы в гипертрофирующемся волокне образуются за счет разрастания предшествующих элементов. При определенных видах мышечной тренировки может формироваться преимущественно красный тип мышечных волокон (у стайеров) или белый тип мышечных волокон (у спринтеров). Возрастная гипертрофия мышечных волокон интенсивно проявляется с началом двигательной активности организма (1—2 года), что обусловлено прежде всего усилением нервной стимуляции. В старческом возрасте, а также в условиях малой мышечной нагрузки наступает атрофия специальных и общих органелл, истончение мышечных волокон и снижение их функциональной способности.
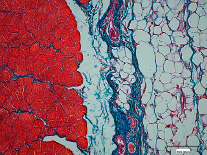
Репаративная регенерацияразвивается после повреждения мышечных волокон. При этом способ регенерации зависит от величины дефекта. При значительных повреждениях на протяжении мышечного волокна миосателлиты в области повреждения и в прилежащих участках растормаживаются, усиленно пролиферируют, а затем мигрируют в область дефекта мышечного волокна, где выстраиваются в цепочки, формируя миотрубку. Последующая дифференцировка миотрубки приводит к восполнению дефекта и восстановлению целостности мышечного волокна. В условиях небольшого дефекта мышечного волокна на его концах, за счет регенерации внутриклеточных органелл, образуютсямышечные почки, которые растут навстречу друг другу, а затем сливаются, приводя к закрытию дефекта. Однако, репаративная регенерация и восстановление целостности мышечных волокон могут осуществляться при определенных условиях: во-первых, при сохраненной двигательной иннервации мышечных волокон, во-вторых, если в область повреждения не попадают элементы соединительной ткани(фибробласты).Иначе на месте дефекта мышечного волокна развивается соединительно-тканный рубец.
Советским ученым А. Н. Студитским доказана возможность аутотрансплантации скелетной мышечной ткани и даже целых мышц при соблюдении определенных условий:
механическое измельчение мышечной ткани трансплантата, с целью растормаживания клеток-сателлитов и последующей их пролиферации;
помещение измельченной ткани в фасциальное ложе;
подшивание двигательного нервного волокна к измельченному трансплантату;
наличие сократительных движений мышц-антагонистов и синергистов.
4. Иннервация и кровоснабжение скелетных мышц
Скелетные мышцы получают двигательную, чувствительную и трофическую (вегетативную) иннервацию. Двигательную (эфферентную)иннервациюскелетные мышцы туловища и конечностей получают от мотонейронов передних рогов спинного мозга, а мышцы лица и головы — от двигательных нейронов определенных черепных нервов. При этом к каждому мышечному волокну подходит или ответвление от аксона мотонейрона, или же весь аксон. В мышцах, обеспечивающих тонкие координированные движения (мышцы кистей, предплечий, шеи), каждое мышечное волокно иннервируется одним мотонейроном. В мышцах, обеспечивающих преимущественно поддержание позы, десятки и даже сотни мышечных волокон получают двигательную иннервацию от одного мотонейрона, посредством разветвления его аксона.
Двигательное нервное волокно, подойдя к мышечному волокну, проникает под эндомизий и базальную пластинку и распадается на терминали, которые вместе с прилежащим специфическим участком миосимпласта образуют аксо-мышечный синапс или моторную бляшку. Под влиянием нервного импульса волна деполяризации с нервного окончания передается на плазмолемму миосимпласта, распространяется далее по Т-канальцам и в области триад передается на терминальные цистерны саркоплазматической сети, обуславливая выход ионов кальция и начало процесса сокращения мышечного волокна.
Чувствительная (афферентная) иннервацияскелетных мышц осуществляется псевдоуниполярными нейронами спинальных ганглиев, посредством разнообразных рецепторных окончаний дендритов этих клеток. Рецепторные окончания скелетных мышц можно разделить надве группы:
I. специфические рецепторные приборы, характерные только для скелетных мышц:
сухожильный орган Гольджи;
неспецифические рецепторные окончания кустиковидной или древовидной формы, распределяющиеся в рыхлой соединительной ткани эндомизия, перимизия и эпимизия.
Мышечные веретена— довольно сложно устроенные инкапсулированные приборы. В каждой мышце содержится от нескольких единиц до нескольких десятков и даже сотен мышечных веретен. Каждое мышечное веретено содержит не только нервные элементы, но также 10—12 специфических мышечных волокон —интрафузальных, окруженных капсулой. Эти волокна располагаются параллельно сократительным мышечным волокнам(экстрафузальным)и получают не только чувствительную, но и специальную двигательную иннервацию. Мышечные веретена воспринимают раздражения как при растяжении данной мышцы, вызванном сокращением мышц-антагонистов, так и при ее сокращении.
Сухожильные органыпредставляют собой специализированные инкапсулированные рецепторы, включающие несколько сухожильных волокон, окруженных капсулой, среди которых распределяются терминальные ветвления дендрита псевдоуниполярного нейрона. При сокращении мышцы сухожильные волокна сближаются и сдавливают нервные окончания. Сухожильные органы воспринимают только степень сокращения данной мышцы. Посредством мышечных веретен и сухожильных органов при участии спинальных центров обеспечивается автоматизм движений (например, при ходьбе).
Трофическая иннервацияобеспечивается вегетативной нервной системой (ее симпатической частью) и осуществляется в основном опосредованно, посредством иннервации сосудов.
Скелетные мышцы богато снабжаются кровью. В рыхлой соединительной ткани перимизия в большом количестве содержатся артерии и вены, артериолы, венулы и артериоло-венулярные анастомозы. В эндомизии располагаются только капилляры, преимущественно узкие (4,5—7 мкм), которые и обеспечивают трофику мышечного волокна. Мышечное волокно, вместе с окружающими его капиллярами и двигательным окончанием составляют мион.В мышцах содержится большое количество артериоло-венулярных анастомозов, обеспечивающих адекватное кровоснабжение при различной мышечной активности.
5. Сердечная поперечно-полосатая мышечная ткань
Структурно-функциональной единицей является клетка —кардиомиоцит. По строению и функциям кардиомиоциты подразделяются надве основные группы:
типичные или сократительные кардиомиоциты, образующие своей совокупностью миокард;
атипичные кардиомиоциты, составляющие проводящую систему сердца и подразделяющиеся в свою очередь на три разновидности.
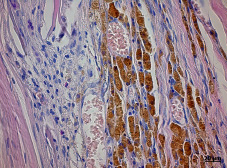
Сократительный кардиомиоцитпредставляет собой почти прямоугольную клетку 50—120 мкм в длину, шириной 15—20 мкм, в центре которой локализуется обычно одно ядро. Покрыт снаружи базальной пластинкой. В саркоплазме кардиомиоцита по периферии от ядра располагаются миофибриллы, а между ними и около ядра локализуются в большом количестве митохондрии. В отличие от скелетной мышечной ткани, миофибриллы кардиомиоцитов представляют собой не отдельные цилиндрические образования, а по существу сеть, состоящую из анастомозирующих миофибрилл, так как некоторые миофиламенты как бы отщепляются от одной миофибриллы и наискось продолжаются в другую. Кроме того, темные и светлые диски соседних миофибрилл не всегда располагаются на одном уровне, и потому поперечная исчерченность в кардиомиоцитах выражена не столь отчетливо, как в скелетных мышечных волокнах. Саркоплазматическая сеть, охватывающая миофибриллы, представлена расширенными анастомозирующими канальцами. Терминальные цистерны и триады отсутствуют. Т-канальцы имеются, но они короткие, широкие и образованы не только углублением плазмолеммы, но и базальной пластинки. Механизм сокращения в кардиомиоцитах практически не отличается от такового в скелетных мышечных волокнах.
Сократительные кардиомиоциты, соединяясь встык друг с другом, образуют функциональные мышечные волокна, между которыми имеются многочисленные анастомозы. Благодаря этому из отдельных кардиомиоцитов формируется сеть —функциональный синтиций. Наличие щелевидных контактов между кардиомиоцитами обеспечивает одновременное и содружественное их сокращение вначале в предсердиях, а затем и в желудочках.
Области контактов соседних кардиомиоцитов носят название вставочных дисков. Фактически, никаких дополнительных структур (диском между кардиомиоцитами нет. Вставочные диски— это места контактов цитолеммы соседних кардиомиоцитов, включающие в себя простые, десмосомные и щелевидные контакты. Обычно во вставочных дисках различают поперечный и продольный фрагменты. В области поперечных фрагментов имеются расширенные десмосомные соединения. В этих же местах с внутренней стороны плазмолемм прикрепляются актиновые филаменты саркомеров. В области продольных фрагментов локализуются щелевидные контакты. Посредством вставочных дисков обеспечивается как механическая, так и метаболическая (прежде всего ионная) связь кардиомиоцитов.
Сократительные кардиомиоциты предсердий и желудочков несколько отличаются между собой по морфологии и функциям. Так, кардиомиоциты предсердий в саркоплазме содержат меньше миофибрилл и митохондрий, в них почти не выражены Т-канальцы, а вместо них под плазмолеммой выявляются в большом числе везикулы и кавеолы — аналоги Т-канальцев. Кроме того, в саркоплазме предсердных кардиомиоцитов у полюсов ядер локализуются специфические предсердные гранулы, состоящие из гликопротеиновых комплексов. Выделяясь из кардиомиоцитов в кровь предсердий, эти вещества влияют на уровень давления крови в сердце и сосудах, а также препятствуют образованию тромбов в предсердиях. Следовательно, предсердные кардиомиоциты, кроме сократительной, обладают и секреторной функцией. В желудочковых кардиомиоцитах более выражены сократительные элементы, а секреторные гранулы отсутствуют.
Вторая разновидность кардиомиоцитов — атипичные кардиомиоциты образуют проводящую систему сердца, состоящую из:
предсердно-желудочковый пучок (пучок Гиса)ствол, правую и левую ножки;
концевые разветвления ножек — волокна Пункинье.
Атипичные кардиомиоцитыобеспечивают генерирование биопотенциалов, их проведение и передачу на сократительные кардиомиоциты.
По своей морфологии атипичные кардиомиоциты отличаются от типичным рядом особенностей:
они крупнее (длина 100 мкм, толщина 50 мкм);
в цитоплазме содержимся мало миофибрилл, которые расположены неупорядочено и потому атипичные кардиомиоциты не имеют поперечной исчерченности;
плазмолемма не образует Т-канальцев;
во вставочных дисках между этими клетками отсутствуют десмосомы и щелевидные контакты.
Атипичные кардиомиоциты различных отделов проводящей системы отличаются между собой по структуре и функциям и подразделяются на три основные разновидности:
Р-клетки (пейсмекеры) водители ритма (I типа);
переходные клетки (II типа);
клетки пучка Гиса и волокон Пуркинье (III тип).
Клетки I типа (Р-клетки)составляют основу синусо-предсердного узла, а также в небольшом количестве содержатся в атриовентрикулярном узле. Эти клетки способны самостоятельно генерировать с определенной частотой биопотенциалы и передавать их на переходные клетки (II типа), а последние передают импульсы на клетки III типа, от которых биопотенциалы передаются на сократительные кардиомиоциты.
Источники развития кардиомиоцитов — миоэпителиальные пластинки, представляющие собой определенные участки висцеральных листков спланхнотома, а конкретнееиз целомического эпителия этих участков.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
В статье представлены данные литературы о морфологических аспектах регенерации скелетных мышц. При повреждении скелетные мышцы подвергаются снижению функциональной активности, что является препятствующим фактором для выполнения той или иной мышечной активности. В работе представлены возможные варианты, которые могут уменьшить повреждение мышечного волокна. Известно, что скелетные мышцы. Скелетная мышца является симпластом, многоядерной структурой, которая образуется в онтогенезе вследствие слияния миобластов. Миоядра, или собственные ядра мышечного волокна, располагаются на периферии и в пространстве, которое находится между миофибриллами и сарколеммой. Также мышечное волокно содержит ядра, которые принадлежат фибробластам, эндотелиоцитам и миосателлитам. Скелетная мышечная ткань способна к регенерации после повреждения. Однако при большой потери мышечной массы для регенерации потребуется интервенционная поддержка. Следовательно, повреждение скелетной мышечной ткани является весомой проблемой в клинике. Для содействия восстановлению и регенерации мышц в течение последнего столетия и особенно в течение последних нескольких десятилетий были разработаны различные способы, в их числе хирургические методы, физиотерапия, использование биоматериалов, мышечная тканевая инженерия, а также клеточная терапия. Тем не менее, существует большая потребность в разработке новых методов и материалов, которые помогут восстановлению скелетных мышц и их функциональной регенерации.

2. Корсакова И. Н., Самчук Д. П., Еремин И. И., Зорин В. Л., Деев Р. В., Пулин А. А. Тканеинженерные конструкции для восстановления скелетной мышечной ткани. Гены и клетки. – 2017. doi: 10.23868/201703004
3. Курмашова Е.Д., Яковлева О.В., Ситдикова Г.Ф. Изменение процессов эндоцитоза синаптических везикул в условиях экспериментального сахарного диабета в различных типах мышц. Вестник науки Сибири. – 2015.
4. Шурыгин М. Г., Болбат А. В., Шурыгина И.А. Миосателлиты как источник регенерации мышечной ткани. Фундаментальные исследования. – 2015. doi: 611.018.6:616-003.93
6. Liu J., Saul D., Böker K.O., Ernst J., Lehman W., and Schilling, A.F. “Current Methods for Skeletal Muscle Tissue Repair and Regeneration,” BioMed Research International, 2018. doi: 10.1155/2018/1984879
8. M. V. Stevanovic, V. G. Cuéllar, A. Ghiassi, and F. Sharpe, “Single-stage Reconstruction of Elbow Flexion Associated with Massive Soft-Tissue Defect Using the Latissimus Dorsi Muscle Bipolar Rotational Transfer,” Plastic and Reconstructive Surgery - Global Open, 2016. doi:10.1097/gox.0000000000001066
10. Yiu E.M., Kornberg A.J., “Duchenne muscular dystrophy” , J Paediatr Child Health, 2015. doi: 10.1111/jpc.12868
Частыми причинами травм скелетных мышц являются дорожно-транспортные происшествия, травмы, полученные при взрывах, боевые ранения, хирургические и ортопедические манипуляции (например, после синдрома длительного сдавливания или резекции опухоли) или повреждения, случившиеся в ходе занятий спортом, приводящие к острой потере мышечной ткани. Повреждения, превышающие 20% мышечной массы, нуждаются в реконструктивных хирургических вмешательствах. Прогрессирующая мышечная потеря может быть следствием метаболических нарушений или наследственных генетических заболеваний, таких как мышечная дистрофия Дюшена, латеральный амиотрофический склероз и детская болезнь Шарко-Мари-Тута [10]. Атрофия мышц также может быть следствием травм периферических нервов, хронической болезни почек, сахарного диабета и сердечной недостаточности [3]. Потеря мышечной массы до 20% может быть компенсирована высокой адаптивностью и регенеративным потенциалом скелетных мышц. За этим порогом функциональные нарушения неизбежны и могут привести как к тяжелой инвалидности, так и к косметическим деформациям, поэтому терапевтическое вмешательство крайне востребовано для таких пациентов.
Анализ и обсуждение. Мышечная регенерация зависит от гетерогенной популяции сателлитных клеток, интерстициальных клеток и кровеносных сосудов и в основном контролируется с помощью белков межклеточного матрикса и секретируемых факторов [4]. В норме мышечная масса поддерживается балансом между синтезом и катаболизмом белка. В большинстве случаев VML тормозит регенерационную способность скелетных мышц, поскольку физически удаляются необходимые регенеративные элементы, в основном сателлитные клетки, периваскулярные стволовые клетки и базальная мембрана. Через денервацию активируются сигнальные пути распада белков (протеасомальные и аутофагиально-лизосомальные пути). Поэтому скорость разложения белка превышает его синтез, что способствует атрофии мышц, сопровождающейся постепенным снижением мышечной массы и диаметров мышечных волокон. Реваскуляризация обычно нарушается. Вследствие наступают ишемические условия способствующие пролиферации фибробластов, фиброзу и формированию фиброзной рубцовой ткани, что приводит к дальнейшей дистрофии мышцы. Состав и степень белков межклеточного матрикса в рубцовых тканях влияют на многие аспекты миогенеза, функции мышц и реиннервации. При хронической потере мышечной массы, такой как мышечная дистрофия Дюшена, фиброз является серьезной проблемой. Вследствие того, что последовательное разрушение миофибрилл не может быть полностью компенсировано пролиферацией сателлитных клеток, следующие воспалительные процессы приводят к изменению продукции белков внеклеточного матрикса и последующему развитию фиброза, а также формированию рубцовой ткани. Рубцовое образование можно уменьшить либо путем введения, например, 5-фторурацила и блеомицина, которые противодействуют пролиферации фибробластов и неоангиогенезу, либо с помощью лазерной терапии и функциональными улучшениями через 6-12 месяцев лечения [1]. Регенерация с регрессией рубцовой ткани и функциональным восстановлением может быть также оптимизирована с помощью трансплантации жира. Тем не менее, уменьшение фиброзирования недостаточно для восстановления и регенерации мышечного волокна. Клинические и научные исследования способствуют восстановлению большой мышечной потери. Современный стандарт лечения VML, как правило, основан на хирургическом вмешательстве с аутологичным мышечным трансплантатом и физиотерапией. Другими способами, которые применяют в клинике, являются: иглоукалывание и применение скаффолдов.
Хирургическое лечение VML включает в себя в основном санацию рубцовой ткани и / или транспозицию мышц. Аутологичная пересадка мышц обычно выполняется в клинической ситуации, когда после травмы, резекции опухоли или повреждения нерва возникают большие участки мышечной потери, что значительно ухудшает двигательную функцию. Хирурги трансплантируют здоровую мышцу из донорского участка, не затронутого повреждением, для восстановления утраченной или нарушенной функции. При отсутствии прилегающей мышцы из-за высокого уровня повреждений нерва или тяжелой травмы может быть применена аутологичная трансплантация мышцы в виде свободной функциональной пересадки. Часто используемыми аутологичными мышцами являются m. latissimus dorsi и m. gracilis. Было показано, что пересадка m. latissimus dorsi является безопасной и эффективной для восстановления сгибания локтевого сустава [8]. В случае синовиальной саркомы, поражающей m. gluteus medius и m. gluteus minimus, функция пораженного тазобедренного сустава может быть полностью восстановлена с помощью свободной нейроваскулярной трансплантации m. latissimus dorsi. Трансплантация m. gracilis обычно используется для восстановления локтевого сустава после травмы плечевого сплетения. Хотя данные мышечные лоскуты могут приводить к значительным терапевтическим результатам, они вызывают прогрессирующую заболеваемость донорского участка и недостаточность иннервации. Более того, до 10% этих реконструктивных операций приводят к полному отторжению трансплантата из-за таких осложнений, как инфекция и некроз.
Физические упражнения обладают способностью предотвращать снижение массы скелетных мышц. Таким образом, помимо хирургических методов, физиотерапия - это неинвазивный / минимально инвазивный способ улучшения восстановления и регенерации мышечной ткани. Данный метод получил широкое применение при восстановлении после травм и трансплантации мышечной ткани или для лечения хронической мышечной дистрофии. Физическая реабилитация направлена на укрепление сохранившихся мышц. Показано, что физиотерапия ускоряет заживление/регенерацию мышц, модулируя иммунный ответ, высвобождая факторы роста, способствуя васкуляризации и уменьшая образование рубцов. Физические упражнения и массаж, стимулирующие ангиогенез, являются потенциальными способами, ускоряющими образование новой мышечной ткани в клинически пересаженных мышечных трансплантатах или других хирургических операциях. Сообщалось, что физические тренировки могут регулировать сигнальный путь IGF-1 (Insulin-like growth factor-1) и уменьшать миостатин в мышечной ткани животных и людей, тем самым предотвращая атрофию мышцы. Физическая терапия действительно может улучшить восстановление мышц; однако этот метод не приносит весомых результатов при регенерации мышц у больных с VML. Кроме того, пациенты с тяжелыми заболеваниями или травмами часто не могут проводить последовательные упражнения, что ограничивает физическую терапию как лечение VML.
Акупунктура - это отрасль традиционной китайской медицины, которая широко используется для лечения различных заболеваний по всему миру. Было показано, что лечение электрическим иглоукалыванием подавляет экспрессию миостатина, приводя к пролиферации клеток-сателлитов и восстановлению скелетных мышц. Акупунктура + низкочастотная электрическая стимуляция (Acu-LFES - Acupuncture plus low-frequency electrical stimulation) усиливают регенерацию мышц и предотвращают потерю мышечной массы путем регулярных тренировок через стимуляцию сокращений. Такой метод лечения подходит для пациентов с тяжелыми заболеваниями, которые не могут часто выполнять упражнения. Было показано, что Acu-LFES противодействует атрофии скелетных мышц, вызванной диабетом, путем увеличения IGF-1 и тем самым стимулирует регенерацию мышц. Применение Acu-LFES для лечения диабетической миопатии и мышечной потери, вызванной хроническим заболеванием почек, показало хорошее функциональное восстановление мышц [9]. Основной механизм включает активацию макрофагов М2 и изменение уровней экспрессии мРНК E3 убиквитин-лигазы-атрогин-1. Подобно физическим упражнениям, иглоукалывание способствует восстановлению функции мышц и стимулирует их регенерацию, особенно у пациентов с атрофией мышц после хронических заболеваний. Тем не менее, не наблюдается значительного успеха при регенерации объемных мышечных дефектов после травмы или резекции опухоли. Кроме того, необходимо много времени, чтобы определить оптимальную продолжительность и интенсивность Acu-LFES в качестве стандартного лечения атрофии мышц.
Биологические скаффолды, состоящие из белков внеклеточного матрикса (ECM - the extracellular matrix), широко используются в регенеративной медицине и в хирургических процедурах для восстановления и регенерации тканей. Скаффолды могут способствовать восстановлению VML, обеспечивая структурную и биохимическую основу. Несколько тканевых скаффолдов были протестированы на животных моделях при незначительных потерях мышечной массы, впоследствии дали хороший результат и были апробированы в клинике. Ксеногенный внеклеточный матрикс и аутологичная ткань были использованы для восстановления функций мышц и одновременного формирования биологической ниши для регенерации. Многослойный каркас из белков межклеточного матрикса, полученный из подслизистой оболочки свиньи, был применен для восстановления у пациентов m. vastus medialis. Через 4 месяца после операции наблюдался заметный прирост показателей функциональной активности, а на месте имплантации была обнаружена новая мышечная ткань. Подслизистая оболочка тонкого кишечника свиньи также использовалась для лечения дефектов брюшной стенки [6]. Кроме того, белки межклеточного матрикса свиньи из мочевого пузыря были имплантированы в попытке лечения VML у человека. Функциональное улучшение с формированием мышечной ткани наблюдалось у трех из пяти пациентов в данном исследовании. Однако ксеногенные скаффолды все еще могут вызывать неблагоприятный иммунный ответ после децеллюляризации, и могут повысить риск передачи инфекционных заболеваний. Поэтому существует клиническая необходимость в разработке новых методов, которые смогут более эффективно восстановить поврежденную мышечную ткань.
Заключение. Повреждение скелетной мышечной ткани или атрофия мышц встречается довольно часто. Хирургические методы достигли значительных результатов и могут гарантировать хорошие результаты для восстановления мышечных функций. Однако, при хирургическом вмешательстве всегда остается риск, обусловленный как человеческим фактором, так особенностями операции. Исследования в области тканевой инженерии и регенеративной клеточной терапии могут решить данную проблему. Тканевая инженерия использует биологические скаффолды, которые направляют развитие мышечной ткани при участии факторов роста. Эти клетки способствуют пролиферации миогенных клеток в поврежденных или атрофических мышцах, что отражается на их дальнейшей регенерации. Подобные творческие подходы опираются на глубокое понимание процесса, необходимого для функционального восстановления мышц (реакция клеток на скаффолды, васкуляризация, миогенез и иннервация), однако все равно нуждаются в дальнейших исследованиях.
11.1. Введение
б) Благодаря данной способности, мышечные ткани обеспечивают
изменение положения в пространстве частей тела или тела в целом, а также
изменение формы и объёма отдельных органов.
11.1.1.1. Виды мышечных тканей и их происхождение
| Виды мышечных тканей | П р о и с х о ж д е н и е | |
| I. Поперечно- полосатые (исчерченные) мышечные ткани | 1. Скелетная мышечная ткань | Из миотомов |
| 2. Сердечная мышечная ткань | Из миоэпикардиальной пластинки (находящейся в составе висцерального листка спланхнотома). | |
| II. Гладкие (неисчерченные) мышечные ткани | 1. Гладкая мышечная ткань сосудов и внутренних органов | Из мезенхимы |
| 2. Мышечная ткань нейрального происхождения (мышцы радужки глаза) | Из клеток нейрального зачатка в составе стенки глазного бокала. | |