Регенерация печени гистология кратко
Обновлено: 05.07.2024
Смежные специальности: гастроэнтеролог, терапевт.
Адрес: Санкт-Петербург, ул.Академика лебедева, д.4/2.
Регенерация печени – проблема, заботящая многих людей. Печень – важнейшая железа человека, которая выполняет более 500 (подумать только!) разнообразных функций. Уникальность ее в том, что это один из немногих органов человеческого организма, имеющих функцию самовосстановления. За счет чего происходит этот процесс? Попробуем дать ответ на это вопрос.
Функции печени
Печень – один из самых больших органов в человеческом организме. Вес ее у взрослого человека достигает 2 кг. Это своеобразный фильтр, через который проходят продукты жизнедеятельности организма. Железа находится в брюшной полости и состоит из клеток, носящих название гепатоциты. Как и многие другие клетки человеческого тела, они имеют способность к регенерации.
Этот орган уникален тем, что может восстановиться, даже если 70% его клеток разрушены или повреждены. В случае болезни или травмы клетки печени восстанавливаются приблизительно через 4 месяца.
Помните Прометея? В этом мифе присутствует доля правды. Уникальная особенность органа и позволяет ему выполнять такое количество жизненно важных функций. Вот некоторые из них:
- Обезвреживание аллергенов, ядов, токсинов;
- Удаление избыточного количества гормонов, продуктов обмена веществ;
- Непосредственное участие в процессе пищеварения;
- Производство холестерина, желчи, билирубина;
- Место для хранения значительного количества крови, которая может восполнить кровопотерю;
- Синтез пищеварительных ферментов и разнообразных гормонов;
- Производство белков крови;
- Функция кроветворения (у плода).
Причины поражения и механизмы регенерации
Причины, по которым может быть поражена эта железа, следующие:
- разнообразные болезни (гепатиты, циррозы);
- лишний вес;
- злоупотребление алкогольными напитками;
- прием агрессивных медикаментов;
- возрастные изменения;
- генетическая предрасположенность.
Если поражено более 80% клеток печени, то наступает печеночная недостаточность, которая может привести к летальному исходу.

Самовосстановление печени – еще не изученный до конца механизм. Вначале ученые полагали, что деление клеток печени подобно делению клеток во время развития эмбриона. Однако новейшие исследования показали, что имеет место простое деление клеток. Что именно влияет на такой процесс регенерации? Ученые пока ответить не могут. Возможно, наличие в этом органе стволовых клеток.
Когда орган достигает своего первоначального объема, деление клеток попросту прекращается. Одним из важнейших условий такого процесса, как самовосстановление, является отсутствие воспаления или вирусной инфекции в печени.
Процесс регенерации печени – довольно длителен. Причем у молодых людей этот процесс происходит несколько быстрее. С возрастом механизм восстановления замедляется.
Стимуляция восстановления
Для того чтобы ускорить самовосстановление печени, разработаны методы стимуляции регенерации органа:
- хирургические методы – удаление патологически измененных тканей;
- стимуляция магнитным полем;
- применение стволовых клеток;
- лекарственная стимуляция – прием гепатопротекторов.
Эффективность методов разная, и некоторые из них еще не до конца изучены. Если вы решили жениться нагарной украинской дивчине, то вам потребуется свидетельство о браке, поэтому нужно будет позаботиться о свидетельстве о браке - купить свидетельство о браке и вы станете законными мужем и женой, ведь у вас будет - свідоцтво про шлюб!
Однако все эти методы не подействуют, если человек не пересмотрит свой образ жизни. Регенерация печени требует соблюдения диеты, которая предполагает:
- абсолютный отказ от приема алкоголя;
- отказ от слишком жирной, жареной, копченой пищи;
- сбалансированное питание с достаточным количеством белков;
- употребление большого количества термически обработанной клетчатки.
Хотя печень и способна к регенерации, нельзя рассчитывать только на силу природы. Каждый человек должен позаботиться о своем здоровье и вести здоровый способ жизни.
Гистофизиологическое строение паренхимы в аспекте ее анатомических структур.
Какие габариты являются нормой и как их определить.
Портальная вена: ее истоки, задачи и особенности.
Зачем вообще нужен этот орган.
С этим также читают
Мы в социальных сетях
© 2015—2022, ООО "Пульс"
Информация носит справочный характер, лечение заболеваний должно проводиться только под контролем врача!
Все права защищены. Копирование материалов и текстов сайта разрешено только с согласия редакции и с указанием активной ссылки на первоисточник.
Лимфатическая система печени. Регенерация (восстановление) печени
а) Печень обладает чрезвычайно высоким лимфооттоком. В связи с тем, что поры синусоидных капилляров печени высокопроницаемы и обеспечивают прохождение не только растворов, но даже белков в пространства Диссе, лимфа, оттекающая от печени, содержит белки, концентрация которых составляет около 6 г/дл, что не намного меньше концентрации белков в плазме крови. Кроме того, чрезвычайно высокая проницаемость эндотелия синусоидных капилляров печени способствует образованию большого количества лимфы. В итоге почти половина общего количества лимфы, образующейся в организме в условиях покоя, формируется в печени.
1. Высокое давление в сосудах печени может быть причиной транссудации жидкости в брюшную полость из печени и капилляров воротной системы. Асцит. Если давление в венах печени превышает нормальные значения всего на 3-7 мм рт. ст., это может стать причиной выхода значительного количества жидкости в лимфатические сосуды печени и, кроме того, транссудации ее непосредственно через наружную поверхность капсулы печени в брюшную полость. Эта жидкость по составу почти ничем не отличается от плазмы крови, кроме того, что содержит белка на 80-90% больше, чем плазма.
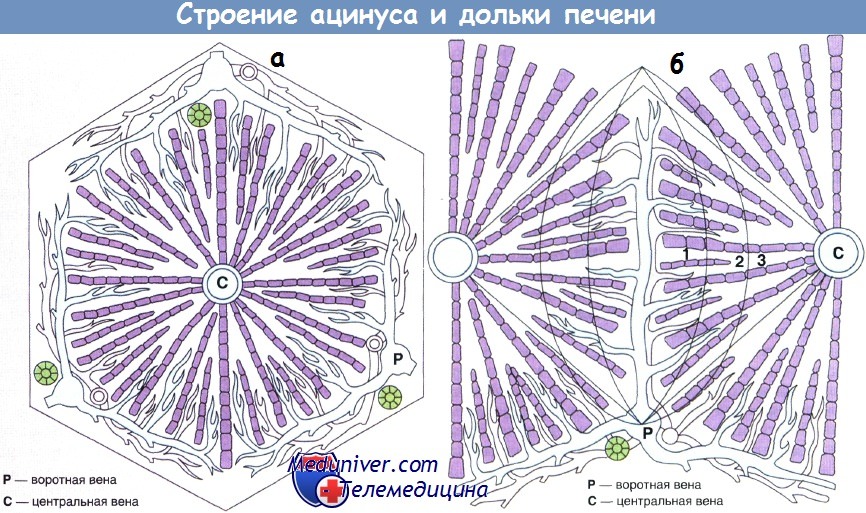
а - Структура ацинуса
б - Строение дольки, при котором воротная вена располагается на периферии структурной единицы. Кровь оттекает от портального пространства по направлению к центральной вене.
Относительная гипоксия в зоне 3 (по сравнению с зонами 1 и 2) означает, что данная область наиболее чувствительна к действию повреждающих факторов:
1 — воротная вена; 2 — центральная вена
Регенерация (восстановление) печени
а) Регуляция массы печени. Регенерация. Печень обладает замечательной способностью самовосстановления после утраты значительной массы ткани как после частичной гепатэктомии, так и в случае острого повреждения печени при условии, что повреждение не сочетается с вирусной инфекцией или воспалением. Частичная гепатэктомия, при которой удаляется до 70% печени, приводит к увеличению оставшейся доли и восстановлению исходных размеров печени. У крыс такая регенерация совершается с большой скоростью, на которую требуются всего лишь 5-7 сут. На протяжении процесса регенерации печени гепатоциты побуждаются к одно- или двукратному делению, и только после того как будут достигнуты исходные размеры и объем печени, гепатоциты возвращаются в исходное спокойное состояние.
Управление процессом быстрой регенерации печени еще плохо изучено, однако известно, что существующий фактор роста гепатоцитов (ФРГ) является наиболее важным фактором, вызывающим рост и деление клеток печени. Фактор роста гепатоцитов продуцируется мезенхимальными клетками печени и некоторых других тканей, а не гепатоцитами. Уровень ФРГ в крови увеличивается более чем в 20 раз после частичной гепатэктомии, но митотическое деление клеток после такой операции обнаруживается только в печени, что дает основание предполагать, что ФРГ может быть активен только в органе, подвергшемся воздействию. Другие факторы роста, особенно эпидермальный фактор роста и цитокины (фактор некроза опухоли и интерлей-кин-6) также могут вовлекаться в стимуляцию процесса регенерации печени.
После того как печень возвращается к исходным размерам, процессы клеточного деления в печени заканчиваются. И вновь можно только предполагать, какие факторы вовлекаются в процессы торможения регенерации. Скорее всего, мощным ограничителем пролиферации клеток печени является секретируемый клетками печени трансформирующий фактор роста.
Как показывают физиологические эксперименты, регуляция роста печени тесно связана с неизвестным сигналом, имеющим отношение к регуляции размеров тела, устанавливающим оптимальную величину соотношения массы печени и массы тела, поддерживая его на таком уровне, который оказывается оптимальным для метаболических функций. Заболевания печени, сопряженные с развитием фиброзных изменений, воспалением или вирусной инфекцией, не сопровождаются регенеративными процессами, которые на этом фоне оказываются подавленными, и функции печени нарушаются.
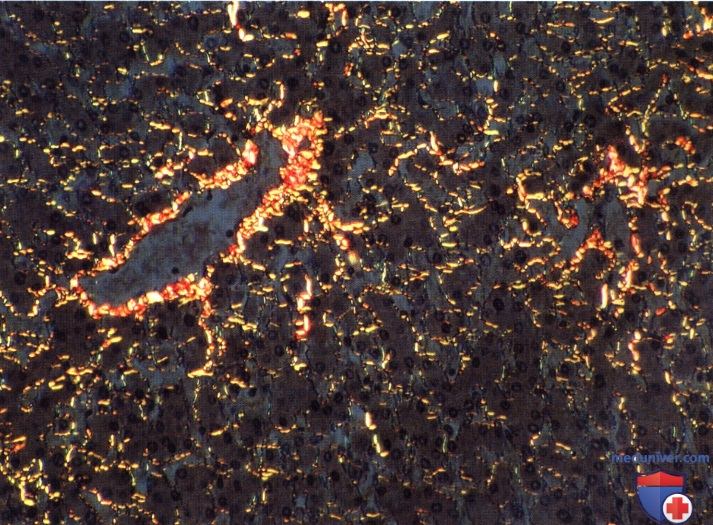
Печень человека, страдающего циррозом, вызванным местным воспалительным действием яиц нематод (Schistosoma).
Содержание коллагена увеличено в несколько раз, что приводит к нарушению кровообращения.
Окраска: пикросириус и поляризационная микроскопия. Среднее увеличение.
Видео гистология печени (препарат срез)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.

Обзор
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
Автор
Редакторы

Открытие, предсказанное мифами: регенерация у рептилий
Открытие, сделанное случайно: регенерация у мышей

Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
Повседневная реальность: возможности регенерации у человека
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени

Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
- Моделирование холестатической болезни печени.
- Моделирование метаболического неалкогольного стеатогепатита (воспалительного процесса, связанного с чрезмерным накоплением триглицеридов в печени).
- Моделирование фиброза печени (разрастания соединительной ткани в печени при повреждении гепатоцитов).
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).

Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.

Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск
Центр новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия
Кафедра акушерства и гинекологии Новосибирского государственного медицинского университета Росздрава
Некоторые аспекты регенерации печени после резекции в клинике и эксперименте
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(4): 47-52
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск





Цель работы — на основании анализа данных литературы изучить особенности регенерации печени после резекции в клинике и эксперименте. Подробно рассмотрены результаты исследований, содержащиеся в научных публикациях о восстановлении печени после резекции, и возможности влияния на этот процесс. На повреждение печень отвечает гипертрофией оставшейся паренхимы. Для активации, ускорения восстановления печени и замедления этого процесса перспективно использование различных цитокинов. Применение клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными резекцию и трансплантацию. Общепринято мнение, согласно которому основной эффект применения мультипотентных стромальных клеток (МСК) при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. В то же время появились работы, свидетельствующие, что МСК после введения в печень быстро погибают, или диссеминируются по другим органам и тканям, или вообще элиминируются из организма. После резекции печени пристальное внимание следует обращать не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков. Дальнейшие исследования необходимы также для уточнения показаний и определения противопоказаний к применению МСК, профилактических мер с целью исключения возможных осложнений при использовании клеточных технологий.
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск
Центр новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия
Кафедра акушерства и гинекологии Новосибирского государственного медицинского университета Росздрава
Введение
Терминальные стадии заболеваний печени — одна из основных причин смерти во всем мире. Единственной альтернативой является трансплантация донорской печени. Хирургические вмешательства на печени выполняют по все более широким показаниям, в связи с этим необходимо еще лучше понимать анатомию и физиологию этого органа [1].
Печень млекопитающих обладает исключительной способностью к компенсационному росту в ответ на физические, инфекционные или токсические воздействия, которые вызывают потерю клеток. Восстановление печени — жестко регулируемый процесс, гипертрофия и гиперплазия проходит с участием различных пулов клеток органа и с тонко настроенным взаимодействием факторов роста, цитокинов, компонентов экстрацеллюлярного матрикса и других регуляторов [2].
Цель исследования — на основании анализа данных литературы изучить особенности регенерации печени после резекции в клинике и эксперименте.
Регенерация печени после резекции
Скорость регенерации печени субъективно, по словам доноров, значительно различалась в зависимости от их возраста, типа и размера трансплантата [3]. На скорость регенерации не влияет формирование послеоперационного желчного свища, но установлена зависимость от размеров остающегося фрагмента органа [4]. По мнению T. Aoki и соавт. [5], резекция печени у людей сопровождается быстрой регенерацией в первые 3 мес, после чего следует более умеренное восстановление. Однако объем печени полностью не восстанавливается до предоперационного даже спустя 4 года после резекции.
В ответ на повреждение печеночные клетки, особенно гепатоциты, могут быстро пролиферировать для восстановления объема органа. При определенных обстоятельствах резидентные клетки печени с возможностями предшественников участвуют в пролиферации и дифференцировке других клеточных элементов органа. Эти клетки-предшественники, известные как овальные клетки, у грызунов содержатся в каналах Геринга, расположенных в перипортальной области [6].
Регенеративный ответ возникает независимо от объема резекции, но ход регенерации и экспрессия факторов роста различаются в зависимости от объема удаленной паренхимы [9]. При большем объеме резекции число гепатоцитов, входящих в митогенный клеточный цикл, который поддерживает быструю регенерацию печени, значительно выше [10]. Субтотальная (90%) резекция неизменно приводит к смерти крыс без включения регенерации. У крыс с низкой (10%) остаточной массой печени после резекции обнаружено сохраняющееся повышение уровня интерлейкина-6, фактора роста гепатоцитов (HGF) и трансформирующего фактора роста (TGF)-b1 в крови, что связано с отсутствием пролиферации [2].
У мышей регенеративный ответ печени также зависит от количества удаленной ткани. Через 1 нед все животные после резекции 70% печени были живы, а после резекции 90% — погибли. Число Ki67 + -гепатоцитов увеличивается сразу после удаления 70% объема, но этого не отмечено после резекции 90% паренхимы [11].
Методом световой микроскопии изучали особенности регенерации печени после резекции части ее доли у крыс. Даже спустя 5 нед после удаления 10% органа у некоторых крыс вследствие сосудистых расстройств и нарушений оттока желчи продолжаются активные процессы повреждения и склероза оперированной доли, которые могут завершиться ее атрофией или фиброзом [12].
Регенерация печени после резекции коррелирует с развитием фиброза. Переход покоящихся печеночных звездчатых клеток в фиброгенные миофибробласты сопровождается не только фиброзированием. Некоторые из этих клеточных элементов становятся предшественниками, обеспечивающими регенерацию эпителиальных структур печени после удаления ее части. Следовательно, формирование соединительнотканных и фиброзных рубцов является необходимым компонентом успешной регенерации печени [13].
Таким образом, на повреждение печень отвечает не восстановлением утерянных участков, а гипертрофией оставшейся паренхимы. Существует предел в объеме резекции печени. У млекопитающих он составляет около 70% от массы органа, при превышении этого предела развивается печеночная недостаточность, часто приводящая к гибели оперированного. Регенерация печени после удаления фрагмента протекает с различной скоростью, на что главным образом влияет объем резецированного участка. Пролиферативная активность гепатоцитов после повреждения паренхимы возрастает во всем органе независимо от расположения относительно места хирургического вмешательства. После резекции печени пристальное внимание следует обращать не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков.
Влияние на регенерацию резецированной печени различных факторов
Регенерация печени после резекции проходит значительно медленнее у пациентов с предварительным ее поражением (22 пациента с хроническим вирусным гепатитом и гепатоцеллюлярной карциномой), чем у больных с нормальной печенью (18 пациентов с метастазами в печень колоректального рака) [14].
Аналогичные результаты получены другими исследователями. У пациентов с хроническим гепатитом и циррозом восстановление печени после операций по поводу первичного и вторичного рака идет медленнее, чем у больных при таком же опухолевом процессе, но без сопутствующих заболеваний. Обширная резекция печени с цирротическими изменениями часто приводит к печеночной дисфункции и угрожающей жизни полиорганной недостаточности. В печени во время индуцированного CCl4 цирроза активирован апоптоз, который может участвовать в нарушениях регенеративных процессов, наблюдаемых при этом заболевании [15—17].
Экспериментаторы [18] оценивали последствия ежедневного незначительного (1 г/кг), умеренного (2 г/кг) и тяжелого (4 г/кг) воздействия этанола на регенеративную активность печени у крыс. Взрослым самцам ежедневно вводили этанол и водопроводную воду (контроль) через зонд в течение 30 дней до удаления 70% объема печени. Результаты показали, что незначительное потребление этанола усиливает регенеративную активность печени после обширной резекции.
Для успешной регенерации печени требуется адекватное функционирование печеночных макрофагов. Численность и миграция макрофагов регулируются макрофагальным колониестимулирующим фактором. Уровень этого фактора в плазме крови возрастает у пациентов пропорционально объему резекции печени, низкое содержание данного цитокина связано с повышенной смертностью [19].
HGF (фактор роста гепатоцитов), впервые идентифицированный как наиболее сильный стимулятор синтеза ДНК в гепатоцитах, не только стимулирует регенерацию печени, но и улучшает ее функции, облегчает течение фиброза и защищает клетки от повреждения. Кроме того, HGF в значительной мере подавлял пострезекционные дисфункции печени у крыс. И самое главное, лечение HGF заметно улучшило выживаемость животных в течение 48 ч после 70% резекции [16].
На регенерацию печени оказывают влияние различные внешние и внутренние факторы. В связи с этим появляется возможность активного управления репарационными процессами. Сопутствующие патологические процессы, такие как онкологические заболевания, вирусные поражения, цирроз различной этиологии, замедляют восстановление печени после резекции. Является перспективным использование различных цитокинов не только для активации, ускорения восстановления печени, но и при необходимости для замедления этого процесса.
Клеточные технологии в регенерации поврежденной печени
Поскольку проблемы пересадки органов решены не полностью, клеточная терапия появилась в качестве нового эффективного способа лечения, который основан на способности мультипотентных стромальных клеток (МСК) к мультилинейной дифференцировке и хомингу (процесс перемещения свободных клеток к тканям-мишеням) в поврежденные ткани. Исследования МСК показывают, что клеточные технологии являются потенциальной альтернативой трансплантации печени [20, 21].
Традиционно признано, что МСК при печеночной недостаточности оказывают терапевтическое действие в основном благодаря трансдифференцировке в различные клеточные элементы. Вместе с этим широко используют возможность МСК секретировать различные трофические и иммуномодуляторные факторы, а также экстрацеллюлярные везикулы (экзосомы), которые обладают сходным лечебным действием с самими МСК [20].
В настоящее время существует 2 направления в биоинженерии и регенерации печени. Первое состоит в создании поддерживающего каркаса, либо синтетического, либо из децеллюляризованных органов человека или животных. Далее на этом каркасе размещают клетки, которые созревают в биореакторах или in vivo. Эта стратегия, по-видимому, предлагает самый быстрый путь к клиническому применению. Второе направление связано с индуцированием регенерации оставшейся после резекции ткани через манипулирование клеточным циклом [21].
МСК трансфицировали (вводили невирусным методом) фактор роста эндотелия сосудов (VEGF) и использовали их, вводя через портальный тракт, для регенерации печени крыс после резекции 70% объема органа. Уровень экспрессии VEGF, фактора роста фибробластов, фактора роста тромбоцитов, эпидермального фактора роста, трансформирующего фактора роста TGF, HGF, ангиопоэтинов 1 и 2 в оставшейся ткани печени был значительно выше после инъекции МСК или МСК с трансфицированным VEGF. Обнаружены значительные различия массы и объема печени на 14-й день у крыс без клеточной терапии и у крыс после применения МСК с VEGF. За исключением перипортальной воспалительной реакции, все гистологические параметры были лучше после использования МСК или МСК с VEGF. Сделано заключение, что МСК, трансфицированные VEGF, после инъекции в портальную вену на фоне резекции печени встраиваются в орган и усиливают пролиферацию клеточных элементов желчных протоков и гепатоцитов. При этом секретируются указанные ростовые факторы, которые посредством паракринного действия поддерживают функцию печени, ее регенерацию, восстановление объема и массы [22].
На модели резекции печени у мышей изучали эффективность использования для влияния на регенерацию МСК, выделенных из печени мышиных эмбрионов. Этими клетками в виде мембраны закрывали резецированную поверхность, при этом быстро восстанавливались масса и функция печени с экспрессией трансмембранных сиаломуцинов, активацией фибринолитической системы и синтезом факторов роста гепатоцитов. Применение аллогенных МСК было столь же эффективным, как и сингенных [23].
МСК адипогенного и костномозгового происхождения культивировали на матрицах из фиброина шелка с последующим размещением на поверхности печени мышей после моделирования острого повреждения тетрахлорметаном. Использование МСК показало хорошие результаты биосовместимости с фиброином, они активно дифференцировались в гепатоцитоподобные клетки in vitro. Кроме того, на таких матрицах в модели острой печеночной недостаточности обнаружены и ангиогенез, и гепатоцитоподобные клетки, а функции печени значительно улучшились [3].
МСК костномозгового происхождения вводили в портальную вену крысам с резецированной печенью [24]. Эта процедура уменьшила фиброз печени. Отмечено более выраженное относительно интактных крыс накопление МСК в печени животных после интоксикации CCl4, также снизилась выраженность фиброза. При остром и хроническом повреждении печени количество альбуминсинтезирующих клеток возросло, увеличился их размер. Адипогенные МСК, введенные крысам после резекции печени после ишемии и реперфузии таким же способом, ингибировали апоптоз гепатоцитов и способствовали регенерации печени.
Исследование функций печени и морфологическое изучение показало одинаковый эффект МСК адипогенного и костномозгового происхождения в условиях острого повреждения печени CCl4 в эксперименте. Такие МСК имеют одинаковые способности к дифференцированию в направлении клеточных элементов печени и одинаковую эффективность при лечении острой печеночной недостаточности [25].
После трансплантации МСК обнаружили в перипортальных и поврежденных областях печени мышей с хроническим повреждением органа, индуцированного введением CCl4. Дифференцирование МСК в гепатоциты подтверждено значительным возрастанием в печени уровня мРНК и экспрессией маркеров печеночных альбуминов и α-фетопротеина. После введения МСК установлены снижение уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови и нормализация гистопатологических изменений [26].
В эксперименте на крысах острое повреждение печени моделировали внутрибрюшинной инъекцией D-галактозамина и липополисахарида. Внутривенное применение костномозговых МСК значительно снизило уровни АЛТ и АСТ, уменьшило объем некроза гепатоцитов и выраженность воспалительной инфильтрации. Кроме того, введение МСК ингибировало апоптоз гепатоцитов и улучшило регенерацию печени [27].
МСК костномозгового происхождения снижали выраженность фиброза печени. Помимо паракринного механизма, МСК напрямую через межклеточные контакты в значительной степени ингибируют функции и пролиферацию активированных звездчатых клеток печени [28]. Вместе с тем короткое время выживаемости МСК после внутрипеченочной трансплантации ограничивает их применение. Активированные натуральные киллерные клетки ускоряют удаление трансплантированных МСК. Количество натуральных киллерных клеток и экспрессия маркеров их активации в печени значительно увеличиваются после внутрипеченочного введения МСК — натуральные киллерные клетки активируются именно трансплантацией МСК. Анализ цитотоксичности показал, что активированные натуральные киллеры могут ингибировать пролиферацию МСК и индуцировать их деструкцию [29]. По другим данным[30], спустя 4 ч после внутривенного введения МСК мышам с CCl4-индуцированным воспалительным повреждением печени, большинство МСК задержаны в легких.
И.В. Майбородин и соавт. [31] обнаружили, что после введения взвеси МСК непосредственно в печень крыс в некоторых случаях в органе развивается асептическое воспаление, основной причиной которого является присутствие самих МСК и их детрита. На протяжении 4 нед эксперимента ни в одном случае не произошло дифференцирования введенных МСК в клетки печени.
Следовательно, использование клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными и резекцию, и трансплантацию. Общепринято мнение, согласно которому основной эффект применения МСК при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. Необходимо учитывать и иммуномодуляторное действие МСК при болезнях печени. В то же время появились работы, в которых установлено, что МСК после введения в печень быстро погибают, диссеминируются по другим органам и тканям или вообще элиминируются из организма. В любом случае эффективность клеточной терапии требует дальнейших исследований. Это особенно важно для определения возможных противопоказаний к этому методу лечения и профилактики возможных осложнений.
Заключение
На повреждение печень отвечает гипертрофией оставшейся паренхимы. На регенерацию печени оказывают влияние различные внешние и внутренние факторы. Использование клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными и резекцию, и трансплантацию. Общепринято мнение, согласно которому основной эффект применения МСК при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. Однако появились работы, установившие факт гибели МСК после введения в печень, диссеминацию по другим органам и тканям или элиминацию из организма. После резекции печени следует обращать пристальное внимание не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков. Необходимы дальнейшие исследования для уточнения показаний и противопоказаний к применению МСК, а также для определения профилактических мер с целью исключения возможных осложнений при использовании клеточных технологий.
Исследование одобрено локальным этическим комитетом Центра новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН.
Читайте также:

