Редуцирующие и нередуцирующие сахара кратко
Обновлено: 05.07.2024
В этом разделе мы опишем некоторые простые опыты, с помощью которых можно определять различные вещества, играющие в клетках важную биологическую роль. Существуют и более сложные методы идентификации и разделения клеточных компонентов. Первое место среди них занимают хроматография и электрофорез; их мы рассмотрим в приложении (т. 3).
Желательно сначала освоить методику анализов, работая с чистыми образцами веществ, подлежащих определению. Овладев методикой и научившись различать соответствующие изменения окраски, можно затем приступить к исследованию различных тканей.
Опыт 3.1. Определение биомолекул в чистом виде
ВНИМАНИЕ! При всех описанных здесь анализах нагревание следует проводить на водяной бане при температуре кипения воды. Прямое нагревание пробирок на огне недопустимо.
Материалы и оборудование
Штатив для пробирок
Раствор иода в йодистом калии
Разбавленная серная кислота
Гидрокабронат натрия (питьевая сода)
5%-ный раствор гидроксида калия
1%-ный раствор сульфата меди
Раствор дихлорфенолиндофенола (ДХФИФ)
1%-ный раствор крахмала (желательно из кукурузной муки)
РЕДУЦИРУЮЩИЕ САХАРА. К редуцирующим сахарам относятся все моносахариды, например глюкоза и фруктоза, и некоторые дисахариды, например мальтоза. Среди наиболее распространенных сахаров единственный нередуцирующий сахар — это сахароза (дисахарид). Используйте для анализа 0,1—1%-ные растворы сахарозы.
Влить в пробирку 2 мл раствора редуцирующего сахара. Добавить равное количество раствора Бенедикта. Встряхнуть и осторожно довести до кипения, продолжая непрерывно встряхивать, чтобы жидкость не выбросило из пробирки
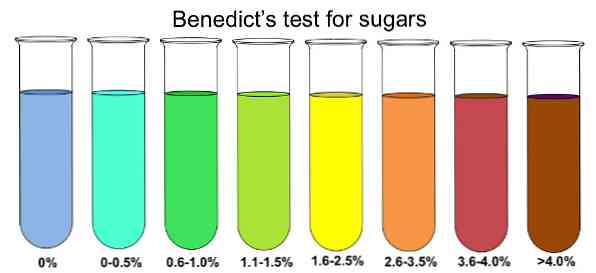
Синяя окраска раствора сменяется зеленой, а затем желтоватой; в конце выпадает кирпично-красный осадок
Раствор Бенедикта содержит сульфат меди. Редуцирующие сахара восстанавливают растворимый синий сульфат меди, содержащий ионы меди(II) [Сu 2+ ], до нерастворимого кирпично-красного осадка оксида меди(I). Оксид меди выпадает в осадок
ПРИМЕЧАНИЕ. Реакция полуколичественная, иначе говоря, она позволяет лишь грубо оценить количество редуцирующего сахара, присутствующего во взятой пробе. Окраска осадка переходит от зеленой к желтой, оранжевой и кирпично-красной с увеличением количества редуцирующего сахара. (Зеленый цвет — это результат смешения появившегося желтого осадка с синим раствором сульфата меди.)
Влить в пробирку 2 мл раствора редуцирующего сахара. Добавить 1 мл реактива Фелинга А и 1 мл реактива Фелинга В. Встряхивая, довести до кипения
Начальная синяя окраска смеси переходит в зеленую, затем в желтую, после чего выпадает кирпично-красный осадок
То же, что и для реакции Бенедикта
ПРИМЕЧАНИЕ. Реакция Фелинга не столь удобна, как реакция Бенедикта, потому что реактивы А и В приходится до анализа хранить отдельно. Чувствительность ее также ниже.
НЕРЕДУЦИРУЮЩИЕ САХАРА. Наиболее распространенный из нередуцирующих сахаров — это сахароза, относящаяся к дисахаридам. Если известно, что редуцирующие сахара в исследуемом растворе отсутствуют (т. е. если предыдущая реакция дала для этого раствора отрицательный результат), то появление кирпично-красного осадка в реакции, описанной ниже, свидетельствует о присутствии какого-то нередуцирующего сахара. Если же было доказано, что в исследуемом растворе содержатся редуцирующие сахара, то в описанной ниже реакции будет получен более обильный осадок, нежели в предыдущей реакции, при наличии в растворе также и какого-либо нередуцирующего сахара.
Влить в пробирку 2 мл раствора сахарозы. Добавить 1 мл разбавленной соляной кислоты. Кипятить в течение 1 мин. Осторожно нейтрализовать гидрокарбонатом натрия, проверяя лакмусовой бумажкой (осторожность требуется потому, что жидкость вскипает). Провести реакцию Бенедикта
Как в реакции Бенедикта
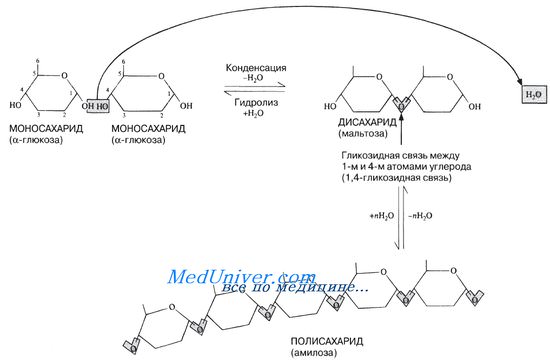
При кипячении с разбавленной соляной кислотой дисахарид гидролизуется до моносахаридных единиц. Сахароза расщепляется на глюкозу и фруктозу. Обе они представляют собой редуцирующие сахара и в реакции Бенедикта дают соответствующие результаты
КРАХМАЛ. Растворим в воде очень слабо, образует в ней коллоидные суспензии. Анализ можно проводить как с суспензией, так и с сухим крахмалом.
Влить в пробирку 2 мл 1 %-ного раствора крахмала. Добавить несколько капель раствора I2/KI
Второй вариант: нанести раствор на сухой крахмал
Под действием раствора I2/KI крахмал окрашивается в темно-синий цвет
Образуется полииодидный комплекс с крахмалом
ЦЕЛЛЮЛОЗА И ЛИГНИН. См. приложение 2 (окрашивание) в т. 3.
ЛИПИДЫ. К липидам относятся масла (например, кукурузное и оливковое), жиры и воска.
Проба с Суданом III
Судан III — красный краситель. Добавить 2 мл масла к 2 мл воды, налитой в пробирку. Добавить несколько капель Судана III и встряхнуть
Окрасившийся в красный цвет слой масла располагается поверх воды. Вода остается неокрашенной
Жировые глобулы окрашиваются в красный цвет и всплывают, потому что их плотность ниже плотности воды
Добавить 2 мл жира или масла в пробирку, содержащую 2 мл абсолютного спирта. Сильно встряхнуть для растворения липида. Добавить равное количество холодной воды
Образуется мутная белая суспензия
Липиды с водой не смешиваются. При добавлении воды к спиртовому раствору липида образуется эмульсия; мельчайшие липидные капельки, взвешенные в воде, отражают свет, вследствие чего эмульсия кажется белой и опалесцирует
Проба с жировым пятном
Нанести каплю исследуемого образца на бумагу. Выждать некоторое время, чтобы дать испариться воде, которая могла туда попасть. Можно слегка прогреть бумагу — это ускорит процесс
На бумаге останется прозрачное пятно
Для этих анализов очень подходит альбумин куриного яйца
Влить 2 мл раствора или суспензии белка в пробирку. Добавить 1 мл реактива Миллона и вскипятить.
ВНИМАНИЕ! Реактив Миллона ядовит — будьте осторожны!
Выпадает белый осадок, который при кипячении коагулирует и окрашивается в красный или оранжево-розовый цвет
Реактив Миллона — это раствор ртути(II) в азотной кислоте, содержащей примесь азотистой кислоты. Аминокислота тирозин содержит фенильную группу, реакция которой с реактивом Миллона приводит к образованию красного комплекса ртути(II). Это неспецифическая реакция, характерная для всех фенолов. Белок при нагревании обычно коагулирует, т. е. дает плотный осадок. Из всех белков, используемых для такого анализа, не содержит тирозина один только желатин
Влить в пробирку 2 мл раствора белка. Добавить равный объем 5%-ного гидроксида калия и перемешать. Добавить 2 капли 1%-ного раствора сульфата меди и перемешать. Нагревания не требуется
Медленно появляется розовато-фиолетовая или пурпурная окраска
Это реакция на соединения, содержащие пептидные связи. В присутствии разбавленного раствора сульфата меди в щелочной среде атомы азота пептидной цепи образуют окрашенный в пурпурный цвет комплекс с ионами меди(II) [Сu 2+ ]. Биурет (производное мочевины) тоже содержит группу —CONH— и поэтому дает такую реакцию
Витамин С (аскорбиновая кислота)
Данный метод можно при необходимости использовать для количественного определения. В этом случае указанные объемы следует отмерять очень точно. Подходящим источником витамина С может служить свежий апельсиновый или лимонный сок в смеси с дистиллированной водой (1:1). Можно использовать также имеющиеся в продаже таблетки витамина С.
Стандартом служит 0,1%-ный раствор аскорбиновой кислоты. Влить 1 мл ДХФИФ в пробирку. Набрать в шприц на 1 мл 0,1 %-ный раствор аскорбиновой кислоты. Добавить аскорбиновую кислоту к ДХФИФ по каплям, слегка помешивая иглой шприца. (Не встряхивать 1 .) Продолжить это до тех пор, пока синий раствор ДХФИФ не обесцветится. Отметить израсходованный объем аскорбиновой кислоты
Исчезновение синей окраски — раствор обесцвечивается
ДХФИФ — синий краситель — восстанавливается аскорбиновой кислотой (сильным восстановителем) до бесцветного соединения
1 Встряхивание раствора может привести к окислению аскорбиновой кислоты кислородом воздуха. Можно проверить самому, как отразится на результатах опыта встряхивание и кипячение.
3.15. Как можно определить концентрацию аскорбиновой кислоты в полученной пробе?
3.16. Вам даны три раствора сахара: в одном содержится глюкоза, в другом - смесь глюкозы и сахарозы, в третьем - сахароза.
а) Как вы определите, какой сахар содержится в каждом из этих растворов?
б) Кратко опишите дальнейшие процедуры, с помощью которых можно подтвердить правильность вашего ответа (допустим, что в вашем распоряжении имеется нужный прибор и что время позволяет провести такие определения).
3.17. Как можно приготовить 100 мл 10%-ного раствора глюкозы?
3.18. В вашем распоряжении имеются в качестве исходных растворов 10%-ный раствор глюкозы и 2%-ный раствор сахарозы. Как можно приготовить из них 100 мл смеси с конечной концентрацией 1% сахарозы и 1% глюкозы?
Опыт 3.2. Определение биомолекул в тканях
Биохимику часто приходится выявлять присутствие тех или иных биомолекул или определять их количество в живых тканях, т. е. вести качественный или количественный анализ. Иногда эти определения можно выполнять непосредственно на самой ткани, но нередко им должен предшествовать тот или иной процесс экстракции или очистки.
Полезно потренироваться на каких-либо обычных пищевых продуктах или на растительном материале, определяя в них те биомолекулы, о которых шла речь в опыте 3.1. Там, где это возможно, мы предлагаем процедуру экстрагирования, которая позволит использовать для анализа чистый бесцветный раствор. Усвоив смысл таких процедур, студент сможет при необходимости сам предложить аналогичные методики.
Материалы и оборудование
Все, что перечислено в опыте 3.1 (от начала и до раствора ДХФИФ)
Ступка с пестиком
Предметные и покровные стекла
Флороглюцин + концентрированная соляная кислота
Микроскопическое исследование тонких срезов ткани
Метод пригоден для знакомства с теми отложениями запасных веществ, которые можно видеть под микроскопом, например с крахмальными зернами в клубне картофеля.
Микроскопическое исследование срезов с соответствующим окрашиванием или какой-либо иной химической обработкой
Метод пригоден для выявления перечисленных ниже веществ.
Редуцирующие сахара. Поместить срез в несколько капель реактива Бенедикта и осторожно нагреть до кипения; при необходимости добавить воды, чтобы предотвратить высыхание.
Крахмал. Поместить в разбавленный раствор I2/КI.
Белок. Поместить срез в несколько капель реактива Миллона и осторожно нагреть до кипения; при необходимости добавить воды, чтобы предотвратить высыхание.
Масла и жиры. Окрасить исследуемый материал, например семена, Суданом III, после чего промыть водой и(или) 70%-ным спиртом. Приготовить срезы и заключить в соответствующую среду.
Целлюлоза, лигнин и т. п. См. табл. 5.5.
Исследование прозрачных водных растворов
Обесцветить ткань, если в этом есть необходимость. Присутствующие в ткани пигменты могут мешать цветным реакциям, но обычно эти пигменты легко удалить из ткани органическими растворителями, например 80%-ным этанолом или 80%-ным пропаноном (ацетоном) (беречь от соприкосновения с открытым огнем). Следует, однако, помнить, что эти растворители могут удалять из ткани липиды и растворимые сахара. Методика пригодна для извлечения хлорофилла из листьев.
Гомогенизация материала. Сахара и белки. Кусочки предназначенного для исследования материала растереть в кашицу с небольшим количеством воды при помощи ступки или миксера. Растертый материал процедить через несколько слоев тонкой кисеи или нейлона, предварительно смоченных водой, и либо отфильтровать, либо отцентрифугировать для удаления твердых частиц. Это может и не потребоваться, если суспензия окажется высокодисперсной и практически бесцветной. Прозрачный раствор анализируют как обычно, а если нужно, приготовляют из него соответствующие разведения. Твердый осадок, если он представляет интерес, также может быть подвергнут анализу.
Липиды. Растереть материал, перенести в пробирку и вскипятить. Липиды отделяются в виде капелек масла. Провести окрашивание Суданом III. Можно вместо этого приготовить эмульсию из тонко наструганного ядра ореха или других пищевых продуктов (которые могут быть и окрашенными) и провести эмульсионную пробу.
Описанная методика пригодна для выявления в различных материалах указанных ниже веществ.

Моносахариды и большинство дисахаридов обладают редуцирующей способностью, все они обязаны (альдегидной) карбоксильной группе, которую они имеют в своей же молекуле. Свободный конец атома используется путем передачи электонов другой свободной молекуле. Их открытая химическая структура (с двумя кольцами химических веществ) позволяет им разбиваться с удвоенной скоростью дисахаридов.
Этот редуцирующий характер можно продемонстрировать с помощью окислительно-восстановительной реакции, проводимой между ними и сульфатом меди (II). Растворы этой соли имеют синий цвет. После реакции с восстановительным углеводным оксидом меди (I) образуется кирпично-красный цвет. Таким образом, изменение цвета указывает на то, что указанная реакция произошла и что, следовательно, данный углевод редуцирующий. Ученые используют несколько обычных химических составов на определение редуцирующего сахара: самые распространенные реакция Бенедикта и реакция Фелинга.
Сахара, которые дают положительные результаты по тестам известны как редуцирующие сахара. Положительный результат дают сахара с полуацетальную или гемикетальную группой. Но я не буду их рассматривать(это для общего понятия).
Углеводы, содержащие только ацетальные или кетальные группы и нет свободной альдегидной функции, дают отрицательный результат с этими растворами, они все - нередуцирующие сахара (тростниковый или свекольный сахар).
Самыми распространенными сахарами в продуктах питания являются глюкоза и фруктоза (моносахариды), а в меньшей степени лактоза и галактоза(дисахариды). Ряд сахаров или сахароза не является редуцирующим сахаром, но если сахарный раствор нагревается или подкисляется, идет гидролиз: сахароза разрушается до глюкозы и фруктозы, а это уже моносахариды. И они редуцируются.
Нередуцирующие сахара.
Это углеводы – полисахариды. Самая распространенная – сахароза. Имеет закрытую (замкнутую )химическую структуру. У нее несколько химических колец(три), где открытые атомы используются для связывания структуры в целом и, следовательно, не имеют свободных электронов для отдачи связующей молекуле. Из-за этого окисления нет во время реакции. Чтобы вызвать разложение, понадобится гораздо больше времени.

У нередуцирующего сахара нет реакционной способности, нет альдегидной группы, поэтому тест Бенедикта дает отрицательный результат.
1. Раствор сахарозы + 2 капли реактива Бенедикта (отрицательный результат, нередуцирующий агент)
2. Раствор фруктозы + 2 капли реактива Бенедикта
3. Раствор глюкозы + 2 капли реактива Бенедикта
4. Раствор лактозы + 2 капли реактива Бенедикта
Редуцироваться (само слово) – буквально если переводить, то в биологии: стать уменьшенных размеров, в техническом понимании - понижение(о давлении газа)
Лактоза. Молочный сахар. Сахароза. Тростниковый сахар. Редуцирующие сахара.
Лактоза, или молочный сахар, содержится только в молоке и служит важным источником энергии для детенышей млекопитающих. Она переваривается медленно и потому способна обеспечивать постоянный стабильный приток энергии.
Сахароза, или тростниковый сахар — самый распространенный в природе полисахарид. Чаще всего она встречается в растениях, где в больших количествах транспортируется по флоэме. Сахароза особенно пригодна для этого, так как благодаря ее высокой растворимости она может транспортироваться в виде весьма концентрированных растворов.
Редуцирующие сахара
Все моносахариды и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к группе редуцирующих (восстанавливающих).
Сахаров, т. е. соединений, способных вступать в реакцию восстановления. Сахароза представляет собой единственный нередуцирующий сахар среди распространенных Сахаров. Две обычные реакции на редуцирующие сахара — реакция Бенедикта и реакция Фелинга — основаны на способности этих Сахаров восстанавливать ион двухвалентной меди до одновалентной. В обеих реакциях используется щелочной раствор сульфата меди(II) (CuSO4), который восстанавливается до нерастворимого оксида меди(1) (Cu20).
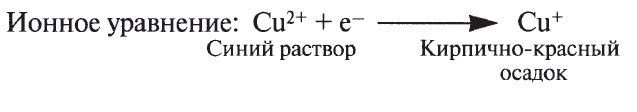
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
редуцирующие сахара это биомолекулы, которые действуют как восстановители; то есть они могут пожертвовать электроны другой молекуле, с которой они реагируют. Другими словами, восстанавливающий сахар представляет собой углевод, который содержит в своей структуре карбонильную группу (С = О)..
Эта карбонильная группа образована атомом углерода, присоединенным к атому кислорода через двойную связь. Эта группа может быть найдена в разных положениях в молекулах сахара, что приводит к другим функциональным группам, таким как альдегиды и кетоны.
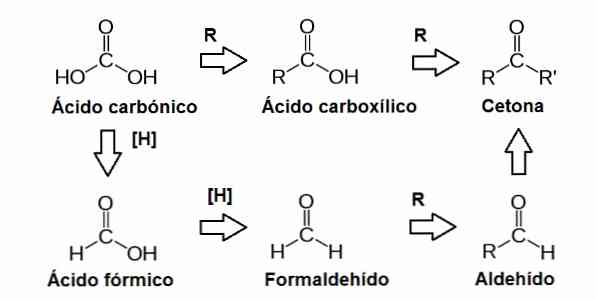
Альдегиды и кетоны находятся в молекулах простых сахаров или моносахаридов. Эти сахара классифицируются в кетозах, если они имеют карбонильную группу внутри молекулы (кетон), или в альдозах, если они содержат ее в терминальном положении (альдегид).
Альдегиды являются функциональными группами, которые могут проводить окислительно-восстановительные реакции, которые включают движение электронов между молекулами. Окисление происходит, когда молекула теряет один или несколько электронов, и восстановление, когда молекула приобретает один или несколько электронов..
Из существующих видов углеводов все моносахариды являются восстанавливающими сахарами. Например, глюкоза, галактоза и фруктоза действуют как восстановители.
В некоторых случаях моносахариды являются частью более крупных молекул, таких как дисахариды и полисахариды. По этой причине некоторые дисахариды, такие как мальтоза, также ведут себя как восстанавливающие сахара..
- 1 Методы определения редуцирующих сахаров
- 1.1 Тест Бенедикта
- 1.2 Реагент Фелинга
- 1.3 Реагент Толленса
- 2.1 Значение в медицине
- 2.2 Реакция Майяра
- 2.3 Качество еды
Методы определения редуцирующих сахаров
Тест Бенедикта
Чтобы определить наличие восстанавливающих сахаров в образце, его растворяют в кипящей воде. Затем добавляют небольшое количество реагента Бенедикта и раствору дают нагреться до комнатной температуры. В следующие 10 минут раствор должен начать менять цвет.
Если цвет меняется на синий, то редуцирующих сахаров нет, особенно глюкозы. Если в анализируемом образце присутствует большое количество глюкозы, изменение цвета будет переходить в зеленый, желтый, оранжевый, красный и, наконец, коричневый..
Реагент Бенедикта представляет собой смесь нескольких соединений: он включает безводный карбонат натрия, цитрат натрия и пентагидрат сульфата меди (II). После добавления в раствор с образцом начнутся возможные реакции восстановления оксида..
Если есть редуцирующие сахара, они уменьшат сульфат меди (синий цвет) раствора Бенедикта до сульфида меди (красноватый цвет), который выглядит как осадок и отвечает за изменение цвета.
Невосстанавливающие сахара не могут этого сделать. Этот конкретный тест обеспечивает только качественное понимание присутствия редуцирующих сахаров; то есть это указывает, есть или нет редуцирующие сахара в образце.
![]()
Реагент Фелинга
Подобно тесту Бенедикта, тест Фелинга требует, чтобы образец полностью растворился в растворе; Это делается в присутствии тепла, чтобы полностью раствориться. После этого добавляют раствор Фелинга, постоянно помешивая..
Если редуцирующие сахара присутствуют, раствор должен начать менять цвет в виде оксида или красного осадка. Если редуцирующих сахаров нет, раствор остается синим или зеленым. Раствор Фелинга также готовят из двух других растворов (А и В).
Раствор A содержит пентагидрат сульфата меди (II), растворенный в воде, а раствор B содержит тетрагидрат тартрата калия-натрия (соль Рошеля) и гидроксид натрия в воде. Два раствора смешивают в равных частях, чтобы сделать окончательное тестовое решение.
Этот тест используется для определения моносахаридов, в частности, альдоз и кетоз. Они обнаруживаются, когда альдегид окисляется до кислоты и образует оксид меди..
После контакта с альдегидной группой он превращается в ион меди, который образует красный осадок и указывает на присутствие восстанавливающих сахаров. Если бы в образце не было редуцирующих сахаров, раствор оставался бы синего цвета, что указывает на отрицательный результат для этого теста..
Реагент Толленс
Тест Толленса, также известный как тест серебряного зеркала, является качественным лабораторным тестом, который используется для различения альдегида и кетона. Он использует тот факт, что альдегиды легко окисляются, в то время как кетоны не.
В тесте Tollens используется смесь, известная как реагент Tollens, который представляет собой основной раствор, содержащий ионы серебра, координированные с аммиаком..
Этот реагент не является коммерчески доступным из-за его короткого срока полезного использования, поэтому он должен быть подготовлен в лаборатории, когда он будет использоваться.
Подготовка реагента включает в себя два этапа:
Шаг 1
Водный нитрат серебра смешивают с водным гидроксидом натрия.
Шаг 2
Водный аммиак добавляют по каплям, пока осажденный оксид серебра полностью не растворится.
Реагент Толленса окисляет альдегиды, которые присутствуют в соответствующих восстанавливающих сахарах. Та же самая реакция включает восстановление ионов серебра из реагента Толленса, который превращает их в металлическое серебро. Если испытание проводится в чистой пробирке, образуется осадок серебра.
важность
Определение наличия редуцирующих сахаров в разных образцах важно в нескольких аспектах, включая медицину и гастрономию..
Значение в медицине
Скрининговые тесты на снижение сахара использовались в течение многих лет для диагностики пациентов с диабетом. Это может быть сделано, потому что это заболевание характеризуется повышением уровня глюкозы в крови, посредством чего определение их может быть выполнено этими методами окисления.
Измеряя количество окислителя, уменьшенного глюкозой, можно определить концентрацию глюкозы в образцах крови или мочи..
Это позволяет пациенту указывать соответствующее количество инсулина, которое необходимо ввести, чтобы уровень глюкозы в крови вернулся в нормальный диапазон..
Реакция Майяра
Реакция Майяра включает комплекс сложных реакций, возникающих при приготовлении некоторых продуктов. Когда температура пищи увеличивается, карбонильные группы восстанавливающих сахаров реагируют с аминогруппами аминокислот..
В результате этой реакции приготовления пищи образуются разнообразные продукты, и, хотя многие из них полезны для здоровья, другие являются токсичными и даже канцерогенными. По этой причине важно знать химию редуцирующих сахаров, которые включены в обычную диету..
При приготовлении продуктов, богатых крахмалоподобным картофелем, при очень высоких температурах (выше 120 ° C) происходит реакция Майяра.
Эта реакция происходит между аминокислотой аспарагин и восстанавливающими сахарами, генерируя молекулы акриламида, который представляет собой нейротоксин и возможный канцероген.
Качество еды
Качество определенных продуктов можно отслеживать с помощью методов обнаружения снижения сахара. Например: для вин, соков и сахарного тростника уровень редуцирующих сахаров определяется как показатель качества продукта..
Для определения восстанавливающих сахаров в пищевых продуктах обычно используют реагент Фелинга с метиленовым синим в качестве индикатора восстановления оксидов. Эта модификация широко известна как метод Лейна-Эйнона.
Разница между восстанавливающими сахарами и невосстанавливающими сахарами
Разница между восстанавливающими и невосстанавливающими сахарами заключается в их молекулярной структуре. Углеводы, которые восстанавливают другие молекулы, делают это, жертвуя электроны из их свободных альдегидных или кетоновых групп..
Следовательно, невосстанавливающие сахара не имеют в своей структуре альдегидов или свободных кетонов. Следовательно, они дают отрицательные результаты в тестах на обнаружение редуцирующих сахаров, как в тесте Фелинга или Бенедикта.
Восстанавливающие сахара включают все моносахариды и некоторые дисахариды, в то время как невосстанавливающие сахара включают некоторые дисахариды и все полисахариды.
Читайте также: