Растворение это в химии кратко
Обновлено: 05.07.2024
РАСТВОРЕ́НИЕ, массообменный процесс образования из двух или нескольких компонентов макроскопически однородных (гомогенных) термодинамически устойчивых систем ( растворов ). Компонент раствора, взятый в большем количестве и имеющий то же агрегатное состояние, что и раствор в целом, называют растворителем; др. компоненты – растворяемыми веществами. Если одним из компонентов является вода, её обычно считают растворителем при любых количественных соотношениях. Растворяемые вещества могут находиться в твёрдом, газо(паро)образном и жидком состояниях. Р. широко применяется в химич., фармацевтич., металлургич. и др. отраслях пром-сти для обработки сырья, полупродуктов, получения целевого продукта.

Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия
Содержание
Твердые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
Раствором именуют и смесь цемента с водой, песком и т.д. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10 −9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10 −9 м — 5·10 −7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворенного вещества сильно меняются и химические свойства - например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
См. также
Растворы электролитов и неэлектролитов
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
См. также
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенного
Концентрация растворов
В зависимости от цели для выражения концентрации растворов используются разные единицы измерения — весовой и объёмный процент, молярность, моляльность, г/л, мольная доля и др.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно лить в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приема существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая беда
- Не плюй в кислоту!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Растворение" в других словарях:
РАСТВОРЕНИЕ — РАСТВОРЕНИЕ, в геологии форма химического ВЫВЕТРИВАНИЯ. Растворение особенно активно в известняковых зонах, где в результате этого мелкие трещинки могут превратится в крупные ТРЕЩИНЫ, ВОРОНКИ и ГРАЙКИ. Растворение также может происходить в… … Научно-технический энциклопедический словарь
растворение — разжижение, лизис, травление, открытие, размешивание, распускание, распахивание, солюбилизация, открывание, разведение, диссолюция, отворение Словарь русских синонимов. растворение сущ. 1. • открывание • отворение • раскрывание • распахивание … Словарь синонимов
РАСТВОРЕНИЕ — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Экономический словарь. 2010 … Экономический словарь
Растворение — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
РАСТВОРЕНИЕ — РАСТВОРЕНИЕ, растворения, мн. нет, ср. (спец.). Действие по гл. растворить2 растворять2. При растворении тел иногда происходит заметное выделение тепла. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
растворение — РАСТВОРИТЬ 2, рю, ришь; рённый ( ён, ена); сов., что. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
"РАСТВОРЕНИЕ" — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Райзберг Б.А., Лозовский Л.Ш., Стародубцева Е.Б.. Современный экономический словарь. 2 е изд., испр. М.: ИНФРА М. 479 с.. 1999 … Экономический словарь
"РАСТВОРЕНИЕ" — уменьшение долевого участия акционеров в распределении чистого дохода в результате увеличения акционерного капитала. Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
растворение — разведение — [Англо русский глоссарий основных терминов по вакцинологии и иммунизации. Всемирная организация здравоохранения, 2009 г.] Тематики вакцинология, иммунизация Синонимы разведение EN dilution … Справочник технического переводчика
растворение — Процесс, при котором жидкость, обычно вода, растворяет твердые частицы горных пород, как, например, это имеет место при химическом выветривании … Словарь по географии
Растворы — однородные (гомогенные) системы, в состав которых входят: растворенные вещества, растворитель и (возможно) продукты химической реакции, протекающей между ними.
Особенностью растворенного вещества является равномерное распределение в объеме вещества, которое играет роль растворителя. Для раствора характерно содержание двух и более компонентов.
- жидкие;
- твердые;
- газообразные.
Растворитель представляет собой вещество, сохраняющее стабильность агрегатного состояния в процессе растворения.
Когда смешивают вещества с идентичными агрегатными состояниями, к примеру, жидкость с жидкостью, газ с газом, твердый материал с твердым, роль растворителя играет компонент с большим содержанием. Процесс, при котором образуется раствор, определяется особенностью взаимодействия частиц растворителя с частицами растворенного вещества и их природой.
Растворение является физико-химическим процессом, в котором можно наблюдать взаимодействие частиц между собой, что приводит к образованию раствора.
Растворение представляет собой результат взаимодействия молекул вещества, играющего роль растворителя, с частицами растворенного вещества. При растворении твердых веществ наблюдают увеличение энтропии. В процессе растворения газообразных веществ энтропия уменьшается. Растворение сопровождается исчезновением межфазной границы, изменением физических свойств раствора, в том числе плотности, вязкости, в некоторых случаях, окраски.
Когда растворитель и растворенное вещество участвуют в химическом взаимодействии, можно наблюдать изменение химических свойств раствора. В качестве примера можно привести растворение газа хлороводорода в воде, результатом которого является образование жидкой соляной кислоты.
Теплота растворения зависит от природы компонентов раствора.
Например: если растворяются кристаллические вещества с растворимостью, увеличивающейся при повышении температуры, то раствор охлаждается. Это объясняется тем, что раствор обладает большей внутренней энергией по сравнению с аналогичными характеристиками кристаллического вещества и растворителя, взятых по отдельности. Как пример, можно рассмотреть кипяток, в котором происходит растворение сахара. В результате раствор значительно охлаждается.
Основные этапы: физическая и химическая стадия
Этапы растворения кристаллических веществ в водной среде:
- Кристаллическая решетка разрушается, что является физической стороной процесса. В результате поглощается теплота, то есть ∆ Н 1 > 0 .
- Частицы вещества взаимодействуют с молекулами растворителя, что соответствует химической стороне процесса. В итоге выделяется теплота, то есть ∆ Н 2 0 .
- Суммарный тепловой эффект: ∆ Н = ∆ Н 1 + ∆ Н 2
Классификация растворов в зависимости от механизма растворения:
Физическим растворением называют процесс разрыва и образования лишь межмолекулярных связей, в том числе, водородных.
Физическое растворение можно наблюдать только в случае определенных веществ, выполняющих роль растворителя и растворенного вещества, не вступающих в химические реакции между собой. К примеру, нафталин растворяется в спирте.
Химическое растворение является видом растворения, которое предполагает разрушение исходных химических связей в процессе химического превращения.
Например: химическое растворение протекает при электрической диссоциации растворяемого вещества.
При растворении имеет место следующая закономерность: подобное хорошо растворяется в подобном. Так, в неполярных растворителях хорошо растворяются неполярные вещества. Полярными растворителями целесообразно растворять полярные вещества. Благодаря исследованиям механизмов растворения, природы растворяемых веществ и растворителей, определяют степень растворимости одного вещества в другом.
Признаки химического взаимодействия при растворении
- Сахар растворяется в воде. Раствор приобретает сладкий вкус.
- Краситель растворяется в воде. В результате раствор приобретает определенную окраску.
Признаками химических явлений являются:
- теплота выделяется, либо поглощается;
- окраска некоторых соединений меняется в процессе образования растворов.
Процесс растворения нитрата аммония в воде сопровождается сильным поглощением теплоты, что объясняет охлаждение раствора. На данном эффекте основан принцип действия гипотермического пакета, который входит в состав автомобильной аптечки для оказания первой медицинской помощи.
Безводный сульфат меди (II) обладает белой окраской. Когда вещество растворяют в воде, раствор окрашивается в голубой цвет.
Факторы растворимости веществ
Растворимость представляет собой свойство вещества растворяться в каком-либо растворителе.
Мера растворимости при заданных условиях определена содержанием данного вещества в насыщенном растворе. Существует условная классификация веществ в зависимости от их способности растворяться:
- малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
- растворимые (больше 1 г растворенного вещества на 100 г растворителя);
- нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
Когда вещество контактирует с водной средой, можно получить следующий результат:
- Вещество растворяется в воде, то есть происходит перемешивание на атомно-молекулярном уровне.
- Химическая реакция.
- Отсутствие растворения, химическая реакция не наблюдается.
Коэффициент растворимости определяется, как отношение массы растворенного вещества к массе растворителя (к примеру, 10 г соли на 100 г воды).
В зависимости от того, какой концентрацией обладает растворенное вещество, растворы условно разделяют на:
- ненасыщенные;
- насыщенные;
- перенасыщенные.
Ненасыщенные растворы — это те, в которых концентрация растворенного вещества меньше по сравнению с концентрацией в соответствующем насыщенном растворе. Особенность ненасыщенного раствора заключается в возможности при заданных условиях растворить в нем еще определенное количество растворенного вещества.
Насыщенные растворы представляют собой растворы с максимальной концентрацией растворенного вещества при заданных условиях.
В некоторых случаях нет необходимости создавать специальные условия для приготовления насыщенного раствора. Эксперимент можно поставить в домашних условиях.
При смешивании поваренной соли с водой образуется раствор. Когда смесь становится насыщенной, поваренная соль перестает растворяться в воде, так как достигнута ее максимальная концентрация.
Перенасыщенным раствором называют такой раствор, в котором растворенное вещество находится в концентрации, превышающей его концентрацию в насыщенном растворе.
Излишки растворенного вещества достаточно просто выпадают в виде осадка. Для получения перенасыщенного раствора можно, к примеру, охладить насыщенный раствор, компонентами которого являются поваренная соль и вода. В том случае, когда температура снижается, уменьшается растворимость поваренной соли. В результате получают перенасыщенный раствор.
В зависимости от концентрации растворенного вещества растворы бывают:
Концентрированные растворы являются растворами, для которых характерно относительно высокое содержание растворенного вещества.
Разбавленные растворы представляют собой растворы, в которых растворенное вещество характеризуется относительно низким содержанием.
Подобная классификация является условной и не зависит от деления раствора по насыщенности. Разбавленный раствор может являться насыщенным. Концентрированный раствор не во всех случаях можно отнести к насыщенным растворам.
Растворимость ( Р , χ и л и k s ) характеризует насыщенный раствор и определяет максимальную массу растворенного вещества, которое растворяется в 100 г растворителя. Размерность растворимости составляет г/ 100 г воды.
χ = m р . в . m р - л я * 100
где m р.в. определяет массу растворенного вещества, г;
m р-ля является массой растворителя, г.
В некоторых случаях допустимо обозначать коэффициент растворимости k s . Показатели растворимости вещества, которое взаимодействует с разными растворителями, могут изменяться в широком диапазоне значений.
Растворимость некоторых веществ в воде при температуре 20 °C:
Растворимость веществ зависит от нескольких факторов:
- природа растворенного вещества и растворителя;
- температура;
- давление;
- посторонние вещества.
Абсолютно нерастворимых веществ не существует. Все вещества лишь условно классифицируют на растворимые, малорастворимые и нерастворимые. Даже такие материалы, как серебро и золото, частично растворяются в воде. С другой стороны, растворимость этих металлов столь мала, что ей допустимо пренебречь.
Растворимость, которой характеризуются твердые вещества, определяется структурой этих веществ, то есть типом кристаллической решетки. К примеру, вещества с металлическими кристаллическими решетками, в том числе железо и медь, отличаются малой растворимостью в воде. Вещества, для которых характерна ионная кристаллическая решетка, обычно хорошо растворяются в воде.
Подобное хорошо растворяется в подобном.
Согласно озвученному правилу, вещества, обладающие связями ионного или ковалентного полярного типа, хорошо растворяются в полярных растворителях. В качестве примера можно привести соли, которые характеризуются хорошей растворимостью в воде. С другой стороны, неполярные вещества в распространенных случаях способны хорошо растворяться в неполярных растворителях.
В большинстве своем соли щелочных металлов и аммония хорошо растворяются в водной среде. Высокой степенью растворимости характеризуются практически все нитраты, нитриты, многие галогениды, за исключением галогенидов серебра, ртути, свинца, таллия, и сульфаты, кроме сульфатов щелочноземельных металлов, серебра и свинца. Сульфиды, фосфаты, карбонаты, некоторые другие соли переходных металлов обладают небольшими показателями растворимости.
Растворимость газообразных веществ в жидких средах определяется их природой. К примеру, в 100 объемах воды при температуре 20 °C можно растворить 2 объема водорода, 3 объема кислорода. При аналогичных условиях в 1 доле воды можно растворить 700 объемов аммиака.
Процесс растворения газообразных веществ в воде, как результат гидратации молекул растворяемого газа, протекает с выделением теплоты. В связи с этим, когда температура повышается, растворимость газообразных веществ снижается.
Температурный режим неодинаково влияет на способность твердых веществ растворяться в воде. В распространенных случаях можно наблюдать повышение растворимости при нагреве твердых веществ.
В качестве примера можно рассмотреть увеличение растворимости таких веществ, как нитрат натрия N a N O 3 и нитрат калия К N O 3 , при повышении температуры. При этом растворение сопровождается поглощением теплоты. Растворимость N a C l в процессе нагрева повышается несущественно, что объясняется практически нулевым тепловым эффектом растворения поваренной соли.
Растворимость твердых и жидких веществ в жидких средах почти не меняется при перепадах давления. Это связано с незначительным изменением объема в процессе растворения. Когда в жидкости растворяют газы, объем системы уменьшается. В связи с этим, при повышении давления увеличивается растворимость газообразных веществ. Общий вид зависимости растворимости газов от давления описан законом У. Генри (Англия, 1803 г.).
Закон У. Генри: растворимость газа при стабильной температуре прямо пропорциональна его давлению над жидкостью.
Рассмотренная закономерность справедлива для небольших давлений в случае газообразных веществ со сравнительно небольшой растворимостью и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителя.
В том случае, когда вода содержит примеси других веществ, например, соли, кислоты и щелочи, газы хуже растворяются в такой среде. Газообразный хлор характеризуется растворимостью в насыщенном водном растворе поваренной соли, которая в 10 раз меньше по сравнению с аналогичным показателем в чистой воде.
Эффект, предполагающий снижение растворимости в присутствии солей, называют высаливанием. Ухудшение свойств растворимости связано с гидратацией солей, которая является причиной уменьшения количества свободных молекул воды. Молекулы воды, образовавшие связи с ионами электролита, не являются растворителем для каких-либо веществ.
Примеры растворения твердых веществ в воде
Данные о растворимости веществ необходимы для решения многих задач по химии, связанных с записью уравнений реакций. Таблица растворимости содержит информацию о зарядах веществ, которую используют для корректной записи реагентов и схем химического взаимодействия. По растворимости в воде определяют способность соли или основания диссоциировать.
Водные соединения, проводящие ток, являются сильными электролитами. Существует и другой тип веществ, которые отличаются тем, что плохо проводят ток. Такие соединения являются слабыми электролитами. Сильные электролиты представляет собой вещества, практически полностью ионизирующиеся в воде. В отличие от них, слабые электролиты проявляют это свойство лишь в малой степени.
Существует несколько видов уравнений:
- молекулярные;
- полные ионные;
- краткие ионные.
Краткие ионные уравнения являются сокращенным вариантом полных ионных уравнений. В полном уравнении принято записывать все ионы из которых состоят реагенты и продукты реакции.
В виде отдельных ионов можно записывать только сильные электролиты.
Затем, сократив одинаковые ионы, присутствующие в обоих частях химического уравнения, получают уравнение в кратком виде.
В молекулярных уравнениях все, без исключения, вещества записаны в молекулярном виде.
гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся переходом твердой фазы в раствор; один из осн. процессов хим. технологии. Р. следует отличать от экстрагирования, при котором контактирующие с раствором твердые частицы состоят из двух или более растворимых и инертных твердых фаз, а Р. носит избират. характер (см. также выщелачивание).
Различают физическое, химическое и электрохимическое Р. При физическом Р. переход в раствор вещества не сопровождается изменением его хим. состава; вещество можно выделить в твердом состоянии с помощью выпаривания и кристаллизации. При химическом Р. переход вещества в раствор сопровождается хим. реакцией; исходное вещество нельзя выделить из раствора в твердом состоянии физ. методами (примеры-Р. металлов или их оксидов в кислотах, Р. фосфоритов либо апатитов в сернокислотном растворе с получением H3PO4 и др.). Электрохимическое Р. протекает в условиях, когда процессу сопутствует перенос электрич. зарядов. Наиб. изучены закономерности и практика Р. твердых веществ с ионной кристаллической решеткой (гл. обр. соли), которым в осн. посвящена данная статья.
Физико-химические основы процесса
Р. сопровождается поглощением или выделением теплоты. Тепловой эффект Р. находят по уравнению: ΔHр = U — — ΔHг(с), где 17- энергия кристаллич. решетки растворяемой соли, ΔHг(с) — теплота гидратации (сольватации) перешедших в раствор ионов соли. При U > ΔHг(с) и ΔHр > 0 процесс эндо-термичсн; при U 0 процесс экзотермичен. Условия самопроизвольного протекания процесса определяются знаком величины ΔG, которую вычисляют по выражению: ΔG = ΔHр — TΔS, где Т — абс. температура; ΔS-изменение энтропии. При ΔG 0 вероятен обратный процесс-кристаллизация. Расчет может дать положит. либо отрицат. результат (отсутствие или наличие растворимости).
При некоторой концентрации, наз. концентрацией насыщения сн, между твердым телом и жидкостью устанавливается равновесие. При нем хим. потенциал вещества в растворе становится равным хим. потенциалу того же вещества в твердом состоянии. Концентрация сн не зависит от давления, однако в значит. степени определяется температурой, с увеличением которой растворимость возрастает. Последняя оказывает сильное влияние на кинетику Р. С увеличением растворимости возрастает разность концентраций (движущая сила процесса) и Р. ускоряется (см. также растворы).
Физическое Р. может протекать по диффузионному, кинетич. или смешанному механизму (см. массообмен). Рассмотрим наиболее распространенный диффузионный механизм. При Р. на поверхности растворяющегося тела возникает диффузионный пограничный слой, в пределах которого концентрация изменяется от сн на поверхности тела до концентрации с в осн. массе раствора. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей ее и тела в слое и вне его (естеств. конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость которого снижается по мере приближения к поверхности тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамич. параметров и уменьшается с увеличением числа Рейнольдса Re = ud/v (u-скорость обтекания жидкостью объекта P., d — его размер, v — кинематич. вязкость жидкости).
Осн. закон кинетики .диффузионного P.: —dM/dt = = kF(cн — с), где М-масса растворяющегося вещества, t-время, k-коэф. массоотдачи, F-площадь поверхности Р. Параметр k определяется уравнениями в обобщенных переменных (табл.; см. подобия теория).
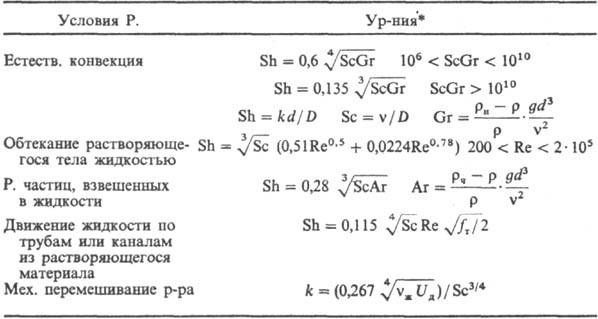
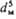
* Обозначения: D-коэф. диффузии; g- ускорение своб. падения; ρ-плотн. раствора; ρн-плотн. насыщ. раствора; ρч-плотн. твердых частиц; fт — коэф. трения; Uд = = N/ρVж-среднее значение диссипации энергии в единице массы перемешиваемой жидкости; N = x ρ w 3 - мощность, затрачиваемая на перемешивание; Vж- объем жидкости в аппарате; w-частота вращения мешалки; dм- диаметр окружности, описываемой мешалкой; 4 — коэф. сопротивления вращению мешалки.
Химическое Р. может протекать без образования или с образованием новой фазы.
Р. без образования новой фазы (продукты реакции растворены в жидкости). Скорость процесса находят из выражения:
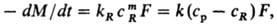
где kR-константа скорости реакции на поверхности Р.; ср, сR-концентрации реагента (кислота, щелочь) в осн. массе раствора и на поверхности Р.; m-стехиометрич. коэффициент. При т = 1 имеем:
Аналогично физическому Р. в данном случае также различают диффузионный, кинетич. и смешанный механизмы.
Р. с образованием новой твердой фазы. Возможно неск. вариантов процесса.
1) Твердый продукт реакции немедленно удаляется с поверхности Р.; при этом скорость процесса остается постоянной (при F = const и с = const).
2) Твердый продукт образует пленку с постоянной по толщине пористостью, плотно связанную с исходным твердым материалом. По мере протекания процесса толщина пленки возрастает, а скорость процесса снижается. Анализ кинетики Р. сферич. частиц (наиболее распространенный случай) в описанных условиях приводит к выражению:
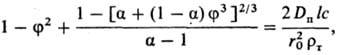
где φ = r/r0; α = m'(ρт/ρп); r0, r-начальный и текущий радиусы растворяющейся сферы из исходного вещества; ρт, ρп-плотн. вещества и продуктов реакции; Dп-коэф. диффузии вещества сквозь пленку продуктов; l, m'-стехиометрич. коэф. пересчета от исходного вещества к реагенту и от продуктов реакции к растворяющемуся веществу.
3) Образующаяся твердая фаза кристаллизуется в растворе, что обусловлено его пересыщением, и осаждается на поверхности Р. Ее экранирование тем значительнее, чем выше концентрация твердых частиц в растворе.
Р. с образованием газообразной фазы встречается особенно часто (Р. металлов в кислотах и разложение ими карбонатов или сульфитов с выделением H2, CO2 или SO2). Газообразные продукты оказывают сильное, иногда определяющее влияние на химическое Р.: изолируют от жидкого реагента поверхность реакции и способствуют хорошему перемешиванию раствора вблизи этой поверхности благодаря выделению газовых пузырьков. Интенсивность пузырькового режима, число пузырьков и частота их образования зависят от концентрации реагента. С ее увеличением возрастает константа скорости kR. При определенной концентрации реагента, наз. критической, константа достигает максимума, а при дальнейшем увеличении уменьшается.
Для мн. объектов Р. в условиях газовыделения протекает в диффузионной области; закономерности изменения конста.нты kR объясняются следующим образом: с возрастанием концентрации реагента интенсифицируется пузырьковый режим, что способствует турбулизации пограничного слоя и уменьшению толщины диффузионного слоя, т. е. интенсификации транспорта реагента к поверхности Р. Одновременно ускоряется экранирование поверхности (изоляция ее от жидкой среды), вследствие чего по достижении критич. концентрации величина kR начинает снижаться. Помимо концентрации реагента на константу скорости влияют вязкость жидкости (с ее увеличением kR уменьшается) и давление в системе; при возрастании последнего рост пузырьков и общая интенсивность пузырькового режима снижаются, что также приводит к уменьшению kR.
Опытные данные по кинетике Р. ряда объектов обобщены критериальными уравнениями, которые применимы к концентрациям, не превышающим критические:
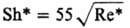
Sc 300 10 −3 2
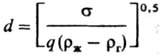
Sс=uж/DR,
где σ-поверхностное натяжение жидкости; DR-коэф. диффузии реагента; ρж, ρг-плотн. жидкости и газа; qR-плотн. потока реагента к поверхности Р.; l-стехиометрич. коэффициент. Обобщение выполнено с учетом результатов экспериментов по P. Mg, Mn, CaCO3, CuCO3 ∙ Cu(OH)2 в кислотах (HCl, HNO3, H2SO4). Известно немало случаев, когда Р. металлов и сплавов протекает в кинетич. области; так, А1 и его сплавы раств. в растворах щелочей, а константа скорости Р. удовлетворяет уравнению: kR = k0e −E/RT (Е-энергия активации, R-газовая постоянная, Т — абс. температура).
Закономерности Р. техн. металлов и их сплавов связаны с электрохим. явлениями (см. коррозия металлов, электрохимическая кинетика).
Способы организации и аппаратурное оформление
Схемы процесса. Пром. реализация Р., проводимого в аппаратах-растворителях, связана с определенной схемой взаимод. твердой и жидкой фаз: замкнутый периодич. процесс (напр., в аппарате с мешалкой); прямоточное или противоточное Р., при котором фазы движутся соотв. в одном направлении либо в противоположных направлениях; периодич. Р. в слое растворяющихся частиц (жидкость фильтруется через неподвижный стационарный слой). В крупнотоннажных производствах наиб. распространены прямоточная и противоточная схемы. При прямотоке поверхность Р. и движущая сила (сн — с) одновременно уменьшаются, что приводит к замедлению процесса. При противотоке уменьшение поверхности Р. сопровождается увеличением разности концентраций, а скорость Р. более постоянна. Выбор схемы Р. зависит также и от др. факторов, напр. от размера частиц растворяющегося вещества. Так, при Р. полидисперсной смеси частиц в противоточном аппарате трудно избежать выноса за его пределы мелкой фракции вместе с жидкостью.
В практике Р. широко применяют комбинир. схемы, комплектуемые из ряда аппаратов. Так, каждый аппарат в отдельности работает по принципу прямотока, а вместе соединены в противоточную схему. Р. обычно предшествует измельчение твердого материала, что способствует ускорению процесса, но требует больших энергетич. затрат и затрудняет фильтрац. очистку полученного раствора. Размер частиц, поступающих на Р., находят оптимизацией его самого и всей совокупности сопутствующих процессов.
При галургич. переработке минер., сырья важную роль играет Р. многокомпонентных солевых систем. Например, в основе получения KCl из сильвинита лежит частичное P. NaCl и почти полное P. KC1 в горячих щелоках с последующим выделением из раствора готового продукта при охлаждении. Кинетика Р. смеси из n компонентов определяется совместным решением (обычно на ЭВМ) системы уравнений:
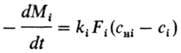
и уравнения материального баланса типа
Аппаратура. При периодич. процессе в одном и том же аппарате выполняют ряд последоват. операций: дозировку компонентов раствора, заполнение рабочего объема, подогрев жидкости до заданной температуры, собственно Р., отделение раствора от нерастворимого остатка, их выгрузку, подготовку к след. циклу. К оборудованию периодич. действия, используемому в малотоннажных производствах и при большом ассортименте растворяемых веществ, относятся аппараты с мех. перемешиванием и со стационарным слоем растворяющихся твердых частиц. В первом случае применяют перемешивающие приспособления разл. типов, частота вращения которых должна быть достаточна для создания гидродинамич. силы, способной привести частицы во взвешенное состояние (см. также перемешивание). Во втором случае раствор фильтруется сквозь слой растворяющихся и инертных частиц, а скорость фильтрования определяет кинетику Р.
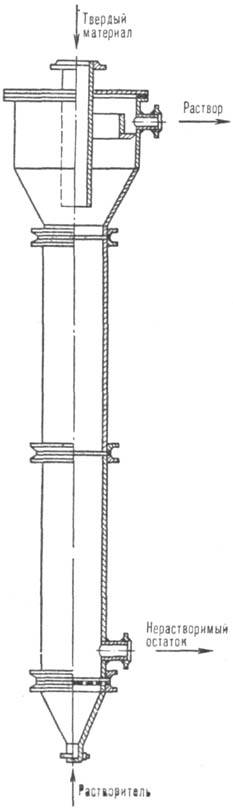
Рис. 1. Колонный аппарат для растворе — ния в псевдоожиженном слое.
Аппараты непрерывного действия используют для Р. больших масс материала. Каждая стадия осуществляется в отдельном аппарате. Пром. значение имеют аппараты: с псевдоожиженным слоем растворяющихся частиц; сочетающие Р. с гидравлич. транспортом целевых продуктов; с транспортирующими и перемешивающимися устройствами; с движущимся слоем твердой фазы.
На рис. 1 представлен аппарат с псевдоожиженным слоем, предназначенный для Р., напр., галитовых отходов (размер частиц 0,5–5,0 мм) калийных предприятий. Скорость движения растворяющего рассола должна превышать скорость псевдоожижения крупных частиц.
Трубчатый растворитель (рис. 2) состоит из ряда последовательно соединенных вертикальных труб, через которые насосом перекачивается суспензия, предварительно подготовленная в аппарате с мешалкой 2. Скорость движения жидкости должна превышать скорость осаждения самых крупных частиц во избежание закупорки труб. В случае аварийной остановки насоса жидкость, содержащая и твердую фазу, спускается в горизонтальный корытный аппарат с мешалкой 7.
К числу аппаратов с транспортирующими и перемешивающими устройствами относится шнековый растворитель (рис. 3). Сварной корпус корытообразной формы снабжен шнеком для перемешивания твердого материала и наклонным ковшовым элеватором для выгрузки нерастворившегося остатка. Уменьшение продольного перемешивания достигается секционированием аппарата спец. перегородками. Растворяющий реагент движется к элеватору (прямоток) или в противоположном направлении (противоток). В перспективе предполагается использование вертикальных противоточных колонных аппаратов с движущимся слоем растворимого вещества.
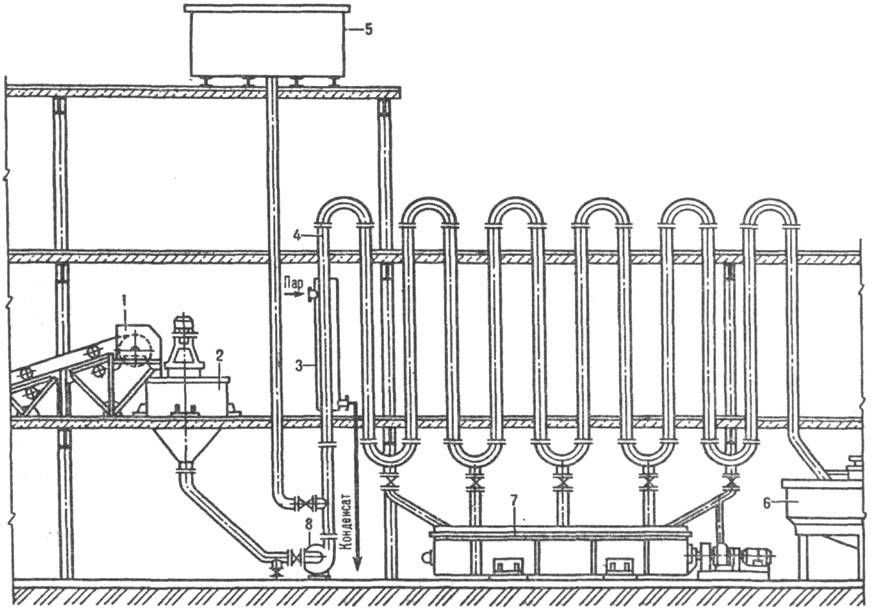
Рис. 2. Трубчатый растворитель: 1 — ленточный транспортер для твердого материала; 2, 7 — аппараты с мешалками; 3 — паровая рубашка; 4 — вертикальные трубы; 5 — бак с водой для промывки труб; 6 — сгуститель; 8 — насос.
Интенсификация процесса. Скорость Р., как правило, возрастает с увеличением температуры, однако раствор можно нагревать до определенного предела, обусловленного пределом кипения жидкости и стоимостью тепловой энергии. В практике Р. используют методы, основанные на обтекании твердых частиц жидкостью, а также на систематич. обновлении поверхности Р.: интенсивное перемешивание мех. мешалками и др. устройствами; наложение поля колебаний (от низкочастотных до ультразвуковых); сочетание Р. и измельчения в одном аппарате; применение электрич. разрядов в жидкости. Два последних метода обеспечивают высокую степень интенсификации Р. и, кроме того, эффективны, если твердые частицы первоначально покрыты экранирующими инертными пленками или примесями.
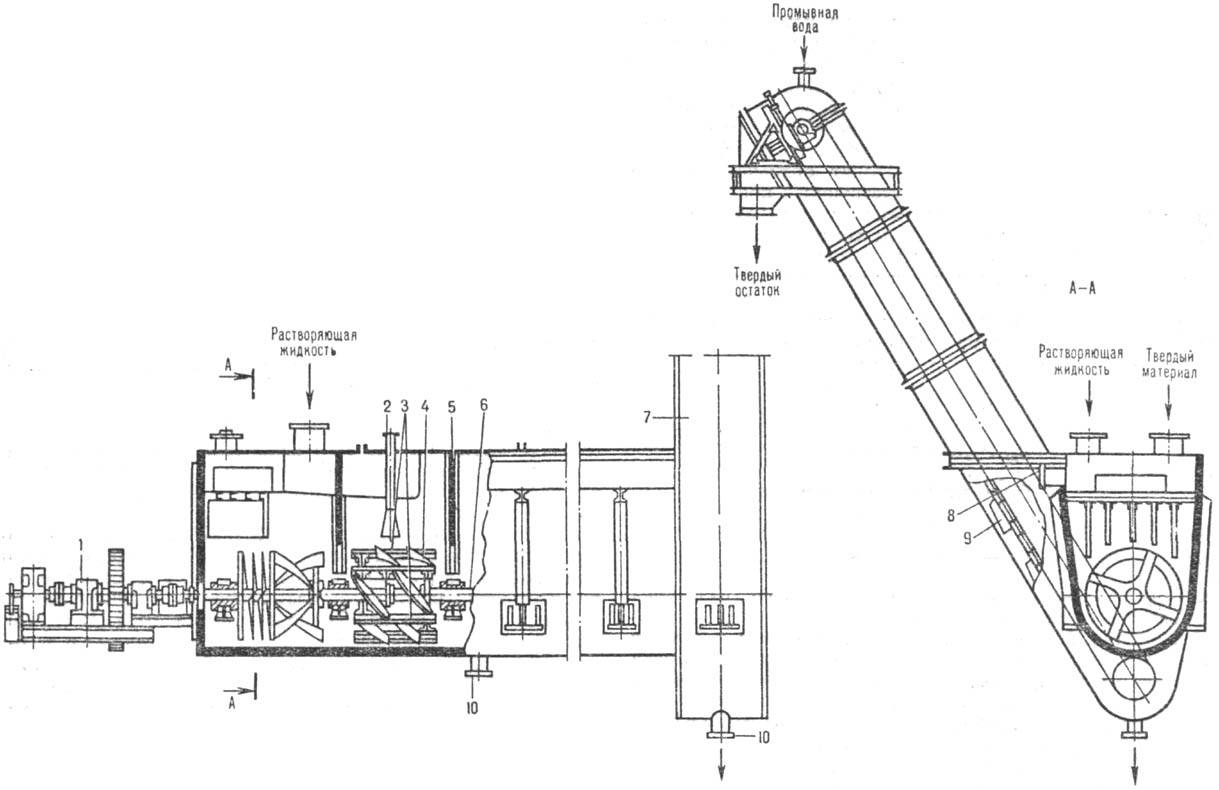
Рис. 3. Шнековый растворитель: 1 — привод; 2 — сопло для пара; 3 — скребки для перемешивания материала в пределах каждой секции; 4, 6 — лопасть и вал мешалки (шнека); 5 — перегородка; 7 — элеватор; 8 — штуцер для отвода раствора; 9 — ковш; 10 — штуцеры для аварийного опорожнения.
Р. широко используют в хим. и смежных отраслях промышленности для получения растворов с последующей их переработкой (см. галургия), отделения растворимых веществ от сопутствующих инертных примесей (напр., в производствах минер. солей и удобрений), обработки растворимых материалов, в т. ч. металлов, с целью придания им определенных размера и формы (т. наз. химическое фрезерование), создания полостей большого объема в соляных толщах с целью хранения в них газов и жидкостей.
Лит.: Здановский А.Б., Кинетика растворения природных солей в условиях вынужденной конвекции, Л., 1956; Аксельруд Г. А., Мол чанов А. Д., Растворение твердых веществ, М., 1977; Галургия, под ред. И. Д. Соколова, Л., 1983; Аксельруд Г. А., Гумницкий Я. М., Дубинин А. И., "Теоретич. основы хим. технологии", 1989, т. 23, № 1, с. 28–33; К а раж ан о в Н. А., Основы кинетики растворения солей, А.-А., 1989.
Читайте также:

