Пролиферация это в патологии кратко
Обновлено: 05.05.2024
ПРОЛИФЕРАЦИЯ (от лат. proles — отпрыск, потомство и fero — несу) — процесс размножения клеток, обеспечивающий рост ткани или органа и компенсирующий потерю части клеточного состава в результате их гибели по тем или иным причинам. Регулируется с помощью специфических веществ: ингибиторов роста — кейлонов и полипептидных факторов роста, которые вырабатываются различными дифференцированными клетками. Регуляция необходима для поддержания оптимального клеточного состава. Наибольшая интенсивность процесса пролиферации наблюдается в обновляющихся клеточных популяциях (клетки крови, кишечного эпителия, тимуса, сальных желез и др.).
Эмбриональный гистогенез. Пролиферация клеток. Клеточный рост, миграция и межклеточные взаимодействия.
В развитии низших и высших позвоночных отчетливо прослеживается единая общебиологическая закономерность, выражающаяся в появлении зародышевых листков и обособлении основных зачатков органов и тканей. Процесс образования тканей из материала эмбриональных зачатков составляет суть учения о гистогенезах.
Эмбриональный гистогенез, по определению А.А. Клишова (1984), — это комплекс координированных во времени и пространстве процессов пролиферации, клеточного роста, миграции, межклеточных взаимодействий, дифференциации, детерминации, программированной гибели клеток и некоторых других. Все названные процессы в той или иной мере протекают в зародыше, начиная с самых ранних стадий его развития.
Пролиферация. Основной способ деления тканевых клеток — это митоз. По мере увеличения числа клеток возникают клеточные группы, или популяции, объединенные общностью локализации в составе зародышевых листков (эмбриональных зачатков) и обладающие сходными гистогенетическими потенциями. Клеточный цикл регулируется многочисленными вне- и внутриклеточными механизмами. К внеклеточным относятся влияния на клетку цитокинов, факторов роста, гормональных и нейрогенных стимулов. Роль внутриклеточных регуляторов играют специфические белки цитоплазмы. В течение каждого клеточного цикла существуют несколько критических точек, соответствующих переходу клетки из одного периода цикла в другой. При нарушении внутренней системы контроля клетка под влиянием собственных факторов регуляции элиминируется апоптозом, либо на некоторое время задерживается в одном из периодов цикла.
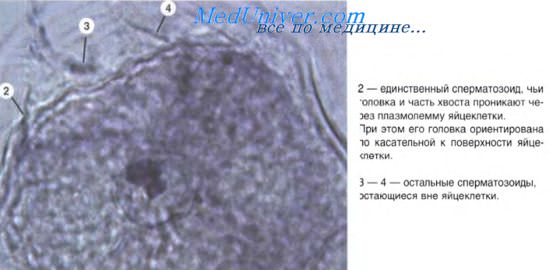
Метод радиографического анализа клеточных циклов в различных тканях выявил особенности соотношения клеточной репродукции и дифференцировки. Например, если в тканях (кроветворные ткани, эпидермис) имеется постоянный фонд пролиферирующих клеток, за счет которых обеспечивается непрерывное возникновение новых клеток взамен погибающих, то эти ткани относятся к обновляющимся. Другие ткани, например, некоторые соединительные, характеризуются тем, что в них увеличение количества клеток происходит параллельно с их дифференцировкой, клетки в этих тканях характеризуются низкой митотической активностью. Это растущие ткани. Наконец, нервная ткань характеризуется тем, что все основные процессы репродукции заканчиваются в период эмбрионального гистогенеза (когда формируется основной запас стволовых клеток, достаточный для последующего развития ткани). Поэтому она отнесена к стабильным (стационарным) тканям. Продолжительность жизни клеток в обновляющихся, растущих и стабильных тканях разная.
Наряду с обновлением клеточной популяции, в самих клетках постоянно наблюдается обновление внутриклеточных структур (внутриклеточная физиологическая регенерация).
Клеточный рост, миграция и межклеточные взаимодействия. Рост клеток проявляется в изменении их размеров и формы. При усилении функциональной активности и внутриклеточных биосинтезов наблюдается увеличение объема клетки. Если объем клетки превышает некую норму, то говорят о ее гипертрофии, и наоборот, при снижении функциональной активности происходит уменьшение объема клетки, а при переходе некоторых нормативных параметров возникает атрофия клетки. Рост клетки не беспределен и определяется оптимальным ядерно-цитоплазменным отношением.
Важное значение для гистогенеза имеют процессы перемещения клеток. Миграция клеток наиболее характерна для периода гаструляции. Однако и в период гисто- и органогенеза происходят перемещения клеточных масс (например, смещения миобластов из миотомов в места закладки скелетных мышц; движение клеток из нервного гребня с образованием спинномозговых ганглиев и нервных сплетений, миграция гоноцитов и т. д.). Миграция осуществляется с помощью нескольких механизмов. Так, различают хемотаксис — движение клеток в направлении градиента концентрации какого-либо химического агента (перемещения спермиев к яйцеклетке, предшественников Т-лимфоцитов из костного мозга в закладку тимуса).
Гаптотаксис — механизм перемещения клеток по градиенту концентрации адгезионной молекулы (движение клеток протока пронефроса у амфибий по градиенту щелочной фосфатазы на поверхности мезодермы). Контактное ориентирование — когда в какой-либо преграде остается один канал для перемещения (описан у рыб при образовании плавников).
Контактное ингибирование — этот способ перемещения наблюдается у клеток нервного гребня. Суть способа заключается в том, что при образовании ламеллоподии одной клеткой и контакта ее с другой клеткой, ламеллоподия прекращает рост и постепенно исчезает, но в другой части мигрирующей клетки при этом формируется новая ламеллоподия.
В процессе миграции клеток важную роль играют межклеточные взаимодействия. Существует несколько механизмов такого взаимодействия (контактного и дистантного). Выделяется большая группа молекул клеточной адгезии (МКА). Так, кадгерины — это Са2+-зависимые МКА, отвечают за межклеточные контакты при образовании тканей, за формообразование и др. В молекуле кадгерина различают внеклеточный, трансмембранный и внутриклеточный домены. Например, внеклеточный домен ответственен за адгезию клеток с одинаковыми кадгеринами, а внутриклеточный — за форму клетки. Другой класс МКА — это иммуноглобулиновое суперсемейство Са2+-независимых МКА, обеспечивающих, например, адгезию аксонов к сарколемме мышечных волокон, или миграцию нейробластов вдоль радиальных глиоцитов в закладке коры большого мозга и др. Следующий класс МКА — это мембранные ферменты — гликозилтранферазы. Последние по типу "ключ-замок" соединяются с углеводными субстратами — гликозаминогликанами надмембранного комплекса клетки, осуществляя таким образом прочное сцепление клеток.
Кроме механизмов межклеточного взаимодействия, существуют механизмы взаимодействия клеток с субстратом. Они включают формирование рецепторов клетки к молекулам внеклеточного матрикса. К последним относят производные клеток, среди которых наиболее изученными адгезионными молекулами являются коллаген, фибронектин, ламинин, тенасцин и некоторые другие. Коллагены, среди которых различают несколько десятков типов, входят в состав межклеточного вещества рыхлой волокнистой соединительной ткани, базальной мембраны и пр. Фибронектин, секретируемый клетками, является связывающей молекулой между мигрирующей клеткой и межклеточным матриксом. Ламинин — компонент базальной мембраны, также связывает мигрирующие клетки с межклеточным матриксом (справедливо по отношению к эпителиоцитам и нейробластам).
Для осуществления связи мигрирующих клеток с межклеточным матриксом клетки формируют специфические рецепторы. К ним относятся, например, синдекан, который обеспечивает контакт эпителиоцита с базальной мембраной за счет сцепления с молекулами фибронектина и коллагена. Интегрины клеточных поверхностей связывают с внеклеточной стороны молекулы внеклеточного матрикса, а внутри клетки — белки цитоскелета (например, актиновые микрофиламенты). Так возникает связь внутри- и внеклеточных структур, что позволяет клетке использовать для перемещения собственный сократительный аппарат. Наконец, существует большая группа молекул, формирующих клеточные контакты, осуществляющие коммуникацию между клетками (щелевые контакты), механическую связь (десмосомы, плотные контакты).
Дистантные межклеточные взаимодействия осуществляются путем секреции гормонов и факторов роста (ФР). Последние — это вещества, оказывающие стимулирующее влияние на пролиферацию и дифференцировку клеток и тканей. К ним относятся, например, ФР, полученный из тромбоцитов и влияющий на переход клеток в фазу размножения (гладких миоцитов, фибробластов, глиоцитов); эпидермальный ФР — стимулирует пролиферацию эпителиоцитов, производных эктодермы; ФР фибробластов — стимулирует пролиферацию фибробластов. Особо выделяется большая группа пептидов (соматотропины, соматомедины, инсулин, лактоген), влияющих на развитие клеток плода.
Факторы, тормозящие пролиферацию и дифференцировку клеток, также принимают кооперативное участие в процессах развития клеток и тканей. К ним относятся, например, бета-интерферон и трансформирующий ФР. Последний, однако, в отношении разных клеточных типов действует по-разному: блокирует размножение многих типов эпителиоцитов, но стимулирует размножение соединительнотканных клеток.
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ПРОЛИФЕРА́ЦИЯ (от лат. proles – отпрыск, потомство и fero – нести), 1) у животных и человека – образование новых клеток путём митоза; лежит в основе роста и дифференцировки тканей в процессе индивидуального развития, обеспечивает обновление клеток и внутриклеточных структур. При патологич. процессах, сопровождающихся повреждением органов и тканей, с помощью П. устраняется образовавшийся дефект и нормализуется нарушенная функция. Интенсивность П. регулируется стимуляторами и ингибиторами, вырабатываемыми как вдали от реагирующих клеток (напр., гормонами), так и внутри них. В раннем эмбриогенезе П. происходит непрерывно. По мере дифференцировки периоды между делениями удлиняются. Некоторые дифференцированные клетки, напр. нервные, не способны к П. 2) У растений П., или пролификацией , называют прорастание к.-л. органа из др. органа, закончившего рост (напр., развитие из цветка облиственного побега, нового цветка или соцветия). П. обычна у розы, земляники, ананаса; встречается также у женских шишек саговников, шишек хвойных.

1. Зайчик А.Ш. Патологическая физиология. Том 2. Патохимия [Текст]: учеб. / А.Ш. Зайчик, Л.П. Чурилов. – 3-е изд. – СПб.:ЭЛБИ-СПб, 2007. – 688 с.
3. Лекция 4. Особенности структуры, функции и метаболизма В- и Т- систем лимфоцитов / Н.П. Чеснокова, Е.В. Понукалина, Т.Н. Жевак [и др.] // Международный журнал фундаментальных и прикладных исследований. 2015. № 4. – С. 293 -297.
4. Патологическая физиология [Текст]: учеб. / под общ. ред. В.В.Моррисона, Н.П. Чесноковой. – 4-е изд. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2009. – 679 с.
6. Типовые патологические процессы как основа патогенеза болезней различной этиологии [Текст]: монография / под общ. ред. В.М. Попкова, Н.П. Чесноковой. – Саратов: Изд–во Сарат. гос. мед. ун-та, 2017. – 536 с.
7. Типовые реакции иммунной системы на действие антигенов-аллергенов [Текст]: учеб. пособие / под ред. Н.П. Чесноковой. – Саратов: Изд-во Сарат. гос. мед. ун-та, 20014. – 156 с.
8. Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза [Текст]: монография / под общ. ред. В.М. Попкова, Н.П. Чесноковой. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2016. – 448 с.
Воспаление – типовой патологический процесс, составляющий основу патогенеза болезней с разнообразной локализацией патологии и симптоматикой. Воспаление может развиваться остро или хронически. При остром развитии воспалительного процесса возникает стереотипный комплекс сосудистых изменений в виде спазма сосудов, артериальной и венозной гиперемии.
Несколько опережая во времени развитие сосудистых реакций, а затем и параллельно с сосудистыми изменениями формируются тканевые расстройства в виде альтерации, экссудации, пролиферации. Указанные сосудистые и тканевые изменения имеют место при различных заболеваниях воспалительной природы – стоматитах, гингивитах, глосситах, паро- и перидонтитах, эзофагитах, энтеритах, миокардитах и так далее, то есть развиваются не зависимо от локализации воспаления [1, 4, 5, 6, 8].
Касаясь характеристики фазы альтерации, следует отметить морфологические и биохимические аспекты ее развития.
Альтерация – обобщающий термин, означающий повреждение. С точки зрения морфологии, это зона некроза, дистрофии, апоптоза, отека тканей и других деструктивных процессов. С метаболической, патохимической, функциональной сторон, это стадия освобождения медиаторов альтерации и проявления их биологических эффектов. По времени развития различают первичную и вторичную альтерацию.
Первичная альтерация формируется в момент воздействия патогенного фактора на организм, ее границы соответствуют зоне первичного действия патогенов.
Вторичная альтерация отсрочена во времени, связана с диффузией из зоны первичной альтерации в окружающую ткань токсических и ферментных факторов патогенности возбудителей бактериальной, вирусной, паразитарной природы, а также медиаторов альтерации гуморального и клеточного происхождения, предсуществующих или вновь синтезируемых.
К основным источникам предсуществующих медиаторов альтерации относятся тучные клетки, а также базофилы, в процессе дегрануляции которых освобождается гистамин, гепарин, серотонин, факторы активации тромбоцитов, хемотаксиса эозинофилов, нейтрофилов, а затем, в процессе антигенной стимуляции, продуцируются интерлейкины и другие биологически активные вещества.
В момент действия альтерирующих факторов терминалями нервных волокон освобождаются нейропептиды, такие, как субстанция P, пептид гена родственного кальцитонину, формирующие чувство боли.
В процессе дегрануляции тромбоцитов, высвобождаются катехоламины, серотонин, лизосомальные гидролазы, факторы гемостаза и фибринолиза.
К числу предсуществующих медиаторов альтерации клеточного происхождения относятся лизосомальная гидролаза, а также лизоцим, катионные белки, лактоферрин. Основными источниками которых являются клетки моноцитарно-макрофагальной системы и гранулоциты.
Типовой реакцией на повреждение в зоне воспаления, в том числе в тканях пародонта, является повышение проницаемости биологических мембран, в частности цитоплазматических, митохондриальных, лизосомальных и др.
Альтерирующие факторы различной биологической, а также, физической и химической природы инициируют активацию таких ферментов в зоне повреждения, как липоксигеназа и циклооксигеназа, обеспечивающих развитие каскада реакций образования, соответственно, лейкотриенов и простогландинов. Последние обладают мощным вазоактивным действием, регулирует тонус и проницаемость сосудистой стенки, гемостатические реакции, вызывая развитие экссудации и эмиграции лейкоцитов на стадии венозной гиперемии.
Важная роль в развитии воспаления принадлежит вновь синтезируемым медиаторам таким как лимфокины и монокины, вызывающим развитие синдрома системного воспалительного ответа, направленного в значительной мере на зобилизацию защитно-приспособительных реакций за счет вовлечения иммунной системы, гормонального баланса, метаболических изменений [1, 4, 5, 6, 7].
В настоящее время известно более 100 биологически активных веществ, секретируемых моноцитами/макрофагами, классификация которых приведена ниже:
1) протеазы: активатор плазминогена, коллагеназа, эластаза, ангиотензин-конвертаза;
2) медиаторы воспаления и иммуномодуляции:ФНО, ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-15, ИФН, лизоцим, фактор активации нейтрофилов, компоненты комплемента;
3) факторы роста: КСФ-ГМ, КСФ-Г, КСФ-М, фактор роста фибробластов, трансформирующий фактор роста;
4) факторы свертывающей системы и ингибиторы фибринолиза: V,VII, IX, X, ингибиторы плазминогена, ингибиторы плазмина;
5) адгезивные вещества: фибронектин, тромбоспондин, протеогликаны.
Лимфокины – это биологически активные вещества, которые продуцируются сенсибилизированными лимфоцитами при специфической антигенной стимуляции [2, 3, 7, 8].
Следует отметить, что часть цитокинов (ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10 и др.) могут продуцироваться лимфоцитами, а также клетками моноцитарномакрофагальной системы. В связи с этим они могут быть отнесены как к группе лимфокинов, так и к группе монокинов.
Лимфокины проявляют многообразную биологическую активность, обеспечивая бластогеный и митогенный эффекты на лимфоидную и моноцитарно-макрофагальную систему, развитие хемотаксиса нейтрофилов, макрофагов, лимфоцитов, вызывая антивирусные и антимикробные эффекты.
К числу вновь синтезируемых медиаторов в зоне воспаления клеточного происхождения относят свободные радикалы, такие как супероксид-анион-радикал, гидроксильный радикал, перекись водорода, оксид азота, имеющие как внутриклеточное, так и внеклеточное происхождение в условиях формирования гипоксии, ишемии, тромбоза, эмболии в зоне воспаления, а также при различных стрессорных ситуациях.
Свободные радикалы взаимодействуют со структурными белками клеток, с липидными компонентами биологических мембран с образованием эндоперекисей с последующей дестабилизацией биосистемы.
Особую роль вразвитии воспаления отводят оксиду азота, который является мощным вазодилятатором, ингибитором агрегации тромбоцитов, нейротрансмиттером неадренергически-нехолинергических нейронов, вызывающих релаксацию гладкой мускулатуры ряда органов и тканей, в частности половых органов.
При остром воспалении свободные радикалы вызывают разрушение межклеточного матрикса, оказывают повреждающее действие на фибробласты, в то же время они могут оказывать стимулирующее влияние на процессы пролиферации [1, 4, 5, 6, 7].
К числу факторов антиоксидантной защиты тканей относятся ферменты: каталаза, супероксиддисмутаза, глутатионпероксидаза, а также витамин К, α-токоферол, метионин и др.
Помимо клеточных медиаторов воспаления большую роль в развитии вторичной альтерации играют плазменные медиаторы: кинины, компоненты системы комплемента, факторы обертывания крови.
Относительно механизмов активации медиаторов альтерации гуморального происхождения следует отметить, что деструкция эндотелия сосудов в зоне альтерации приводит к обнажению субэндотелиальной выстилки с выраженными прокоагулянтными свойствами за счет наличия коллагена, эндотелина, простагландинов F2α, тромбоксанов, фибронектина и других компонентов. При этом возникает инициация внешнего и внутреннего механизмов активации протромбиназы и соответственно систем гемостаза, фибринолиза, комплемента, калликреин-кининовой системы, тромбоцитарного звена гемостаза.
Одновременно с тканевыми изменениями в зоне воспаления в тканях пародонта развивается комплекс сосудистых реакций. При кратковременном действии достаточно сильного повреждающего фактора первоначально возникает спазм сосудов вследствие раздражения вазоконстрикторных нервных окончаний и гладкомышечных элементов сосудистых стенок. Спазм сосудов очень быстро сменяется артериальной гиперемией – увеличением кровенаполнения воспалительного очага за счет усиления притока крови в условиях накопления умеренного количества биологически активных веществ – медиаторов воспаления, активации аксон-рефлекса и повреждения вазоконстрикторных нервных окончаний. Артериальная гиперемия характеризуется умеренным расширением артериол, капилляров и венул, увеличением скорости кровотока, феноменом новообразования капилляров, активацией обменных процессов в тканях [1, 4, 5].
В последующем артериальная гиперемия сменяется венозной вследствие нарушения оттока крови из очага воспаления. Этому способствует уменьшение просвета сосудов за счет набухания эндотелия, краевого стояния лейкоцитов, сгущения крови, агрегации тромбоцитов, а также сдавление венул и лимфатических сосудов экссудатом. Для венозной гиперемии характерно значительной расширение сосудов микроциркуляторного русла, замедление скорости кровотока, снижение оксигенации тканей очага воспаления. На стадии венозной гиперемии создаются условия для развития последующих тканевых изменений: экссудации и эмиграции.
Экссудация (от лат. ex-sudare – потеть) – выпотевание белоксодержащей жидкой части крови через сосудистую стенку в воспаленную ткань.
В основе развития экссудации при воспалении лежат следующие механизмы:
1) повышение проницаемости сосудов в результате воздействия медиаторов воспаления, ионов водорода, лизосомальных ферментов;
2) возрастание гидродинамического давления в сосудах очага воспаления вследствие увеличенного кровенаполнения;
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации;
4) снижение онкотического давления крови из-за потери белков в условиях повышенной проницаемости сосудистых;
5) диффузия жидкой части крови через микропоры в эндотелиальных клетках (трансцеллюлярные каналы), а также активный перенос микровезикул при цитопемсисе.
Ведущим фактором экссудации является повышение проницаемости сосудов. К медиаторам воспаления, влияющим на проницаемость сосудистой стенки, относятся гистамин, серотонин, брадикинин, С5а и С3а, лейкотриены С4 и Д4, которые влияют непосредственно на эндотелиальные клетки, вызывая их контракцию, а также С5а de Arg, лейкотриен В4, интерлейкин-1, фактор активирующий тромбоциты [4, 5, 6, 7, 8].
Повышение проницаемости сосудов при воспалении является двухфазным. Первая фаза, или немедленная, возникает вслед за действием альтерирующего агента, достигает максимума на протяжении нескольких минут и продолжается в течение 5-30 минут. Вторая фаза, замедленная, развивается постепенно, достигает максимума через 4-6 часов и длится иногда до 10 часов в зависимости от вида и интенсивности воспаления.
Степень повышения проницаемости сосудов при воспалении определяет не только интенсивность экссудации, но и качественный состав экссудата, содержащего большее, чем в транссудате, количество белка, биологически активных веществ. В зависимости от качественного состава выделяют следующие виды экссудатов:
Эмиграция – выход форменных элементов белой крови за пределы сосудистого русла в очаг воспаления. Последовательность выхода лейкоцитов в зону воспаления получила название закона И. И. Мечникова, согласно которому через 1,5-2 часа с момента действия альтерирующего агента интенсивно эмигрируют нейтрофильные лейкоциты, которые выходят через поры между эндотелиальными клетками. Через 18–20 часов в зоне воспаления появляются моноциты, а затем лимфоциты, которые эмигрируют путем цигопемсиса и частично через поры между эндотелиальными клетками. При поражении тканей пародонта значительно усиливается эмиграция гранулоцитов и мононуклеаров не только в очаг воспаления, но и в ротовую полость. Выход форменных элементов в полость рта осуществляется через зубодесневой желобок из посткапиллярных венул маргинальной части десен и межзубных сосочков, расположенных непосредственно под эпителием [4, 5, 6, 7, 8].
Эмиграция лейкоцитов обусловлена, во-первых, действием хемоаттрактантов, обусловливающих развитие положительного хемотаксиса. В роли хемоаттрактантов могут выступать продукты специфических реакций в организме: компоненты комплемента (С3а, С5а, С567), лимфокины, цитофильные антитела, иммунные комплексы. В другую группу входят неспецифические эндогенные цитотаксины, выделяемые из поврежденных, инфицированных или активированных клеток, – калликреин, фибринопептид В, коллаген, лейкоэгрезин, цАМФ и др. Третью группу составляют экзогенные хемоаттрактанты, выделяющиеся в процессе жизнедеятельности различными микроорганизмами.
Миграции из кровотока и положительному хемотаксису лейкоцитов в полость рта способствует наличие мощных хемотаксических агентов бактериальных зубных бляшек.
Формирование в очаге воспаления положительного потенциала альтерации способствует эмиграции лейкоцитов под действием электрокинетических сил.
Выходу лейкоцитов способствует высокая проницаемость сосудов и процесс экссудации.
Эмигрировавшие элементы белой крови в зоне воспаления выполняют ряд функций. Нейтрофильные лейкоциты и моноциты обеспечивают фагоцитоз, являющийся одним из важнейших механизмов неспецифической резистентности организма. В то же время лейкоциты в зоне воспаления являются источником целого ряда бактерицидных факторов и биологически активных веществ – миелопероксидазы, лизоцима, лактоферрина, катионных белков, кининов, простагландинов, лизосомальных ферментов, хемотаксических факторов. Активные гранулоциты и моноциты продуцируют эндогенные пирогенные факторы, вызывающие развитие лихорадки, обеспечивающей реализацию комплекса защитно-приспособительных реакций в организме. Моноциты, относящиеся к категории макрофагов, принимают участие в инициировании иммунного ответа при воспалении, обеспечивая подготовку антигенов переработку их в иммуногенную форму. Таким образом, эмигрировавшие в зону воспаления моноциты принимают участие в специфических механизмах реагирования на действие патогенного фактора. Лимфоциты являются источником лимфокинов и принимают непосредственное участие в иммунологических механизмах защиты [2, 7, 8].
Исходом венозном гиперемии является развитие престаза и стаза – полной остановки кровотока в микроциркуляторном русле.
Пролиферация является завершающей фазой развития воспаления, обеспечивающей репаративную регенерацию тканей на месте очага альтерации. Процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, фагоцитоз инфекционных возбудителей воспаления клеточного детрита. По периферии очага воспаления формируется фибробластический барьер, за счет которого зона воспаления инкапсулируется и возникает постоянная миграция клеточных и неклеточных элементов соединительной ткани и формирование соединительнотканного остова на месте первичной и вторичной альтерации. Одновременно в ряде тканей происходит размножение и органоспецифических элементов с последующим полным или частичным восстановлением структуры и функции поврежденной ткани [4, 5, 6, 7, 8].
Локальные расстройства кровоснабжения и обменных процессов в зоне воспаления, как правило, сочетаются с комплексом метаболических и функциональных расстройств на уровне целостного организма.
Синдром системного воспалительного ответа
Синдром системного воспалительного ответа – это комплекс цитокин-опосредованных системных морфологических, функциональных и биохимических изменений в организме, возникающих на фоне развития воспалительно-деструктивных процессов инфекционной, аллергической, онкологической, травматической природы, . стрессорного воздействия.
Основными признаками ССВО, помимо гормонального дисбаланса, являются: увеличение содержания в крови белков острой фазы, развитие лейкоцитоза более 12000 мкл, в тяжелых случаях возможна лейкопения – менее 4000 мкл.
Одновременно развивается температурная реакция выше 38 °С под влиянием провоспалительных цитокинов – вторичных эндопирогенов (ИЛ1, ИЛ6, ИЛ8, ФНОα, КСФ). Активация симпатоадреналовой системы приводит к развитию тахикардии, параллельно возникает тахипноэ.
Наиболее достоверным и хорошо изученным признаком острой фазы ответа является изменение белкового состава крови.
Белки острой фазы синтезируются главным образом в печени и делятся на две группы:
1. Позитивные маркеры (α1-антихемотрипсин, С-реактивный белок, фракция С3 комплемента, церулоплазмин, фибриноген, гаптоглобин, орозомукоид, плазминоген, антитромбин III), уровень которых возрастает.
2. Негативные маркеры (альбумин, трансферин), уровень которых снижается.
Уровень позитивных маркеров острой фазы нарастает в течение 24-48 часов после воздействия чрезвычайного альтерирующего фактора, причем в случае травматического повреждения степень увеличения позитивных маркеров в крови коррелирует с тяжестью повреждающего воздействия. При неосложненном течении патологии уровень позитивных маркеров острой фазы нормализуется в течение 72-96 часов. Однако в случае развития септических заболеваний, хронических воспалительных процессов, у больных с осложненным послеоперационным периодом уровень позитивных маркеров острой фазы длительное время может оставаться повышенным. В этих случаях большую прогностическую ценность представляет мониторинг позитивных маркеров острой фазы.
Наиболее чувствительным критерием системного действия на организм острой воспалительной реакции является возрастание концентрации в крови С-реактивного белка, в связи с чем наиболее распространен в клинической практике мониторинг С-реактивного белка. Последний является полипептидом с ММ 120 кД, обладает способностью связываться с полисахаридом С на поверхности одной из разновидностей стрептококка. Увеличение продукции С-реактивного белка печенью сочетается с последующим развитием комплекса системных реакций, в частности, индуцируемой этим белком активацией комплемента, подавлением функции тромбоцитов и лимфоцитов, торможением ретракции сгустка, стимуляцией фагоцитарной активности нейтрофилов.
Читайте также:

