Волновые свойства электрона кратко
Обновлено: 18.05.2024
До 1924 г. ученые считали, что наблюдаемые свойства электрона вполне соответствуют представлениям о нем как об очень небольшой электрически заряженной частице, во всем похожей, кроме размера, на шарик подшипника, несущий электрический заряд. Но в 1924 г. французский физик Луи де Бройль (род. в 1892 г.) установил волновой характер электрона. Исследуя квантовую теорию при подготовке докторской диссертации в Парижском университете, он установил, что выявляется поразительная аналогия между свойствами электронов и свойствами фотонов, если движущемуся электрону приписать некоторую длину волны. Такая длина волны электрона называется сейчас длиной волны де Бройля.
Уравнение, определяющее длину волны электрона, имеет следующий вид:
В этом уравнении λ — длина волны электрона, h — постоянная Планка, m — масса электрона и v — скорость движения электрона. Из уравнения видно, что электрон, находящийся в состоянии покоя, имеет бесконечно большую длину волны и что длина волны уменьшается с увеличением скорости движения электрона.
Пример 3.7.
Какова длина волны электрона, если его кинетическая энергия равна 13,6 эВ?
Решение. Прежде всего следует рассчитать, чему равна величина mv — момент поступательного движения электрона. Кинетическая энергия электрона равна
1/2mv 2 = 13,6 эВ×0,1602·10 -18 Кл =2,18·10 -18 Дж,
Умножив обе части этого равенства на m, получим
m 2 v 2 = 4,36·10 -18 ×0,9108·10 -30 = 3,96·10 -48 .
Извлекая корень квадратный из обеих частей уравнения, получим
Искомую длину волны теперь можно вычислить, воспользовавшись уравнением де Бройля:
λ=h/mv=0,66252·10 -33 Дж·с / 1,99·10 -24 кг·м·с -1 = 3,33·10 -10 м = 333 пм.
Таким образом, электрон, ускоренный разностью потенциалов 13,6 В, имеет длину волны де Бройля, равную 333 пм.
Теперь легко можно вычислить длину волны электрона, обладающего в 100 раз большей кинетической энергией, т. е. электрона, ускоренного разностью потенциалов 1360 В. Поскольку кинетическая энергия пропорциональна квадрату скорости, такой электрон приобретает скорость в десять раз большую, чем электрон, обладающий энергией 13,6 эВ, а его длина волны будет, согласно уравнению де Бройля, в десять раз меньше. Следовательно, длина волны электрона, обладающего энергией 1360 эВ, равна 33,3 пм.
Прямое экспериментальное подтверждение волновой природы электрона
Волновой характер движущихся электронов был с несомненностью установлен работами американского физика К. Дж. Девиссона (1881— 1958) и английского физика Дж. П. Томсона (род. в 1892 г.). Эти исследователи обнаружили, что электроны, рассеиваемые кристаллами, дают дифракционную картину, подобную той, которую дают рассеиваемые кристаллами рентгеновские лучи, и, более того, такая дифракционная картина соответствует длине волны, даваемой уравнением де Бройля.
Способность электронов проникать через вещество значительно меньше проникающей способности рентгеновских лучей с той же длиной волны. Поэтому для получения дифракционной картины пучок электронов должен отражаться от поверхности кристалла (как это имело место в опытах Девиссона и его сотрудников, использовавших монокристалл никеля) или же следует пропускать поток электронов, обладающих высокой скоростью, через очень тонкий кристалл или через слой кристаллического порошка (как делал Томсон).
Структуру кристаллов можно изучать как методом дифракции электронов, так и методом дифракции рентгеновских лучей. Электронографический метод оказался особенно полезным при изучении строения очень тонких пленок на поверхности кристаллов. Благодаря применению этого метода удалось, например, показать, что при адсорбции аргона на чистой поверхности кристалла никеля атомы аргона занимают лишь одну четвертую часть возможных положений, образуемых треугольниками никелевых атомов (на октаэдрической грани кристалла с плотнейшей кубической упаковкой; рис. 2.7). Этот метод применяли и при изучении структуры очень тонких окисных пленок, образующихся на поверхности металла и защищающих его от дальнейшей коррозии.
Электронографический метод широко используют также при определении строения молекул газа. На рис. 3.14 схематически показано, каким образом возникает дифракционная картина; точно так же происходит и рассеяние волн двухатомными молекулами. Молекулы газа имеют разную ориентацию, в связи с чем дифракционная картина получается несколько расплывчатой. Она представляет собой серию колец. Если известна длина волны электронов, то, измерив диаметры этих, колец, можно рассчитать межатомные расстояния в изучаемых молекулах. Электронографическим методом удалось установить строение: нескольких сот разных молекул.
Длина волны нейтрона.
Дифракция нейтронов Волновой характер имеют не только электроны, но также протоны,, нейтроны (разд. 3.5) и другие частицы. Их длины волн можно рассчитать по уравнению де Бройля, подставляя в него соответствующие значения масс частиц. Относительная способность разных атомов кристалла рассеивать нейтроны отличается от соответствующей способности рассеивать рентгеновские лучи. Как следствие этого, изучение дифракции нейтронов кристаллами дает дополнительную информацию к той, которую можно получить при изучении дифракции рентгеновских лучей. Оказалось, что дифракция нейтронов дает особенно ценную информацию о расположении атомов водорода в кристалле, содержащем более тяжелые атомы, а также при изучении веществ, обладающих магнитными свойствами.
В 1924 г. французский физик Луи де Бройль (1892—1987) предположил, что все частицы вещества, подобно свету, обладают волновыми свойствами. Связь между волновыми и корпускулярными свойствами частиц такая же, как и между соответствующими свойствами света. Энергия частицы Е равна энергии кванта волнового поля с частотой v, т. е. Е = h v, где h — постоянная Планка, а импульс частицы р = hk, где к — волновое число, h =h/2n. Поведение частиц, так же как при рассмотрении фотонов, описывалось с помощью волнового поля, интенсивность которого определяла вероятность того, что частица может быть обнаружена в определенной области пространства. Гипотеза де Бройля основывалась на сходстве уравнений, описывающих поведение лучей света и частиц вещества, и носила исключительно теоретический характер. Для ее подтверждения или опровержения требовались экспериментальные факты.
Первое опытное подтверждение гипотезы де Бройля было получено в опытах американских исследователей Девиссона и Джермера в 1927 г., изучавших рассеяние электронов на монокристалле никеля. Схема эксперимента приведена на рисунке.
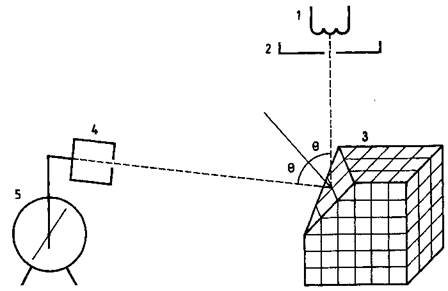
Схема эксперимента Девиссона и Джермера
Электроны, вылетающие из раскаленной нити 1, попадали в ускоряющее электрическое поле, создаваемое между электродами 1 и 2, с разностью потенциалов U, в котором они приобретали кинетическую энергию mv 2 /2 = eU.
Пройдя отверстие в электроде 2, электроны попадали на кристалл никеля J, на котором происходило их рассеяние. При помощи детектора, ведерка Фарадея 4, соединенного с электрометром 5, измерялось число электронов, рассеянных на угол 6 от нормали к грани кристалла. Меняя положение детектора, можно было исследовать зависимость числа рассеянных электронов от угла θ при различных значениях энергии электронов.
В опытах Девиссона и Джермера были установлены два замечательных факта:
наблюдалась зависимость числа рассеянных электронов от угла рассеяния, причем максимум числа электронов при данном значении ускоряющего напряжения соответствовал максимуму дифракционной картины, если считать кристалл никеля дифракционной решеткой, а электронам приписать длину волны в соответствии с гипотезой де Бройля;
при данном угле падения и изменении скорости электронов l>, что достигалось изменением напряжения U, ускоряющего электроны, интенсивность отраженного пучка периодически изменялась (рис. 113).
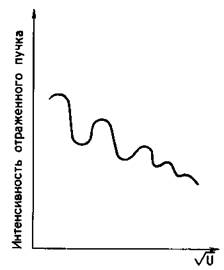 |
| Зависимость числа дифрагированных электронов от ускоряющего напряжения |
Электроны вели себя так, будто они были волнами. По результатам эксперимента удалось установить, что длина волны электронов в точности соответствовала предположению Луи де Бройля.
Позже Д ж. П. Т о м с о н у, сыну Дж. Дж. Томсона, удалось получить дифракционную картину, пропуская электроны с энергией нескольких десятков тысяч эВ через тонкие металлические пленки .
 |
| Дифракция электронов |
Электронная дифракционная картина очень похожа на рентгеновскую картину дифракции. Чтобы доказать, что она не вызвана вторичными рентгеновскими лучами, возникающими при торможении электронов в веществе, вдоль фотопластинки, где образовывалась электронная дифракционная картина, создавалось магнитное поле. При этом дифракционная картина смещалась поперек поля. Если бы картина создавалась рентгеновскими лучами, то никакого смещения не было бы. Усилия Дж. П. Томсона и К. Дж. Девиссона были отмечены в 1937 г. Нобелевской премией.
Позже дифракцию наблюдали и для более тяжелых заряженных частиц, а также для нейтральных атомов.
В 1949 г. советские физики Л. М. Биберман, Н. Г. Сушкин, В. А. Фабрикант, пропуская через дифракционное устройство слабый по интенсивности поток электронов, обнаружили явление дифракции. В опыте промежуток времени между последовательными прохождениями электронов сквозь мишень в 3 • 10 4 раз превышал время прохождения отдельного электрона через экспериментальную установку. Этот эксперимент можно интерпретировать так, что каждый электрон дифрагирует, проходя через дифракционную решетку, а вероятность его обнаружения на экране за решеткой определяется волновой функцией, описывающей поведение электрона в свободном пространстве.

Эксперименты по дифракции электронов и других микрочастиц вещества с очевидностью убеждают в том, что вещество, так же как и электромагнитное поле, обладает волновыми свойствами. Это обстоятельство является чрезвычайно удивительным, так как находится в резком противоречии со сложившимися представлениями об окружающем нас физическом мире.
Действительно, модель корпускулы—частицы, с помощью которой в классической физике описывали движение макроскопических тел, подразумевает локализацию этих тел в пространстве, при этом координаты частицы и ее скорость могут быть определены одновременно в любой момент времени. Однако эксперименты по дифракции электронов разрушают эти представления, так как невозможно представить себе электрон проходящим через две щели сразу, как это следует из результатов таких экспериментов.
Переход на язык классического волнового описания поведения электрона также мало что дает, так как электрон во всех экспериментах регистрируется всегда целиком, и все попытки определить, через какую щель в опыте по дифракции все-таки он проходит, оканчиваются неудачей.
Единственным выходом из создавшегося положения явился отказ от классических моделей волны или частицы при описании свойств микрообъектов. С точки зрения такого подхода электрон, так же как и фотон или какой-то другой микрообъект, не является ни волной, ни частицей. Микрообъекты представляют собой квантовые образования; их поведение можно описать с помощью волновой функции, интенсивность которой пропорциональна вероятности нахождения частицы в определенной области пространства в определенный момент времени. Раздел физики, в котором изучается поведение микрочастиц, получил название квантовой механики. С помощью квантовой механики получены наиболее убедительные результаты при объяснении физики атомов и молекул и закономерностей их спектров.
В 1924 г. французский физик Луи де Бройль (1892—1987) предположил, что все частицы вещества, подобно свету, обладают волновыми свойствами. Связь между волновыми и корпускулярными свойствами частиц такая же, как и между соответствующими свойствами света. Энергия частицы Е равна энергии кванта волнового поля с частотой v, т. е. Е = h v, где h — постоянная Планка, а импульс частицы р = hk, где к — волновое число, h =h/2n. Поведение частиц, так же как при рассмотрении фотонов, описывалось с помощью волнового поля, интенсивность которого определяла вероятность того, что частица может быть обнаружена в определенной области пространства. Гипотеза де Бройля основывалась на сходстве уравнений, описывающих поведение лучей света и частиц вещества, и носила исключительно теоретический характер. Для ее подтверждения или опровержения требовались экспериментальные факты.
Первое опытное подтверждение гипотезы де Бройля было получено в опытах американских исследователей Девиссона и Джермера в 1927 г., изучавших рассеяние электронов на монокристалле никеля. Схема эксперимента приведена на рисунке.

Схема эксперимента Девиссона и Джермера
Электроны, вылетающие из раскаленной нити 1, попадали в ускоряющее электрическое поле, создаваемое между электродами 1 и 2, с разностью потенциалов U, в котором они приобретали кинетическую энергию mv 2 /2 = eU.
Пройдя отверстие в электроде 2, электроны попадали на кристалл никеля J, на котором происходило их рассеяние. При помощи детектора, ведерка Фарадея 4, соединенного с электрометром 5, измерялось число электронов, рассеянных на угол 6 от нормали к грани кристалла. Меняя положение детектора, можно было исследовать зависимость числа рассеянных электронов от угла θ при различных значениях энергии электронов.
В опытах Девиссона и Джермера были установлены два замечательных факта:
наблюдалась зависимость числа рассеянных электронов от угла рассеяния, причем максимум числа электронов при данном значении ускоряющего напряжения соответствовал максимуму дифракционной картины, если считать кристалл никеля дифракционной решеткой, а электронам приписать длину волны в соответствии с гипотезой де Бройля;
при данном угле падения и изменении скорости электронов l>, что достигалось изменением напряжения U, ускоряющего электроны, интенсивность отраженного пучка периодически изменялась (рис. 113).
 |
| Зависимость числа дифрагированных электронов от ускоряющего напряжения |
Электроны вели себя так, будто они были волнами. По результатам эксперимента удалось установить, что длина волны электронов в точности соответствовала предположению Луи де Бройля.
Позже Д ж. П. Т о м с о н у, сыну Дж. Дж. Томсона, удалось получить дифракционную картину, пропуская электроны с энергией нескольких десятков тысяч эВ через тонкие металлические пленки .
 |
| Дифракция электронов |
Электронная дифракционная картина очень похожа на рентгеновскую картину дифракции. Чтобы доказать, что она не вызвана вторичными рентгеновскими лучами, возникающими при торможении электронов в веществе, вдоль фотопластинки, где образовывалась электронная дифракционная картина, создавалось магнитное поле. При этом дифракционная картина смещалась поперек поля. Если бы картина создавалась рентгеновскими лучами, то никакого смещения не было бы. Усилия Дж. П. Томсона и К. Дж. Девиссона были отмечены в 1937 г. Нобелевской премией.
Позже дифракцию наблюдали и для более тяжелых заряженных частиц, а также для нейтральных атомов.
В 1949 г. советские физики Л. М. Биберман, Н. Г. Сушкин, В. А. Фабрикант, пропуская через дифракционное устройство слабый по интенсивности поток электронов, обнаружили явление дифракции. В опыте промежуток времени между последовательными прохождениями электронов сквозь мишень в 3 • 10 4 раз превышал время прохождения отдельного электрона через экспериментальную установку. Этот эксперимент можно интерпретировать так, что каждый электрон дифрагирует, проходя через дифракционную решетку, а вероятность его обнаружения на экране за решеткой определяется волновой функцией, описывающей поведение электрона в свободном пространстве.
Эксперименты по дифракции электронов и других микрочастиц вещества с очевидностью убеждают в том, что вещество, так же как и электромагнитное поле, обладает волновыми свойствами. Это обстоятельство является чрезвычайно удивительным, так как находится в резком противоречии со сложившимися представлениями об окружающем нас физическом мире.
Действительно, модель корпускулы—частицы, с помощью которой в классической физике описывали движение макроскопических тел, подразумевает локализацию этих тел в пространстве, при этом координаты частицы и ее скорость могут быть определены одновременно в любой момент времени. Однако эксперименты по дифракции электронов разрушают эти представления, так как невозможно представить себе электрон проходящим через две щели сразу, как это следует из результатов таких экспериментов.
Переход на язык классического волнового описания поведения электрона также мало что дает, так как электрон во всех экспериментах регистрируется всегда целиком, и все попытки определить, через какую щель в опыте по дифракции все-таки он проходит, оканчиваются неудачей.
Единственным выходом из создавшегося положения явился отказ от классических моделей волны или частицы при описании свойств микрообъектов. С точки зрения такого подхода электрон, так же как и фотон или какой-то другой микрообъект, не является ни волной, ни частицей. Микрообъекты представляют собой квантовые образования; их поведение можно описать с помощью волновой функции, интенсивность которой пропорциональна вероятности нахождения частицы в определенной области пространства в определенный момент времени. Раздел физики, в котором изучается поведение микрочастиц, получил название квантовой механики. С помощью квантовой механики получены наиболее убедительные результаты при объяснении физики атомов и молекул и закономерностей их спектров.
1923 год ознаменовался событием, значимо ускорившим развитие квантовой физики. Французским физиком Л. де Бройлем была предложена гипотеза, предполагающая универсальность корпускулярно-волнового дуализма. В своей концепции Де Бройль сформулировал утверждение о том, что, помимо фотонов и электроны, а также прочие частицы материи имеют как корпускулярные, так и волновые свойства.
Описание гипотезы де Бройля
Идеи де Бройля содержали мысль о том, что любой микрообъект имеет, с одной стороны, корпускулярные характеристики – энергия E и импульс p , а с другой стороны, волновые характеристики – частота v и длина волны λ . При этом количественное соотношение корпускулярных и волновых характеристик аналогично тому же для фотона:
E = h v , p = h v c = h λ .
Как уже было сказано выше, в гипотезе французского физика шла речь о всех видах микрочастиц, соответственно и указанное выше соотношение применимо для любых из них, в том числе, и для обладающих массой m . Любая частица, обладающая импульсом, была сопоставлена с волновым процессом с длиной волны λ = h p .
Для частиц, имеющих массу: λ = h p = h 1 - v 2 / c 2 m v .
В нерелятивистском приближении ( υ c )
Основой идей де Бройля стали размышления о симметрии свойств материи, и в то время, увы, гипотеза не получила опытного подтверждения. Однако, она стала мощнейшим катализатором развития новых идей о природе материальных объектов. На протяжении последующих нескольких лет выдающиеся умы XX века (физики В. Гейзенберг, Э. Шредингер, П. Дирак, Н. Бор и др.) создавали теоретические основы новой науки, названной квантовой механикой.
Дифракция электронов
Впервые гипотеза де Бройля была экспериментально подтверждена в 1927 году, когда американские физики К. Девиссон и Л. Джермер выяснили, что пучок электронов, рассеивающийся на кристалле никеля, дает ясную дифракционную картину, похожую на возникающую тогда, когда на кристалле рассеивается коротковолновое рентгеновское излучение. В исследованиях физиков кристалл служил естественной дифракционной решеткой. По тому, какое положение имели дифракционные максимумы, выяснилась длина волны электронного пучка, и она полностью соответствовала той, что вычислялась по формуле де Бройля.
В 1928 году физик из Англии Г. Томсон (являющийся сыном Дж. Томсона, который открыл за 30 лет до этого электрон) вновь подтвердил гипотезу де Бройля. Эксперименты Томсона позволили наблюдать дифракционную картину, которая возникала, когда пучок электронов проходил через тонкую поликристаллическую фольгу из золота.
Рисунок 5 . 4 . 1 . Упрощенная схема опытов Г. Томсона по дифракции электронов. K – накаливаемый катод, A – анод, Ф – фольга из золота.
За фольгой установлена фотопластинка, на которой наблюдались явные концентрические светлые и темные кольца. Радиусы этих колец варьировались в зависимости от скорости электронов (т. е. длины волны) согласно де Бройлю (рис. 5 . 4 . 2 ).
Рисунок 5 . 4 . 2 . Картина дифракции электронов на поликристаллическом образце при длительной экспозиции ( a ) и при короткой экспозиции ( b ) .
В случае ( b ) видны точки попадания отдельных электронов на фотопластинку.
В последующие годы эксперимент Г. Томсона многократно повторяли и результат был неизменен даже в тех случаях, когда поток электронов был столь слабым, что через прибор единовременно проходила только одна частица (например, опыт В. А. Фабриканта в 1948 г.). Так была доказана идея, что волновые свойства характерны как для большой совокупности электронов, так и для каждого электрона в отдельности.
В последующем явления дифракции обнаружились и для нейтронов, протонов, атомных и молекулярных пучков. Доказанное экспериментально наличие волновых свойств различных видов микрочастиц позволило сделать вывод об универсальности этого явления в природе, являющегося общим свойством материи. Если продолжать данное рассуждение, волновыми свойствами должны обладать и макроскопические тела. Но из-за больших показателей массы, присущих макроскопическим телам, их волновые свойства затруднительно доказать при помощи экспериментов.
К примеру, пылинка массой 10 – 9 г , которая движется со скоростью 0 , 5 м / с , обладает волной де Бройля с длиной примерно 10 – 21 м, т. е. меньше размера атома на 11 порядков. Подобная длина волны находится за границами области, которая доступна для наблюдения.
Приведенный пример демонстрирует, что для макроскопических тел доступно лишь проявление корпускулярных свойств.
Приведем еще пример.
U = 100 В , длину волны де Бройля для него мы можем определить по формуле: λ = h 2 m e U
Приведенный пример - нерелятивистский случай, поскольку разница между кинетической энергией электрона e U = 100 э В и энергией покоя m c 2 ≈ 0 , 5 М э В достаточно значима (кинетическая энергия значимо меньше энергии покоя).
В результате расчета получим: λ ≈ 0 , 1 н м , т. е. полученная длина волны примерно соответствует размерам атомов. Для таких электронов кристалл служит отличной решеткой для дифракции. Как раз подобные малоэнергичные электроны показывают четкую дифракционную картину при проведении экспериментов по дифракции электронов. Вместе с этим электрон с такими характеристиками, испытавший дифракционное рассеяние на кристалле как волна, осуществляет взаимодействие с атомами фотопластинки в качестве частицы и вызывает почернение фотоэмульсии в некоторой точке (рис. 5 . 4 . 2 ).
Резюмируя, еще раз отметим, что гипотеза де Бройля о корпускулярно-волновом дуализме, доказанная экспериментально, глобально поменяла представления о том, какими свойствами обладают микрообъекты.
Все микрообъекты обладают и волновыми, и корпускулярными свойствами, но при этом не являются ни волной, ни частицей в стандартном представлении.
Одновременного проявления различных свойств микрообъектов не происходит: они являются дополнением друг друга, и лишь их совокупность характеризует микрообъект в целом.
Эти заключения были сформулированы датским физиком Н.Бором и получили название принципа дополнительности. Упрощенно возможно говорить о том, что микрообъекты распространяются как волны, а обмениваются энергией как частицы.
Факт, что необходимо использовать вероятностный подход, описывая микрообъекты, является важной отличительной чертой квантовой теории. Квантовая механика для характеристики состояний микрообъектов включает в себя понятие волновой функции Ψ (пси-функции).
Квадрат модуля волновой функции | Ψ | 2 пропорционален вероятности нахождения микрочастицы в единичном объеме пространства.
Определенный вид волновой функции задается внешними условиями, в которых находится микрочастица. Математический инструментарий квантовой механики дает возможность определять волновую функцию частицы, которая находится в заданных силовых полях. Безграничная монохроматическая волна де Бройля является волновой функцией свободной частицы, на которую не действуют никакие силовые поля.
Максимально четко явление дифракции наблюдается тогда, когда размерность препятствия, на котором происходит дифракция волн, соизмерима с длиной волны. Подобное поведение характерно для волн любой физической природы и, в частности, электронных волн. Для волн де Бройля естественная дифракционная решетка - это упорядоченная структура кристалла с пространственным периодом порядка размеров атома (приблизительно 0 , 1 н м ). Нет возможности создать искусственным образом препятствие указанного размера (к примеру, отверстие в непрозрачном экране), однако, чтобы уяснить природу волн де Бройля, возможно проводить, так сказать, мысленные эксперименты.
Для примера разберем дифракцию электронов на одиночной щели шириной D (рис. 5 . 4 . 3 )
Рисунок 5 . 4 . 3 . Дифракция электронов на щели. График справа – распределение электронов на фотопластинке.
Из общей массы электронов, проходящих через щель, свыше 85 % окажутся в центральном дифракционном максимуме. Угловая полуширина θ 1 этого максимума определится из условия
Указанная формула - часть волновой теории. Если рассуждать, опираясь на корпускулярные свойства, возможно сказать, что, когда электрон проходит через щель, он получает дополнительный импульс в перпендикулярном направлении. Можем пренебречь оставшимися 15 % электронов, попадающих на фотопластинку за пределами центрального максимума, и тогда будем считать, что максимальное значение p y поперечного импульса равно:
p у = p · sin θ 1 = h λ · sin θ 1
В этой формуле p является модулем полного импульса электрона, равным (по гипотезе де Бройля) h λ . Величина p , когда электрон проходит через щель, неизменна, поскольку неизменной является длина волны λ . Указанные выражения дают возможность записать следующее соотношение:
Для задач квантовой механики это несложное с виду соотношение, служащее следствием волновых свойств микрочастицы, имеет глубочайший смысл. Электроны проходят через щель, что есть эксперимент, где y – координата электрона – определяется с точностью Δ y = D .
Величина Δ y носит название неопределенности измерения координаты.
Вместе с тем, точность определения y – составляющей импульса электрона в момент прохождения через щель – равна p y или даже больше, учитывая побочные максимумы дифракционной картины.
Эта величина носит название неопределенности проекции импульса и обозначается как Δ p y .
Показатели Δ y и Δ p y связаны соотношением:
и оно названо соотношением неопределенностей Гейзенбурга.
Величины Δ y и Δ p y следует уяснить в том смысле, что микрочастицы не обладают одновременно точным значением координаты и соответствующей проекцией импульса. Соотношение неопределенностей не имеет отношения к несовершенству используемых приборов, чтобы одновременно измерить координаты и импульс микрочастицы. Соотношение Гейзенбурга есть проявление той самой дуальной корпускулярно-волновой природы материи микрообъектов. Соотношение дает возможность дать оценку тому, насколько применимы к микрочастицам постулаты классической механики. Оно также демонстрирует, что к микрообъектам невозможно применить понятие траектории в классическом понимании, поскольку характеристикой движения по траектории в любой момент времени являются определенные значения координат и скорости. В принципе нет возможности указать траекторию, по которой в некотором мысленном эксперименте двигался некий определенный электрон после прохождения щели до фотопластинки.
И все же определенные условия создают ситуацию, когда соотношение неопределенностей не является противоречием классическому описанию движения тел, в частности, микрочастиц.
К примеру, электронный пучок в кинескопе телевизора при вылете из электронной пушки имеет диаметр D около 10 – 3 с м . В телевизоре ускоряющее напряжение U ≈ 15 к В .
Нетрудно рассчитать импульс электрона: p = 2 m e U ≈ 6 , 6 · 10 - 23 к г · м / с
Данный импульс имеет направление вдоль оси трубки. Из соотношения неопределенностей вытекает, что электронам при формировании пучка сообщается неконтролируемый импульс Δ p , являющийся перпендикуляром к оси пучка: Δ p ≈ h D ≈ 6 , 6 · 10 – 29 к г · м / с .
Допустим, до экрана кинескопа электроны проходят расстояние L ≈ 0 , 5 м . В таком случае размытие Δ l пятна на экране, заданное волновыми свойствами электрона, составит:
∆ l ≈ ∆ p p L ≈ 5 · 10 - 5 с м
Так как Δ l D , возможно рассмотреть движение электронов в кинескопе телевизора при помощи основ классической механики.
Так, используя соотношение неопределенностей, есть возможность выяснять, насколько справедливы законы классической физики в отдельных случаях.
Проведем еще мысленный эксперимент: это будет дифракция электронного пучка на двух щелях
(рис. 5 . 4 . 4 ).
Структура эксперимента аналогична структуре оптического интерференционного опыта Юнга.
Рисунок 5 . 4 . 4 . Дифракция электронов на двух щелях.
Проанализировав данный эксперимент, мы можем отметить некоторые трудности логических умозаключений в квантовой теории. Собственно, то же затруднение имеет место быть при попытке объяснить оптический опыт Юнга на основе концепции фотонов.
Конечно, довольно затруднительно представить с точки зрения присущей нашему мышлению логике, что единственным ответом на указанный выше вопрос является факт, что электрон проходит через обе щели. Нашему мышлению свойственно представлять поток микрообъектов в виде направленного движения, например, маленьких шариков и соответственно описывать это движение, опираясь на законы классической физики. Однако для всех микрочастиц характерны как корпускулярные, так и волновые свойства. Нам легко представится, как электромагнитная световая волна пройдёт сквозь две щели в оптическом эксперименте Юнга, поскольку волна не имеет локализации в пространстве. Но при рассмотрении концепции фотонов приходится принять, что и каждый фотон не имеет локализации. Мы не имеем возможности указать, через какую щель прошел фотон, как и не имеем возможности отследить точную траекторию полета фотона до фотопластинки с указанием точной точки его попадания. Опыты демонстрируют такую картину, что, даже когда фотоны проходят сквозь интерферометр поштучно, интерференционная картина после прохождения многих независимых фотонов все равно имеет место быть. Таким образом, квантовая физика формулирует вывод: фотон интерферирует сам с собой.
Сказанное выше имеет отношение и к эксперименту по дифракции электронов на двух щелях. Все известные экспериментальные факты в своей совокупности могут быть объяснены, если признать, что волна по де Бройлю каждого конкретного электрона проходит одномоментно сквозь обе щели, и, как результат, имеет место явление интерференции.
Поштучный поток электронов также дает интерференцию при длительной экспозиции, т. е. электрон, как и фотон, интерферирует сам с собой.
Полному отказу от волновых представлений о природе света препятствуют не только сила традиции, удобство волновой теории и трудность современной квантовой теории. Есть и более серьезная причина. В 1924 г. французский физик Луи де Бройль впервые высказал идею, согласно которой одновременное проявление корпускулярных и волновых свойств присуще не только свету, но и любому другому материальному объекту. Эта идея была лишь теоретической гипотезой, так как в то время наука не располагала экспериментальными фактами, которые бы подтверждали существование волновых свойств у элементарных частиц и атомов. В этом заключалось существенное отличие гипотезы де Бройля о волновых свойствах частиц от гипотезы Эйнштейна о существовании фотонов света, выдвинутой им после открытия явления фотоэффекта.
Гипотеза де Бройля о существовании волн материи была детально разработана, и полученные из нее следствия могли быть подвергнуты Экспериментальной проверке. Основное предположение де Бройля заключалось в том, что любой материальный объект обладает волновыми свойствами и длина волны связана с его импульсом таким же соотношением, каким связаны между собой длина световой волны и импульс фотона. Найдем выражение, связывающее импульс фотона с длиной волны света К. Импульс фотона определяется формулой:
можно определить массу фотона:
Учитывая это, можно формулу (27.1) преобразовать так:
Отсюда получаем для длины световой волны формулу:
Если это выражение справедливо, как предположил де Бройль, для любого материального объекта, то длина волны тела массой движущегося со скоростью может быть найдена так:
Первое экспериментальное подтверждение гипотезы де Бройля получили в 1927 г. независимо друг от друга американские физики К. Д. Дэвиссон и . Джермер и английский физик Д. П. Томсон. Дэвиссон и Джермер изучали отражение электронных пучков от поверхности кристаллов на установке, схема которой изображена на рисунке 125. Перемещая приемник электронов по дуге окружности, центр которой находится в месте падения электронного пучка на кристалл, они обнаружили сложную зависимость интенсивности отраженного пучка от угла (рис. 126). Отражение излучения только под определенными углами означает, что это излучение представляет собой волновой процесс и его избирательное отражение есть результат дифракции на атомах кристаллической решетки. По известным значениям постоянной кристаллической решетки и угла дифракционного максимума можно по уравнению Вульфа — Брэггов
вычислить длину волны дифрагировавшего излучения и сопоставить ее с дебройлевской длиной волны электронов вычисленной по известному ускоряющему напряжению
Вычисленная таким образом из опытных данных длина волны совпала по значению с дебройлевской длиной волны.
Интересны результаты другого опыта, в котором пучок электронов направлялся на монокристалл, но расположение приемника и кристалла не изменялось. При изменении ускоряющего напряжения, т. е. скорости электронов, зависимость силы тока через гальванометр от ускоряющего напряжения имела вид, представленный на рисунке 127. Электронный пучок испытывал наиболее эффективное отражение при скоростях частиц, удовлетворяющих условию дифракционного максимума.
Последующие эксперименты полностью подтвердили правильность гипотезы де Бройля и возможность использования уравнения (27.6) для расчета длины волны, связанной с любым материальным объектом. Обнаружена дифракция не только элементарных частиц (электрон, протон, нейтрон), но и атомов.
Выполнив расчеты длины дебройлевской волны для различных материальных объектов, можно понять, почему мы не замечаем в повседневной жизни волновых свойств окружающих нас тел. Их длины волн оказываются столь малыми, что проявление волновых свойств невозможно обнаружить. Так, для пули массой 10 г, движущейся со скоростью 660 м/с, длина дебройлевской волны равна:
Дифракция электронов на решетке кристалла никеля становится заметной лишь при таких скоростях движения электронов,
при которых их дебройлевская длина волны становится сравнимой с постоянной решетки. При этом условии дифракционная картина, получаемая от электронного пучка, становится подобной картине дифракции пучка рентгеновских лучей с такой же длиной волны. На рисунке 128 представлены фотографии дифракционных картин, наблюдающихся при прохождении пучка света (а) и пучка электронов (б) у края экрана.
Строение атома.

Атом – мельчайшая частица химического элемента, носитель всех его химических свойств. Атом неделим в химическом отношении. Атомы могут существовать как в свободном состоянии, так и в соединении с атомами того же элемента или другого элемента.
За единицу атомных и молекулярных масс в настоящее время приняли 1/12 часть массы атома углерода с атомной массой, равной 12 (изотоп ). Эту единицу называют углеродной единицей.
Масса и размеры атомов. Число Авогадро.
Грамм-атом, так же как и грамм-молекула любого вещества, содержит 6,023•10^23 атомов или соответственно молекул. Это число называется числом Авогадро (N0). Так, в 55,85 г железа, 63,54 г меди, 29,98 г алюминия, и т. п. находится число атомов, равное числу Авогадро.
Зная число Авогадро, нетрудно подсчитать массу одного атома любого элемента. Для этого гpaмм-атомную массу одного атома надо разделить на 6,023•10^23 . Так, масса атома водорода (1) и масса атома углерода (2) соответственно равны:
Исходя из числа Авогадро, можно оценить и объем атома. Например, плотность меди равна 8,92 г/см^3, а грамм-атомная масса 63,54 г. Значит, один грамм-атом меди занимает объем , и на один атом меди приходится объем .
Структура атомов.
Атом является сложным образованием и состоит из ряда более мелких частиц. Атомы всех элементов состоят из положительно заряженного ядра и электронов — отрицательно заряженных частиц очень малой массы. Ядро занимает ничтожно малую часть всего объема атома. Диаметр атома равен см, а диаметр ядра - см.
Хотя диаметр ядра атома в 100000 paз меньше диаметра самого атома, практически вся масса атома сосредоточена в его ядре. Отсюда следует, что плотность атомных ядер очень велика. Если бы удалось собрать 1 см3 атомных ядер, то его масса была бы около 116 млн. тонн.
Ядро состоит из протонов и нейтронов. Эти частицы имеют общее название — нуклоны.
Протон - - устойчивая элементарная частица с массой, близкой к углеродной единице. Заряд протона равен заряду электрода, но с обратным знаком. Если заряд электрона принимают равным —1, то заряд протона равен +1. Протон – это атом водорода, лишенный электрона.
Нейтрон – атомная оболочка, отрицательный заряд которой компенсирует положительный заряд ядра, обусловленный наличием в нем протонов.
Таким образом, количество электронов в атоме равно количеству протонов в его ядре.
Зависимость между числом протонов , числом нейтронов и массовым числом атома выражается уравнением: N=A-Z
Отсюда число нейтронов в ядре атома любого элемента равно разности между его массовым числом и числом протонов.
Так число нейтронов в ядре атома радия с массой 226 N=A-Z=226-88=138
Масса и заряд электрона.
Все химические процессы образования и разрушения химических соединений происходят без изменения ядер атомов элементов, входящих в состав этих соединений. Изменения претерпевают только электронные оболочки. Химическая энергия, таким образом, связанa с энергией электронов. Чтобы понимать процессы образования и разрушения химических соединений, следует иметь представления о свойствах электрона вообще и особенно о свойствах и поведении электрона в атоме.
Электрон — это элементарная частица, обладающая элементарным отрицательным электрическим зарядом, т. е. наименьшим могущим существовать количеством электричества. Заряд электрона равен эл. ст. ед. или кулона. Масса покоя электрона равна г, т.е. в 1837,14 раза меньше массы атома водорода. Масса электрона составляет углеродной единицы.
Модель атома по Бору.
В начале XX века М. Планк А. Эйнштейн создали квантовую теорию света, согласно которой свет является потоком отдельных квантов энергии, которую нecyт частицы света — фотоны.
Величина кванта энергии (E) различна для различных излучений и пропорциональна частоте колебаний :
,
где h - постоянная Планка.
М. Планк показал, что атомы поглощают или испускают лучистую энергию только отдельными вполне определенными порциями – квантами.
Пытаясь увязать закон классической механики с квантовой теорией датский ученый Н. Бор считал, что электрон в атоме водорода может находиться лишь на определенных — постоянных орбитах, радиусы которых относятся друг к другу как квадраты целых чисел Эти орбиты Н. Бором были названы стационарными.
Излучение энергии происходит только при переходе электрона с более дальней орбиты на более близкую к ядру орбиту. При переходе же электрона с болей близкой орбиты на более дальнюю энергия атомом поглощается.
, где - энергии электронов в стационарных состояниях.
При Ei > Ек энергия выделяется.
При Ei п
Если, например, n=4, то электрон, находится на четвертом, считая от ядра атома, энергетическом уровне, или на N уровне.
Орбитальное квантовое числа l, которое иногда называют побочным квантовым числом, характеризует различное энергетическое состояние электрона данного уровня. Тонкая структура спектральных линий говорит о том, что электроны каждого энергетического уровня группируются в подуровни. Орбитальное квантовое число связано с моментом количества движения электрона при его движении относительно ядра атома. Орбитальное квантовое число определяет также форму электронного облака Квантовое число l может принимать все целочисленные значения от 0 до (п-1). Например, при n=4, l=0, 1, 2, 3. Каждому значению l соответствует определенный подуровень. Для подуровней применяются буквенные обозначения. Так, при l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f- подуровнях. Электроны различных подуровней соответственно называют s-, p-, d-, f - электронами. Возможное число подуровней для каждого энергетического уровня равно номеру этого уровня, но не превышает четырех. Первый энергетический уровень (п=1) состоит из одного s-подуровня, второй (п=2), третий (п=3) и четвертый (п=4) энергетические уровни состоят соответственно из двух (s, p), трех (s, p, d) и четырех (s, p, d, f) подуровней. Больше четырех подуровней не может быть, так как значения l=0, 1, 2, 3 описываю электроны атомов всех 104 известных сейчас элементов.
Если l=0 (s-электроны), то момент количества движения электрона относительно ядра атома равен нулю. Это может быть только когда электрон поступательно движется не вокруг ядра, а от ядра к периферии и обратно. Электронное облако s-электрона имеет форму шара.
Магнитное квантовое число - c моментом количества движения электрона связан и его магнитный момент. Магнитное квантовое число характеризует магнитный момент электрона. магнитное квантовое число характеризует магнитный момент электрона и указывает на ориентацию электронного облака относительного избранного направления или относительно направления магнитного поля. Магнитное квантовое число может принимать любые целые положительные и отрицательные значения, включая и ноль в пределах от – l до + l. Например, если l=2, то имеет 2 l+1=5 значений (-2, -1, 0, +1, +2). При l=3 число значений равно 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). Число значений магнитного квантового числа , которое равно 2 l+1, - это число энергетических состояний, в которых могут находиться электроны данного подуровня. Таким образом, s-электроны имеют лишь одно состояние (2 l+1=1), p-электроны – 3 состояния (2 l+1=3), d-, f-электроны – соответственно 5 и 7 состояний. Энергетические состояния принято обозначать схематически энергетическими ячейками, изображая их в виде прямоугольников, а электроны в виде стрелок в этих ячейках.
Спиновое квантовое число - характеризует внутреннее движение электрона — спин. Оно связано с собственным магнитным моментом электрона, обусловленным его движением вокруг своей оси. Это квантовое число может принимать только два значения: + 1/2 и —1/2, в зависимости от того, параллельно или антипараллельно магнитному полю, обусловленному движением электрона вокруг ядра, ориентируется магнитное поле спина электрона.
Два электрона (пара) с одинаковыми значениями квантовых чисел: n, I, , но с противоположно направленными спинами (↑ ↓) называются спаренными или неподеленной парой электронов. Электроны с ненасыщенными спинами (↑↑) называются неспаренными.
Принцип Паули, принцип наименьшей энергии, правило Гунда.
Распределение электронов в атомах элементов определяют три основных положения: принцип Паули, принцип наименьшей энергии и правило Гунда.
Принцип Паули. Изучая многочисленные, спектры атомов швейцарский физик В. Паули в 1925 году пришел к выводу, который получил название принципа или запрета Паули: „Двум электронам атома запрещено быть во всех отношениях похожими друг на друга" или, что то же самое, „в атоме не может быть даже двух электронов с одинаковыми значениями всех четырех квантовых чисел". Энергетические состояния электронов, характеризуемые одинаковыми значениями трех квантовых чисел: n, I и m1 принято обозначать энергетической ячейкой .
Согласно принципу Паули, в энергетической ячейке может быть только два электрона, причем с противоположными спинами
Нахождение в одной энергетической ячейке третьего электрона означало бы, что у двух из них все четыре квантовых числа одинаковы. Число, возможных состояний электронов (рис. .4) на данной подуровне равно числу значений магнитного квантового числа для этого подуровня, т. е. 21+ 1. Максимальное число электронов на этом подуровне, согласно принципу Паули будет 2(21+ 1). Таким образом, на s-подуровне возможно 2 электрона ; на p-подуровне 6 электронов ; на d-подуровне 10 электронов ; на f-подуровне 14 электронов . Число возможных состояний электронов на каком-либо уровне равно квадрату главного квантового числа а максимальное число электронов на этом уровне
Принцип наименьшей энергии.
Последовательность размещения электронов в атоме должна отвечать наибольшей связи их с ядром, т. е. электрон, должен обладать наименьшей энергией. Поэтому электрону необязательно занимать вышележащий энергетический уровень, если в нижележащем уровне есть места, располагаясь на которых электрон будет обладать меньшей энергией.
Так как энергия электрона в основном определяется значениями главного n и орбитального / квантовых чисел, то сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и / является меньшей. Например, запас энергии на подуровне 4s(n +/ = 4 +0 = 4) меньше, чем на 3d(n + /= 3 + 2 = 5); на 5s (n + / = 5 + 0 = 5) меньше, чем на 4d(n + / = 4 + 2 = 6); на 5р(п + / = 5 +1 =6) меньше, чем на 4f(n + 1 = 4+3 = 7). Если для двух уровней суммы значений n и / равны, то сначала идет заполнение подуровня с меньшим значением п. Например, на подуровнях 3d, 4p, 5s суммы значений n и / равны пяти, в этом случае сначала заполняются подуровни с меньшими значениями главного квантового числа n, т. е. в следующей последовательности: 3d-4р-5s.
Когда энергии близких подуровней очень мало отличаются друг от друга, встречаются некоторые исключения из этого правила. Так, подуровень 5d заполняется одним электроном 5dl раньше 4f; 6d1-2 раньше 5f.
Заполнение энергетических уровней и подуровней идет в следующей последовательности: ls→2s→2p→3s→3p→4s→ 3d → 4р→ 5s → 4d → 5р→ 6s →(5dl) →4f→ 5d→6p→ 7s→ (6d1-2)→5f→ 6d→7p

Правило Гунда.
Электроны в пределах данного подуровня располагаются сначала каждый в отдельной ячейке в виде неспаренных „холостых" электронов. Иными словами, при данном значении I электроны в атоме располагаются так, что суммарное спиновое число их максимально. Например, если в трех р-ячейках надо разместить три электрона, то каждый из них будет располагаться в отдельной ячейке таким образом:

Электронные формулы атомов и схемы.
Принимая во внимание рассмотренные положения, легко представить распределение электронов по энергетическим уровням и подуровням в атомах любого элемента. Это распределение электронов в атоме записывается в виде так называемых электронных формул. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни электронов; цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа - число электронов на данном подуровне. Например, запись 5р3 оначает, что 3 электрона располагаются на р-подуровне пятого энергетического уровня.
Чтобы составить электронную формулу атома любого элемента, достаточно знать номер данного элемента в периодической системе и выполнить основные положения, которым подчиняется распределение электронов в атоме.
Пусть, например, нужно составить электронные формулы для атомов серы, кальция, скандия, железа и лантана. Из периодической таблицы определяем номера данных элементов, которые соответственно равны 16, 20, 21, 26, . Это значит, что на энергетических уровнях и подуровнях у атомов данных элементов содержится соответственно 16, 20, 21, 26, 57 электронов. Соблюдая принцип Паули и принцип наименьшей энергии, т. е. последовательность заполнения энергетических уровней и подуровней, можно составить электронные формулы атомов этих элементов:

Структура электронной оболочки атома может быть изображена и в виде схемы размещения электронов по энергетическим ячейкам.
Для атомов железа такая схема имеет следующий вид:

На этой схеме наглядно видно выполнение правила Гунда. На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона. Однако следует помнить, что для каждого s-, р-, d-, f-электрона характерно свое электронное облако. Различная форма электронного облака указывает на то, что электрон имеет неодинаковую вероятность нахождения в данной области пространства атома. В зависимости от значения магнитного квантового числа m1 ориентация электронного облака в пространстве будет также различной.
Читайте также:

