Происхождение водорода в химии кратко
Обновлено: 06.07.2024
Водоро́д — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1 H — протон. Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ .
Содержание
История
Происхождение названия
Распространённость
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов ( 8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 % ). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C ) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных атомов и ионов.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 % ). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере ( 0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 % .
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
1.Электролиз водных растворов солей:
2.Пропускание паров воды над раскаленным 1000°C :
4. В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
См. также

Эмиссионный спектр водорода
Водород может существовать в двух формах (модификациях) — в виде −259,10 °C , т. кип. −252,56 °C ) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C , т. кип. −252,89 °C ) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.

Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно 80 К соотношение форм приблизительно 1:1 . Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25 ). Без катализатора превращение происходит медленно, что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C , удельная теплота сгорания 120.9·10 6 Дж/кг , малорастворим в воде — 18,8 мл/л . Водород хорошо растворим во многих металлах ( Ni , Pt, Pd и др.), особенно в палладии ( 850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.

Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C . Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см 3 ) и текучая (вязкость при −253 °C 13,8 спуаз ). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм . Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Изотопы

Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1 H — дейтерий (D), 3 Н — дейтерий являются стабильными изотопами с 1 и 2 . Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % [2] . Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3 Н (тритий) нестабилен. Его период полураспада составляет 12,32 [2] лет . Тритий содержится в природе в очень малых количествах.
В литературе приводятся данные о изотопах водорода с массовыми числами 4 — 7 . Однако, приводимые периоды полураспада 10 −15 — 10 −23 сек , настолько малы, что вызывают оправданные сомнения в результатах.
Природный водород состоит из молекул H2 и HD ( 3200:1 . Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1 .
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов [3] .
| Температура плавления, K | Температура кипения, K | Тройная точка, K / kPa | Критическая точка, K / kPa | Плотность жидкий / газ, кг/м³ | |
|---|---|---|---|---|---|
| H2 | 13.95 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 22,13 | 16,60 / 12,8 | 35,91 / 1,48 | 114,80 / 1,802 | |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,310 | |
| D2 | 18,62 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,230 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства

Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2 Ca + H2 → Mg + H2 → H2O → Взаимодействие с оксидами металлов (как правило, d-элементов)
Гидрирование органических соединений
Молекулярный водород широко применяется в катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением [4] . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
Применение
Одно время высказывалось предположение, что в недалёком будущем основным источником получения энергии станет реакция горения водорода, и уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды. Электролиз воды — довольно энергоёмкий процесс, и в настоящее время получать водород электролизом в промышленных масштабах невыгодно. Но ожидалось, что электролиз будет основан на использовании среднетемпературной ( 500—600 °C ) теплоты, которая в больших количествах возникает при работе атомных электростанций. Эта теплота имеет ограниченное применение, и возможности получения с её помощью водорода позволили бы решить как проблему экологии (при сгорании водорода на воздухе количество образующихся экологически вредных веществ минимально), так и проблему утилизации среднетемпературной теплоты.
Атомарный водород используется для Атомно-водородной сварки .
Пищевая промышленность
Примечания
- ↑Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т.. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 400. — 623 с. — 100 000 экз. (см. ISBN )
- ↑ 2,02,1 G. Audi, O. Bersillon, J. Blachot, A.H. Wapstra. The Nubase evaluation of nuclear and decay properties. Nuclear Physics A 729 (2003), pages 3-128.
- ↑Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 9783527308170
- ↑ Правилов А. М. Фотопроцессы в молекулярных газах. М.: Энергоатомиздат, 1992.
См. также
1. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н.Е.Кузьменко, В.В.Еремин, В.А.Попков. - М.: Издательство "Экзамен",2005. 2. Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
История открытия водорода занимает важную веху в развитии науки. Согласно современным научным представлениям, этот газ – один из самых распространенных элементов во Вселенной. Он является наиболее важным веществом для существования звезд, а, следовательно, главным источником энергии.

Краткая история открытия водорода
История открытия водорода (H) на этом не заканчивается. В 1931 году профессором химии Гарольдом Юри, работавшим в Чикаго (США), был обнаружен газ дейтерий. Он является тяжелым изотопом водорода и записывается как 2 H и D.

Кирпичики мироздания
Первый топливный элемент
История открытия водорода богата интересными событиями. В 1839 году британский ученый сэр Уильям Роберт Гроув провел эксперименты по электролизу. Он использовал электричество для разделения воды на водород и кислород. Позже исследователь задумался, а можно ли сделать обратное действие – генерировать электричество из реакции кислорода с водородом? Гроув закрыл платиновые пластинки в отдельных запечатанных емкостях, в одной из которых содержался водород, а в другой – кислород. Когда контейнеры были погружены в разбавленную серную кислоту, между двумя электродами потек ток с образованием воды в газовых баллонах. Затем ученый связал несколько подобных устройств в последовательную цепь, чтобы увеличить напряжение, создаваемое в газовой батарее.
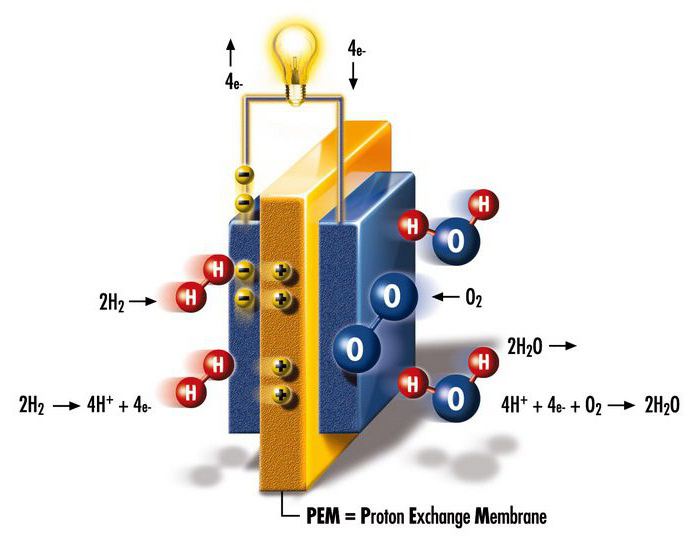
Автономные источники энергии
В 1932 году Фрэнсис Томас Бэкон, инженер Кембриджского университета в Великобритании, продолжил работу над проектами Гроува, Монда и Лангера. Он заменил платиновые электроды менее дорогой никелевой сеткой, а вместо электролита с серной кислотой использовал щелочной гидроксид калия (менее агрессивный к электродам). Это было по существу создание первого щелочного топливного элемента, получившего название ячейка Бэкона. Британцу потребовалось еще 27 лет, чтобы продемонстрировать установку, способную производить 5 кВт энергии, что достаточно для питания сварочного аппарата. Примерно в то же время был продемонстрирован первый автомобиль на топливных элементах.

Полезный, но опасный
Вывод
Водород – один из важнейших элементов во Вселенной. Хотя его свойства хорошо изучены, он не перестает интересовать ученых, инженеров, конструкторов. Данный элемент является темой тысяч научных работ, дипломов и рефератов. История открытия водорода – это история самой науки, системы знаний, пришедшей на смену невежеству и религиозным догмам.

Газ без цвета, запаха и вкуса
Водород / Hydrogenium (H), 1
2,20 [1] (шкала Полинга)
0,0000899 (при 273 K (0 °C)) г/см³
(300 K) 0,1815 Вт/(м·К)
Три изотопа водорода имеют собственные названия: 1 H — протий (Н), 2 H — дейтерий (D) и 3 H — тритий (радиоактивен) (T).
Содержание
История
Происхождение названия
Распространённость
Во Вселенной
Водород — самый распространённый элемент во Вселенной [3] . На его долю приходится около 92 % всех атомов (около 8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
В промышленности
В лаборатории
Физические свойства



Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·10 6 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.


Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.


Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Изотопы


Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1 H — протий (Н), 2 Н — дейтерий (D), 3 Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % [4] . Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3 Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет [4] . Тритий содержится в природе в очень малых количествах.
В литературе [4] также приводятся данные об изотопах водорода с массовыми числами 4—7 и периодами полураспада 10 −22 —10 −23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов [5] .
| Температура плавления, K | Температура кипения, K | Тройная точка, K / kPa | Критическая точка, K / kPa | Плотность жидкий / газ, кг/м³ | |
|---|---|---|---|---|---|
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,6 / 12,8 | 35,91 / 1,48 | 114,0 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,23 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице [4] [6] .
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства


Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:

Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:

и с единственным неметаллом — фтором, образуя фтороводород:

С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:


Записанное уравнение отражает восстановительные свойства водорода.

С галогенами образует галогеноводороды:
\ 2HF>" width="" height="" />
, реакция протекает со взрывом в темноте и при любой температуре, \ 2HCl>" width="" height="" />
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:

Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
\ 2NaH>" width="" height="" />
\ CaH_2>" width="" height="" />
\ MgH_2>" width="" height="" />
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:

Взаимодействие с оксидами металлов (как правило, d-элементов)
\ Co + H_2O >" width="" height="" />
\ 2Fe + 3H_2O >" width="" height="" />
\ W + 3H_2O >" width="" height="" />
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.

Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением [7] . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объему. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако, следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг [8] . В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
Пищевая промышленность
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающую среду и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.

История открытия
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы
Водород это газ, молекула его состоит из двух атомов.
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Практическое применение
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Читайте также:

