Признаки протекания химических реакций кратко
Обновлено: 05.07.2024
Нас окружает множество химических процессов не только в школе, но и в жизни. Часть из них красочные и яркие, многие – не имеют явных видимых эффектов. Важно понять одно: если реакция прошла, это всегда можно определить прямыми или косвенными методами. Кроме того, часто признак химического процесса интересный, но из-за низкой скорости ее протекания увидеть эффект практически невозможно (например, люминесценция растений). В статье разберем какие существуют признаки реакции и как можно повлиять на процесс ее проведения.
План урока:
Основные понятия
Под химической реакцией понимают процесс превращения одних веществ в другие. При этом, происходит передача электронов или образование новых связей. Каждое химическое взаимодействие характеризуется специфическими параметрами, характеризующими сами реактивы, условия проведения и химические преобразования. От всех этих факторов зависит внешний вид реакционной массы.
- Вещества, которые вступают в химическую реакцию, называются исходными, а образующие в результате нее – продукты.
- Исходя из преобразований молекул выделяют типы химических реакций: соединение, расщепление, замещение, обмен. Есть более сложные варианты: полимеризация, комплексообразование, перенос.
- В любой реакции происходит изменение энергетических состояний молекул. В одних случаях требуется затрата энергии на разрыв молекулярных связей – эндотермические реакции, в других – энергия выделяется сама из-за ее высвобождения – экзотермические процессы.
- Вещества могут находиться в разных агрегатных состояниях – жидком, твердом, газообразном. Также, в процессе химического взаимодействия может происходить смена агрегатного состояния.
Все эти факторы формируют параметры химического процесса: признаки, скорость, обратимость и т.д.
Признаки химической реакции
Признак химической реакции – видимое изменение в реакционной смеси, по которому мы можем определить, что реакция прошла.
Такие признаки могут быть видны сразу:
- Выделение газа;
- Выпадение осадка;
- Растворение осадка
- Изменение цвета;
- Свечение;
- Появление специфического запаха
Иногда, констатировать процесс реакции можно только с использованием дополнительных реактивов:
- Изменение кислотности раствора;
- Образование продукта, вступающего в специфическую реакцию с видимыми изменениями характеристик реакционной смеси.
Выделение газа
Выделение газа происходит при образовании газообразного продукта или слабого электролита, распадающегося с выделением газа. Основной сложностью является идентификация образовавшегося продукта. Для каждого вещества существуют специфические признаки, идентифицирующие его.
Таблица. Газ и методы его определения
Выпадение осадка
Запомнить в какой реакции произойдет выпадение осадка не нужно. Это можно определить по таблице растворимости.
Осадки разных соединений отличаются по цвету и размеру кристаллов. Многие соединения имеют белый цвет:
- Карбонат кальция (растворим в кислотах);
- Сульфат бария (мелкокристаллический, нерастворим в кислотах);
- Гидроксид магния (аморфный);
- Гидроксид алюминия (студенистый);
- Гидроксид цинка (растворим в избытке щелочи);
- Фосфат кальция;
- Кремниевая кислота (коллоидная масса).
Ряд солей имеют желтый цвет:
- Бромид серебра (светло-желтый);
- Сульфат кадмия;
- Фосфат серебра.
Ярко-красное окрашивание характерно для гесацианоферрата калия, а гексацианоферрат железа – синий.
Сульфаты большинства металлов черного цвета.
Свечение
Люминесценция – редки признак химической реакции. Это часто наблюдается в живой природе у растений (в процессе фотосинтеза) и животных (светлячки).
К химии это можно наблюдать при использовании специального вещества – люминола. Такие реакции широко распространены в криминалистике, так как люминол очень чувствителен к органическим веществам. Причем, по цвету и степени свечения можно определить примерный состав и время оставления обнаруженного следа.
Появление специфического запаха
Запах можно почувствовать при образовании газов. Основные газы? из них – аммиак и оксид серы (IV). Такие вещества ядовиты, поэтому их идентификация без соблюдения техники безопасности может привести к отравлению и ожогу слизистой носа.
Изменение кислотности раствора
В реакции может происходить образование кислот, оснований или солей. Изменение кислотности можно определить добавив индикатор. В химии используются три основные индикатора: фенолфталеин, метилоранж, лакмус.
Для определения щелочи лучше всего использовать фенолфталеин, так как он меняет цвет только в этой среде. Самым неудобным индикатором для определения кислотности среды является метилоранж, так как различить в реальности оранжевый и желтый бывает сложно.
Кроме растворов индикаторов можно использовать индикаторную бумагу: она может быть пропитана одним индикатором или всеми одновременно. Последняя называется универсальной. С помощью такой бумаги можно определить не только среду – кислая, щелочная или нейтральная, но и более точное значение pH. Такая бумага очень чувствительна. Вместе с ней предоставляется шкала изменения цвета и соответствующие значения pH.
У индикаторной бумаги разных марок шаг чувствительности разный и варьирует от единиц до сотых.
В медицине определение кислотности имеет важное значение, так как многие процессы идут при определенной кислотности. Так, в ротовой полости среда щелочная и фермент слюны – амилаза – работает только в такой среде. В желудке среда кислая, что важно для пищеварительных ферментов желудка. При различных заболеваниях или вредных привычках может изменяться параметр кислотности, что служит важным диагностическим признаком.
Обратимость химических реакций
Химические процессы могут протекать как в одну, так и в обе стороны. Последние называются обратимыми.
Чаще всего, в таких реакциях устанавливается равновесие – это значит, она идет с одинаковой скоростью в обоих направлениях. Зафиксировать тот или иной продукт становится сложно. В основном, направление процесса изменяется при повышении концентрации одного из реактивов.
Практически любая реакция, в которой не образуется окончательный продукт – газ, осадок или вода – являются обратимыми, так как ионы в растворе соединяются как в исходные молекулы, так и в продукты реакции с одинаковой скоростью. Зафиксировать образование одного из продуктов реакции не представляется возможным.
Обратимым реакциям можно задать определенное направление, используя катализаторы:
Например, в реакции получения аммиака из водорода и азота – 3H2 + N2 ⇌ 2NH3 – в качестве катализатора используют порошок железа, смещающего равновесие в сторону прямой реакции.
Для разных обратимых процессов характерны специфические катализаторы, ускоряющие прямой или обратный процесс.
Таблица. Условия протекания обратимых реакций
Изменение объема смеси взаимодействующих веществ не влияет на скорость, так как увеличение количества молекул не ускоряет их движение. А вот повышение чистоты реагентов может увеличить скорость реакции, так как увеличит вероятность столкновения нужных реагентов. Правда, в ряде случаев (серная и азотная кислота) изменение концентрации приводит к изменению состава продуктов.
Иногда, для течения реакции в определенно направлении нужно отводить продукт ее протекания: собирать осадок, газ или осаждать один из растворимых продуктов.
Таким образом, считается, что реакция идет, если мы можем увидеть или проверить с помощью специальных реактивов (индикаторов) образование новых продуктов. Если реакция идет в обоих направлениях, то она считается обратимой. В таком случае, ускорить ее в определенном направлении можно изменением условий (давление, температура, катализатор) или отведением одного из продуктов реакции.

Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.





Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.

В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Часто мы даже не подозреваем, что на наших глазах идет химическая реакция, а нередко и сами являемся ее участниками. Разбираемся, что же такое химические реакции, каковы их типы, классификация, скорость и признаки



Без химических реакций была бы невозможна эволюция в природе. В открытом космосе встречаются в основном только атомы водорода (H) и гелия (He). Это объясняется отсутствием необходимых условий для прохождения химических реакций.
Химическая реакция – это процесс превращения одного или нескольких веществ в другие вещества, в результате чего происходит перераспределение электронов и ядер. Сами ядра атомов при этом не меняются:
Химические реакции нельзя путать с физическими процессами. В физических процессах вещества сохраняют свой состав, хотя могут образовывать смеси, изменять внешнюю форму либо агрегатное состояние. Так, превращение воды в пар или лед является физическим процессом, а не химической реакцией. Химическое взаимодействие, в результате которого образуется вода, описывается формулой:
Отличаются химические реакции и от ядерных реакций, в которых происходят изменения в ядрах атомов и образуются атомы новых элементов. В ходе химических процессов новые вещества получаются в результате изменений, происходящих в электронной оболочке атомов.
Выделяют следующие типы химических реакций: реакции соединения, разложения, замещения и обмена.
Реакция соединения представляет собой образование одного сложного вещества в результате соединения двух или более веществ. Например:
В результате реакции разложения происходит распад одного сложного вещества на несколько простых.
Реакция замещения протекает между простыми и сложными веществами, при этом атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Zn + 2HCL = ZnCl₂ + H₂
Реакция обмена возможна между двумя сложными веществами, в результате чего они обмениваются своими составными частями и образуются два новых сложных вещества.
MgO + H2SO₄ = MgSO₄ + H₂O

Существует целый ряд признаков, по которым можно классифицировать химические реакции: по агрегатному состоянию, по изменению степеней окисления реагентов, по тепловому эффекту реакции, по направлению протекания, по наличию катализаторов.
По агрегатному состоянию (газообразному, жидкому, твердому) реагирующих веществ химические реакции подразделяются на гомогенные и гетерогенные. Гомогенные реакции протекают в одной фазе, например, в виде раствора:
HCl + NaOH = NaCl + H₂O
Гетерогенные реакции осуществляются на границе раздела двух фаз. Например, твердое вещество и газ:
По изменению степеней окисления реагентов выделяют окислительно- восстановительные реакции. Окисление – это процесс отдачи электронов, что приводит к увеличению степени окисления. Восстановление – это присоединение электронов и уменьшение степени окисления. Элемент, отдающий электроны, называется восстановителем, а элемент, принимающий электроны, – окислителем. Например, в реакции Fe + CuSO₄ = FeSO₄ + Cu железо отдает два электрона и является восстановителем, а медь принимает два электрона и выступает в качестве окислителя.
По тепловому эффекту химические реакции делятся на экзотермические (сопровождающиеся выделением тепла +Q) и эндотермические (идущие с поглощением тепла -Q).
Яркий пример экзотермических реакций – процесс горения:
CH₄ + 2O₂ = CO₂ + 2H₂O +Q
К эндотермическим реакциям относятся реакции разложения:
CaCO₃ = CaO + CO₂ –Q
По направлению протекания химические реакции бывают обратимыми и необратимыми. Обратимые реакции одновременно протекают в двух противоположных направлениях: H₂ + I₂ = 2HI
Необратимые реакции идут только в одном направлении: 2Mg + O₂ = 2MgO
По наличию катализаторов (веществ, участвующих в реакции, изменяющих ее скорость, но остающихся неизменными после завершения реакции) химические реакции подразделяются на каталитические (протекающие в присутствии катализаторов) и некаталитические (идущие без катализаторов). В уравнениях каталитических реакций химическая формула катализатора записывается над знаком равенства или обратимости.
Скорость химической реакции показывает, как изменяется концентрация реагирующих веществ в единицу времени. Скорость реакции тем выше, чем больше количество реагирующих веществ и чем меньше время самой реакции. Данные процессы изучаются специальным разделом химии – химической кинетикой.
Скорость химических реакций зависит от следующих условий: наличие катализатора, степень измельченности реагирующих веществ, давление и температура, природа веществ, вступающих в реакцию, концентрация реагентов.
В соответствие с правилом Вант-Гофа в случае возрастания температуры на каждые 10 градусов по Цельсию скорость химической реакции увеличивается в 2-4 раза.
В результате химических реакций происходит превращение одних веществ в другие. При этом изменяются не только сами вещества, но и их свойства. Такие изменения и являются признаками химических реакций. К ним относятся:
- Яркое свечение и выделение или поглощение тепла

Скорость химической реакции зависит от целого ряда факторов.
1. Природа веществ, вступающих в химическую реакцию. Так, чем активнее металл, тем он быстрее окисляется и более бурно взаимодействует с водой. Знание природы реагирующих веществ позволяет предсказать скорость протекания химической реакции.
2. Концентрация реагентов. Чем выше их концентрация, тем больше скорость реакции, поскольку с увеличением концентрации возрастает количество столкновений молекул реагирующих веществ. Например, горение в чистом кислороде идет гораздо активнее, чем на воздухе, так как концентрация кислорода в воздушной среде в пять раз ниже.
3. Площадь поверхности реагирующих веществ. Чем эта площадь больше, тем выше скорость реакции. Твердые вещества поэтому измельчают, а жидкости – распыляют. К примеру, если кусок мрамора превратить в порошок, то его реакция с соляной кислотой намного ускорится.
4. Температура. Повышение температуры на каждый градус ведет к возрастанию скорости реакции. Это связано с увеличение числа активных молекул, имеющих повышенную энергию, способствующую вступлению веществ в химическую реакцию.
5. Давление. Оно оказывает существенное воздействие на скорость реакции в газообразном состоянии. При увеличении давления скорость реакции возрастает, что объясняется повышением концентрации молекул реагирующих веществ.
6. Катализатор. Скорость реакции увеличивается в присутствии специальных веществ – катализаторов. Они образуют промежуточные вещества, которые более активно реагируют между собой. При этом сам катализатор в процессе реакции не расходуется. Существуют также вещества, замедляющие процесс реакции (ингибиторы).

С помощью этого видеоурока учащиеся рассмотрят основные признаки химических реакций: образование осадка, выделение газа, изменение цвета, выделение или поглощение теплоты.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Признаки химических реакций"
Химические реакции – это превращения одних веществ в другие, которые сопровождаются явлениями, называемыми признаками химических реакций.
Основными признаки химических реакций являются:
· выделение или поглощение теплоты;
· выпадение и растворение осадка.
Рассмотрим каждый из этих признаков.

Рассмотрим ещё один опыт, в ходе которого происходит изменение цвета раствора. В одном стакане у нас находится фиолетово-розовый раствор, который представляет собой раствор перманганата калия в щелочной среде, а во втором стакане – оранжевый раствор, который представляет собой подкисленный раствор дихромата калия. Добавляем в каждый стакан бесцветный раствор сульфита натрия. В первом стакане раствор становится зелёного цвета, во втором – также приобретает зелёную окраску.
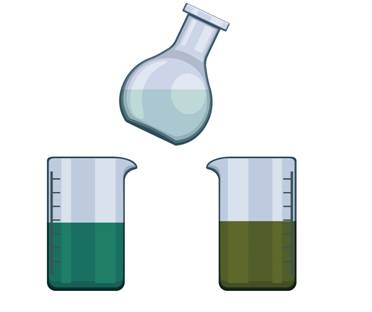
В стакан с водой добавим несколько кристалликов перманганата калия, а затем сюда же поместим таблетку аскорбиновой кислоты. Перемешаем всё. Раствор становится бесцветным. Во всех этих опытах мы наблюдали изменение цвета.

В газовых зажигалках можно увидеть бесцветную жидкость, которая является смесью двух газов: пропана и бутана. Здесь они в жидком состоянии, потому что находятся под высоким давлением. Если нажать на кнопку зажигалки, послышится характерное шипение – это газы вырываются наружу. Происходит реакция горения пропана и бутана.

Таким образом, переход пропана и бутана в жидкое состояние – это физическое явление, а горение этих газов – химическое. В данном эксперименте мы наблюдали выделение света и тепла – это также признаки химических реакций.
Рассмотрим ещё один признак химической реакции – образование и растворение осадка. В два химических стакана, содержащих бесцветный раствор гидроксида натрия и желтоватый раствор жёлтой кровяной соли, добавим раствор хлорида железа. В первом стакане образуется осадок бурого цвета, а во втором – осадок синего цвета.

Если в первый стакан с бурым осадком добавить соляную кислоту, то осадок начинает растворяться.
Благодаря образованию нерастворимого вещества карбоната кальция в результате химических превращений в пещерах растут сталактиты и сталагмиты. Такие процессы длятся тысячелетиями.

Рассмотрим ещё один признак химической реакции – образование газа. В пробирку с кусочками мрамора добавим соляной кислоты. Происходит бурное выделение пузырьков газа.
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите "Нет".
Укажите реальные данные, иначе мы не сможем с вами связаться! Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Читайте также:

