Природные источники алканов кратко
Обновлено: 05.07.2024
Рассмотрим получение и химические свойства алканов. В промышленности основным исходным сырьем для получения алканов служат такие природные источники как нефть и природный газ. Нефть – сложный природный объект, основную массу которого составляют углеводороды (УВ) трех гомологических рядов – алканы, циклоалканы и арены, однако наиболее широко представлены углеводороды смешанного гибридного строения. В составе различных фракций нефти содержатся алканы с числом углеродных атомов от 5 до 30. На 95% природный газ состоит из метана, остальные 5% — примесью этана и пропана.
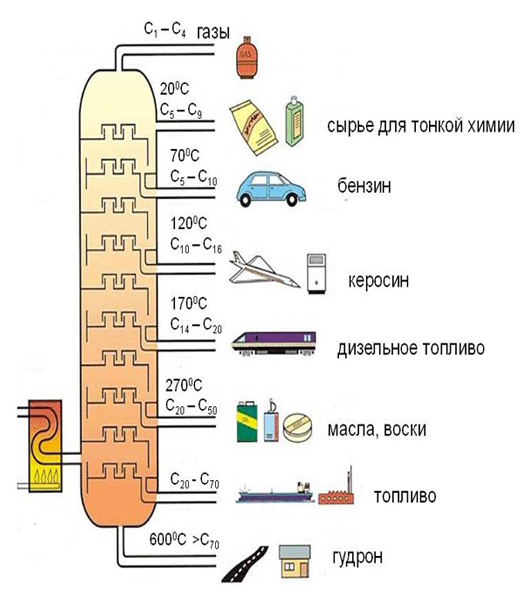
Алканы выделяют из сырья путем фракционной перегонки, основанной на разности температур кипения. Однако выделение чистых индивидуальных алканов является сложным процессом, поэтому чаще всего получают их смеси. Другим способом их получения является крекинг — термическое разложение углеводородов, в результате которого в углеводородной цепи соединений с более высокой молекулярной массой происходит разрыв углерод-углеродной связи с образованием соединений с более низкой молекулярной массой.
Различают термический крекинг и каталитический крекинг.
Термический крекинг был открыт русским инженером В.Г. Шуховым в 1891 г. Термический крекинг проводят при температуре 450–700 o С. При этом происходит разрыва С–С связей высококипящих алканов с образованием более низкокипящих алканов и алкенов:
При температуре более 1000°С происходит разрыв как С–С связей, так и более прочных С–Н связей.
Каталитический крекинг осуществляется при температуре 500°С, атмосферном давлении в присутствии катализаторов (чаще всего оксидов алюминия и кремния). В этом случае разрыв связей молекул сопровождается реакциями изомеризации и дегидрирования.
Синтетические методы получения алканов
1.Гидрирование ненасыщенных углеводородов.
Реакцию осуществляют в присутствии катализаторов (Ni, Pd) при нагревании:
2.Дегалогенирование моногалогенпроизводных алканов.
В присутствии металлического натрия нагревание моногалогензамещенных алканов приводит к образованию алканов с удвоенным числом атомов углерода (реакция Вюрца):
3.Сплавление безводных солей карбоновых кислот с щелочами. При получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
4.Получение смеси алканов из синтез-газа (СО + Н2):
5.Электролиз раствора солей карбоновых кислот (синтез Кольбе).
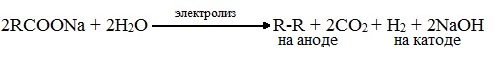
При электролизе солей карбоновых кислот на аноде выделятся соответствующий алкан и углекислый газ, на катоде — водород и щелочь
Получение метана
1. Действие на раскаленную медь смеси сероводорода и сероуглерода:
2. Нагревание до 1200 градусов смеси водорода и углерода (а в присутствии никелевого катализатора до 475 градусов):
Та же самая реакция протекает в горящей в атмосфере водорода электрической дуге.
3. Взаимодействие карбида алюминия с водой:
4. Нагревание смеси щелочи и ацетата натрия:
5. Взаимодействие водорода и оксида углерода (II):
Химические свойства алканов
1.Реакция дегидрирования (протекает при повышенной температуре в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO):
2СН4 → CH≡CH+ H2 (катализатор — С, 1500°С)
2.Реакция дегидроциклизации (протекает при повышенной температуре в присутствии катализаторов):

3.Реакция изомеризации (протекает при повышенной температуре в присутствии катализатора):

4.Крекинг (нагрев до высоких температур без доступа воздуха):
5.Окисление:
Неполное окисление алканов используют для получения карбоновых кислот, кетонов, альдегидов, спиртов:
бутан уксусная кислота
Действие кислорода воздуха в присутствии солей марганца на алканы с числом атомов углерода в цепи более 25 приводит к образованию смеси карбоновых кислот, среднее число атомов углерода в цепи которых составляет 12-18.
Полное окисление алканов (горение) –это экзотермическая реакция, которая сопровождается разрывом всех С-С и С-Н связей:
Низшие алканы (метан, этан, пропан, бутан) – легко воспламеняются, увеличение углеродной цепи алканов ведет к затруднению их горения, что объясняется недостатком кислорода воздуха, необходимого для полного окисления всего углерода. При этом происходит горение с образованием копоти, угарного газа.
СН4 + H2O → CO + 3H2 (катализатор — Ni, 800°С)
7. Реакция замещения (SR)
Замещение атома водорода происходит по радикальному механизму. Вначале преимущественно замещается третичный атом углерода, затем вторичный и первичный.
- Реакция галогенирования алканов возможна только при действии света или высокой температуры. При этом образуются галогеналканы:

Реакция продолжается до тех пор, пока не израсходуется один из реагентов. При большом количестве галогена в результате реакции образуется смесь продуктов замещения 2-х, 3-х и т.д. атомов водорода
Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь).
Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум.
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом.
В промышленности
1. Получение алканов из природных источников (нефть, природный газ)
2. Синтезом на основе водяного газа из оксида углерода (II) и водорода можно получить метан:
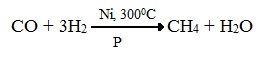
3. Синтезом из водяного газа (СО+Н2) получают смесь алканов:
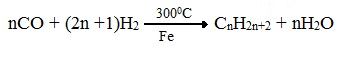
В лаборатории
1. Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):
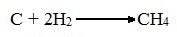
2. Гидролиз карбида алюминия (получение метана)


3. Взаимодействие карбида алюминия с сильными кислотами
5. Каталитическое гидрирование (+Н2) непредельных углеводородов
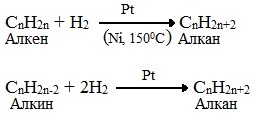
6. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
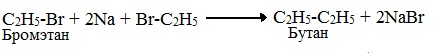
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
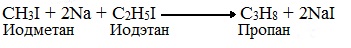
7. Электролиз растворов солей карбоновых кислот (реакция Кольбе)
Рубрики: Алканы Теги: Алканы
Юрий, спасибо) Исправила)
Добрый день, спасибо за материал и за труд, но есть неточность в реакции Дюма — от щелочи переходит протон, а у вас показано, что остается ОН целиком.
Алканы — предельные (насыщенные, парафиновые) углеводороды, то есть органические соединения, состоящие из углерода и водорода, не имеющие двойных, тройных связей. Основополагающий вывод теории химического строения А. М. Бутлерова о связи между строением и свойствами лежит в основе нашего рассмотрения отдельных классов органических соединений. С той или иной степенью полноты такая взаимосвязь прослеживается в рамках матрицы свойств-признаков, которая может иметь вид, представленный в табл. 9-1.
Практическое значение алканов
Понятны в этой связи две основные области применения алканов — в качестве высококалорийного топлива, прежде всего моторного, потребность в котором постоянно растет в мире, и как важнейшее промышленное сырье для получения самых разнообразных химических продуктов.
В обоих качествах алканам в ближайшее время приемлемой альтернативы нет. В ряду углеродсодержащих органических природных продуктов (уголь, торф, древесина, нефть, газ) последние два наиболее насыщены водородом и являются по этой причине наиболее удобным и дешевым сырьем в органическом синтезе. Переход промышленности органического синтеза на это сырье в первой половине XX века позволил качественно обновить и расширить ассортимент химической продукции, значительно снизив ее себестоимость.
Нахождение алканов в природе
Основными источниками алканов в природе являются нефть и природный газ. Нефть представляет собой сложную смесь органических соединений, состоящую в основном из алканов, циклоалканов, ароматических углеводородов; алкены в нефти почти никогда не содержатся. Ее состав сильно варьирует в зависимости от месторождения. Например, алканы в очень большом количестве содержатся в пенсильванской (США), татаро-башкирской, грозненской (Россия) нефти, циклоалканы — в бакинской, в уральской нефти много ароматических углеводородов. Природный газ содержит главным образом метан, а попутный нефтяной газ — в основном метан, а также другие летучие алканы — этан, пропан, бутан, изобутан.
Строение алканов
Алканы содержат химические связи двух типов: С-С и С-Н . Это типичные ковалентные двухцентровые, двухэлектронные, неполярные химические связи. Прочность связей С-С и С-Н (табл. 9-3) зависит от типа атома углерода, у которого происходит разрыв связи.
Наименее прочной она является у третичного атома углерода, что делает такую связь наиболее уязвимой при химических реакциях. Дипольный момент алканов равен нулю, что свидетельствует о неполярном характере связей С-Н и С-С . Межмолекулярные взаимодействия алканов включают главным образом дисперсионную составляющую и являются очень слабыми. Это предопределяет для алканов в твердом состоянии молекулярный тип кристаллической решетки и легкость ее разрушения.
Пространственные конформационные изомеры алканов (см. раздел 3.2.3) имеют малый энергетический барьер и в нормальных условиях не могут быть выделены в индивидуальном виде, так как они быстро переходят друг в друга. Однако, поскольку конформационная изомерия проявляется относительно каждой С-С связи, ее суммарное влияние становится заметным.
Физические свойства алканов
Слабостью межмолекулярных взаимодействий обусловлены высокая летучесть и испаряемость низших алканов, очень низкая температура плавления (табл. 9-5). Очевидно закономерное влияние молекулярной массы алканов на температуры плавления и кипения, на плотность, которая даже у полиэтилена и полипропилена, тем не менее, остается меньше единицы. Разветвления цепи, уменьшая межмолекулярные взаимодействия и делая более рыхлой упаковку молекулярной кристаллической решетки, закономерно снижают по сравнению с нормальными (неразветвленными) изомерами температуры кипения, плавления и плотность. Первые четыре члена гомологического ряда алканов в нормальных условиях являются газами, от пентана до пентадекана — жидкостями, начиная с гексадекана — твердые вещества. Для бытовых целей обычно используют пропан-бутановую смесь, которая легко сжижается при небольших давлениях.
Химические свойства алканов
Неполярность связей С-С и С-Н предопределяет в основном гомолитический тип разрыва связей и радикальный характер химических реакций. Вследствие высокой прочности связей С-С и С-Н следует ожидать от алканов химической инертности. В каких же условиях и с какими реагентами алканы способны вступать в химические реакции? Проведем анализ простейшей реакции хлорирования метана:
Принципиальная возможность протекания данной реакции может быть установлена, согласно уравнению (53), для реакции, протекающей в изобарно-изотермических условиях:
ΔG = ΔН – TΔS
Поскольку в результате реакции число частиц не меняется, изменением энтропии ( ΔS ) можно пренебречь, тогда ΔG ≈ ΔН .
Таким образом, для реакции хлорирования метана, согласно (58),
получим уравнение изотермы Вант-Гоффа:
ΔG ~ ΔH = -2,3RTlgK. (87)
Оценим теперь глубину протекания реакции, возможный максимальный выход продуктов реакции. Примем Т= 300 К, R = 8,314 Дж/(К·моль). Тогда согласно (80) имеем:
Очевидно, что реакция практически нацело сдвинута вправо. Известно эмпирическое правило для реакций, в которых изменение энтропии незначительно: если ΔН 1, если ΔН>+63 кДж, то К 6С (тв.) + 7Н2 (газ) С6Н14 (газ)
тепловой эффект ΔН = -167,4 кДж/моль, но К ~ 1.
Хотя реакция хлорирования метана принципиально возможна, тем не менее смесь метана и хлора в темноте в нормальных условиях не реагирует! Такая ситуация объясняется только тем, что велика энергия активации данной реакции. Последнее обстоятельство не позволяет преодолеть энергетический барьер заметному числу исходных молекул.
Любая многостадийная химическая реакция включает медленную, лимитирующую стадию, определяющую скорость реакции. Выявление и изучение такой стадии, анализ факторов, влияющих на ее ход, и являются центральной проблемой для асинхронных процессов. В газовой фазе, где решающим при беспорядочном броуновском движении будет столкновение частиц, более вероятно реализуется асинхронный процесс. Реакция хлорирования метана может начаться с двух реакций, других типов связей нет:
а) Cl2 → Cl • + Сl • ΔHa = +242,7 кДж/моль
При отсутствии внешних воздействий (сольватация и др.) тепловое движение при температурах ниже 100 °С может разрушить связь не прочнее 130 кДж/моль в очень незначительном числе молекул. Вот почему в обычных условиях реакция хлорирования метана не идет! Квант близкого к УФ света имеет энергию порядка 293 кДж/моль. Этой энергии достаточно только для разрыва связи Сl-Сl . Гетеролиз Сl-Сl → Cl + + Cl – невозможен, так как на это требуется 1129,7 кДж/моль в очень незначительном числе молекул. Далее радикал Сl • может реагировать двояким образом:
Очевидна предпочтительность реакции в). Атака радикала хлора на водород метана не требует строгой ориентации. Далее возможен только один вариант взаимодействия:
д) СН • 3 + Сl2 →СН3Сl + Сl • ΔHд = -338,9 + 242,7 = -96,2 кДж/моль
Важной особенностью этого механизма является то, что вместо радикала хлора, расходуемого в реакции в ), появляется другой радикал хлора в реакции д ). Такие процессы называются цепными и имеют три фазы: инициирование, рост цепи и обрыв цепи.
Инициирование обычно осуществляется УФ-, γ-, рентгенол ским облучением, воздействием высоких температур, добавлением активных радикалов, получаемых разложением перекисей или других легко разлагаемых до радикалов соединений.
RO—OR →RO • + RO • ΔН =+146,4 кДж/моль
Обрыв цепи, кроме указанных реакций, возможен на стенках сосуда, при взаимодействии с примесями и т. д. Теоретически одного акта разрыва связи Сl-Сl достаточно для завершения реакции во всем объеме. Однако на самом деле число циклов обычно не превышает 100-10000. Это обусловлено тем, что реакции обрыва цепи идут исключительно быстро, поскольку при этом происходит образование устойчивых молекул из нестабильных радикалов.
Рост цепи доминирует над обрывом в условиях, когда концентрация радикалов мала, то есть вероятность встречи двух радикалов меньше, чем радикала и молекулы (в данном случае — метана). Поэтому необходимо постоянное инициирование. За цикл работ по разработке теории цепных реакций в 1956 году удостоены Нобелевской премии Н. Н. Семенов (Россия) [60] и С.-Н. Хиншелвуд (Англия). Теория цепных реакций оказалась хорошо приложимой к процессам горения, окисления органических соединений, старения полимеров, горения, детонации порохов и взрывчатых веществ, гетерогенного катализа, полимеризации, деления трансурановых элементов и др.
Атомы углерода в алканах находятся в sp 3 -гибридизованном состоянии. В алканах имеются связи С-С и С-Н. В метане имеются только С-Н связи. Связи С-Н образуются путем перекрывания 2s АО атома водорода с sp 3 гибридизованной АО атома углерода. Связи С-С образуются путем перекрывания sp 3 -гибридизованных орбиталей атомов углерода.

Перекрывание атомных орбиталей происходит по линии, связывающей ядра атомов. Такие связи называются -связями.
Направленность -связей в метане – к вершинам правильного тетраэдра под углом 109 0 , что соответствует направленности четырех sp 3 -гибридизованных атомных орбиталей атома углерода.

Длина связи между атомами углерода в алканах 0,154нм, длина связи между атомами углерода и водорода 0,112нм.
Природные источники алканов
Природными источниками алканов являются нефть и природный газ. Природный газ в основном состоит из метана (до 98%), этана, пропана. Эти же газообразные углеводороды растворены в нефти. Метан, выделяющийся в угольных шахтах, называется рудничным газом. В результате гниения целлюлозы без доступа воздуха также образуется метан, который выделяется со дна болот (болотный газ).
При перегонке нефти получаются продукты, представляющие собой смеси углеводородов, содержащих алканы. Такими являются: петролейный эфир (Ткип. 40-75 0 С), бензин (Ткип. 70-180 0 С), керосин (Ткип. 180-230 0 С), дизельное топливо (Ткип. 230-305 0 С) и мазут. При перегонке мазута при пониженном давлении или с водяным паром получают соляровое масло, смазочные масла, вазелин, парафин.
Синтетические способы получения алканов
Гидрирование угля.
Гидрирование угля происходит под действием водорода только в присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) и при высоких температурах (450-470 0 С). Процесс проводят под давлением до 300 атм.:
В результате образуется смесь различных алканов, которая используется в качестве моторного топлива.
Гидрирование двуокиси и окиси углерода.


В присутствии катализатора, содержащего кобальт или железо, при температуре от 180 0 до 300 0 С смесь СО и Н2 реагирует с образованием смеси алканов (синтин).
Взаимодействие галогеналканов с натрием (реакция Вюрца).
Реакция идет через образование промежуточного натрийорганического соединения.
Электролиз солей карбоновых кислот (реакция Кольбе).
В этой реакции анион карбоновой кислоты на аноде отдает электрон (окисляется), образуя свободный радикал, который разлагается на СО2 и алкильный радикал. Алкильные радикалы димеризуются.

Декарбоксилирование карбоновых кислот.
При нагревании солей карбоновых кислот в присутствии щелочей при 250 0 -300 0 С происходит их разложение, и выделяется алкан.

Гидрирование ненасыщенных углеводородов


Химические свойства алканов
Слабая полярность -связей в алканах является причиной их малой реакционной способности. При обычных условиях на них не действуют окислители, восстановители, кислоты и щелочи.
Реакции радикального замещения атомов водорода.
Связи С-Н в алканах при sp 3 -гибридизованном атоме углерода малополярны, поэтому для них характерен гомолитический разрыв с образованием свободных радикалов:

Такой разрыв связей происходит в реакциях галогенирования, нитрования, сульфохлорирования и сульфоокисления.
Гомолитический разрыв связей требует большой энергии активации, поэтому реакции радикального замещения проходят при высоких температурах или при облучении светом.
По уменьшению реакционной способности галогены располагаются в ряд: F2 Cl2 Br2. Иод не реакционноспособен.
Хлорирование и бромирование
При освещении смеси Cl2 (или Br2) и алкана светом подходящей длины волны протекают следующие элементарные реакции.
а) Инициирование цепной реакции:

Для гомолитического разрыва связи в молекуле хлора требуется 300кДж на 1 моль хлора. Время жизни хлор-радикала 10 -2 сек.
б) Цикл цепной реакции (рост цепи):


Реакции, при которых стадия инициирования приводит к двум или более самоподдерживающимся реакциям (рост цепи), заканчивающиеся обрывом цепи, называются цепными. Реакция не останавливается на стадии получения только монохлорпроизводного:

По энергии С-Н связи в алканах отличаются друг от друга:
Тип связи Энергия связи (Е, кДж/моль)
Таким образом, наиболее активными являются С-Н связи при третичном атоме углерода.
При взаимодействии алканов с фтором выделяется большое количество тепла, что приводит к расщеплению С-С связей.
В связи с этим фторирование алканов проводят при разбавлении фтора азотом.
При взаимодействии алканов с разбавленной азотной кислотой или оксидами азота при нагревании происходит замещение атомов водорода на нитро-группу, и образуются нитроалканы (метод Коновалова).


Алканы взаимодействуют с SO2 и O2 при ультрафиолетовом облучении. В результате образуются алкансульфокислоты.

Реакции алканов с кислородом.
а) В присутствии кислорода воздуха алканы легко сгорают с образованием СО2 и Н2О и выделением большого количества тепла (46000-50000 кДж/кг). Эта реакция широко используется в энергетических целях. Такое сгорание происходит в двигателях всех типов. В двигателе внутреннего сгорания при сжатии смеси паров бензина с воздухом нормальные углеводороды образуют перекиси, вызывающие преждевременное воспламенение (без участия запальной свечи). Это явление называется детонацией и причиняет вред, так как способствует изнашиванию двигателя. Разветвленные алканы лишены этого недостатка. Особенно ценны в качестве моторного топлива углеводороды, имеющие четвертичный углеродный атом (с неоструктурой), например:

н-гептану – 0. Бензин сравнивают со смесью, содержащей а% изооктана и (100-а)% н-гептана. При одинаковом поведении обеих проб в двигателе бензину приписывают октановое число а.
Смеси газообразных алканов с кислородом взрывоопасны.
б) Окислением алканов в газообразной или в жидкой фазе воздухом или кислородом в присутствии катализаторов могут быть получены продукты частичного окисления, в основном, карбоновые кислоты.
Пример: окисление н-бутана при 80-100 0 С, давлении 400атм, в присутствии в качестве ктализатора солей марганца или оксидов металлов (MnO2).


Реакция проходит с разрывом углерод-углеродных цепей.

в) Окислительный пиролиз метана.

г) Конверсия метана.

Эта реакция является главным источником СО и Н2, которые широко применяются в промышленных синтезах.
Термические превращения алканов.
При температуре выше 500 0 С алканы распадаются с выделением водорода и образованием углеводородов с более низкой молекулярной массой. Присутствие катализаторов уменьшает температуру распада. В этих реакциях происходит гомолитический разрыв связей С-С и С-Н. Термические превращения алканов называют крекингом. Термический и каталитический крекинг широко применяется в промышленности.
Труднее всего превращается метан.

Алканы с более длинной углеводородной цепью образуют ненасыщенные углеводороды или распадаются на углеводороды с меньшей молекулярной массой.


Алканы с шестью и более углеродными атомами в присутствии катализаторов способны к циклизации и образованию бензола и его производных – ароматических углеводородов.

Эта реакция называется дегидроциклизацией или ароматизацией.
Читайте также:

