Применение водорода кратко химия
Обновлено: 30.06.2024
Водород (H, лат. hydrogenium) — является химическим элементом периодической системы с обозначением H и атомным номером 1, представляет собой самым легкий из элементов периодической таблицы.
Водород соответствует главной подгруппе I группы и располагается в первом периоде периодической системы химических элементов Д.И. Менделеева. Элемент является наиболее распространенным во Вселенной. Из водорода состоит около 75% всей барионной массы. Звезды, за исключением компактных, в основном состоят из водородной плазмы.
В основном состоянии водород характеризуется следующей электронной схемой:
Первый энергетический уровень атома водорода (он же внешний) содержит один неспаренный электрон в основном энергетическом состоянии. Атом водорода обладает степенями окисления — от -1 до +1. Характерные степени окисления -1, 0, +1.
Известны три изотопа водорода, в отличие от изотопов других элементов они имеют собственные названия:
- протий 1 Н ;
- дейтерий 2 Н (обозначается также D );
- тритий 3 Н (T, является радиоактивным).
Ядро протия, который является наиболее распространенным изотопом водорода, включает в себя лишь один протон и не имеет нейтронов, ядро дейтерия содержит один протон и один нейтрон, ядро трития — один протон и два нейтрона.
В стандартных условиях при обычной температуре и давлении простое вещество водород представляет собой нетоксичный двухатомный газ без цвета, запаха и вкуса. Химическая формула газообразного вещества H 2 . Смешиваясь с воздухом или кислородом, водород приобретает свойства горючести, пожаро- и взрывоопасности. Вещество также взрывоопасно при наличии окисляющих газов, в том числе, фтора или хлора.
В связи с легкостью формирования ковалентных связей водородом с большинством неметаллов, большая часть данного вещества на нашей планете представлена в виде разнообразных соединений, к примеру, воды или органических веществ. Водород имеет большое значение для реализации кислотно-основных реакций, растворяется в этаноле и таких металлах, как:
- железо;
- никель;
- палладий;
- титан;
- платина;
- ниобий.
История открытия
В XVI и XVII столетиях, отмеченных эпохой становления химии как науки, наблюдали явление высвобождения горючего газа в процессе взаимодействия кислот и металлов. Впервые водород удалось синтезировать Парацельсу в XVI веке путем погружения стружки железа в серную кислоту. В 1671 году Робертом Бойлем была подробно описана химическая реакция между железной стружкой и разбавленными кислотами. Результатом такого процесса являлось выделение газообразного водорода.
Распространенность в природе
В настоящее время водород является самым распространенным элементом во Вселенной. На долю водорода приходится примерно 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля других вместе взятых элементов равна приблизительно 0,1 %). Водород представляет собой основную часть звезд и межзвездного газа.
В условиях звездных температур (к примеру, температура поверхности Солнца достигает 6000 °C) водород представлен в форме плазмы. Межзвездное пространство заполнено данным элементом в виде отдельных молекул, атомов и ионов. Вещество способно формировать молекулярные облака, которые существенно отличаются размерами, плотностью и температурой.
Массовая доля водорода в земной коре равна 1%. Данный факт позволяет водороду занимать десятое место по распространенности. Следует отметить, что значение элемента в природном мире определено не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна примерно 52%). В связи с этим, роль водорода в химических процессах, которые протекают в жизни нашей планеты, велика и сравнима по значению с кислородом.
Почти весь водород на Земле представлен в виде соединений, что отличает элемент от кислорода, присутствующего на планете и в связанном, и в свободном состояниях. Атмосфера содержит лишь незначительное количество водорода в виде простого вещества (0,00005 % по объему для сухого воздуха). Водород является компонентом почти каждого органического вещества и включен в состав всех живых клеток, где, исходя из числа атомов, на элемент приходится около 63%.
Химические и физические свойства
Физические свойства водорода:
- плотность при нормальных условиях 0,0000899 (при 273 K (0 °C)) г / с м 3 ;
- температура плавления 14,01 K. то есть −259,14 °C;
- температура кипения 20,28 K, то есть −252,87 °C;
- тройная точка 13,96 К (−259,19°C), 7.205 кПа;
- критическая точка 32,24 К, 1,30 МПа;
- удельная теплота плавления 0,117 кДж/моль;
- удельная теплота испарения 0,904 кДж/моль;
- молярная теплоемкость 28,47[4] Дж/(K·моль);
- молярный объем 14 , 1 с м 3 / м о л ь ;
- атомная масса (молярная масса) 1,00811 а. е. м. (г/моль)
Водород представляет собой самый легкий газ, который легче, чем воздух в 14,5 раз. В связи с этим, мыльные пузыри, наполненные водородом, на воздухе поднимаются вверх. Чем меньшей массой обладают молекулы, тем большую скорость они развивают при одинаковой температуре. Являясь самыми легкими, молекулы водорода перемещаются быстрее по сравнению с молекулами любого другого газа. По этой причине они с большей скоростью передают теплоту между объектами. В результате водород характеризуется максимальными показателями теплопроводности в сравнении с другими веществами в газообразном состоянии. Данный показатель приблизительно в 7 раз превышает аналогичные характеристики воздуха.
Водород малорастворим в воде — 18,8 мл/л. Вещество легко растворяется во многих металлах ( N i , P t , P d и других), особенно в палладии (850 объемов H 2 на 1 объем P d ). Растворимость водорода в металлах определяется способностью вещества диффундировать в их кристаллическую решетку. Процесс диффузии через углеродистый сплав (к примеру, сталь) в некоторых случаях протекает, сопровождаясь разрушением сплава из-за химической реакции водорода и углерода. Явление получило название декарбонизации. Водород практически не растворяется в серебре.
Водород в жидком агрегатном состоянии можно встретить в небольшом интервале температур от −252,76 °C до −259,2 °C. Вещество представляет собой жидкость, которая не обладает окраской, характеризуется легкостью (плотность при −253 °C составляет 0,0708 г/ с м 3 ) и текучестью (вязкость при −253 °C равна 13,8 сП). Критические параметры водорода:
- температура −240,2 °C;
- давление 12,8 атм;
- критическая плотность 0 , 0312 г / с м 3 ;
- критический объем 66 , 95 — 68 , 9 с м 3 / м о л ь ( 0 , 033 м 3 / к г ) .
Перечисленные параметры являются причиной возникновения трудностей при сжижении водорода. Твердое вещество обладает температурой плавления −259,2 °C, плотностью 0 , 0807 г / с м 3 (при −262 °C). В твердом агрегатном состоянии водород представляет собой массу, похожую на снег, в виде кристаллов гексагональной сингонии. Относится к пространственной группе P6/mmc, имеет параметры ячейки a = 0,378 нм и c = 0,6167 нм.
В 1935 году Уингер и Хунтингтон выдвинули гипотезу о том, что при повышении давления до 250 тысяч атм возможен переход водорода в металлическое состояние. Синтез данного вещества в устойчивом состоянии сопровождался заманчивыми перспективами его применения как сверхлегкого металла, составного компонента легкого и энергоемкого ракетного топлива.
В 2014 году ученым удалось установить тот факт, что при давлении около 1,5—2,0 млн атм водород приобретает способность к поглощению инфракрасного излучения. Явление подтвердило способность электронных оболочек молекул вещества поляризоваться. Вполне допустимо, что при еще более высоких характеристиках давления водород трансформируется в металл. В 2017 году была зафиксирована информация о вероятном экспериментальном наблюдении трансформации водорода в металлическое состояние при условиях высокого давления.
Спиновые формы молекулярного водорода:
Данные модификации вещества несколько отличаются по следующим параметрам:
- физические свойства;
- оптические спектры;
- характер рассеивания нейтронов.
В молекуле ортоводорода o - H 2 (температура плавления составляет −259,10 °C, температура кипения равна −252,56 °C) спины ядер параллельны, а у параводорода ρ - H 2 (температура плавления −259,32 °C, температура кипения −252,89 °C) — противоположны друг другу (антипараллельны). Равновесная смесь o - H 2 и ρ - H 2 при заданной температуре называется равновесный водород e - H 2 .
Разделение спиновых изомеров водорода возможно путем адсорбции на активном угле при температуре жидкого азота. Если температуры очень низкие, то равновесие между ортоводородом и параводородом практически нацело смещено в сторону параводорода. Это объясняется более низкими энергетическими характеристиками пара-молекулы по сравнению с энергией орто-молекулы. При 80 К соотношение модификаций приближенно соответствует 1:1. Десорбированный с угля параводород в процессе нагрева трансформируется в ортоводород, что сопровождается образованием равновесной смеси.
В условиях комнатной температуры равновесная смесь ортоводорода и параводорода имеет состав 75:25. При отсутствии катализатора взаимное превращение протекает с относительно низкой скоростью. Это позволяет проанализировать свойства модификаций водорода. В том случае, когда межзвездная среда разрежена, характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Водород способен проявлять свойства окислителя и свойства восстановителя. В связи с этим, вещество может вступать в химические реакции и с металлами, и с неметаллами.
Реакция водорода с активными металлами сопровождается образованием гидридов:
При специальных условиях происходит реакция водорода с серой. Результатом химического процесса является образование бинарного соединения сероводорода:
Водород не вступает во взаимодействие с кремнием и фосфором.
Взаимодействие водорода с азотом происходит при нагреве и давлении. Реакция протекает при наличии катализатора и приводит к образованию аммиака:
В специальных условиях (в присутствии катализаторов) протекает реакция водорода с углеродом:
Горение водорода происходит при взаимодействии с кислородом и сопровождается взрывом:
Смесь водорода с кислородом в мольном соотношении 2 : 1 называется гремучим газом.
Водород вступает в химические реакции со сложными веществами, способен восстанавливать металлы из основных и амфотерных оксидов. Водородом можно восстановить из оксида металлы, которые располагаются в электрохимическом ряду напряжений после алюминия. Процесс сопровождается образованием металла и воды.
Взаимодействие водорода с оксидом цинка сопровождается образованием цинка и воды:
Восстановление меди из оксида меди (II) с помощью водорода:
Восстановление водородом оксидов некоторых неметаллов, к примеру, взаимодействие водорода с оксидом кремния:
Со многими органическими веществами водород вступает в реакции присоединения, то есть реакции гидрирования.
Молекулярный водород нашел широкое применение в органическом синтезе и используется с целью восстановления органических соединений. Данные процессы носят название реакций гидрирования. Подобное взаимодействие возможно при наличии катализатора, повышенном давлении и нагреве. В качестве катализатора допустимо использовать гомогенные (к примеру, Катализатор Уилкинсона) и гетерогенные (например, никель Ренея, палладий на угле) вещества.
Каталитическое гидрирование ненасыщенных соединений в виде алкенов и алкинов сопровождается образованием насыщенных соединений — алканов:
Как получить водород, основные реакции
Водород в основном используют для переработки нефтепродуктов и производства аммиака. По большей части вещество промышленным способом получают из природного газа. Остальной объем синтезируют из угля. Около 0,1 % водорода вырабатывают с помощью электролиза.
Конверсия метана с водяным паром при 1000 °C:
Пропускание водяного пара над раскаленным коксом при температуре около 1000 °C:
Электролиз водных растворов солей:
Электролиз водных растворов гидроксидов активных металлов (преимущественно гидроксида калия), уравнение процесса сводится к следующему:
Применяют также промышленный способ электролиза химически чистой воды, исключая какие-либо добавки. Технологическое оборудование, в данном случае, является обратимым топливным элементом, дополненным твердой мембраной из полимерного материала или без нее.
Каталитическое окисление кислородом:
Существуют лабораторные методы синтеза водорода.
Взаимодействие разбавленных кислот с металлами, к примеру, цинка и разбавленной серной кислоты:
Химическая реакция кальция с водой:
Взаимодействие щелочей с цинком или алюминием:
Водород получают путем электролиза водных растворов щелочей или кислот на катоде, к примеру, можно записать следующее уравнение реакции катодного процесса при электролизе раствора кислоты:
Ключевые слова конспекта: химические свойства водорода, применение водорода,
Водород при комнатной температуре малоактивен. При нагревании водород реагирует со многими простыми и сложными веществами.
Реакции соединения
В реакциях с неметаллами водород является восстановителем. При поджигании на воздухе водород сгорает или реагирует с кислородом с взрывом:
2Н2 + О2 = 2Н2O.
При поджигании водород реагирует с газом хлором Сl2 (на ярком свету — с взрывом) с образованием газа хлороводорода НСl.
Н2 + Сl2 = 2НСl.
Реакции с бромом и йодом обратимы и протекают при 400-500 °С.
При температуре 150-200 °С водород реагирует с серой, при этом получается газообразный сероводород:
При более высокой температуре идет заметное разложение сероводорода.
Синтез метана в реакции с графитом проходит при повышенном давлении и 600 °С. При более высокой температуре преобладает обратное направление процесса:
Реакция водорода с азотом протекает достаточно быстро только при 500 °С в присутствии катализатора Fe3O4 при давлении 20-30 МПа:
Летучие водородные соединения, в формулах которых первым стоит Н, называют, прочитывая формулы справа налево: НСl — хлороводород, H2S — сероводород, НВг — бромоводород. Названия веществ СН4 — метан, NH3 — аммиак.
В реакциях с металлами водород оказывается окислителем. При нагревании он реагирует с щелочными и щелочноземельными металлами, образуя гидриды:

В гидридах щелочных и щелочноземельных металлов водород находится в степени окисления -1.
Реакции замещения
При нагревании водород реагирует с оксидами многих металлов. Продукты реакции — свободный металл и вода. Реакции замещения с участием водорода — реакции восстановления:
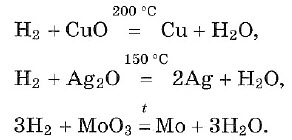
Хром и более активные металлы водородом из соединений не восстанавливаются.
Применение водорода
Раньше водород использовали для наполнения воздушных шаров и дирижаблей. Впоследствии от этого отказались из-за взрыво- и пожароопасности водорода. Сейчас водород — ракетное топливо. Водород необходим для синтеза аммиака NH3 и хлороводорода НСl. С помощью водорода получают особо чистые металлы для полупроводниковой техники. В органической химии с применением водорода получают метиловый спирт СН3ОН, твердые пищевые жиры из растительных масел, синтетическое жидкое топливо. Изотопы водорода — дейтерий 2 D и тритий 3 Т — термоядерное горючее.

История открытия
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы
Водород это газ, молекула его состоит из двух атомов.
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Практическое применение
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Современную промышленность сложно представить без применения технических газов на различных этапах производства. На сегодняшний день водород входит в тройку наиболее востребованных промышленностью газов, уступая лишь кислороду и азоту.
Современную промышленность сложно представить без применения технических газов на различных этапах производства. На сегодняшний день водород входит в тройку наиболее востребованных промышленностью газов, уступая лишь кислороду и азоту.
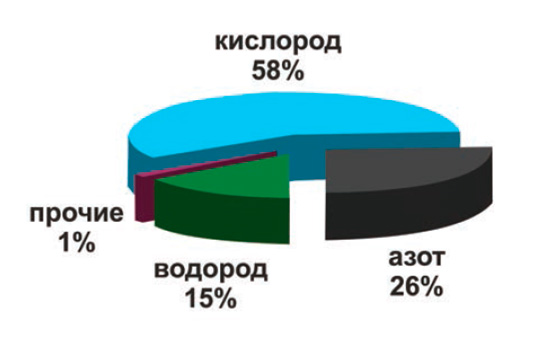 |
| Структура производства промышленных газов в России, % |
Водород относится к числу важнейших видов сырья химической и нефтехимической промышленности. Свойства этого газа обуславливают его применение и в других отраслях промышленности: металлургической, пищевой, стекольной, электронной, электротехнической.
Структура потребления водорода в России в 2013 г.
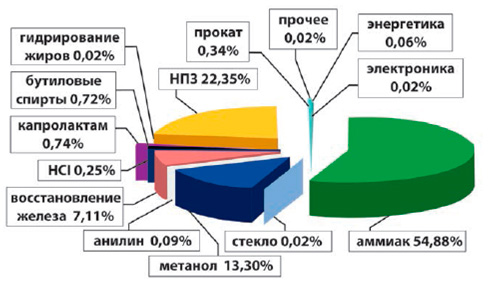
| Аммиак | 54,88% |
| Нефтеперерабатывающие заводы | 22,35% |
| Метанол | 13,30% |
| Восстановление железа | 7,11% |
| Капролактам | 0,74% |
| Бутиловые спирты | 0,72% |
| Прокат | 0,34% |
| HCl | 0,25% |
| Анилин | 0,09% |
| Энергетика | 0,06% |
| Гидрогенизация жиров | 0,02% |
| Электроника | 0,02% |
| Стекло и керамика | 0,02% |
| Прочее | 0,02% |
Химическая промышленность
В России основная область потребления водорода – производство химических продуктов, прежде всего аммиака и метанола.
Лидерами по потреблению водорода являются предприятия, производящие аммиак NH 3 . Сейчас на 28 предприятиях в России используется 2,46 млн.т. водорода в год.
Потребление водорода при синтезе метанола CH 3 OH составило 0,6 млн.т. в 2013 г.
Потребление водорода в остальных сегментах химической промышленности не превышает 90 тыс.т. – 3% от объема потребления.
Нефтеперерабатывающая промышленность
Повышается потребность НПЗ в водороде, необходимом для получения топлив из тяжелого высокосернистого сырья. Огромное количество водорода требуется для установок гидрообессеривания, гидрокрекинга дистиллятов, гидроочистки, изомеризации, производств смазочных материалов. Кроме того, водород на НПЗ используется для активации катализаторов риформинга и регенерации катализаторов изомеризации.
Металлургия
Основной областью применения водорода в металлургии является производство металлизированного сырья методом прямого восстановления железа. Сейчас в этом процессе потребляется около 320 тыс.т. водорода.
Значительные объемы водорода расходуются в технологических процессах прокатного производства (при термической обработке холоднокатаного проката). Потребление водорода – около 15 тыс.т. в год.
Водород на металлургических предприятиях используется также для создания защитной азотно-водородной атмосферы при термообработке труб.
Стекольная промышленность
В стекольной промышленности водород применяется при производстве листового стекла float-методом, а также для получения кварцевого стекла, которое изготавливают плавлением чистого горного хрусталя, кварца или синтетического оксида кремния в водородно-кислородном пламени.
Энергетика
В энергетике водород используется для охлаждения мощных турбогенераторов, благодаря его высокой теплопроводности и коэффициенту диффузии, а также нетоксичности. По оценкам, в энергетике на ТЭЦ, АЭС потребляется около 4-5 тыс.т. водорода в год.
Пищевая промышленность
В пищевой промышленности водород используется в процессах гидрогенизации масел и жиров при получении твердых жиров (маргарина). Объем потребления водорода масложировыми комбинатами оценивается на уровне 1,5 тыс.т. в год.
Среди прочих потребителей водорода – обогатительные комбинаты, заводы, занимающиеся фабрикацией ядерного топлива, предприятия электронной и электротехнической промышленности, транспортные и газовые компании, фармацевтика.
Читайте также:

