Применение оксидов металлов кратко
Обновлено: 02.07.2024
В оксиды металлов они представляют собой неорганические соединения, состоящие из катионов металлов и кислорода. Обычно они содержат огромное количество твердых ионных веществ, в которых оксид-анион (O 2– ) электростатически взаимодействует с частицами M + .
M + Любой катион, происходящий из чистого металла, выглядит следующим образом: от щелочных и переходных металлов, за исключением некоторых благородных металлов (таких как золото, платина и палладий), до самых тяжелых элементов p-блока периодической таблицы ( вроде свинца и висмута).
Почему окисление металла приводит к деградации его поверхности? Это происходит из-за включения кислорода в кристаллическую структуру металла.
Когда это происходит, объем металла увеличивается, а исходные взаимодействия ослабевают, что приводит к разрыву твердого тела. Точно так же эти трещины позволяют большему количеству молекул кислорода проникать во внутренние металлические слои, полностью разъедая деталь изнутри.
Однако этот процесс происходит с разной скоростью и зависит от природы металла (его реакционной способности) и физических условий, которые его окружают. Следовательно, существуют факторы, ускоряющие или замедляющие окисление металла; два из них - наличие влажности и pH.
Аналитически тенденция металла образовывать соответствующий оксид отражается в его потенциалах восстановления, которые показывают, какой металл реагирует быстрее по сравнению с другим.
Золото, например, имеет гораздо больший восстановительный потенциал, чем железо, поэтому оно сияет своим характерным золотым свечением без оксида, который его притупляет.
Свойства неметаллических оксидов
Свойства оксидов металлов различаются в зависимости от металла и того, как он взаимодействует с анионом O 2– . Это означает, что некоторые оксиды имеют более высокую плотность или растворимость в воде, чем другие. Однако все они имеют общий металлический характер, что неизбежно отражается на их основности.
Другими словами: они также известны как основные ангидриды или основные оксиды.
Основность
Основность оксидов металлов можно проверить экспериментально с помощью кислотно-основного индикатора. Как? Добавление небольшого кусочка оксида в водный раствор с некоторым растворенным индикатором; Это может быть сжиженный сок пурпурной капусты.
Имея тогда диапазон цветов в зависимости от pH, оксид превратит сок в голубоватый цвет, соответствующий основному pH (со значениями от 8 до 10). Это связано с тем, что растворенная часть оксида высвобождает ионы ОН. – к среде, которые в указанном эксперименте ответственны за изменение pH.
Второе уравнение - это равновесие растворимости гидроксида M (OH)2. Обратите внимание, что металл имеет заряд 2+, что также означает, что его валентность равна +2. Валентность металла напрямую связана с его склонностью приобретать электроны.
Амфотеризм
Оксиды металлов являются основными, однако не все они имеют одинаковый металлический характер. Откуда вы знаете? Найдите металл M на периодической таблице. Чем дальше вы находитесь от него и в периоды низкой активности, тем более металлическим он будет и, следовательно, тем более основным будет ваш оксид.
Водный комплекс - это не что иное, как координация п молекулы воды с металлическим центром M. Для комплекса M (OH2)6 2+ , металл М 2+ он окружен шестью молекулами воды и может рассматриваться как гидратированный катион. Многие из этих комплексов имеют интенсивную окраску, например, наблюдаемую для меди и кобальта.
Номенклатура
Как называются оксиды металлов? Это можно сделать тремя способами: традиционным, систематическим и стандартным.
Традиционная номенклатура
Чтобы правильно назвать оксид металла в соответствии с правилами, установленными IUPAC, необходимо знать возможные валентности металла M. Самому большому (наиболее положительному) присваивается суффикс -ico к названию металла, в то время как минор, приставка –oso.
Пример: учитывая валентность металла M +2 и +4, его соответствующие оксиды являются MO и MO.2. Если бы M был свинцом, Pb, то PbO был бы оксидом свинца.медведь, и PbO2 оксид свинцаico. Если металл имеет только одну валентность, его оксид обозначается суффиксом –ico. Итак, Na2Или это оксид натрия.
Однако этот тип номенклатуры представляет определенные трудности и обычно используется меньше всего.
Систематическая номенклатура
Он учитывает количество атомов M и кислорода, которые составляют химическую формулу оксида. От них присваиваются соответствующие префиксы моно-, ди-, три-, тетра- и т.д.
Если взять в качестве примера три недавних оксида металлов, PbO представляет собой монооксид свинца; PbO2 диоксид свинца; и Na2Или оксид динатрия. В случае ржавчины Fe2ИЛИ3, его соответствующее название - триоксид дихирона.
Номенклатура акций
В отличие от двух других номенклатур, в этой более важна валентность металла. Валентность обозначается римскими цифрами в скобках: (I), (II), (III), (IV) и т. Д. Оксид металла тогда называют оксидом металла (n).
Применяя номенклатуру акций для предыдущих примеров, мы имеем:
-PbO: оксид свинца (II).
-PbO2: оксид свинца (IV).
-На2О: оксид натрия. Поскольку он имеет уникальную валентность +1, он не указывается.
Расчет числа валентности
Но если у вас нет периодической таблицы с валентностями, как вы можете их определить? Для этого необходимо помнить, что анион O 2– вносит два отрицательных заряда в оксид металла. Следуя принципу нейтральности, эти отрицательные заряды должны нейтрализоваться положительными зарядами металла.
Следовательно, если количество атомов кислорода известно из химической формулы, валентность металла может быть определена алгебраически, так что сумма зарядов равна нулю.
Mn2ИЛИ7 у него семь атомов кислорода, поэтому его отрицательные заряды равны 7x (-2) = -14. Чтобы нейтрализовать отрицательный заряд -14, марганец должен давать +14 (14-14 = 0). Поднимая математическое уравнение, мы получаем:
Число 2 связано с наличием двух атомов марганца. Решение и решение для X, валентности металла:
Как они сформированы?
Влага и pH напрямую влияют на окисление металлов до соответствующих им оксидов. Наличие CO2Кислый оксид, он может быть растворен в воде, покрывающей металлическую часть, в достаточной степени, чтобы ускорить включение кислорода в анионной форме в кристаллическую структуру металла.
Эту реакцию также можно ускорить с повышением температуры, особенно когда желательно получить оксид за короткое время.
Прямая реакция металла с кислородом
Оксиды металлов образуются в результате реакции между металлом и окружающим кислородом. Это может быть представлено химическим уравнением ниже:
Эта реакция протекает медленно, так как кислород имеет прочную двойную связь O = O и электронный перенос между ним и металлом неэффективен.
Однако он значительно ускоряется с увеличением температуры и площади поверхности. Это связано с тем, что необходимая энергия обеспечивается для разрыва двойной связи O = O, и, поскольку имеется большая площадь, кислород равномерно перемещается по металлу, одновременно сталкиваясь с атомами металла.
Чем больше количество реагирующего кислорода, тем выше валентность или степень окисления металла. Зачем? Потому что кислород забирает у металла все больше и больше электронов, пока не достигнет максимальной степени окисления.
Это можно увидеть, например, для меди. Когда кусок металлической меди реагирует с ограниченным количеством кислорода, образуется Cu.2O (оксид меди (I), оксид меди или оксид дикобра):
4Cu (ов) + O2(г) + Q (тепло) => 2Cu2O (s) (красный сплошной)
Но когда он вступает в реакцию в эквивалентных количествах, получается CuO (оксид меди (II), оксид меди или монооксид меди):
2Cu (т) + O2(г) + Q (тепло) => 2CuO (s) (черное твердое вещество)
Реакция солей металлов с кислородом
Оксиды металлов могут образовываться в результате термического разложения. Чтобы это стало возможным, из исходного соединения (соли или гидроксида) должны высвободиться одна или две небольшие молекулы:
Отметим, что H2O, CO2, НЕТ2 я2 высвобождающиеся молекулы.
Приложения
Из-за богатого состава металлов в земной коре и кислорода в атмосфере оксиды металлов обнаруживаются во многих минералогических источниках, из которых можно получить прочную основу для производства новых материалов.
Каждый оксид металла находит очень специфическое применение, от питательного (ZnO и MgO) до цементных добавок (CaO) или просто в качестве неорганических пигментов (Cr2ИЛИ3).
Некоторые оксиды настолько плотны, что контролируемый рост их слоев может защитить сплав или металл от дальнейшего окисления. Исследования даже показали, что окисление защитного слоя продолжается, как если бы это была жидкость, покрывающая все трещины или поверхностные дефекты металла.
Оксиды металлов могут принимать удивительные структуры в виде наночастиц или крупных полимерных агрегатов.
Этот факт делает их объектом исследований для синтеза интеллектуальных материалов из-за их большой площади поверхности, которая используется для разработки устройств, реагирующих на наименьшие физические воздействия.
Точно так же оксиды металлов являются сырьем для многих технологических применений, от зеркал и керамики с уникальными свойствами для электронного оборудования до солнечных батарей.
Примеры
Оксиды железа
2Fe (ы) + O2(g) => 2FeO (s) оксид железа (II).
6FeO (ов) + O2(г) => 2Fe3ИЛИ4магнитный оксид (ы) железа.
Вера3ИЛИ4, также известный как магнетит, представляет собой смешанный оксид; Это означает, что он состоит из твердой смеси FeO и Fe.2ИЛИ3.
Оксиды щелочных и щелочноземельных металлов
-CaO: оксид кальция.
-MgO: оксид магния.
-BeO: оксид бериллия (амфотерный оксид)
Оксиды группы IIIA (13)
Элементы IIIA группы (13) могут образовывать оксиды только со степенью окисления +3. Таким образом, они имеют химическую формулу M2ИЛИ3 и его оксиды следующие:
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений.
Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы), состоящие из одного вида атомов и сложные , состоящие из нескольких видов атомов .
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли.
По наличию в составе молекулы одновалентных гидроксильных групп ОН (I) выделяют неорганические вещества под названием "гидроксиды".
ОКСИДЫ
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентностью II . Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF 2 .
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксидыметаллов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII . Например, CrO 3 -оксид хрома (VI), Mn 2 O 7 - оксид марганца (VII)):
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV , а также цинк и бериллий (Например, BeO, ZnO, Al 2 O 3 , Cr 2 O 3 ).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
Растворимы в воде.
Исключение – SiO 2
Основные оксиды
Амфотерные оксиды
С водой не взаимодействуют. В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
2. Даны вещества: CaO, NaOH, CO 2 , H 2 SO 3 , CaCl 2 , FeCl 3 , Zn(OH) 2 , N 2 O 5 , Al 2 O 3 , Ca(OH) 2 , N 2 O, FeO, SO 3 , Na 2 SO 4 , ZnO, CaCO 3 , Mn 2 O 7 , CuO, KOH, CO, Fe(OH) 3 . Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe 2 O 3 и др.), некоторые - жидкости (Н 2 О, Сl 2 О 7 и др.) и газы (NO, SO 2 и др.).
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Химические формулы оксидов и их названия Вам уже известно, что оксиды – это бинарные соединения, в состав которых обязательно входит химический элемент кислород.
На сегодняшний день получены оксиды всех существующих в природе химических элементов кроме трех: гелия, неона и аргона.
Рассмотрим химические формулы оксидов, с которыми мы уже встречались:
CO2, SO2, Fe3O4 и т.д.
Как видно, в формулах оксидов на первом месте принято записывать химический символ элемента, который образует оксид, а на втором – химический символ кислорода. Попробуем вывести общую формулу для оксидов, то есть формулу, при помощи которой можно составить формулу оксида любого элемента. Элемент, образующих оксид, будем обозначать буквой R, а его валентность в оксиде, как х.
С учетом того, что валентность кислорода равна II, получим:
Итак, общая формула оксидов:
Рассмотрим пример. Необходимо составить формулы оксидов серы, в которых сера проявляет валентность IV и VI. Получаем: В тех случаях, когда оксид образован химическим элементом с переменной валентностью, после названия оксида, в скобках, римской цифрой указывается валентность элемента в данном оксиде.
Например:
SO2 – оксид серы (IV), SO3 – оксид серы (VI). Если валентность химического элемента постоянна, естественно, он может образовать с кислородом только один оксид. В таких случаях валентность в скобках после названия не указывается. Например: ZnO – оксид цинка
Классификация оксидов
Оксиды – весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд природных пигментов. Оксидами также является класс минералов, представляющих собой соединения металлов с кислородом. Самым распространенным оксидом в земной коре является минерал кварц, его систематическое название – оксид кремния (IV) – SiO2. Этот оксид образует множество различных минералов, которые геологи объединяют в минералы группы кварца.
По своему агрегатному состоянию оксиды могут быть газообразными: углекислый газ CO2, сернистый газ SO2 – эти газы бесцветны. А оксид азота (IV) NO2 – газ коричневого цвета.
Оксидов – жидкостей в обычных условиях сравнительно немного. Примеры таких оксидов: вода – оксид водорода, оксид марганца (VII) Mn2O7, оксид хлора (VII) Cl2O7, оксид хлора (VI) ClO3.
Большинство оксидов – твердые вещества, имеющие молекулярное или ионное строение.
Оксиды металлов имеют ионное строение. В кристаллических решетках оксидов металлов находятся ионы кислорода O2− и ионы соответствующего металла. Оксиды неметаллов, как правило, имеют молекулярное строение. На рисунке 139 приведена модель молекулы оксида фосфора (V).
Химическая формула оксида фосфора (V), которую мы уже записывали не раз – P2O5.
На самом деле это эмпирическая, простейшая формула. Истинная химическая формула, которая реально отвечает строению оксида фосфора (V) – P4O10 Существуют оксиды и атомного строения. К таким оксидам относятся оксид бора B2O3, оксид кремния (IV) SiO2. Кристаллические решетки этих оксидов состоят из атомов.
Применение оксидов
Многие оксиды нашли разнообразное применение в различных сферах деятельности человека. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически нерастворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды. TiO2 добавляют в качестве наполнителя в мыло, лекарственные препараты, которые выпускаются в виде таблеток.
Оксид хрома (III) – Cr2O3 – кристаллы темно-зеленого цвета (см. рисунок 138, а), нерастворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это далеко не единственное их применение Оксиды неметаллов так же имеют широкое применение. Углекислый газ, или оксид углерода (IV) – CO2 применяется как наполнитель углекислотных огнетушителей, так как данный оксид негорюч. Сернистый газ, или оксид серы (IV) – SO2 применяется в качестве дезинфицирующего вещества для зернохранилищ. Как вы уже заметили, множество химических веществ имеют тривиальные названия. Ниже приведены тривиальные названия некоторых оксидов:

Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
О чем эта статья:
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:

Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.

Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
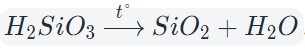
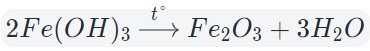
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Читайте также:

