Предельные одноатомные спирты их строение свойства получение и применение этилового спирта кратко
Обновлено: 05.07.2024
Предельные одноатомные спирты – это органические вещества, состоящие из радикала предельного углеводорода и функциональной гидроксильной группы (–OH).
Общая формула предельных одноатомных спиртов: CnH 2n + 1– OH или R-OH.
Физические свойства. Низшие спирты до C12H25 -OH – жидкости, а высшие – твердые вещества. Низшие спирты хорошо растворимы в воде. По мере увеличения молекулярной массы спирта растворимость уменьшается. Метиловый спирт - сильный яд! Этиловый спирт - медленно действующее наркотическое вещество, вызывающее постепенное отравление организма (действует на печень и мозг, рождение умственно отсталых детей). Метанол, этанол и пропанол-1 имеют алкогольный запах!
Химические свойства.
Свойства спиртов определяются функциональной гидроксильной (–ОН) группой.
· Водные растворы спиртов не действуют на индикаторы, они нейтральны.
· спирты подобно воде реагируют с активными металлами:
этанол натрий этилат натрия водород
· в присутствии конц. серной кислоты спирты реагируют с галогеноводородными кислотами, при этом образуются галогенопроизводные углеводородов:
этанол соляная к-та хлорметан вода
· дегидратация спиртовв присутствии водоотнимающих средств (конц. H2SO4):
· взаимодействуют с кислотами с образованием сложных эфиров.
· cпирты горят с образованием углекислого газа и воды:
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожениеорганических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.003)

Строение
Общая формула предельных одноатомных спиртов – CnH2n+1-OH. Гидроксил является функциональной группой и определяет физические и химические свойства спиртов.
Основные одноатомные спирты (гомологический ряд метанола):
Насыщенным спиртам свойственна структурная и межклассовая изомерия. В зависимости от расположения гидроксильной группы в молекуле вещества различают:
- первичные спирты – гидроксил прикреплён к первому атому углерода;
- вторичные спирты – гидроксил находится у второго атома углерода;
- третичные спирты – гидроксил соединён с третьим атом углерода.
Начиная с бутанола, наблюдается изомерия углеродного скелета. В этом случае название спирта записывается с двумя цифрами: первая указывает на положение метильной группы, вторая – гидроксила.
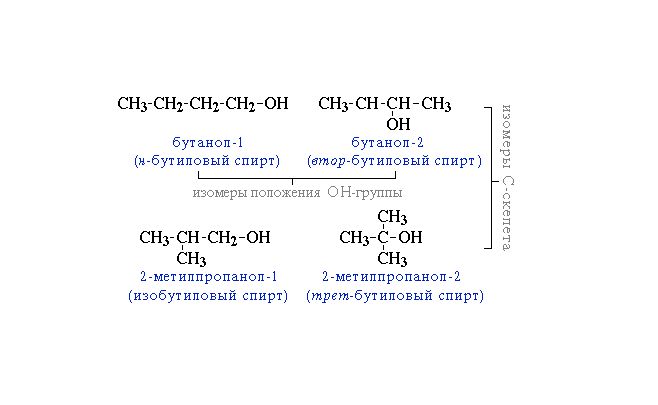
Рис. 2. Изомерия углеродного скелета насыщенных спиртов.
Одноатомные спирты образуют межклассовые изомеры с простыми эфирами – этиловый спирт (CH3CH2-OH), диметиловый эфир (CH3-O-CH3).
Несмотря на то, что пропанол содержит три атома углерода, он может образовывать только два изомера по гидроксильной группе – пропанол-1 и пропанол-2.
Свойства
В зависимости от количества атомов углерода меняется агрегатное состояние одноатомных спиртов. Если в молекуле до 15 атомов углерода, то это жидкость, больше 15 – твёрдое вещество. Хорошо смешиваются с водой первые два спирта из гомологического ряда – метанол и этанол, а также структурный изомер пропанол-2.
Активность спиртов объясняется наличием О-Н и С-О связей, которые легко разрываются. Основные химические свойства одноатомных спиртов приведены в таблице.
Реакция
Описание
Уравнение
Реагируют только со щелочными и щелочноземельными металлами с разрывом связи О-Н
Горят в присутствии перманганата или дихромата калия (KMnO4, K2Cr2O7)
Гидроксильная группа вытесняется галогеном
Реагируют с минеральными и органическими кислотами с образованием сложных эфиров
С оксидами металлов
Качественная реакция с образование альдегида
Протекает в присутствии сильной кислоты при высокой температуре
С карбоновыми кислотами
Реакция этерификации – образование сложных эфиров

Рис. 3. Качественная реакция одноатомных спиртов.
Одноатомные спирты имеют широкое применение в промышленности. Наиболее активно применяется этанол. Его используют для изготовления парфюмерии, уксусной кислоты, лекарств, лаков, красителей, растворителей и других веществ.
Что мы узнали?
Из урока химии узнали, что предельные или насыщенные одноатомные спирты являются производными предельных углеводородов с одной гидроксильной группой (гидроксилом). Это жидкости или твёрдые вещества в зависимости от количества атомов углерода. Одноатомные спирты образуют изомеры по гидроксильной, метильной группе и с простыми эфирами. Предельные одноатомные спирты реагируют со щелочными металлами, кислотами, оксидами. Используются для изготовления лекарств, растворителей, кислот.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
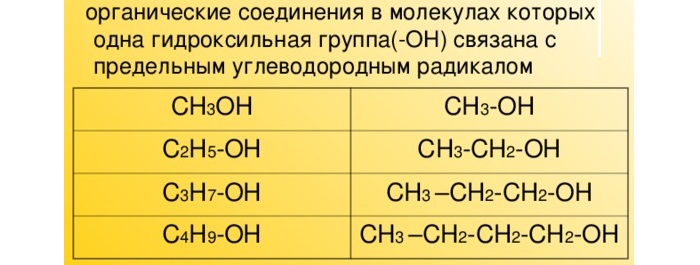
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
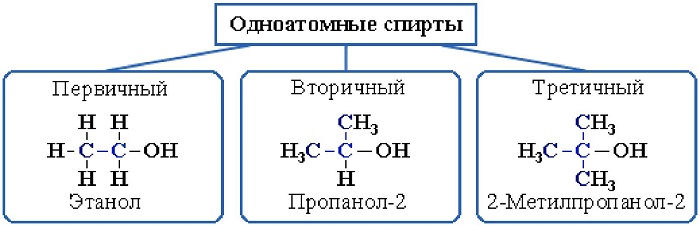
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
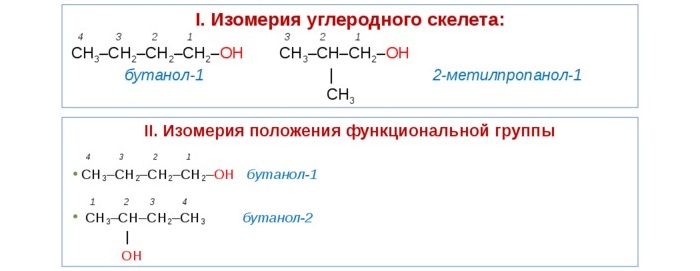
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.

Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
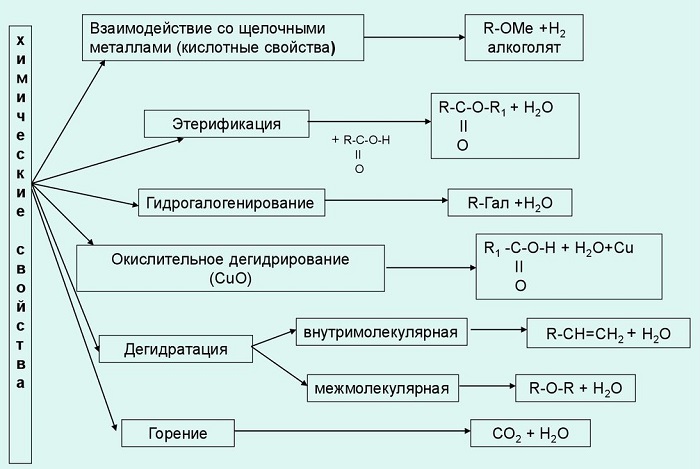
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт - сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение

Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
3. Восстановление кетонов:
4. Этанол получают путем разложения глюкозы:
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
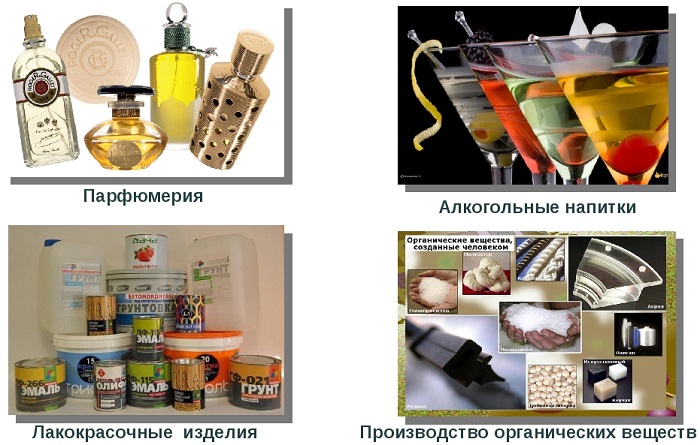
Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.

Одноатомные спирты
Ключевые слова конспекта: Функциональная группа. Спирты. Предельные одноатомные спирты. Изомерия положения функциональной группы. Водородная связь. Реакция этерификации.
Этиловый спирт и его действие на организм
Изготавливать алкогольные напитки люди научились ещё до нашей эры. С давних времён способ получения вин сбраживанием фруктовых соков дошёл до наших дней.
Дурманящий компонент алкогольных напитков впервые был выделен алхимиками только в XI в. и получил название aqua vitae — жизненная вода. Вскоре за ним закрепилось название винный спирт. Употребление алкоголя нашими предками преследовало практическую цель: за счёт вина, разбавленного водой, или пива организм получал до 25 % энергии. До сих пор можно услышать, как пиво за его калорийность называют жидким хлебом.
Коварство алкогольных напитков заключается в том, что они очень быстро вызывают привыкание, а их токсическое действие на организм проявляется не сразу. Однозначно доказано, что любое, даже незначительное, употребление алкоголя вредит здоровью человека. При попадании винного спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, формируется неадекватное поведение. Кроме этого, под действием алкоголя происходит обезвоживание организма, кровеносные сосуды расширяются, усиливается ток крови в капиллярах, в результате чего появляется ощущение тепла и покраснение кожи. В больших количествах алкоголь приводит к тяжёлым отравлениям и гибели клеток печени.
Химическое название винного спирта вам уже знакомо: этиловый спирт, или этанол. Его химическая формула С2Н5ОН. Его молекулы содержат функциональную гидроксильную группу —ОН.
Гомологический ряд предельных одноатомных спиртов
Этиловый спирт относится к одному из классов кислородсодержащих органических соединений — спиртам.

В молекуле этилового спирта содержится одна гидроксильная группа, связанная с остатком предельного углеводорода — этильным радикалом. Именно поэтому этиловый спирт относится к гомологическому ряду предельных одноатомных спиртов. Их состав соответствует общей формуле CnH2n+1OH.
Этиловый спирт, содержащий в молекуле два углеродных атома, является вторым представителем предельных одноатомных спиртов. Родоначальник гомологического ряда — метиловый спирт СН3ОН.
Химические формулы и названия первых представителей гомологического ряда предельных одноатомных спиртов приведены в таблице.

Номенклатура и изомерия спиртов
По международной номенклатуре названия спиртов образуют от названия соответствующего алкана с добавлением суффикса -ол, указывающего на принадлежность вещества к данному классу органических соединений. Обратите внимание, что при составлении названия спиртов углеродные атомы нумеруют с того конца цепи, к которому ближе гидроксильная группа.
Два последних спирта (см. табл.) обладают одной и той же молекулярной формулой С3Н7ОН, а вот химическое строение у них различное. Пропанол-1 и пропанол-2 — это изомеры, различающиеся положением функциональной группы в молекуле. Это ещё один вид структурной изомерии.

Физические свойства спиртов
В отличие от углеводородов, гомологические ряды которых начинаются с газообразных веществ, в ряду предельных одноатомных спиртов нет газов. Кроме того, в противоположность углеводородам, практически нерастворимым в воде, спирты с числом углеродных атомов от 1 до 4 смешиваются с водой в любых соотношениях. Оба эти свойства обусловлены способностью спиртов за счёт гидроксильных групп образовывать между молекулами особые связи, которые называют водородными связями.

За счёт водородных связей молекулы спиртов ассоциированы в жидкости (рис. 23, а) и хорошо растворимы в воде (рис. 23, б).
Спирты — прекрасные растворители органических веществ.
Способы получения спиртов

В промышленности спирты получают присоединением воды к этиленовым углеводородам. Например, в присутствии кислот этилен вступает в реакцию гидратации с образованием этилового спирта:

Ввести в молекулу органического вещества гидроксильную группу можно и с помощью реакции замещения. Так, при обработке галогеналканов водным раствором щёлочи атом галогена замещается группой ОН:
Химические свойства спиртов
Подобно большинству органических веществ, спирты горят. Пламя, образующееся при горении спиртов с небольшим числом атомов углерода в молекуле, бледно-голубое, практически не коптит, при горении выделяется большое количество теплоты:
Горючесть спиртов позволяет использовать их в качестве добавки к автомобильному бензину. В некоторых странах (Бразилия, США, Венесуэла) миллионы автомобилей адаптированы к использованию в качестве топлива чистого этанола.
Данную реакцию можно использовать для обнаружения спиртов.
Из курса химии основной школы вам известно, что вода бурно реагирует с активными металлами (щелочными, щелочноземельными) с выделением водорода:
2Н—О—Н + 2Na = 2NaOH + H2↑

По строению молекулы спиртов напоминают молекулы воды, только вместо одного из двух атомов водорода они содержат углеводородный радикал. Как и вода, спирты способны взаимодействовать со щелочными металлами. При этом также выделяется водород и образуется производное спирта, подобное солям:

Ещё одно важное свойство спиртов — взаимодействие с карбоновыми кислотами с образованием сложных эфиров:
Реакцию образования эфира называют реакцией этерификации.
Применение спиртов
Область применения спиртов чрезвычайно широка. Метанол используют в качестве сырья для производства формальдегида, уксусной кислоты, пластмасс, лекарственных веществ. В некоторых странах его также используют как добавку к моторному топливу. В нашей стране в этих целях метанол не используют. Он очень ядовит! Уже 5—7 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Этиловый спирт благодаря своей растворяющей способности используют в качестве растворителя лаков и красок. Также его применяют как компонент моющих жидкостей, в парфюмерной и фармацевтической промышленности. Кроме того, этиловый спирт широко применяют в медицине для дезинфекции, компрессов, обтираний и др.
На основе этилового спирта в промышленности получают десятки органических веществ: сложные эфиры, галогенпроизводные углеводородов, уксусную кислоту. Помимо спиртных напитков, этанол в небольших количествах содержат и продукты, получаемые брожением: кефир (0,1—0,2 %), квас (0,5—1 %), кумыс (до 3 %).
Читайте также:

