Получение трансгенных животных кратко
Обновлено: 05.07.2024
Биотехнология — это производство необходимых человеку продуктов и материалов с помощью живых организмов, культивируемых клеток и биологических процессов.
Возможности биотехнологии необычайно велики благодаря тому, что ее методы выгоднее обычных: они используются при оптимальных условиях (температуре и давлении), более производительны, экологически чисты и не требуют химических реактивов, отравляющих среду и др.
Объектами биотехнологии служат многочисленные представители групп живых организмов микроорганизмы (вирусы, бактерии, протисты, и др),
растения, животные, а также изолированные из них клетки и субклеточные структуры. Биотехнология базируется на протекающих в живых системах физиолого-биохимических процессах, в результате которых осуществляются выделение энергии, синтез и расщепление продуктов метаболизма, формирование химических и структурных компонентов клетки.
производство с помощью микроорганизмов и культивируемых эука-риотических клеток биологически активных соединений (ферментов, витаминов, гормональных препаратов), лекарственных препаратов (антибиотиков, вакцин, сывороток, высокоспецифичных антител и др.), а также белков, аминокислот, используемых в качестве кормовых добавок;
применение биологических методов борьбы с загрязнением окружающей среды (биологическая очистка сточных вод, загрязнений почвы и т. и.) и для защиты растений от вредителей и болезней;
создание новых полезных штаммов микроорганизмов, сортов растений, пород животных и т. п.
Задачи, методы и достижения биотехнологии. Главной задачей селекционеров - решение проблемы создания новых форм растений, животных и микроорганизмов, хорошо приспособленных к индустриальным способам производства, устойчиво переносящих неблагоприятные условия, эффективно использующих солнечную энергию и, что особенно важно, позволяющих получать биологически чистую продукцию без чрезмерного загрязнения окружающей среды. Принципиально новыми подходами к решению этой фундаментальной проблемы является использование в селекции генной и клеточной инженерии[1].
Генная (генетическая) инженерия — раздел молекулярной генетику связанный с целенаправленным созданием новых молекул ДНК, способных размножаться в клетке-хозяине и осуществлять контроль за синтезом необходимых метаболитов клетки. Возникнув на стыке химии нуклеиновых кислот и генетики микроорганизмов, генная инженерия занимается расшифровкой структуры генов, их синтезом и клонированием, вставкой выделенных из клеток живых организмов или вновь синтезированных генов в клетки растений и животных с целью направленного изменения их наследственных свойств[2].
выделение генов (отдельных фрагментов ДНК) из клеток бак- терий, растений или животных. В отдельных случаях эту операцию заменяют искусственным синтезом нужных генов;
соединение (сшивание) отдельных фрагментов ДНК любого происхождения в единую молекулу в составе плазмиды;
введение гибридной плазмидной ДНК, содержащей нужный ген, в клетки хозяина;
копирование (клонирование) этого гена в новом хозяине с обеспечением его работы.
Они содержат во всех своих клетках дополнительную ДНК-трансген, внедренную в клетки животного с хромосомами и там реализующуюся. Трансген наследуется, согласно законам Менделя.
Причины создания Трансгенных растения и животные различаются степенью сложности своего создания. Животные используются для решения теоретических задач в биомедицине и сельском хозяйстве. Среди причин создания трансгенных организмов можно обозначить следующие: животные с геном гормона роста в равных условиях содержания выдают повышенные темпы роста; для усиления иммунитета к инфекциям; для получения биологически активных веществ; для получения человеческого белка от трансгенных животных; использование животных как биореакторов для получения медпрепаратов. Первые такие животные были получены в 1974 году в Кембридже ученым по имени Рудольф Яниш. Он в эмбрион мыши ввел ДНК-вирус обезьяны. В России первые трансгенные животные были выведены в 1982 году [3] .
Клонированный ген вводят в ядро оплодотворенной яйцеклетки.
Оплодотворенные яйцеклетки с экзогенной ДНК имплантируют в рецепиентную женскую особь (поскольку успешное завершение развития эмбриона млекопитающих в иных условиях невозможно).
Отбирают потомков, развившихся из имплантированных яйцеклеток, которые содержат клонированный ген во всех клетках.
Скрещивают животных, которые несут клонированный ген в клетках зародышевой линии, и получают новую генетическую линию.
Все имеющиеся методы переноса генов (трансгеноз) пока еще не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы. При трансгенозе могут возникать неожиданные проблемы. Одна из первых работ по генетической транформации животных проводились путем встраивания генов гормона роста. Перенос гена гормона роста крысы мышам увеличивал рост мышей в 2 раза. Эксперименты по трансгенозу генов гормона роста быка кроликам также увенчались успехом. А вот аналогичные эксперименты по модификации крупного рогатого скота привели к увеличению прироста всего на 10-20% [6] .
В практических целях трансгенные животные используются различными зарубежными фирмами как коммерческие биореакторы, обеспечивающие производство разнообразных медицинских препаратов (антибиотиков, факторов свертываемости крови и др.). Кроме того, перенос новых генов позволяет получать трансгенных животных, отличающихся повышенными продуктивными свойствами (например, усиление роста шерсти у овец, понижение содержания жировой ткани у свиней, изменение свойств молока) или устойчивостью к различным заболеваниям, вызываемым вирусами и другими патогенами. В настоящее время человечество уже использует множество продуктов , получаемых с помощью трансгенных животных: медицинские препараты, органы, пища. Главными критериями в создании трансгенных особей являются их качественные и количественные показатели продуктивности, а не внешние признаки [5] .
Уже сейчас существуют коровы с генами зебу, которые отличаются невосприимчивостью ко многим кровепаразитарным заболеваниям. Введенные в геном крупного рогатого скота гены зебу кодируют сразу несколько признаков, благодаря чему полученные трансгенные животные вместе с устойчивостью к болезням приобрели повышенную жаровыносливость и неприхотливость к кормовой базе.
Методы создания трансгенных животных.
Процесс создания очень длительный и непростой. Существует несколько основных способов создания генных модификаций у высших животных:
- пронуклеарная микроинъекция;
- использование вирусных конструкций;
- использование эмбриональных стволовых клеток.
Метод пронуклеарной микроинъекции.
Один из наиболее удобных и часто используемых.
Его преимущества состоят в том, что он универсален: с его помощью можно вмешиваться в геном любых животных. Этот метод позволяет получить быстрый результат: требуемые показатели проявляются уже в первом поколении. Он не имеет ограничений по размеру внедряемого участка ДНК. Если при использовании вирусных конструкций можно вставить только 8 – 10 тысяч пар нуклеотидов, то с помощью пронуклеарной микроинъекции можно ввести во много раз больше – 100 тысяч и даже несколько миллионов пар нуклеотидов! Т. е. за одно вмешательство можно ввести намного больше целевой генетической информации. Суть этого способа следующая: у отобранных самок животных искусственно стимулируют овуляцию и оплодотворяют вышедшие яйцеклетки. Затем, либо в ядро мужского пронуклеуса, либо в ядро создавшейся клетки на стадии зиготы внедряют с помощью специального оборудования (микроманипулятора) нужный участок ДНК (или генную конструкцию) [1] .
Создание одной минимальной популяции из нескольких трансгенных животных стоит от 60 до 300 тысяч долларов США. Кроме того, для осуществления необходимых действий нужен микроманипулятор и другое дорогостоящее оборудование.
Метод с использованием вирусных конструкций.
Намного дешевле создавать трансгенных животных с помощью вирусов.
Для осуществления этого способа учёные сначала создают псевдовирус из обычного вируса. Суть преобразования состоит в том, что из вируса удаляют большинство его генов, оставляя только самые необходимые для его выживания, и прикрепляют нужный для создания трансгенного животного участок ДНК. После этого измененным, относительно безвредным вирусом обрабатывают зиготу. Вирус проникает в зиготу, самостоятельно встраивается в геном зиготы и одновременно встраивает нужный ген. Затем зиготу культивируют некоторое время в инкубаторе и трансплантируют в матку суррогатной матери, а по истечении срока беременности получают трансгенный молодняк. Это потомство тестируют на присутствие того гена, который планировалось ввести в его геном, отбирают нужных особей и размножают их с применением жёсткой выбраковки животных, не соответствующих заданным параметрам, искусственного отбора и подбора пар, как и в предыдущем случае[6].
Эффективность этого метода намного выше, чем микроинъекции – она составляет до 70%! Но есть и недостатки: не только чужой ген действует на геном эмбриона, но и сам геном влияет на чужеродный ген, изменяя его работу. Если вирус встроился в участок ДНК эмбриона, который активно не работает, то и этот целевой ген тоже работать не будет, несмотря не своё присутствие в геноме трансгенного животного. Впервые вирусы для переноса гена использовал Рудольф Яниш в 1970 году[7].
Метод с применением эмбриональных стволовых клеток
Для получения трансгенных животных использовались и другие методы, к которым относятся: применение сперматозоидов, обработанных экзогенной ДНК, для оплодотворения яйцеклеток в условиях invitro; использование липосом в качестве вектора чужеродной ДНК. Однако, эти методы имеют значительно менее широкое распространение, в сравнении с методом микроинъекции[2].
Использование трансгенных животных с современном мире.
Создание новых животноводческих пород, дающих продукты с повышенным содержанием некоторых компонентов (например, в Великобритании существует стадо коров, молоко которых идеально подходит для приготовления сыра чеддер).
Создание животных, способных продуцировать несвойственные их виду белки (например, сообщалось о разработках направленных на получение свиней, способных продуцировать интерферон человека).
Создание трансгенных животных, являющихся донорами при трансплантациях органов человеку.
Технология создания трансгенных животных является одной из наиболее бурно развивающихся биотехнологий в последние 10 лет. Трансгенные животные широко используются как для решения большого числа теоретических задач, так и в практических целях для биомедицины и сельского хозяйства. Некоторые научные проблемы не могли бы быть решены без создания трансгенных животных. На модели трансгенных лабораторных животных проводятся широкие исследования по изучению функции различных генов, регуляции их экспрессии, фенотипическому проявлению генов, инсерционному мутагенезу и др. Трансгенные животные важны для различных биомедицинских исследований. Уже получены трансгенные коровы и козы, в молоке которых содержится человеческий белок лактоферрин[1].
Трансгенных животных получают и для целей ксенотрансплантации (пересадки органов человеку). Одним из излюбленных доноров органов являются свиньи, так как имеется анатомическое сходство органов и сходство иммунологических свойств. Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие[4].
Существует множество трансгенных животных, моделирующих различные заболевания человека (рак, атеросклероз, ожирение и др.). Так, получение трансгенных свиней с измененной экспрессией генов, определяющих отторжение органов, позволит использовать этих животных для ксенотрансплантации (пересадки органов свиньи человеку).
В практических целях трансгенные животные используются различными зарубежными фирмами как коммерческие биореакторы, обеспечивающие производство разнообразных медицинских препаратов (антибиотиков, факторов свертываемости крови и др.). Кроме того, перенос новых генов позволяет получать трансгенных животных, отличающихся повышенными продуктивными свойствами (например, усиление роста шерсти у овец, понижение содержания жировой ткани у свиней, изменение свойств молока) или устойчивостью к различным заболеваниям, вызываемым вирусами и другими патогенами. В настоящее время человечество уже использует множество продуктов, получаемых с помощью трансгенных животных: медицинские препараты, органы, пища[7].
Проблемы при трансгенезе
Для решения задачи генно-инженерного изменения количественных признаков животных, имеющих полигенную природу, очевидно, потребуется получение политрансгенных сельскохозяйственных животных только вследствие технических причин (поскольку для этого, возможно, потребуется осуществление многоступенчатого трансгенеза), но и из-за невозможности клонировать еще неизвестные гены. В связи с этим основной интерес большинства исследователей связан сейчас с генами, работа которых определяет относительно независимые морфофункциональные признаки животного (информационный генетический иммунитет, продукция белков животных и человека). Не исключено, однако, что на этом пути может быть получено положительное изменение каких-либо других хозяйственно-полезных признаков животных, определяемых единичными генами животных[5].
Заключение
Развитие биотехнологии сельскохозяйственных животных, в том числе генная инженерия, открывает новые возможности развития животноводства.
Важнейшим направлением генной инженерии является получение трансгенных особей с интегрированными в геном генными конструкциями, связанными с усилением иммунитета животных к инфекционным заболеваниям.
Другим актуальным направлением генной инженерии животных является получение животных продуцентов биологически активных веществ, необходимых в медицине, ветеринарии и технологии переработки продуктов животноводства. Многие биологически активные вещества не могут производиться традиционными методами в достаточных количествах и с желательным качеством.
Таким образом, главными критериями в создании трансгенных особей являются их качественные и количественные показатели продуктивности, а не внешние признаки. Генномодифицированные животные создаются преимущественно не для развлечения, а для рационального решения глобальных проблем, связанных с дальнейшим существованием человечества. Успехи в области молекулярной генетики и биологии гена должны обеспечить дальнейший прогресс в проблеме трансгенеза сельскохозяйственных животных, а, следовательно, в повышении эффективности и рентабельности производства многообразной животноводческой продукции.
Основная проблема, которую нужно решить для того, чтобы создание любых трансгенных животных с помощью метода переноса ядер стало реальным, - это сохранение плюрипотентности клеток в непрерывной культуре.
Трансгенные животные, примеры которых будут приведены ниже, были получены экспериментальным путем. Они содержат во всех своих клетках дополнительную ДНК-трансген, внедренную в клетки животного с хромосомами и там реализующуюся. Трансген наследуется, согласно законам Менделя.

Причины создания
Трансгенные растения и животные различаются степенью сложности своего создания. Животные используются для решения теоретических задач в биомедицине и сельском хозяйстве. Среди причин создания трансгенных организмов можно обозначить следующие:
- животные с геном гормона роста в равных условиях содержания выдают повышенные темпы роста;
- для усиления иммунитета к инфекциям;
- для получения биологически активных веществ;
- для получения человеческого белка от трансгенных животных;
- использование животных как биореакторов для получения медпрепаратов.
Первые такие животные были получены в 1974 году в Кембридже ученым по имени Рудольф Яниш. Он в эмбрион мыши ввел ДНК-вирус обезьяны. В России первые трансгенные животные были выведены в 1982 году.
Получение
Зачем нужны трансгенные животные? Их создание происходит путем переноса клонированных ДНК в ядра оплодотворенных яйцеклеток, называемых зиготами, или стволовых эмбриональных клеток. После чего в органы репродуктивности пересаживаются измененные зиготы или яйцеклетки.
Если не вдаваться в подробности, то весь процесс заключается в следующем:
- В ядро яйцеклетки, предварительно оплодотворенной, вводится клонированный ген.
- Оплодотворенные яйцеклетки с внедренной ДНК помещаются в выбранную заранее женскую особь для дальнейшего вынашивания трансгенного плода.
- Проводится отбор потомства, родившегося при помощи внедрения чужеродной ДНК, с таким расчетом, чтобы клонированный ген содержался в каждой клетке полученного организма.
- Скрещиваются животные, которые в клетках зародышевой линии несут клонированный ген.
- Таким образом получают новую генетическую линию.
Подобные эксперименты весьма затратны в плане необходимого для этого времени. Несмотря на это, трансгенез становится мощнейшим инструментом для исследования заболеваний человека. При помощи трансгенеза проводится работа над генетической модификацией молочных желез животных для получения из молока белка, идентичного человеческому, а также для изготовления фармацевтических препаратов.
Методы трансгенеза животных
Для чего они нужны? Трансгенные животные – это отдельные особи, геном которых отличается искусственно дополненной генетической информацией. Трансген представляет собой в одном случае самостоятельный участок ДНК с собственными регуляторными последовательностями. В другом - это созданный из различных молекул ДНК-гибридный (рекомбинантный) ген.
Трансген – это введенный искусственно и закрепившийся в ДНК животного чужеродный ген. А трансгенез – это процесс интеграции и переноса в геном животного чужеродной генетической информации.
Существуют определенные методы получения трансгенных животных. Среди них выделяют:
- Микроинъекционный метод.
- Метод использования ретровирусных векторов.
- Пересадка ядер клеток, которые культивируются in vitro.
- Метод липосом – переносчиков ДНК.
- Метод использования половых клеток семенников.
Метод микроинъекции
Впервые для получения трансгенных животных был использован именно метод микроинъекции. Это произошло в 1985 году одновременно в двух исследовательских лабораториях. Одна из них принадлежала США, другая находилась в Германии. В настоящее время этот метод является наиболее часто используемым.
Способ микроинъекции основан на введении раствора генных конструкций в мужской пронуклеус (предшественник ядра) зигот. При оплодотворении в яйцеклетке образуются два ядра, одно из которых мужское (мужской пронуклеус), другое - женское (женский пронуклеус). Мужской и женский пронуклеусы после сближения объединяются в общее ядро с соединением отцовских и материнских хромосом в один генотип эмбриона.
Об успешности микроинъекции можно судить по увеличению объема пронуклеуса в 1,5 раза. Когда процедура завершается, получившиеся эмбрионы несколько часов культивируются, а затем подсаживаются в матку одновременно нескольким самкам.
После рождения потомства производится анализ на интеграцию трансгена путем отбора проб. Число трансгенных малышей от общего числа родившегося при помощи данного метода потомства весьма незначительно. У испытуемых мышей это примерно 15 %, у свиней - от 10 до 15 %, у овец, коз и крупного рогатого скота этот показатель лавируется от 5 до 10 %. Над улучшением данного соотношения ученые работают по сей день.
Метод использования ретровирусных векторов
Перенос ДНК в эмбриональные линии животных при помощи ретровирусных векторов – это довольно результативный метод. Ретровирусы являются ядросодержащими вирусами. Их генетический материал – это одноцепочечная рибонуклеиновая кислота (РНК).

Ретровирусы могут быть экотропными, то есть способными воспроизводиться в клетках одного вида животных или нескольких близкородственных видов. Например, вирус лейкимии мыши может размножаться только в клетках мыши или крысы. Амфотропные же вирусы способны к распространению во многих видах животных.
Ретровирус проникает в клетку при помощи микропиноцитоза – транспорта небольших по размеру молекул. У одних вирусов транскрипция происходит в ядре клетки, у других - в цитоплазме. Если интеграция случается в геноме генеративных клеток, то ретровирусы передаются потомству по наследству. Здесь идет речь об эндогенных ретровирусах.
Впервые вирусная ДНК была обнаружена в клетках взрослой мыши в 1974 году. Инфекция зигот в большинстве случаев приводит к получению трансгенных животных, так как интеграция возможна, если клетка вступает в непрямое деление после репликации ДНК.

Преимущества использования ретровирусных векторов:
- Почти 100 % эмбрионов, обработанных ретровирусом, могут быть инфицированы.
- Становится возможным проведение генной терапией наследственных заболеваний.
- Ретровирусы делают возможной трансформацию отдельных органов (например, молочных желез для повышения удоя).
Недостатки использования ретровирусных векторов:
- Ограниченная емкость.
- Подавление экспрессии трансгенов in vivo.
- Низкий титр (решена при помощи псевдотипирования).
- Возможность клеточных онкогенов.
- Невозможность передачи по наследству трансформации отдельных органов.
Метод пересадки ядер клеток
Особенностью метода является использование трансформированных клеточных линий для получения трансгенных особей при помощи генных конструкций. Для этого берутся стволовые линии, а также соматические клетки, которые культивируются in vitro, то есть в пробирке.
Одним из методов пересадки ядер является метод микроманипуляции, и заключается он в следующем:
- При помощи микропипетки происходит извлечение пронуклеусов после того, как произошло прокалывание зон пеллюцида и зон плазматической мембраны.
- Пипеткой с большим диаметром в тот же прокол вводится ядро с полным набором хромосом от донора.
При помощи такого метода цитоплазма зиготы травмируется намного меньше, как и донорское ядро.
Существует еще один способ трансплантации ядра. Этот метод заключается в использовании для этой цели цитохалазинов, то есть веществ, которые синтезированы при помощи грибов. Структура микроферментов (нитей, состоящих из молекул глобулярного белка актина) разрушается цитохалазином В, после чего ядро может быть расположено уникальным образом.
Ядро при помощи тоненькой нити цитоплазмы остается соединенным с клеткой. Затем эта связь искусственно разрывается при помощи центрифугирования. Образуются цитопласты (клетки без ядра) и кариопласты (ядра, окруженные цитоплазмой). В градиенте плотности цитопласты отделяются от интактных клеток, и могут быть использованы для соединения с кариопластами других клеток, чтобы получилась жизнеспособная клетка.
Метод липосом – переносчиков ДНК
Это самый безвредный метод трансгенеза. Его особенность заключается в использовании липосом для сохранения и переноса в них генов. Липосомы создаются с различными свойствами. Они не иммуногены и не обладают токсичностью.
Однако данный метод не является эффективным, потому что ДНК, транспортированная таким образом в клетку, сразу же захватывается лизосомами и разрушается ими.
Метод использования половых клеток семенников
Сперматозоиды – это природный вектор, который транспортирует ДНК в клетку. Но проводимые в этой области исследования показали неоднозначные результаты метода. В экспериментах М. Lavitrano в 1989 году 30 % опытных мышей, которые были получены при помощи инъекций измененных сперматозоидов в неоплодотворенные яйцеклетки мыши, оказались трансгенными и могли передавать трансген по наследству.
В другом случае множество попыток повторить этот результат в других лабораториях не увенчались успехом, при сходных условиях были получены разные результаты. Из всего этого можно сделать предположение, что удачная трансформация ДНК наблюдается только на определенной стадии клеточного цикла. До сих пор ведутся исследования в области определения механизма встраивания экзогенной ДНК в геном сперматозоида.
Возможность использования после криоконсервации сперматозоидов является положительным моментом данного метода. Отрицательной же стороной считается большое количество микроманипуляций, необходимых при трансгенезе при помощи этого способа.
Но все же сперматозоиды имеют способность поглощать ДНК и накапливать ее в ядре. Для достижения большего эффекта соединения ДНК со сперматозоидом существует несколько методов: липосомный, инъекция в семенники, в семенные канальцы при помощи создания пор в липидной мембране под действием электрического поля.
Выключенные гены
Выключение гена – это подавление экспрессии генов, то есть сайленсинг генов или генный нокаут. При этом процессе экспрессия необходимого гена прекращается, но последовательность нуклеотидов остается неизменной.

Выключение гена может происходить при переносе информации с ДНК на РНК, то есть транскрипции, и после нее. Механизмы выключения генов защищают организм от вирусов и прыгающих генов. Поэтому сайленсинг является частью иммунной системы, которая защищает от чужеродной ДНК. Трансгенные животные с выключенными генами и их создание называются генным таргетингом.
Наследование генов, согласно законам Менделя
Законы Менделя описывают особенности передачи от организма родителя к организму детеныша характеристик, несущих наследственность. Данные принципы находятся в основе классической генетики. В основном во всех научных статьях раскрывается одно из правил Менделя и пара законов.
Правило первого поколения гибридов и их единообразие гласит о том, что данные гибриды всегда наследуют один из признаков родителя.
Закон расщепления признаков является первым законом Менделя. В нем говорится о том, что у ¾ подопытных животных выявились доминантные признаки, а у ¼ - рецессивные.
Закон независимого наследования признаков является вторым законом. Здесь Менделем описывается распределение признаков при скрещивании полигибридном и дигибридном.
Полезные свойства
Создание трансгенных животных с новыми полезными свойствами – это процесс непрекращающийся.
Трансгенные животные, примеры которых приведены ниже, уже существуют в современном мире:
- В Великобритании при помощи трансгенеза были выведены овцы. Молоко этих животных содержит в себе фактор, способствующий свертыванию крови.

- У трансгенных свиней, созданных в России, был изменен обмен веществ посредством введения гена соматотропина, что позволило снизить жирность мяса.
- Американцы работают над созданием коров, в чьем молоке содержится человеческий альбумин, который используется для поддержания нормального давления крови.
Перспективы использования трансгенных животных
В ближайшем будущем предполагается создание таких животных, одни гены которых нокаутированы, а другие введены в состав их генома.
Предполагается, что такое молоко в своем составе будет максимально приближено к составу материнского молока человека. В этом направлении проводится работа с эмбриональными стволовыми клетками.

- Использование трансгенных животных для получения органов, которые пересаживаются человеку.
Не секрет, что человечество нуждается в донорских органах. Сейчас генетики ведут работу над выращиванием таких органов в теле животных. Например, органы свиней вполне могли бы подойти по своему размеру и составу. Но они будут незамедлительно отторгнуты человеческой иммунной системой. Чтобы этого не происходило, создается трансгенная свинья, у которой выключены гены гистосовместимости, а вместо них внедрены гены гистосовместимости человека.

Создание трансгенных животных - трудозатратный процесс. Согласно статистике, на 100 инъецированных зигот овцы, 40 мышиных зигот и 1500 зигот коровы приходится менее 50% особей, экспрессирующих трансгенный белок. При удачной попытке получения трансгенного животного совсем необязательно, что его потомками будет наследован трансген. Поэтому клонирование животного с необходимыми генетическими параметрами – есть оптимальный выход из положения.
В наши дни трансгенные организмы перестают быть редкостью и значение их для биологии и медицины трудно переоценить. Искусственное включение практически любого интересующего исследователей гена позволяет физиологам изучать на трансгенных животных различные отклонения в гомеостазе организма, иммунной системе, в эмбриогенезе и во многих других случаях
Получение трансгенных животных
Исследования в биомедицине сосредоточены в основном на том, чтобы создать широкий спектр моделей заболеваний человека, включая такие, как атеросклероз, диабет, гипертонию, болезнь Альцгеймера, ретинобластому, онкологические и многие другие заболевания. Модели трансгенных животных, как правило мышей, позволяют изучать механизмы развития и лечения болезней человека.
Трансгенные мыши являются также незаменимой модельной системой и для тестирования генетических конструкций перед получением сельскохозяйственных трансгенных животных-биореакторов, способных с молоком продуцировать белки человека.
Наиболее широко используемый метод введения трансгена – микроинъекция в пронуклеусы (мужское и женское ядро) зиготы в тот момент, когда спермий проник в яйцеклетку, и пронуклеусы готовятся к слиянию. Суть метода заключается во введении в мужской пронуклеус с помощью микроманипулятора со стеклянным капилляром (диаметр кончика 1 мкм) раствора экзогенной (чужеродной) ДНК (500—1000 копий гена). Эта процедура проводится под микроскопом со специальной оптикой, позволяющей видеть пронуклеусы в трехмерном измерении.
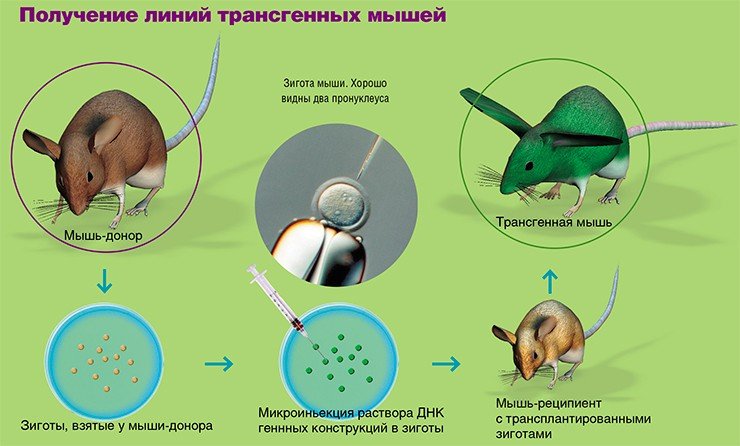
Эффективность интеграции трансгенов в геном, т. е. число трансгенных животных от общего числа родившихся при использовании данного метода в зависимости от вида животных колеблется незначительно. Так, у мышей этот показатель составляет 5—15 %, у свиней – 10—15 %, у кроликов – 10 %, у овец, коз и коров – 5—10 %.
Вот далеко не полный список фармакологически ценных белков человека, полученных от трансгенных мышей: интерферон, фактор свертываемости крови IX, сывороточный альбумин, некоторые иммуноглобулины и многие другие белки, которые уже рекомендованы для создания молочных биореакторов
Можно выделить следующие этапы получения трансгенных животных:
1) получение зигот от гормонально стимулированных самок;
2) микроиньекция раствора ДНК генных конструкций в мужской пронуклеус зиготы;
3) трансплантация проинъецированных зигот самкам-реципиентам, подготовленным для вынашивания беременности;
4) анализ родившихся потомков на присутствие трансгена методом полимеразной цепной реакции (ПЦР-анализ);
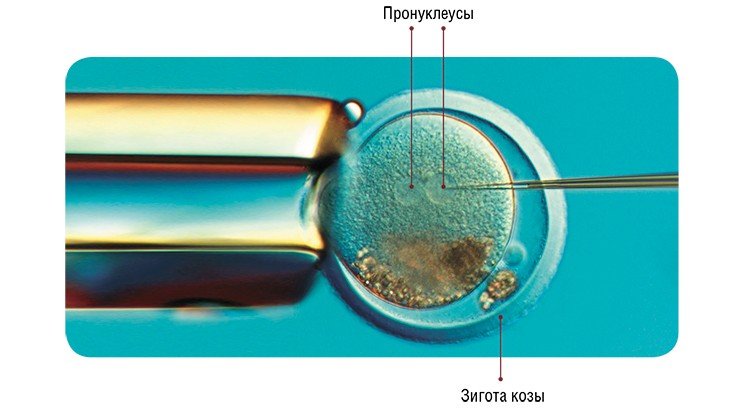
5) анализ трансгенных животных по наследованию трансгена, экспрессии рекомбинантного белка, его биологической активности; необходимо узнать, активен ли встроенный трансген, передается ли он потомкам, обладает ли белок всеми биологическими свойствами его природного аналога и соответствует ли уровень продукции биотехнологическим целям;
6) создание линии (стада) трансгенных животных для научных или биотехнологических целей.
Животные-биореакторы
В настоящее время имеются примеры успешного применения этой технологии, и созданы трансгенные козы, овцы, кролики, свиньи – продуценты человеческих белков: -антитрипсина, сывороточного реактивного белка С, антитромбина, факторов VIII и IX свертываемости крови, лактоферрина, кальцитонина и др. (Wall et al., 1997; Rudolph, 1999; Гольдман и др., 2002).
Фармакологический рынок рекомбинантных белков, полученных из молока трансгенных домашних животных оценивается в 1 млрд долл. в настоящее время и прогнозируется его развитие до 18,6 млрд долл. к 2013 г. (Niemann и др., 2007).
Тестирование новых генно-инженерных конструкций, как правило, производится на трансгенных мышах из-за того, что большинство крупных животных – потенциальных продуцентов лекарственных белков человека имеют длительный репродуктивный период и к тому же дорого обходятся. Анализ генетических конструкций на трансгенных мышах позволяет быстро отобрать из них наиболее перспективные как по уровню продукции заданного белка, так и по его биологическим свойствам.

Получение эффективного продуцента – большая удача и гарантия в относительно сжатые сроки создания стада его потомков, обеспечивающих рынок ценным фармакологическим продуктом. При таком стаде создается лаборатория по выделению и очистке рекомбинантного белка, который передается в соответствующие фарминституты для тестирования, проведения его предклинических и клинических испытаний и разрешения применения получаемого лекарства в медицинской практике.
Опыт ведущих фармакологических фирм США, Канады и Англии показывает, что такие проекты длятся около 10 лет при высоком уровне финансирования. С сожалением можно отметить, что в России таких технологий практически нет, как и инфраструктуры для их развития, а это означает, что биологически ценные белки человека мы будем покупать за рубежом. А таких белков уже около 60 (Rudolph, 1999).
К тому же досадно, что российские ученые получили и протестировали на трансгенных мышах несколько эффективных генных конструкций для целей биотехнологии (Завадская и др., 2001; Дворянчиков и др., 2005; Гольдман и др., 1998; Zakharova et al., 2006), однако современных биотехнологических ферм в России нет, и эти разработки пока не используются в полной мере.
Скорее как исключение следует отметить два биотехнологических проекта, развивающихся в России.

В рамках российско-бразильского проекта, о котором рассказывается выше, участвуют Институт цитологии и генетики СО РАН, Институт молекулярной генетики РАН, Государственный университет Рио де Жанейро (UFRJ) и Университет штата Сеара (UECE), в июле 2006 г. получена трансгенная коза с геном Г-КСФ человека, конструкция предварительно была протестирована на трансгенных мышах (Dvoryanchikov et al., 2005). Статья, посвященная получению трансгенной козы опубликована в Журнале Академии наук Бразилии (Freitas et al., 2007). Осенью 2007 г. эксперимент успешно повторен, и в марте 2008 г. родились три трансгенных козленка, из которых сейчас успешно подрастают только двое – Камилла и Августин.
Второй биотехнологический проект на козах, известный нам пока только из популярной прессы, развивается в совместном российско-белорусском проекте с генетической конструкцией лактоферрина человека. Лактоферрин содержится в женском грудном молоке и является природным антибиотиком, защищающим детский организм от всевозможных болезней. Государственными заказчиками программы выступают Федеральное агентство по науке и инновациям России и Национальная академия наук Белоруссии. Основные исследования проводят специалисты Института биологии гена РАН и Научно-практического центра НАН Белоруссии по животноводству. В конце 2007 г. ученые сумели получить двух трансгенных козлят, которые несут ген лактоферрина человека.
Гольдман И. Л. и др. Лактоферин: свойства и перспективы биотехнологического производства // Биотехнология. 1998. № 4. С. 3—16.
Гольдман И. Л. и др. Трансгенные козы в мировой фармаиндустрии ХХI века // Генетика. 2002. Т. 38, № 1. С. 5—21.
Завадская Е. С. и др. Получение рекомбинантного эндостатина в молоке трансгенных мышей // Генетика. 2001. Т. 37. С. 1207—1212.
Dvoryanchikov G. A. et al. Secretion of Biologicaly Active Human Granulocyte Colony-Stimulating Factor (G-CSF) in Milk of transgenic Mice // Russian J. of Genetics. 2005. V. 41, N. 10. P. 1088—1094.
Freitas V. J. et al. Production of transgenic goat (Capra hircus) with human Granulocyte Colony Stimulating Factor (hG-CSF) gene in Brazil // Ann. Braz. Acаd. Sci. 2007. V. 79 N. 4. P. 585—592.
Hubel K. et al. Clinical applications of granulocyte colony-stimulating factor: an update and summary // Ann. Hematol. 2003. V. 82. P. 207—213.
Niemann H. et al. Transgenic farm animals: an update // Reprod. Fertil. Dev. 2007. № 19. 762 р.
Wall R. J. et al. Transgenic dairy cattle: genetic engineering on a large scale // J. Dairy Sci. 1997. V. 80. P. 2213—2224.
Wall R. J. Transgenic livestock: progress and prospects for the future // Theriogenology. 1996. V. 45. P. 57.
Zakharova E. S. et al. Transcription and mRNA splicing of the human lactoferrin gene controlled by the regulatory region of the bovine alphaS1 casein gene in the mammary gland of transgenic mice and in mouse embryonic stem cells // Dokl. Biochem. Biophys. 2006. N. 411. P. 336—338.
Фотоматериалы получены совместно с участником проекта Л. Е. Андреевой (к. б. н., с. н. с. Института молекулярной генетики РАН (Москва)).

16.04.2019
Развитие современной науки и прикладных ее направлений осуществляется во всех отраслях человеческой деятельности. Новейшие технологии всё чаще находят применение даже в одной из наиболее консервативных отраслей сельского хозяйства – животноводстве. Внедрение научных технологических разработок дает ощутимые результаты на таких этапах как кормление животных, кормопроизводство, содержание поголовья, скоростное выращивание мясного молодняка и т. п. Кроме того, более весомое значение приобретает генная инженерия . Умение искусственно изменять набор генов животных открывает огромные перспективы перед учёными, животноводами и человечеством в целом.
Когда речь заходит о трансгенных животных , воображение большинства из нас создает некий фантастический образ свирепого существа-конструктора, в котором соединены воедино части тел разных животных. А учёных, занятых трансгенной работой, многие представляют как злых гениев, ведущих цивилизацию к неминуемой гибели. Но на практике всё совсем иначе. И хотя некоторые трансгенные животные, созданные ради эксперимента (например, светящиеся в темноте мыши) внешне отличаются от обычных, в большинстве своём они сохраняют прежний облик.
Главными критериями в создании трансгенных особей являются их качественные и количественные показатели продуктивности, а не внешние признаки. Генномодифицированные животные создаются преимущественно не для развлечения, а для рационального решения глобальных проблем, связанных с дальнейшим существованием человечества.
Основные цели вмешательства в генетическую суть живых организмов состоят в изменение свойств животных в нужном для человека направлении, приобретении ими новых возможностей, а также в устранении некоторых негативных качеств. С помощью генной инженерии учёные создают животных с особыми, необычными параметрами продукции, животных, устойчивых к различным болезням, животных с повышенной продуктивностью и т. д. Благодаря такой работе можно уверенно утверждать, что на сегодняшний день в животноводстве уже достигнуты большие успехи.


В другом примере переноса генов результаты ещё более впечатляют. В результате введения в ядра оплодотворённых икринок рыбы нерка генетической информации, кодирующей повышенную выработку гормона роста, годовалые трансгенные нерки, которые вывелись из этих икринок, весили в среднем в 10 раз больше, чем их нетрансгенные ровесники!

С помощью генной инженерии созданы также свиньи, у которых добавлен геном, кодирующий выработку пищеварительного фермента фитазы . Эти животные лучше переваривают и усваивают корм, благодаря чему повышается его конверсия и ускоряется рост свиней. В результате, при тех же затратах корма существенно повышается продуктивность животных, и мяса производится значительно больше.
Создание сельскохозяйственных животных, устойчивых к основным заболеваниям, которые наносят ощутимый материальный ущерб хозяйству и даже могут передаваться человеку, имеет большие экономические перспективы, т. к. это поможет избежать расходов на профилактику, лечение, устранение последствий заболеваний (дезинфекция, утилизация павших животных, карантинные ограничения и пр.), а также недополучения продукции.
Например, ведутся исследования по решению проблемы лейкоза крупного рогатого скота, который вызывают РНК-содержащие вирусы. Введение в ядро генов, кодирующих антисмысловую РНК, теоретически должно сделать КРС устойчивым к лейкозу. Эксперименты на кроликах уже дали положительный результат. Одно из подобных достижений – свиньи, поросята которых резистентны к диарее , что очень упрощает их выращивание.
Уже сейчас существуют коровы с генами зебу, которые отличаются невосприимчивостью ко многим кровепаразитарным заболеваниям. Введенные в геном крупного рогатого скота гены зебу кодируют сразу несколько признаков, благодаря чему полученные трансгенные животные вместе с устойчивостью к болезням приобрели повышенную жаровыносливость и неприхотливость к кормовой базе.

Но генные модификации можно применять не только для решения продовольственных и экономических задач. Используя генную инженерию, можно удовлетворять многие человеческие потребности в педиатрии и медицине в целом. Одна из групп генномодифицированных коров способна давать молоко, содержащее человеческий белок лактоферрин (в молоке обычных коров этого вещества нет). Лактоферрин является важной составляющей гуморального иммунитета, он обладает противовирусным, антибактериальным, противогрибковым, антипаразитарным действием, а также каталитической активностью и используется при искусственном выкармливании новорождённых детей.
Также ведётся работа по созданию свиней, способных продуцировать интерферон человека, в котором очень нуждается фармацевтическая отрасль. От модифицированных животных (коров, свиней, коз, кроликов, овец) уже удалось получить восемнадцать лекарственных белков. В качестве живых биологических фабрик они существенно рентабельнее, чем аналогичное по производительности промышленное производство нужных веществ.
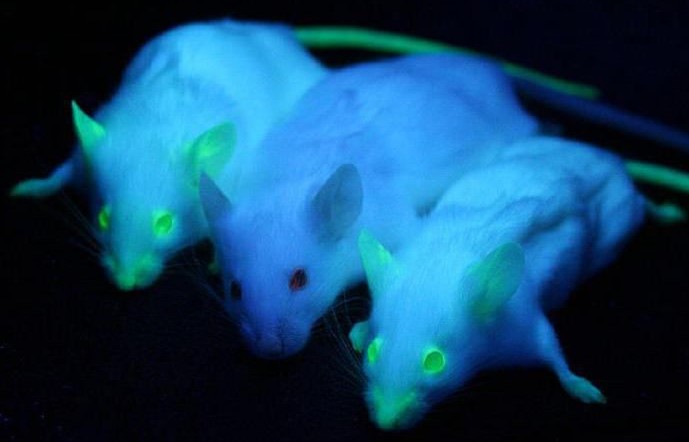
В Англии учёные-генетики смогли создать трансгенных кур, которые несут яйца, содержащие лечебный белок с miR24-молекулой и человеческий интерферон b-1a . После специальной обработки эти вещества используются как сырьё в производстве препаратов, предназначенных для лечения артритов, множественного рассеянного склероза и злокачественных опухолей у человека.
Но как же создают трансгенных животных? Процесс этот очень длительный и непростой. Существует несколько основных способов создания генных модификаций у высших животных:
- пронуклеарная микроинъекция ;
- использование вирусных конструкций ;
- использование эмбриональных стволовых клеток .
Из них наиболее удобный и часто используемый – это метод пронуклеарной микроинъекции . Его преимущества состоят в том, что он универсален: с его помощью можно вмешиваться в геном любых животных. Этот метод позволяет получить быстрый результат: требуемые показатели проявляются уже в первом поколении. Он не имеет ограничений по размеру внедряемого участка ДНК. Если при использовании вирусных конструкций можно вставить только 8–10 тысяч пар нуклеотидов, то с помощью пронуклеарной микроинъекции можно ввести во много раз больше – 100 тысяч и даже несколько миллионов пар нуклеотидов! Т. е. за одно вмешательство можно ввести намного больше целевой генетической информации.
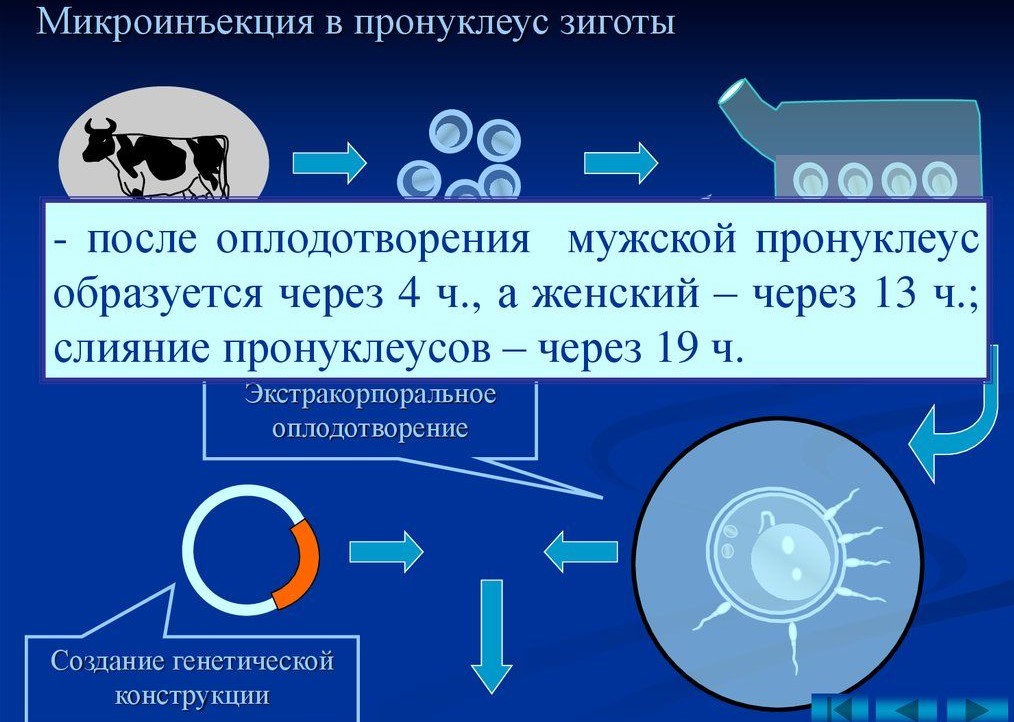
Суть этого способа следующая: у отобранных самок животных искусственно стимулируют овуляцию и оплодотворяют вышедшие яйцеклетки. Затем, либо в ядро мужского пронуклеуса, либо в ядро создавшейся клетки на стадии зиготы внедряют с помощью специального оборудования (микроманипулятора) нужный участок ДНК (или генную конструкцию). После внедрения зиготу неделю (за это время целевой ген встраивается в геном клетки-рецепиента и изменённая клетка начинает своё развитие в многоклеточный модифицированный организм) культивируют в питательной среде с высоким содержанием углекислого газа (5%, как в живых тканях организма млекопитающих), затем на стадии морулы или ранней бластоцисты пересаживают в матку суррогатной матери.
Достаточно хорошо отработаны технологии генных модификаций для таких видов рыб как форель, карп, лососевые. Они состоят в том, что нужные участки ДНК вводят в оплодотворенные икринки с помощью микроинъекции. Развитие модифицированной икры протекает в воде, в ванных с регулируемыми параметрами микроклимата. После инъекций чужеродных генов выживает примерно от 35 до 80% эмбрионов. Из них успешно принимают новые гены в свой генетический набор от 10 до 70%. То есть, эффективность перенесения нужной наследственной информации у промысловых рыб относительно большая. Ведётся работа по внедрению генов, которые увеличат устойчивость рыбы к болезням и неблагоприятным воздействиям окружающей среды.
Далеко не все попытки генных манипуляций заканчиваются успешно. На каждом этапе количество эмбрионов постоянно уменьшается на 10–20% по разным причинам. Какие-то гибнут, других отбраковывают сами учёные. Из тысячи яйцеклеток может получиться лишь несколько удачных трансгенных животных. Технология микроинъекции даёт хорошие по качеству результаты, но она слишком дорогая. Создание одной минимальной популяции из нескольких трансгенных животных стоит от 60 до 300 тысяч долларов США. Кроме того, для осуществления необходимых действий нужен микроманипулятор и другое дорогостоящее оборудование. Намного дешевле создавать трансгенных животных с помощью вирусов .
Для осуществления этого способа учёные сначала создают псевдовирус из обычного вируса. Суть преобразования состоит в том, что из вируса удаляют большинство его генов, оставляя только самые необходимые для его выживания, и прикрепляют нужный для создания трансгенного животного участок ДНК. После этого измененным, относительно безвредным вирусом обрабатывают зиготу. Вирус проникает в зиготу, самостоятельно встраивается в геном зиготы и одновременно встраивает нужный ген. Затем зиготу культивируют некоторое время в инкубаторе и трансплантируют в матку суррогатной матери, а по истечении срока беременности получают трансгенный молодняк. Это потомство тестируют на присутствие того гена, который планировалось ввести в его геном, отбирают нужных особей и размножают их с применением жёсткой выбраковки животных, не соответствующих заданным параметрам, искусственного отбора и подбора пар, как и в предыдущем случае.
Эффективность этого метода намного выше, чем микроинъекции – она составляет до 70%! Но есть и недостатки: не только чужой ген действует на геном эмбриона, но и сам геном влияет на чужеродный ген, изменяя его работу. Если вирус встроился в участок ДНК эмбриона, который активно не работает, то и этот целевой ген тоже работать не будет, несмотря не своё присутствие в геноме трансгенного животного. Впервые вирусы для переноса гена использовал Рудольф Яниш в 1970 году.
Если в ходе ознакомления с данным материалом у вас возникли вопросы, их можно задать на нашем форуме.
Чугуевец Виталий
Читайте также:

