Получение спиртов из предельных и непредельных углеводородов кратко
Обновлено: 04.07.2024
Наибольшее промышленное значение имеют метанол и этанол.
Промышленный синтез метанола.
Метанол применяется в производстве ряда органических веществ (формальдегида, лекарств), используется как растворитель лаков и красок, служит добавкой к топливам. В настоящее время метанол получают экономически выгодным способом из синтез-газа:
1.Синтез-газ получают взаимодействием метана (природного газа) с водяным паром в присутствии катализатора:
2.Из синтез-газа получают метанол:

СО + 2Н2 СН3ОН +Q
1моль 2моль 1 моль
Эта реакция обратимая, экзотермическая, чтобы сместить равновесие в сторону образования метанола, нужно воспользоваться принципом Ле-Шателье:
1.Реакция сопровождается уменьшением объёма, поэтому повышение давления будет способствовать образованию метанола.
2.Реакция экзотермическая, следовательно, особенно сильно нагревать вещества нельзя.
Из-за обратимости процесса исходные вещества реагируют не полностью. Поэтому образовавшийся спирт необходимо отделять, а непрореагировавшие газы снова направлять в реактор, то есть осуществлять циркуляцию газов.
Получение спиртов из предельных и непредельных углеводородов.
1. Этанол в промышленности получают гидратацией этилена:
2. Из предельных углеводородов спирты получают через галогенопроизводные. Первая реакция – галогенирование алкана:
Вторая реакция- взаимодействие бромэтана с водным раствором щёлочи:

C2H5Br + НОН C2H5ОН + НBr
Щёлочь нужна, чтобы нейтрализовать НBr.
Промышленного значения такой способ не имеет, им пользуются в лабораториях. Но он важен в теоретическом отношении, так как показывает взаимосвязь между предельными углеводородами, их галогенопроизводными и спиртами.
Альдегиды, их химическое строение и свойства, получение и применение (на примере муравьиного и уксусного альдегидов).

Альдегиды – органические вещества, содержащие альдегидную функциональную

группу (или –СНО), соединённую с углеводородным радикалом.
Общая формула альдегидов:
Гомологический ряд
НСНО метаналь, формальдегид
СН3СНО этаналь, ацетальдегид
Физические свойства, применение
Формальдегид – газ с характерным запахом, ядовит, его 40% раствор называется формалином. Применяется в медицине для дезинфекции, получения пластмасс. Ацетальдегид – жидкость, растворимая в воде, ядовита, применяется для получения пластмасс, этанола, уксусной кислоты.
Химические свойства
ацетальдегид уксусная кислота
2. Окисление гидроксидом меди – качественная реакция на альдегиды – образование кирпично-красного осадка Cu2O
3. Восстановление водородом (получение спирта)
Получение
1. Окисление спиртов
2. Гидратация ацетилена

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |

| Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана: |

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |

Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
| Например: при гидрировании ацетона образуется изопропанол |

| Например, гидрирование диальдегида – один из способов получения этиленгликоля |

4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).

Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.

7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота |

При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат) |

Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

В этой статье мы разберемся, какие вещества называют спиртами, а также узнаем о них все, что требует школьная программа по химии за 10 класс.
О чем эта статья:
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН − .
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
У многоатомных — несколько групп ОН − .
Например, предельный двухатомный спирт этиленгликоль (этандиол):

Трехатомный спирт глицерин:

Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.

По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.

Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.

Радикально-функциональная номенклатура
СH3—OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
Высокий уровень развития науки химии и инновационные технологии позволили применять различные способы получения спиртов. Статистические данные свидетельствуют о росте спроса на производство данных видов органических соединений в промышленных масштабах.
К спиртам относят вещества, химическая формула которых включает гидроксильные группы (ковалентно связанные атомы кислорода и водорода - НО).
В зависимости от количества гидроксилов выделяют:
Одноатомные спирты - получают путем преобразования предельных углеводородов (алканов). Виды одноатомных органических соединений: пропанол 1 и 2; метанол; этанол и другие.
Полиолы (многоатомные спирты), к которым относятся: двухатомные (гликоли). Диол этиленгликоль выделяют из этилена. Триол (глицерин) относится к трёхатомным спиртам.

Классифицируют органические соединения по виду углеводородных радикалов: предельные, непредельные, ароматические.
Различают по месту привязки гидроксильной группы в молекулярной цепи: первичные, вторичные и т. д.
Свойства зависят от всех элементов молекулярного строения в совокупности.
Химические способы получения спиртов
Получают двумя основными способами: химическим (синтетические спирты) и биохимическим (биоспирты).
От метода получения, исходного сырья зависят свойства вещества, его целевое использование в промышленном, пищевом производстве. Для первого вида основным сырьём служит древесина и нефтепродукты. Этанол, полученный из этих продуктов в качестве технического спирта, используют в химическом, промышленном производстве. Он содержит определённое количество вредных примесей.
Применение биохимического способа предполагает использование в качестве исходного сырья продуктов растительного происхождения. Этим способом получают медицинский, пищевой этанол.
Получение спиртов из галогеноуглеводородов
Гидролиз галогенопроизводных происходит на основе реакции нуклеофильного замещения. Реагент на внешнем уровне молекулы имеет неопределённые пары электронов, которые отрываются и перестраивают молекулярную решётку.
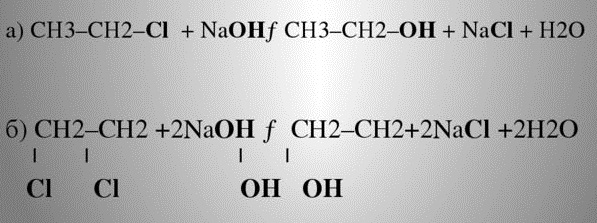
Под воздействием паров воды, щелочного раствора (реагента), температуры, галоген замещается гидроксилом, образуется спиртосодержащее органическое соединение.
Щелочной гидролиз галогеноалкенов — промышленный способ получения технического этанола из этилена.
Получение спиртов из алкенов
Алкены — этиленовые углеводороды. К ним относят бутен, этилен, пропилен и т. д. Их молекулярная цепочка включает двойную связь атомов углерода (Н₂С).
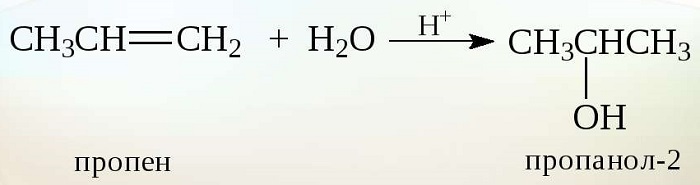
Существует два основных способа получения алкенов:
методом крекинга углеводородов (нефти и газа);
В зависимости от вида алкенов, в условиях высокой температуры (ориентировочно 300⁰С), давления (до 70 атмосфер) из водных растворов кислот образуются спирты. В промышленном производстве чаще в качестве реагента выступает ортофосфорная кислота.
Этот способ подходит для производства этилового и вторичных спиртов. К примеру из пропилена получают пропанол 2.
Получение из простых алкенов и спиртов
Спиртосодержащие органические соединения получают в результате реакции гидроборирования. Первичное сырьё (алкены) под воздействием раствора перекиси водорода гидролизуются, получают спирты.
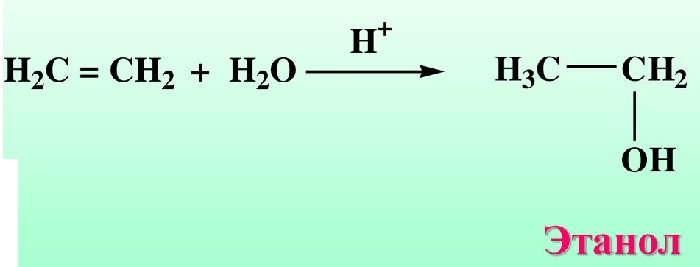
Гидратация — процесс сложный. Он происходит в два этапа:
Промежуточное соединение вступает в реакцию со щелочным раствором перекиси водорода.
Гидроборирование — быстрый и удобный способ получения первичных спиртов. Подобный процесс происходит при нагревании вторичных спиртов, обработки их щелочными растворами перекисью водорода.
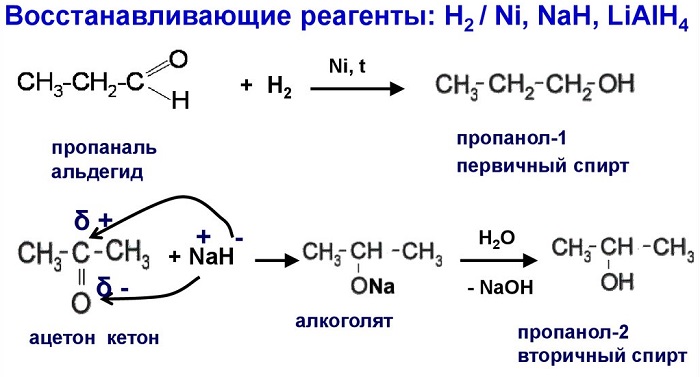
Получение спиртов из альдегидов и кетонов
Альдегиды и кетоны - вещества, в составе которых присутствует карбонильная группа (-СНО). У альдегидов –СНО связан с водородом и одним углеводородным радикалом. У кетонов 2 связи – СНО с радикалами.

Восстановление молекулы спирта происходит при нагревании с использованием никелевого катализатора. Реакция восстановления позволяет получать из альдегидов первичные спирты, из кетонов — вторичные.
Получение спиртов из карбоновых кислот и сложных эфиров
Процесс превращения карбоновых кислот, сложных эфиров в спиртоорганические соединения основан на реакции гомологизации. В результате дополнения метиленовых групп к молекулам кислот, эфиров образуются гомолог, спирт. Катализаторами процесса выступают алюмогидрид лития.
![]()
Сложный процесс проходит в несколько этапов:
Сначала в эфирную суспензию добавляется карбоновая кислота.
Её разделяют на фракции при помощи кислот, щелочных растворов.
Характерно, что это процесс взаимообратный. Из спиртосодержащих веществ синтезируют карбоновые кислоты, сложные эфирные соединения.
Получение спиртов восстановлением эпоксидов и карбонильных соединений
Оксираны (эпоксиды) или эпоксидные соединения — простые эфиры циклической формы с атомом кислорода.
Под воздействием реагентов литийдиалкилкупратов происходит разрыв кольцевой структуры молекулы, образуются молекулы органических спиртосодержащих соединений.
Получение спиртов с использованием металлорганических соединений
Исходным сырьём для получения служат карбоновые кислоты и их производные, эфиры, кетоны. Металлоорганические соединения кадмия, ртути, алюмний бромид, диалкилкупраты щелочных металлов - они вступают в реакцию с исходными компонентами (метод Гильмана). В качестве растворителя используют чаще хлористый метилен. Реакция происходит при низких температурах.
Получение спиртов окислительными методами
Используется несколько методик преобразования ненасыщенных спиртов с использованием разных реагентов и апротонных растворителей. Последние способны растворять ионные реагенты.

окисление диоксидом марганца + органический растворитель;
с использованием пентана, хлористого метилена;
окислители на основе хрома (6 валентного), марганца (6-7 валентного).
Процент выхода зависит от типа используемого реагента.
Другие способы получения спиртов
Существуют и другой способ - биохимического брожения сырья растительного происхождения. Лучше всего для этих целей подходят продукты с высоким содержанием сахара, клетчатки, крахмала. Под воздействием дрожжей, отдельных видов бактерий, плесневых грибов происходит брожение массы.
В сусле углеводы биомассы разделяются на углекислый газ, воду и этанол. Методом дистилляции выделяют его из перебродившего сусла. После ректификации (очищения), чистота этанола составляет 95-100%. Класс пищевого спирта определяет степень очистки, исходное сырьё для его производства.
Множество способов получения спиртов обусловлено широким спектром спиртосодержащих соединений и их свойствами.
Спирты - кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда - метанол - CH3OH. Общая формула их гомологического ряда - CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH - гликоли), трехатомными (3 группы OH - глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса "ол" к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) - алкены, а в реакциях с водным раствором щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы - образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии - кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный - образуются алкены.
- Диметиловый эфир - CH3-O-CH3
- Метилэтиловый эфир - CH3-O-C2H5
- Диэтиловый эфир - C2H5-O-C2H5

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
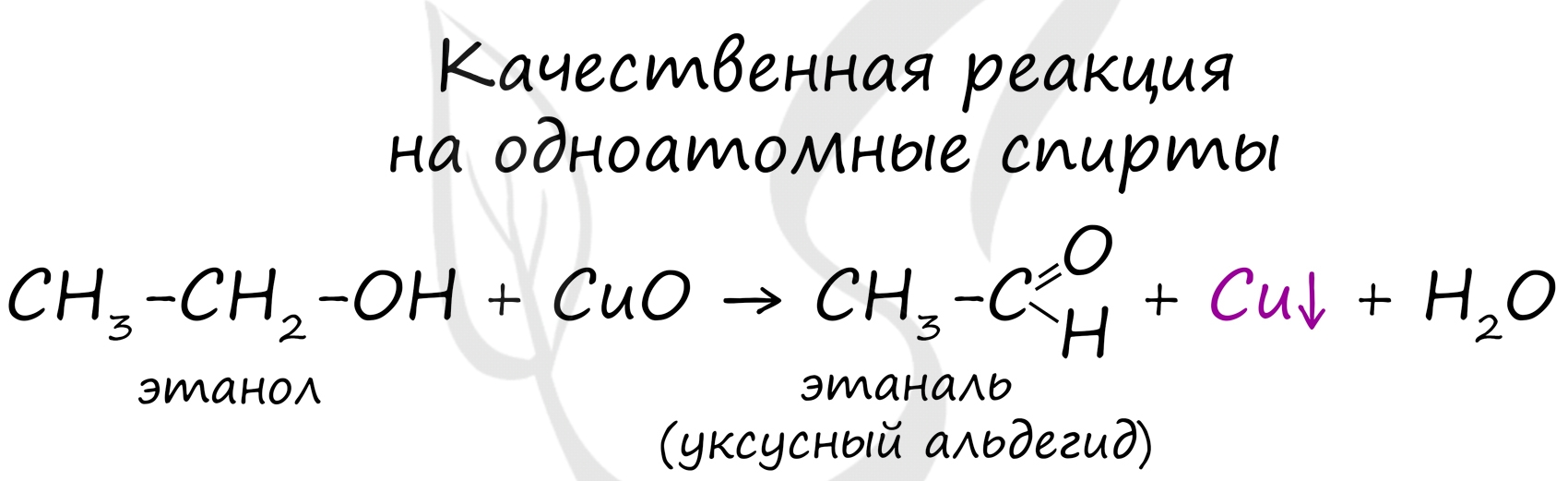
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть окислены далее - до карбоновых кислот, в отличие от кетонов, которые являются "тупиковой ветвью развития" и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:


