Получение серы в лаборатории кратко
Обновлено: 08.07.2024
Знать: план изучения подгруппы элементов и отдельных веществ; аллотропные модификации кислорода и серы; физические и химические свойства, получение и применение кислорода, серы, воды, оксидов серы(IV) и серы(VI), cерной кислоты, сульфатов; качественные реакции на сульфат- и сульфид-ионы; химические реакции, лежащие в основе производства серной кислоты; общие научные принципы химического производства.
Уметь: давать характеристику подгруппе элементов; предсказывать свойства веществ по их строению; рассматривать в сравнении аллотропные модификации; записывать уравнения реакций, характеризующие свойства кислорода, серы и их соединений; рассматривать химические свойства веществ с точки зрения окислительно-восстановительных и ионных представлений; на основе знаний о скорости химических реакций и химическом равновесии обосновывать выбор условий течения реакций, лежащих в основе производства серной кислоты; определять на практике сульфат- и сульфид-ионы; решать расчетные задачи на все ранее изученные типы.
Основные понятия: аллотропия, аллотропные модификации (видоизменения), водородная связь, сернистый ангидрид, серный ангидрид, комплексное использование сырья.
Контрольные вопросы
1. Каково строение атома серы?
2. Каковы возможные степени окисления серы в соединениях?
3. Назовите важнейшие минералы серы.
4. Где в природе встречается сера?
5. Как получают серу в промышленности?
6. Каковы физические свойства серы?
7. Какие аллотропные формы серы вам известны?
8. В какие реакции может вступать сера? Напишите уравнения реакций.
9. Где применяется сера?
10. Каковы физические свойства сероводорода?
11. Как расположены атомы в молекуле сероводорода, какого типа связь между ними и каковы их степени окисления?
12. Как получают сероводород? Приведите не менее двух уравнений реакций получения H2S.
13. Почему сероводород является сильным восстановителем?
14. Как происходит полное и неполное окисление сероводорода? Составьте уравнения соответствующих реакций.
15. Что образуется при растворении сероводорода в воде?
16. Какие реакции без изменения степени окисления серы S возможны для сероводорода? Напишите уравнения таких реакций.
17. Как распознать сульфиды? Где они применяются?
18. Какие оксиды образует сера? Каковы степени окисления серы в них?
19. Как можно получить диоксид серы? Назовите не менее трех способов получения SO2.
20. Почему диоксид серы может быть и окислителем, и восстановителем?
21. Какие реакции возможны для диоксида серы? Напишите уравнения реакций восстановления и окисления SO2.
22. Где применяется диоксид cеры?
23. Что образуется при растворении диоксида серы в воде?
24. Что вы знаете о сернистой кислоте?
25. Как можно получить триоксид серы? Напишите уравнение реакции.
26. Что образуется при растворении триоксида серы в воде?
27. Что такое олеум?
28. Каковы физические свойства серной кислоты?
29. Как правильно растворять концентрированную серную кислоту в воде?
30. Как в промышленности получают серную кислоту?
31. Каковы химические свойства разбавленной серной кислоты? Напишите уравнения реакций замещения и обмена с участием H2SO4 (разб.).
32. Какая качественная реакция на сульфат-ион? Составьте уравнения реакций в молекулярном и сокращенном ионном видах.
33. Почему концентрированная серная кислота является сильным окислителем?
34. Каковы особые свойства концентрированной серной кислоты?
35. Как концентрированная серная кислота взаимодействует с металлами?
36. Где применяются серная кислота и ее соли?
4.1. Некоторые соединения кислорода и серы,
их свойства
4.1.1. Лабораторные способы получения кислорода
В лаборатории кислород получают разложением перманганата калия. В сухую пробирку насыпают перманганат калия, герметично закрывают пробирку пробкой с газоотводной трубкой. Далее нагревают пламенем спиртовки сначала всю пробирку, а потом только ту ее часть, где находится перманганат калия. Конец газоотводной трубки опускают до дна банки или цилиндра. Присутствие кислорода проверяют с помощью тлеющей лучинки (рис. 1).
Рис. 1.
Лабораторная установка
для получения кислорода
4.1.2. Пероксид водорода
Соли, соответствующие пероксиду водорода, – пероксиды:
4.1.3. Cоединения серы в степени окисления +4
Окислители и восстановители: SO2 и Na2SO3.
Установка для получения диоксида серы состоит из колбы, пробки с газоотводной трубкой, пробирки-сборника, штатива и горелки. В колбу помещают сульфит натрия и заливают раствором серной кислоты. Далее колбу закрепляют в штативе и нагревают, сернистый газ будет поступать в пробирку-сборник с водой (рис. 2). (Сернистый газ ядовит, и его необходимо нейтрализовать.)
Рис. 2.
Получение диоксида серы
в лаборатории
4.1.4. Свойства концентрированной серной кислоты
Концентрированная серная кислота реагирует даже с металлами, расположенными в ряду напряжений правее Н с выделением SO2:
C активными металлами кислота H2SO4 (конц.) восстанавливается до S, H2S и SO2:
На холоду Н2SO4 (конц.) пассивирует металлы Fe, Al, Cr.
Кислота Н2SO4 (конц.) не действует на Au, Pt даже при нагревании.
Реакции серной кислоты с неметаллами:
Рис. 3.
Приготовление раствора
серной кислоты
4.1.5. Свойства сероводорода
Разложение при нагревании:
Горение полное (избыток О2):
Горение неполное (недостаток О2):
Взаимодействие с галогенами:
Окисление азотной кислотой:
Взаимодействие со слабыми окислителями:
Установка для получения сероводорода состоит из штатива с закрепленной пробиркой, резиновой пробки с отверстием и стеклянной трубки. В пробирку помещают сульфид железа(II) и доливают разбавленную хлороводородную кислоту, пробирку закрывают пробкой с газоотводной трубкой. Сероводород будет выделяться по трубке (рис. 4).
Рис. 4.
Получение сероводорода
в лаборатории
Правило смешивания: массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей:
где 1 и 2 – массовые доли веществ в смешиваемых растворах,
3 – массовая доля вещества в смеси, причем 1 > 3 > 2.
Для облегчения использования этого правила можно применять правило креста, или квадрат Пирсона:
В точке пересечения двух прямых помещают массовую долю вещества в смеси 3. У концов этих прямых слева от точки пересечения указывают массовые доли 1 и 2, а справа – разности массовых долей вещества в смеси и смешиваемых растворах: 3 – 2 и 1 –3.
Задача 1. Определите массы исходных растворов с массовыми долями серной кислоты 60% и 7,5%, если при их смешивании образовался раствор массой 350 г с массовой долей серной кислоты 15%.
Решение
Обозначим через m1 массу исходного раствора с 1 = 60% и через m2 массу раствора с 2 = 7,5%. Воспользуемся правилом креста:
Задача 2. В раствор, содержащий 15,9 г смеси сульфатов калия и магния, прибавили избыток хлорида бария. В результате образовалось 25,63 г сульфата бария. Определите массовые доли сульфата калия и сульфата магния в исходной смеси.
Решение
1. Запишем уравнения реакций:
2. Вычислим массы компонентов смеси.
Согласно условию задачи х + y = 15,9 г и a + b = 25,63 г.
Составим систему уравнений и решим ее:
3. Вычислим массовые доли солей в исходной смеси:
(К2SO4) = 8,74/15,9 = 0,55, или 55%,
(MgSO4) = 1 – 0,55 = 0,45, или 45%.
Задача 3. Железная пластинка массой 18 г опущена в раствор сульфата меди(II). Когда она покрылась медью, ее масса стала равной 20 г. Какая масса железа перешла в раствор?
Решение
Обозначим х = (Fe) = (Cu), тогда
56х – масса железа, перешедшего в раствор,
64х – масса меди, выделившейся на пластинке,
Отсюда х = 0,25 моль.
m(Fe) = 0,25•56 = 14 г – перешло в раствор.
Задания для самоконтроля
1. Допишите уравнения практически осуществимых реакций:
2. Какие из предложенных веществ реагируют между собой:
Напишите молекулярные и ионные уравнения реакций.
3. С какими веществами реагирует оксид серы(IV):
4. Напишите уравнения реакций следующих превращений:
Установите формулы веществ А и Х.
5. Составьте схемы электронного баланса, расставьте коэффициенты в уравнениях реакций:
6. Через раствор массой 280 г, содержащий 0,02 массовые доли гидроксида калия, пропустили 2,24 л оксида серы(IV). Какая соль (кислая или средняя) образовалась? Какова ее масса?
Ответ. Кислая соль KHSO3 массой 12 г.
7. Какова массовая доля гидроксида натрия в растворе массой 200 г, если известно, что при пропускании сернистого газа через раствор образуется сульфит натрия массой 25,2 г?
8. Рассчитайте массу серной кислоты, содержащейся в растворе объемом 2 л с массовой долей кислоты 0,98, плотность раствора 1,84 г/см 3 .
9. Какой объем раствора серной кислоты концентрацией 0,25 моль/л вступает в реакцию с цинком, если при этом выделяется водород объемом 6,72 л (н. у.)?
10. Оксид серы(VI) в промышленности получают согласно уравнению
Известно, что в состоянии равновесия концентрации [SO2] = 0,4 моль/л, [O2] = 0,2 моль/л, [SO3] = 0,8 моль/л. Вычислить исходную концентрацию [SO2].
11. При полном разложении 56,1 г смеси хлората калия и перманганата калия образовалось 8,96 л кислорода. Определите состав исходной смеси в % по массе.
12. При нагревании 63,2 г перманганата калия получено 3,36 л кислорода. Определите степень разложения перманганата калия (в %) и количественный состав твердого остатка.
13. Вычислите объем раствора серной кислоты с массовой долей Н2SO4 96% ( = 1,84 г/мл), необходимого для приготовления 2 л раствора с молярной концентрацией 0,25 моль/л.
Серу можно получить как из источников самородной серы, так и из ее соединений. В промышленности серу получают выплавкой самородной серы перегретым паром через скважины. Расплавленная сера выносится на поверхность, где ее разливают в формы.
В лаборатории серу можно получить из сульфида и сульфита натрия. Для этого нужно смешать их растворы в стехиометрическом соотношении и полученный раствор нейтрализовать соляной или серной кислотой:
Сера выделяется в виде мелкодисперсного порошка, который при отстаивании осаждается. Практически серу в лаборатории получают очень редко.

Внимание!
Прежде чем следовать каким-либо советам, проконсультируйтесь с врачом.
Медкурс.ру ©2007-2022.

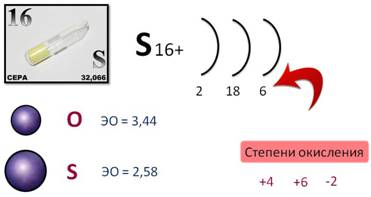
Сера расположена в ВИа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 . В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS 2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,

Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
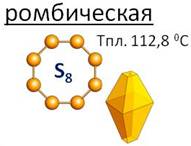
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.

Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S 8
t°пл. = 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
Окислительные свойства серы
( S 0 + 2ē → S -2 )
1) Сера реагирует со щелочными металлами без нагревания:
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2) С некоторыми неметаллами сера образует бинарные соединения:
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
( S — 2ē → S +2 ; S — 4ē → S +4 ; S — 6ē → S +6 )
S + O 2 – t° → S +4 O 2
2S + 3O 2 – t °; pt → 2S +6 O 3
S + Cl 2 → S +2 Cl 2
S + 3F 2 → SF 6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H 2 SO 4 (конц) → 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) → H 2 S +6 O 4 + 6NO 2 + 2H 2 O
Реакции диспропорционирования:
6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
7) сера растворяется в концентрированном растворе сульфита натрия:
S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия

Данный видеоурок полностью посвящён сере. Начинается он стихотворением о сере. Затем подробно рассказано об особенностях строения её атома, нахождении в природе, характерных степенях окисления, а также аллотропных модификациях серы. Здесь описаны все химические свойства серы, а уравнения рассматриваются с позиции процессов окисления-восстановления. В уроке есть демонстрация горения серы на воздухе и в кислороде. Кроме серы, здесь описываются характерные свойства и таких её соединений, как сероводорода, оксидов и сернистой кислоты.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Сера, соединения серы"
Сера, соединения серы
Немало сера знаменита,
И в древности её Гомэр воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.



Сера – элемент VI A группы, значит, на внешнем энергетическом уровне у неё шесть электронов. По сравнению с кислородом, радиус атома серы больше, меньшее значение электроотрицательности, поэтому восстановительные свойства у неё выражены сильнее. Для серы характерны такие степени окисления, как +4, +6, а в соединении с менее электроотрицательным элементом, её степень окисления -2.
Для серы характерна аллотропия. Сера существует в трёх аллотропных модификациях: ромбической, моноклинной, пластической.
Наиболее известна ромбическая сера. В узлах её кристаллической решётки находятся циклические восьмиатомные молекулы, которые напоминают корону, атомы серы здесь соединены одинарными ковалентными связями. Ромбическая сера – хрупкое жёлтое вещество, легко измельчается в порошок.
Её кристаллы имеют вид октаэдров со срезанными углами. Эти кристаллы окрашены в лимонно-жёлтый цвет, их температура плавления 112,8 0 С. При комнатной температуре в эту модификацию превращаются все остальные модификации.
Моноклинная сера получается при кристаллизации из расплава, она представляет собой игольчатые кристаллы, температура плавления которых 119,3 0 С.

При нагревании кусочков серы в пробирке она плавится, превращается в жидкость жёлтого цвета. При температуре 160 0 С жидкая сера начинает темнеть, приобретая прежний тёмно-коричневый цвет. Если её вылить в холодную воду, то она застывает в виде прозрачной резинообразной массы. Это и есть пластическая сера в виде нитей. Но через несколько дней она также превращается в ромбическую серу.

Сера не растворяется в воде, кристаллы серы в воде тонут, а порошок плавает по поверхности, но она хорошо растворима в сероуглероде.





Сера вступает в реакции с металлами. Например, в реакции серы с кальцием образуется сульфид кальция. Кальций повышает свою степень окисления с 0 до +2, а сера понижает с 0 до -2. В этой реакции кальций – восстановитель, а сера – окислитель.

Сера вступает в реакцию и с ртутью, при этом образуется сульфид ртути (II). Ртуть повышает свою степень окисления с 0 до +2, а сера понижает степень окисления с 0 до -2. Ртуть выступает в роли восстановителя, а сера – в роли окислителя. Эта реакция лежит в основе удаления и обезвреживания разлитой ртути. Такой процесс называется дэмеркуризацией.

Сера вступает в реакцию с водородом. В результате этой реакции образуется сероводород. Водород повышает свою степень окисления с 0 до +1, а сера понижает с 0 до -2. В этой реакции водород выступает в роли восстановителя, а сера – в роли окислителя.
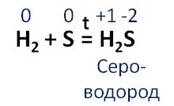
Сера реагирует с кислородом с обрзованием сернистого газа. В этой реакции сера повышает свою степень окисления с 0 до +4, а кислород понижает с 0 до -2. Сера является восстановителем, а кислород – окислителем.

Проведём эксперимент: наберём в ложечку для сжигания веществ немного серы и нагреем на пламени спиртовки. Сера горит, но на воздухе горение почти незаметно. Опустим горящую серу в колбу с кислородом, сера горит ярким синим пламенем. При этом выделяется газ с характерным резким запахом.

В природе сера встречается в самородном состоянии и в виде соединений. Вам уже известны такие природные соединения серы, как цинковая обманка – ZnS, киноварь – HgS, свинцовый блеск – PbS, пирит, или колчедан – FeS2, CuS – медный блеск, глауберова соль – Na2SO4 ∙ 10H2O, гипс – CaSO4 ∙ 2H2O, горькая, или английская соль – MgSO4 ∙ 7H2O.


Сера – жизненно важный химический элемент. Она входит в состав некоторых белков, витаминов и гормонов. Сера участвует в окислительно-восстановительных процессах организма, при недостатке серы в организме наблюдаентся хрупкость и ломкость костей, выпадение волос.
Серой богаты бобовые растения, овсяные хлопья и яйца.



Серу используют в производстве спичек и бумаги, резины и красок, взрывчатых веществ и лекарств, косметических препаратах. В сельском хозяйстве её применяют для борьбы с возбудителями грибных и бактериальных болезней, вредителями растений. Около половины добываемой серы идёт на производство серной кислоты.

Сероводород – H2S – одно из соединений серы. Сероводород представляет собой бесцветный газ с резким запахом, он ядовит и вызывает отравление даже при незначительном содержании в воздухе. В одном объёме воды растворяется 2,5 объёма сероводорода. Сероводород может накапливаться в организме, соединяясь с железом гемоглобина, что может привести к обморочному состоянию. Сероводород входит в состав некоторых минерльных вод, применяемых с лечебной целью.

Сероводород содержится в вулканических газах и постоянно образуется на дне Черного моря. Он образуется при гниении белка.
При растворении в воде сероводорода образуется слабая сероводородная кислота. Соли сероводородной кислоты называют сульфидами. Сульфиды щелочных и щелочноземельных металлов и сульфида аммония хорошо растворимы в воде, остальные сульфиды нерастворимы и окрашены в различные цвета. Например, сульфид цинка – ZnS – белого цвета, сульфид свинца (II) – PbS – чёрного цвета, сульфид марганца (II) – MnS – розового цвета.
В лаборатории сероводород получают действием соляной кислоты на сульфид железа (II).

Сероводород горит с образованием сернистого газа и воды.

Но если охладить это пламя, то образуется не сернистый газ, а свободная сера.

В реакциях сероводород является восстановителем, потому что у серы здесь минимальная степень окисления.
Раствор сероводорода в воде – сероводородная кислота.

Поэтому диссоциирует с образованием гидросульфид-иона и сульфид-иона.

Качественной реакцией на сероводородную кислоту и её соли является взаимодействие с растворами солей свинца (II). При этом образуется осадок сульфида свинца (II) чёрного цвета.

Сера образует ещё одно соединение – оксид серы (IV), которое образуется при сгорании серы. Это бесцветный газ с резким запахом, тяжелее воздуха и ядовит.

В промышленности оксид серы (IV) получают при горении серы и полном сгорании сероводорода при обжиге руд.

В лаборатории его получают действием кислот на сульфиты. Например. При взаимодействии сульфита натрия и серной кислоты образуется гидросульфат натрия сернистый газ и вода.

Оксид серы (IV) – кислотный оксид, проявляет все свойства, характерные для кислотных оксидов. При растворении в воде он образует сернистую кислоту. Эта неустойчивая кислота, которая разлагается на исходные вещества.
H2O + SO2 ↔ H2SO3
Соли сернистой кислоты назывются сульфитами. Эта кислота может образовывать средние и кислые соли. Например, Na2SO3 – сульфит натрия – средняя соль, NaHSO3 – гидросульфит натрия – кислая соль. Эти две соли используют при отбеливании шерсти, шёлка, бумаги и соломы, в качестве консервирующих средств.
Таким образом, сера – элемент VI A группы, у неё шесть электронов на внешнем энергетическом уровне. В соединениях она проявляет степени окисления +4, +6 и -2. Поэтому в реакциях она проявляет восстановительные и окислительные свойства. Для серы характерны аллотропные модификации. Сера в природе находится в свободном состоянии и в виде соединений. Наиболее распространёнными соединениями серы является оксид серы (IV) и сероводород. Сера и её соединения находят широкое применение во многих областях народного хозяйства.
Читайте также:

