Получение моноклональных антител кратко
Обновлено: 02.07.2024
Моноклональные антитела — это новейшее достижение медицины, которое применяется при лечении тяжелых заболеваний. Среди них злокачественные новообразования, аутоиммунные, системные, заболевания сердечно-сосудистой системы, некоторые инфекции и многое другое. Помимо этого, моноклональные антитела широко используются в диагностике, например, в иммуногистохимии, иммуноферментном анализе, проточной цитофлуориметрии и др. Таким образом, данная технология используется во многих отраслях современной медицины.
Человечество уже давно открыло для себя действие антител — особых молекул, которые вырабатываются клетками иммунной системы для распознавания чужеродных агентов — антигенов и их уничтожения. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген, причем не просто антиген, а отдельный его фрагмент — детерминантную группу. В одном антигене может быть несколько таких детерминантных групп, и к ним будут образовываться разные антитела. Более того, к одной детерминанте может образовываться сразу несколько видов антител, которые могут отличаться по структуре, степени родства и прочности связывания. Таким образом, при введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту.
Антитела образуются специальными антителообразующими клетками. Причем каждый их вид образуется отдельной группой генетически однородных клеток — клонов. Чем больше необходимо видов антител, тем больше образуется клонов. Соответственно, антитела, которые вырабатываются одним клоном клеток называются моноклональными антителами.
Раньше для производства антител применялась иммунизация животных, после которой отбиралась их плазма и использовалась для приготовления отдельных препаратов — иммунных сывороток для борьбы с различными токсинами (дифтерия, столбняк), вирусами, ядами и др. Но бывают ситуации, когда нужно конкретное антитело, направленное на конкретную детерминанту антигена. Здесь уже обычной иммунизацией не обойтись. Требуются более прицельные технологии.
Способы получения моноклональных антител
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.

В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.

Изменение клеточных сигналов
В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Комплемент-зависимая цитотоксичность
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Усиление цитотоксического воздействия иммунных клеток
Развитие адаптивного иммунитета
Препараты с моноклональными антителами
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Применение неконъюгированных антител
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы. Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета.
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Применение конъюгированных антител
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.

Проблемы при использовании моноклональных антител
Несмотря на, казалось бы, огромные перспективы в лечении онкологических больных, применение моноклональных антител не является панацеей и тоже имеет ряд проблем:
- Препараты на основе моноклональных антител биологически и биохимически нестабильны. Особенно это касается конъюгированных антител. Это требует особых условий производства, хранения и транспортировки.
- Антитела плохо проникают внутрь опухоли.
- Они могут вызывать иммунный ответ против себя, что блокирует их действие. У 75% пациентов, которым вводились мышиные антитела, наблюдалось образование нейтрализующих антител, что снижало эффективность лечения.
- Препараты на основе моноклональных антител оказывают токсическое действие. Конечно, оно не такое выраженное как у цитостатиков, но в ряде случаев токсичность настолько высокая, что требует отмены препарата.
- Наиболее важным моментом является высокая специфичность моноклональных антител и высокая гетерогенность опухолевых клеток. Не все раковые клетки имеют молекулы мишени, на которые направлено действие препарата. Соответственно, они ускользают от его действия и остаются нетронутыми. Постепенно масса этих клеток накапливается и опухоль становится резистентной к данному методу лечения.
Чтобы улучшить результаты лечения, разрабатываются новые виды моноклональных антител. Одним из вариантов являются биспецифические антитела, которые направлены сразу на две молекулярные мишени, например, блинатумомаб — препарат, направленный сразу на две клеточные мишени В-лимфоцита — CD 19 и CD22. Он повышает узнаваемость злокачественных клеток даже после их трансформации в другие виды лейкоза.
В любом случае моноклональные антитела — это новое и высокоперспективное направление в современной онкологии. Разработка современных, более совершенных технологий помогает решать имеющиеся проблемы и делает лечение пациентов эффективнее и безопаснее.
Моноклональные антитела в биотехнологии. Использование моноклональных антител.
Люди обладают иммунной системой, которая способна отвечать на внедрение чужеродных молекул образованием антител. Молекулы, которые стимулируют образование антител, называются антигенами. Обычно это белки или гликопротеины. Каждый антиген стимулирует образование специфического антитела, которое точно ему соответствует и способно связываться с ним и разрушать его. Так, например, если чужеродное тело поступает с определенным видом бактерий, иммунная система распознает антигены на внешних мембранах бактериальных клеток как чужеродные и соответственно образуются антитела, специфичные к этим антигенам. Антитела продуцируются особыми лимфоцитами, которые называются В-клетками.
В 1970-х годах Цезарь Мильштейн (С. Milstein) и Георг Кёлер (G. Kohler), работавшие в Кембридже, пытались найти способ получения антител только одного типа. До того времени антитела выделяли из крови животных, которых специально подвергали действию нужного антигена. Однако конечный продукт получался недостаточно чистым и содержал сотни различных антител. Мильштейн и Кёлер решили проблему, разработав методику получения моноклональных антител, за которую в 1984 г. они были удостоены Нобелевской премии. Мо-ноклональный означает принадлежащий одному клону. Каждый тип антител продуцируется одним типом В-клеток, которые клонируют сами себя, другими словами, размножаются, образуя много идентичных копий самих себя в ответ на определенный антиген. Теоретически можно выделить и культивировать определенный тип В-клеток и получить большое количество чис-тых антител одного типа.
Поскольку все антитела, полученные таким путем, происходят от одного клона, они называются моноклональными. Однако в культуральной среде В-клетки могут поддерживаться лишь несколько дней. Мильш-тейн и Кёлер путем слияния В-клеток с раковыми клетками, которые являются бессмертными, получили клетки гибридомы. Эти клетки продолжают размножаться и могут быть клонированы, что позволяет получать большое количество антител.
Получение моноклональных антител
Получение моноклональных антител начинают с того, что определенный антиген вводят лабораторному животному (обычно это мышь). Спустя некоторое время, необходимое для иммунного ответа, из селезенки животного выделяют лимфоциты и смешивают их с особым типом раковых клеток в соответствующей культуральной среде. Чтобы стимулировать слияние лимфоцитов с раковыми клетками, в среду добавляют по-лиэтиленгликоль. Подбирают такие условия роста, которые позволяют выживать только гибридным клеткам. Из них выбирают клетки, производящие определенные антитела, и культивируют эти клетки отдельно. Клетки продолжают делиться независимо и являются постоянным источником чистых антител.

Использование моноклональных антител
ТЕСТ НА БЕРЕМЕННОСТЬ.
Из 150 диагностических моноклонапьных антител, применяемых в настоящее время, примерно одна треть используется для выявления беременности. Как только эмбрион достигает матки (в пределах четырех дней после зачатия), он прикрепляется к ее стенке. Этот процесс называется имплантацией. Информация об этом поступает в яичники женщины, чтобы они могли отреагировать соответствующим образом. При поступлении такого сигнала яичники производят гормоны, поддерживающие внутренний слой матки. При этом у женщины прекращаются менструации, и эмбрион сохраняется. Сигналом для яичников служит гормон, продуцируемый ворсинками хориона — органа, с помощью которого зародыш соединяется со стенкой матки. Название этого гормона — хори-онический гонадотропин человека (сокращенно ХГЧ). Он циркулирует в крови матери, откуда и поступает в яичники. Ко времени, когда у женщины в норме должна начаться менструация (примерно через 14 дней после зачатия), уровень ХГЧ повышается настолько, что его можно обнаружить в моче. ХГЧ является гликопротеином, и к нему можно получить антитела с помощью описанного выше метода.
Современные тесты на беременность основаны на выявлении ХГЧ в пробе мочи женщины с помощью моно-клональных антител. Процедура описана на рисунке. Набор для тестирования в домашних условиях, с помощью которого результат получают в течение 5 мин, имеется в продаже. Можно установить беременность даже раньше, если для исследования использовать кровь.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Моноклональные антитела, которые можно выработать против практически любого природного антигена, широко используются как в молекулярной биологии и биохимии, так и в медицине.
Авторы
Редакторы
Эта статья посвящена замечательному достижению современной иммунологии — методу гибридóм. Соматический гибрид нормальной антителообразующей и опухолевой клеток (гибридóма) дает потомство, обладающее бессмертием опухолевой клетки и способностью к синтезу антител, унаследованному от клетки нормальной. Гибридомы продуцируют огромное количество моноклональных антител, обладающих уникальной специфичностью.
При введении в организм животных и человека чужеродных макромолекулярных веществ — белков или полисахаридов (антигенов) в крови появляются защитные белки — антитела, для которых характерна необыкновенная, уникальная специфичность. Каждое антитело узнает только свой антиген, точнее, одну его детерминантную группу. Детерминантная группа состоит из нескольких остатков аминокислот или сахаров (обычно из 6–8), образующих пространственную структуру, характерную для данного белка. В одном белке, состоящем из нескольких сот аминокислот, имеется несколько (5–15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней. То же относится и к полисахаридным антигенам, детерминантные группы которых образуются 3–6 остатками моносахаридов.
Таким образом, при введении антигена возникает большое семейство антител, направленных к разным его детерминантам и различающихся также внутри группы антител, направленных к одной и той же детерминанте. В крови иммунизированных животных появляется богатый и уникальный по составу спектр антител, который и обеспечивает их абсолютную специфичность в распознавании данного антигена.
Антитела давно и широко используются для нейтрализации бактериальных токсинов (дифтерийного, столбнячного), змеиных ядов (кобры, гадюки), вирусов, попавших в кровь (особенно эффективно для вируса кори), и для идентификации индивидуальных белков (и других антигенов), находящихся в клетке или сложнейших тканевых экстрактах. Однако иногда требуются не многокомпонентные смеси антител, возникающие в крови в ответ на введение антигена, а отдельные, элементарные составляющие этой смеси, направленные лишь к одной детерминанте антигена и имеющие одни и те же характеристики. Такие антитела бывают нужны как для изучения их собственной природы, так и для практического использования, например для доставки в опухоли токсических веществ.
Как получить такие антитела?
Очевидно, что путем иммунизации, то есть введением животному индивидуального антигена или только одной его детерминантной группы, это сделать, как правило, невозможно. Почему? Дело в том, что в организме в процессе созревания антителообразующих клеток (АОК) образуется большое количество (миллионы) генетически однородных семейств клеток — клонов, каждый из которых специализируется на синтезе только одного варианта антител, и в этом причина большого разнообразия антител, индуцируемых даже одним антигеном. Таких клонов много больше, чем требуется антител для распознавания любого, случайно взятого антигена. Антиген, попадая в организм, стимулирует размножение тех клонов, которые продуцируют антитела к его детерминантам.
Казалось бы, выход прост: надо вырастить отдельные клоны антителообразующих клеток in vitro — в культуре тканей — и они будут продуцировать моноклональные антитела, то есть антитела одной строго определенной специфичности, продукт одного клона. Но и это оказалось невозможным: нормальные клетки смертны, вскоре после высаживания в культуру они погибают. Дело не доходит до образования клонов АОК. Добавление в культуру факторов роста несколько продлевает их жизнь, но тоже не решает проблемы.
Дорогу указывают опухоли
Слишком редки были совпадения. Тогда попробовали индуцировать опухоли антителообразующих клеток опухолеродными вирусами. Результаты были лучше, однако создать простой и универсальный метод получения моноклональных антител на этом пути также не оказалось возможным.
Как это было сделано?
Успех пришел, как всегда, неожиданно, как побочный продукт исследования, имевшего иные цели. В начале 70-х годов молодой немецкий иммунолог Жорж Кёлер, получивший стипендию для работы в знаменитом Базельском институте иммунологии, заинтересовался вопросом о генетической изменчивости антител. В то время можно было ожидать, что антитела мутируют (генетически изменяются) с бóльшей частотой, чем другие белки. Для исследования надо было изолировать клон АОК, продуцирующий антитела определенной специфичности, получить из него стабильную клеточную линию, поддерживаемую в пробирке (в культуре), и проследить, с какой частотой появятся там генетически измененные варианты. Для реализации проекта Кёлер поехал в Англию, в лабораторию Сезара Мильштейна, изучавшего клоны плазмоцитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной АОК и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой — бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить.
Гибридóмы
Методы гибридизации соматических (то есть не половых) клеток к тому времени были хорошо известны и широко применялись для разных целей. Для этого использовали вирус, способствующий слиянию клеток. Разнородные клетки, у которых слились оболочки, образовывали двуядерные гибриды, которые сохраняли способность к клеточным делениям. В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридóма. Гибридому можно получить и между нормальной АОК и опухолевой, плазмоцитомной клеткой. Плазмоцитома была взята потому, что она больше всего соответствовала АОК по типу дифференцировки: весь ее синтетический аппарат был настроен на синтез иммуноглобулинов. Проблема заключалась в том, как отделить заданную гибридому от присутствующих в системе отдельных неслившихся клеток и от гибридов иного состава или иной специфичности, чем требуемые.
Для достижения этой цели авторы разработали специальную схему, использующую отбор клеток в селектирующей среде. Прежде всего был получен особый мутант мышиной плазмоцитомы, рост которого можно было контролировать составом питательной среды. Для получения мутанта использовали особенности синтеза нуклеиновых кислот (ДНК и РНК), имеющихся во всех клетках и необходимых для их существования. Известно, что имеются два пути синтеза предшественников нуклеиновых кислот: основной и резервный. Основной — это путь новообразования нуклеотидов (звеньев, входящих в состав нуклеиновых кислот). Этот путь включает несколько этапов и блокируется противоопухолевым препаратом аминоптерином (А). Однако клетки не гибнут от этого препарата, поскольку обладают резервным путем — способностью синтезировать нуклеотиды и нуклеиновые кислоты, реутилизируя продукты распада ранее синтезированных нуклеиновых кислот: гипоксантина (Г) и тимидина (Т). Добавление Г и Т в питательную среду, содержащую А, снимает токсический эффект последнего.
Для селекции гибридом надо было получить мутант плазмоцитомы, не способный пользоваться резервным путем и, следовательно, погибающий в среде, содержащей Г, A и T (ГАТ-среда). Такой мутант получили путем добавления в среду токсических аналогов Г и Т. Все клетки, способные усваивать Г и Т, включали их токсичные аналоги и погибали. Выживали лишь те редкие мутанты, которые были неспособны усваивать Г и Т, то есть были лишены резервного пути. Из потомства этих клеток дополнительно отбирали еще и такие мутанты, которые утратили способность к синтезу собственных иммуноглобулинов. Теперь все было готово для получения гибридом, то есть гибридов нормальных АОК и плазмоцитомных клеток (рис. 1).
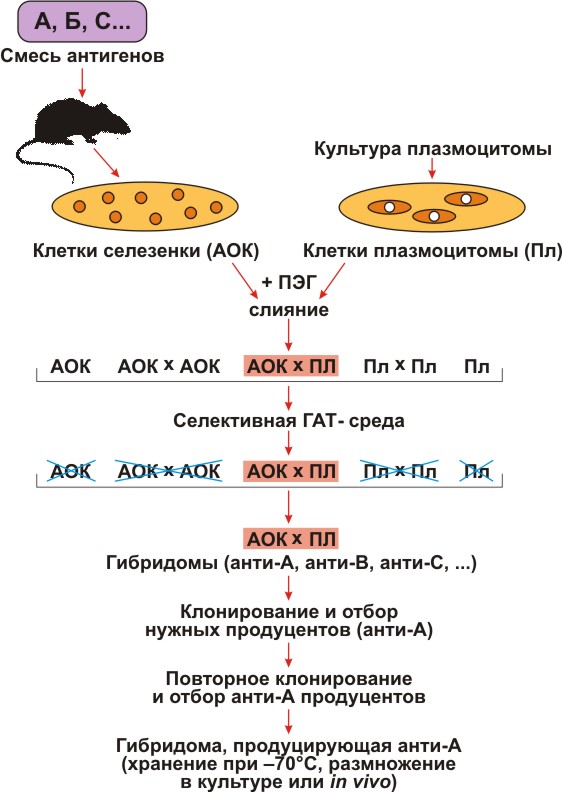
Рисунок 1. Схема получения гибридом. Условные обозначения: А, В, С — многокомпонентная смесь антигенов, использованная для иммунизации; АОК — антителообразующие клетки селезенки; Пл — клетки плазмоцитомы, не растущие в селективной ГАТ-среде; ПЭГ — полиэтиленгликоль; ГАТ — среда, содержащая гипоксантин, аминоптерин, тимидин; анти-А, анти-В, анти-С — моноклональные антитела соответственно к А-, В-, С-антигенам.
Мышей интенсивно иммунизировали определенным материалом — белком, бактериальной клеткой или клеткой животного происхождения. Когда в их крови появлялись антитела, у них брали селезенку и лимфатические узлы (места скопления АОК), и из них готовили взвесь клеток. К ней добавляли в избытке клетки мутантной плазмоцитомы и полиэтиленгликоль (ПЭГ). После короткой инкубации, требующейся для слияния клеток, их отмывали от ПЭГа и помещали в среду, содержащую Г, Т и А (ГАТ-среда). Теперь в системе находились гибриды АОК и АОК, АОК и плазмоцитомы, а также оставшиеся свободными АОК и клетки плазмоцитомы. Из них нужно было отобрать только гибриды АОК и плазмоцитомы. После недолгого (несколько дней) культивирования одиночные АОК, а также гибриды АОК и АОК погибали, так как нормальные клетки смертны и быстро погибают в культуре.
Плазмоцитомные клетки и их гибриды также погибали, так как А блокировал основной путь синтеза предшественников нуклеиновых кислот, а Г и Т их не спасали. Выживали, следовательно, только гибриды АОК и плазматических клеток, так как бессмертие они унаследовали от плазмоцитомы, а резервный путь — от нормальной клетки. Такие гибриды — гибридомы — сохраняли способность синтезировать и секретировать антитела.
Моноклональные антитела
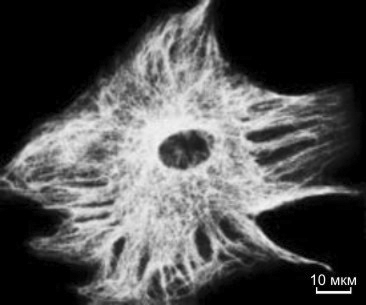
Рисунок 2. Иммунофлуоресцентное окрашивание клетки соединительной ткани (фибробласта) моноклональным антителом к тубулину — белку микротрубочек, образующих скелет клетки.
Применение
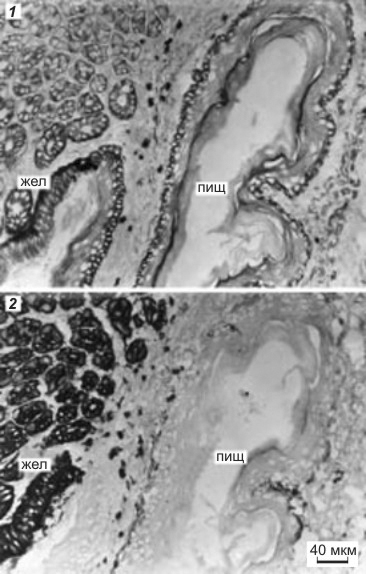
Рисунок 3. Последовательные срезы через желудок (жел) и пищевод (пищ) мыши, окрашенные двумя моноклональными антителами: 1 — первое моноклональное антитело реагирует с эпителием пищевода и слабее с эпителием желудка; 2 — второе моноклональное антитело реагирует только с эпителием желудка.
Обычные поликлональные антитела давно и широко применяются для определения биологически активных веществ — белков крови и других биологических жидкостей, гормонов, ростовых факторов, клеточных рецепторов, медиаторов воспаления и иммунитета, бактериальных и вирусных антигенов, различных ядов и т.п. Моноклональные антитела из-за высочайшей специфичности, стандартности и технологичности получения успешно вытесняют и заменяют иммунные сыворотки.
Первоначально статья была опубликована в Соросовском образовательном журнале [1], позже — на сайте автора.
Синтетические моноклональные антитела
Автор дополнительной главы — Жанна Олиферова.
Описанный выше метод гибридом позволил получать неограниченное количество моноклональных антител, специфичных к одной детерминантной группе. Их широкое применение в медицине и иммунологии поставило новые задачи:
- Мышиные антитела плохо подходят для использования в клинической практике — они вызывают иммунный ответ в организме человека точно так же, как введённый антиген приводит к выработке антител у мышей, из-за чего они быстро удаляются из организма. Стремление создать полностью человеческие антитела для клинической практики стало стимулом для разработки новых технологий.
- Иммунизация — необходимое условие для получения гибридомы, но не все молекулы могут легко активировать АОК. Например, они могут быть слишком токсичны для введения мышам. Каждая гибридома производит антитело только к одной детерминанте, но не всегда можно выбрать антитела с необходимой специфичностью к нужному белку даже из большого количества гибридом. Например, у исследователя могут быть такие требования к антителам: специфически связываться только с одним из двух похожих белков или узнавать только одну конформацию белка. Получить такие антитела при помощи метода гибридом очень трудно, потому что при иммунизации антитела могут вырабатываться к антигенным детерминантам, которые одинаковы у двух белков, так как они расположены на поверхности и более доступны для связывания антител. Требовался новый метод, который бы позволил получать антитела нужной аффинности и специфичности, не прибегая к иммунизации мышей.
Появление такого метода стало возможном благодаря развитию нескольких научных направлений. Прежде всего этому способствовал прогресс в понимании структуры и функции антител. Какой механизм обусловливает высокую аффинность и специфичность антител, которые производит гибридома? Во время дифференцирования B-лимфоцитов (в процессе соматической генетической рекомбинации) нуклеотидная последовательность гена, кодирующего вариабельный домен B-клеточного рецептора, собирается из нескольких сегментов (рис. 4). Эта последовательность уникальна у каждой B-клетки, как и рецепторы на её поверхности. Когда B-клетка узнаёт свой антиген, она активируется и становится АОК, часть из которых сразу начинает производить антитела низкой аффинности. Рецепторы других АОК проходят процесс аффинного созревания, в результате которого аффинность и специфичность рецептора АОК, а, следовательно, и антител, повышается.

Аффинное созревание основано на соматической гипермутации, в процессе которой в последовательности вариабельных доменов рецепторов специальные белки вносят 1–5 мутаций на каждое деление клетки. Большинство мутаций приводит к тому, что B-клетка перестает узнавать антиген и погибает. Редкие мутации повышают аффинность рецептора к антигену (такие мутации накапливаются в CDR-участках), и B-клетки, несущие такие рецепторы, выживают, размножаются и производят антитела с высокой аффинностью и специфичностью [7], [8]. К сожалению, этот процесс ещё недостаточно хорошо изучен, чтобы его можно было контролировать в пробирке и таким образом получать антитела с нужной специфичностью.
Развитие методов генной инженерии привело к появлению новых возможностей: вариабельные и константные участки генов, кодирующих антитела, можно комбинировать в пробирке, вносить в них мутации, отбирать необходимые варианты и экспрессировать в бактериях. Так можно получать антитела с нужными свойствами, не иммунизируя мышей. Для того чтобы это стало реальностью, сначала надо было создать библиотеки вариабельных доменов антител. Начало этому было положено в 1989 году, когда соответствующие гены были выделены из пяти гибридом и из активированных клеток селезёнки иммунизированных мышей. Эти гены были клонированы, и были определены их нуклеотидные последовательности. В настоящее время для создания библиотек используют вариабельные домены наивных (неактивированных) лимфоцитов мышей или человека и даже комбинируют фрагменты природных вариабельных доменов с синтезированными человеком [9].
В 1988 году Fab-фрагмент антитела впервые был экспрессирован в бактерии. Чтобы создавать антитела без использования гибридом, оставалось решить последнюю задачу: физически связать между собой антитело и кодирующий его ген, тогда выбрав из библиотеки антитело, специфичное к данной молекуле, можно клонировать его ген для экспрессии в бактерии и получать нужное количество антител. В 1990 году Г. Винтер и соавторы встроили в геном бактериофага нуклеотидную последовательность Fab-фрагмента антитела, объединив его с частью гена поверхностного белка III этого фага [10]. Это позволило экспрессировать на поверхности каждой вирусной частицы несколько копий этого гибридного белка, сохраняющего специфичность к своему антигену, — а значит, можно было проводить селекцию нужного антитела из фаг-дисплейной библиотеки (рис. 5). Один раунд селекции может увеличить частоту фага, специфичного к данному антигену, в 1000 раз. За несколько раундов можно из большой популяции выделить редкие фаги, специфичные к данному антигену, извлечь из них ДНК, определить нуклеотидную последовательность и клонировать для получения антител в бактерии.

Рисунок 5. Фаг-дисплейные библиотеки. Бактериофаги, несущие миллионы различных фрагментов антител, наносят на колонку, содержащую нужный антиген (1). После отмывания ненужных фагов (2), те, которые связывают данный антиген (3), снимают с колонки и размножают в бактериях (4). Нуклеотидная последовательность отобранных фагов может быть модифицирована (5), после чего мутированные фаги размножают в бактериях (6) и повторяют процесс селекции (7).
Кристаллографические структуры комплексов антиген—антитело позволили понять принципы организации, стоящие за кажущимся бесконечным разнообразием природных антител [11], [12]. Например, за исключением CDR-участков, структура антител довольно консервативна: известно всего несколько десятков различных структур, некоторые из которых более стабильны и встречаются в природных антителах чаще. При создании современных фаг-дисплейных библиотек выбирается одна наиболее стабильная структура вариабельных доменов тяжёлой и легкой цепи, разнообразие аминокислотных остатков CDR-участков создаётся искусственно [12]. Анализ природных антиген-связывающих сайтов антител выявил, что наиболее часто непосредственно взаимодействуют с поверхностью антигена аминокислотные остатки тирозин (Tyr) и серин (Ser), поэтому первые библиотеки синтетических антител получали, варьируя именно эти остатки в ключевых позициях CDR. В последующих поколениях библиотек начали варьировать также остатки, которые не взаимодействуют с поверхностью антигена непосредственно, но влияют на конформацию CDR-участков. Современные библиотеки содержат более 10 миллиардов фрагментов антител с уникальной специфичностью [12].

Приведённый пример показывает, что развитие современных методов производства моноклональных антител превратило их в чрезвычайно точный научный инструмент, с помощью которого будет сделано ещё немало интересных открытий.
В статье рассмотрено использование моноклональных антител в иммунотерапии и иммунодиагностике онкологических заболеваний и их производство с использованием гибридомной технологии, представлена технологическая схема и машинно-аппаратурная схема производства
Ключевые слова: моноклональные антитела, иммунотерапия, гибридомная технология
Tolkova E.S.
Undergraduate student, Nizhny Novgorod State Technical University n.a. R.E. Alekseev
PRODUCTION OF MONOCLONAL ANTIBODIES
Abstract
The article considers the use of monoclonal antibodies in immunotherapy and immunodiagnostics of oncological diseases and their production using hybridoma technolody with flow diagram and technological scheme of manufacturing process
Keywords: monoclonal antibodies, immunotherapy, hybridoma technology
Создание иммунопрепаратов и диагностических тест-систем является одним из наиболее перспективных направлений разработки биотехнологических препаратов. Объем мирового рынка, предположительно, достигнет 60-80 млрд долларов к 2018 году. В России разработка и продажа препаратов моноклональных антител также является одним из быстрорастущих сегментов рынка. Однако в том, что касается этих препаратов, российский рынок до сих пор на 90% представлен импортными препаратами [4].
Препараты на основе МКА получили широкое распространение в иммунотерапии и иммунодиагностике злокачественных заболеваний. Уже сегодня без препаратов на основе МКА немыслима диагностика злокачественных заболеваний крови, определение иммунологического статуса пациентов, контроль за эффективностью лечения. Антитела, узнающие опухолеспецифичные антигены, могут использоваться для идентификации опухолевых клеток в различных образцах, включая образцы биопсии. С этой целью применяют метрологические методы, т.е. методы изучения антител и антигенов с помощью реакций антиген-антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Для диагностики онкологических заболеваний разработаны различные диагностикумы для количественного определения онкомаркеров: ПСА, СА 125, альфа-фетопротеина и многих других. Помимо этого антитела узнают раковые клетки in vivo и поэтому накапливаются в районе опухоли после введения в кровь больного раком. Таким образом, использование антител с присоединенной радиоактивной меткой также может использоваться для идентификации опухоли, и этот подход может также быть полезен для локализации опухолей радиографией [6].
Использование МКА для иммунотерапии злокачественных образований обусловлено высокой аффинностью антител, используемых в препаратах. Однако главным преимуществом препаратов на основе МКА является их низкая токсичность по сравнению с другими методами лечения. Так, например, при некоторых опухолях иммунотерапия препаратами МКА обладает несомненной эффективностью, сопоставимой с химиотерапией и значительно меньшей токсичностью [5]. Иммунотерапия онкологических заболевания с помощью МКА включает их использование в радиотерапии и в биотерапии.
МКА можно использовать для доставки радиоизотопов к опухолям для диагностической визуализации. Однако если использовать более мощные изотопы, такие как иттрий-90 и иод-131, то можно очень эффективно уничтожать опухолевые клетки. В этом случае, антитела, узнающие опухолеспецифические антигены, помогают концентрировать изотоп в месте локализации опухоли, максимально увеличивая смертоносный эффект для опухолевых клеток и минимизируя влияние на окружающие ткани. Этот подход известен как радиоиммуннотерапия (РИТ), он оказался очень успешным при лечении гематологических раков и в меньшей степени для лечения некоторых опухолей.
Недостаток обычной РИТ состоит в том, что влияние циркулирующих радиоактивных клеток часто приводит к повреждению костного мозга и стволовых клеток. Для преодоления этой проблемы было разработано несколько новых подходов, включающих предварительный выбор мишени. Например, трехступенчатый подход, использовавшийся при лечении рака яичников, заключается в следующем: на первой стадии в организм вводится антитело с присоединенным остатком биотина, узнающее опухолевый антиген. Затем вводится второй компонент, который выводит из системы кровообращения циркулирующие антитела. Наконец, вводится содержащий радиоизотоп стрептавидин, который доставляет высокую дозу радиоактивности непосредственно к раковой опухоли с минимальным уровнем вредя для других тканей. Этот подход основан на высоком сродстве биотина и стрептавидина, что позволяет целенаправленно и эффективно воздействовать на опухоль [5].
Традиционный метод производства МКА – это метод in vivo, представляющий собой введение мышам или крысам гибридомных клеток выбранного клона с последующим развитием опухолевых асцитов и отбором асцитной жидкости. Однако этот метод обладает рядом значительных недостатков. Во-первых, от мыши можно получить до 50 мг целевого продукта, что не удовлетворяет потребность в препаратах на основе моноклональных антител. Во-вторых, производство in vitro позволяет обеспечить контроль производства, стандартизацию, а также имеет важные преимущества над производством в условиях in vivo в отношении вирусной безопасности, постоянства производства и отсутствия контаминирующих иммуноглобулинов в неочищенных сборах. Другие преимущества этого метода производства заключаются в использовании культуральных сред без сыворотки, а также в значительном сокращении использования животных [1]. Исходя из этих соображений, способ производства in vitro является предпочтительным, и производство in vivo допускается только в определенных обстоятельствах и должно быть обосновано.
Существуют два подхода к культивированию животных клеток in vitro. Первый подход основан на иммобилизации и включении клеток в твердую матрицу. В качестве примера можно привести перфузию в пористые волокна, применение микрокапсул, агарозных микрошариков или керамических кассет. Второй подход включает культивирование клеток в гомогенной суспензии. Выбор одного из этих двух методов получения моноклональных антител в основном определяется требованиями производственного процесса.
Тем не менее, культивирование клеток в гомогенной суспензии имеет ряд преимуществ: это довольно простой и легкий в управлении метод. Он обладает высокой воспроизводимостью, а значит, высокими потенциальными возможностями для производства высококачественной продукции. Система получения моноклональных антител в гомогенной суспензии способна работать асептически в течение длительного времени, а также просто и эффективно масштабируется. Кроме того, при проведении процесса в суспензии за счет перемешивания достигается высокая гомогенность культуры.
Технологическая схема производства моноклональных антител может быть представлена следующим образом:
Рис. 1 – Технологическая схема производства моноклональных антител
Она включает два этапа – лабораторный, результатом которого является подготовка инокулята, и цеховой, результатом которого является непосредственно получение готового продукта.
Процесс иммунизации проводится с целью формирования иммунного ответа и запуска выраженного антителообразования. Дополнительной задачей является перевод их в такое функциональное состояние, при котором они способны будут образовывать антителопродуцирующие гибридные клетки. Обычно для этого используют мышей или крыс, которых иммунизируют очищенными антигенами. Большое значение имеет то, насколько эффективно проходит процесс иммунизации. Его успех определяется рядом факторов, в том числе свойствами иммуногена, сочетанием с адъювантами, подбором оптимальной схемы иммунизации.
Параллельно с этим происходит культивирование миеломы. Клетки миеломы – это злокачественные трансформированные лимфоидные клетки костного мозга, которые способны синтезировать моноклональные антитела определенной специфичности и обладают способностью к неограниченному размножению in vivo и in vitro.
Плазмоцитомы обладают слабой способностью к росту вне организма. Для поддержания культуры клеток используются различные ростовые факторы, источником которых могут быть перитонеальные макрофаги, спленоциты или сыворотка крови мышей, иммунизированных полным адъювантом Фрейнда.
Гибридизацию лимфобластов и плазмоцитомы проводят путем клеточного слияния, опосредованного различными агентами, приводящими к изменению мембран клеток, формированию цитоплазматических контактов и формированию дикарионов. В качестве индуктора слияния клеток в современных работах используется полиэтиленгликоль (ПЭГ). Он вызывает перераспределение мембранных белков, обеспечивая контакт и слияние клеток за счет ионов кальция, приводящих к образованию кальциевых каналов между клетками. Более современный способ индукции слияния клеток состоит в использовании воздействия электрических импульсов, в результате чего получают несколько типов дикарионов.
Для отбора гибридных клеток используется среда НАТ, содержащая аминоптерин, а также гипоксантин и тимидин, опосредующие альтернативный путь синтеза ДНК. В результате селекции выживают только дикарионы, возникшие в результате слияния двух лимфобластов или лимфобласта и плазмоцитомы. Первые быстро погибают ввиду ограниченного пролиферативного потенциала, а целевые гибридные клетки выживают.
Следующим этапом является скрининг гибридов-продуцентов. Наиболее распространенными методами являются методы иммуноанализа на основе ферментных и флуоресцентных меток.
После отбора гибридомных клеток, синтезирующих интересующие антитела, приступают к их массовому наращиванию, результатом чего является подготовка инокулята.
Рис. 2 – Машинно-аппаратурная схема производства
На рисунке представлена машинно-аппаратурная схема производства Методом масштабирования приготовляется инокулят в CO2-инкубаторе 1. Приготовляется и стерилизуется среда в стерилизаторе 2. Готовая и стерилизованная питательная среда и инокулят подаются в ферментер 3.
После процесса ферментации содержимое ферментера подается в центрифугу 4, где разделяются культуральная жидкость и биомасса. Предварительная очистка культуральной жидкости производится в фильтре 5, после чего культуральная жидкость поступает в емкость для хранения 6.
Из емкости для хранения культуральная жидкость поступает в колонну для аффинной хромотографии 7, а затем в колонну для ионно-обменной хромотографии 8. Затем жидкость стерилизуется в установке вирусной инактивации 9. Очистка от остаточных примесей осуществляется в колонне гель-фильтрации 10, после чего продукт поступает в емкость 11.
Накопление целевого продукта происходит в результате ферментации. Наиболее эффективным подходом является культивирование в гомогенной суспензии. Для культивирования могут использоваться бессывороточные среды, например, среда на основе RDF. Примером среды, включающей сыворотку, может быть RPМI 1640. Однако в современных работах чаще всего используются бессывороточные среды. При этом культивирование проводят при температуре около 37 о С в присутствии СО2. Очень важно эффективное перемешивание, так как при культивировании необходимо равномерное распределение клеток по всему объему сосуда. Процесс ферментация аэробный, производится полунепрерывным способом с подпиткой при активной подаче воздуха.
При культивировании клеток целевой продукт секретируется в культуральную жидкость, поэтому необходимо удаление биомассы, это осуществляется в процессе центрифугирования. После отделения биомассы, культуральная жидкость фильтруется через мембранный фильтр с размером пор 0,2 мкм и временно помещается в хранилище для дальнейшей обработки. В процессе фильтрации осуществляется полное удаление оставшихся клеток, а также снижение объема жидкости с целью облегчения хромотографии. Может потребоваться несколько следующих друг за другом этапов фильтрации для достижения этих целей.
От области применения антител зависит необходимая степень очистки. Для диагностических целей достаточно иметь препараты антител 70 – 95% степени чистоты. С другой стороны, при применении антител в иммунотерапии их чистота должна быть выше. Очистка осуществляется в следующих друг за другом стадиях аффинной и ионно-обменной хроматографии. В качестве ионнообменника для выделения антител чаще всего используют диэтиламиноэтил, прикрепленный к целлюлозе, сефарозе или акриламидным гранулам. В аффинной хроматографии для очистки используют прикрепленные к носителю антигены.
Вирусная инактивация осуществляется с целью обеззараживания вирусов и бактерий, находящихся в культуральной жидкости.
Следующий этап производства имеет своей целью удаление оставшихся примесей и повышение объемной концентрации целевого продукта. Для этого применяется гель-фильтрация на колонках с агарозой, сефарозой или сефадексом.
Разработка иммунопрепаратов – активно развивающаяся область биотехнологии. В том, что касается разработки препаратов на основе моноклональных антител, наблюдается тенденция к уменьшению использования животных. Так, например, проводились работы по созданию генетически модифицированных бактерий на основе штамма E. coli, способных синтезировать моноклональные антитела [3]. Кроме этого, активно разрабатываются так называемых гуманизированные и химерные антител, которые больше напоминают человеческие иммуноглобулины и потому будут более безопасными в использовании.
Однако создание специфических антител, не вызывающих перекрестных реакций, представляет собой довольно трудную задачу, поскольку получение антител человека путем традиционной гибридомной технологии сталкивается с рядом проблем [2]:
- хромосомы человека в клетках, полученных слиянием лимфоцитов человека с клетками миеломы мыши, нестабильны;
- пока не удалось получить эффективные клеточные линии миеломы человека, которые могли бы заменить мышиные;
- иммунизация человека различными антигенами не проводится из этических соображений.
Таким образом, для получения антител, не вызывающих у человека развития иммунного ответа, было необходимо разрабатывать иные методы. Химерные, гуманизированные и одноцепочечные антитела были разработаны путем сочетания использования гибридомной технологии и технологии рекомбинантной ДНК [2, 5].
Химерные (также гибридные) антитела – это антитела, в которых домен мышиных иммуноглобулинов замещен соответствующим константным доменом иммуноглобулина человека. Они разрабатываются следующим образом: при помощи рекомбинантной технологии соединяются разнородные молекулы ДНК, кодирующие человеческий Fc-фрагмент и мышиный Fab-фрагменты антитела. Поскольку иммуногенные и эффекторные свойства антител определяются в основном его константным доменом, а специфичность взаимодействия с антигеном – вариабельным доменом, то химерные антитела вызывают значительно меньше осложнений при сохранении специфичности, аффинности и авидности, свойственных мышиным моноклональным антителам.
В структуре гуманизированных антител мышиное происхождение имеют только небольшие антигенсвязывающие гипервариабельные участки вариабельного домена. Таким образом, гуманизированные антитела содержат еще меньше чужеродного белка, и соответственно, вероятность иммунного отторжения организмом человека существенно снижается. Это в основном снимает проблему развития иммунного ответа на введение антител больному с терапевтическими или диагностическими целями.
Наряду с полноразмерными химерными и гуманизированными антителами, методами генной инженерии возможно получать так называемые одноцепочечные антитела, состоящие только из вариабельного фрагмента иммуноглобулина, т.е. из вариабельных доменов легких и тяжелых цепей иммуноглобулина, ковалентно связанных гибким пептидным линкером. Одноцепочечные антитела представляют собой минимальный фрагмент молекулы иммуноглобулина, который обладает хорошей антигенсвязывающей активностью.
Проводятся исследования по созданию в перспективе полностью человеческих рекомбинантных антител путем объединения вариабельных доменов антител человека, обладающих целевой активностью, с константными доменами иммуноглобулинов человека нужного изотипа. Главной стадией в создании полноразмерных человеческих антител является получение вариабельных доменов, отвечающих за специфичность антитела, его аффинность и биологические свойства [2].
Препараты на основе МКА получают все большее распространение в иммунодиагностике и, можно сказать, становятся незаменимыми в терапии злокачественных заболеваний, так как они являются эффективным средством терапии и обладают гораздо меньшей токсичности, чем другие формы терапии злокачественных заболеваний. Можно предположить, что разработка иммунопрепаратов на основе МКА будет продолжать активно развиваться, и объем мирового рынка будет расти.
Читайте также:

