Осмотическое давление кратко и понятно
Обновлено: 08.07.2024
Осмотическое давление - избыточное гидростатическое давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану.
Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворенного вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделенных полупроницаемой мембраной, называется тоничность.
Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Осмотическое давление может быть весьма значительным.
В дереве, например, под действием осмотического давления растительный сок (вода с растворенными в ней минеральными веществами) поднимается по ксилеме от корней до самой верхушки.
Одни только капиллярные явления не способны создать достаточную подъемную силу — например, секвойям требуется доставлять раствор на высоту до 100 м.
При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено.
Коллоидно-осмотическое давление плазмы и интерстициальной жидкости
а) Белки плазмы создают коллоидно-осмотическое давление. В отдельной статье на сайте дана основная характеристика осмотического давления. Там подчеркивалось, что только те молекулы и ионы, которые не проходят через поры полупроницаемых мембран, участвуют в создании осмотического давления. Поскольку белки являются растворенными в плазме и тканевой жидкости компонентами, которые не проходят через поры капиллярной стенки, именно они ответственны за величину осмотического давления по обе стороны стенки капилляров. Чтобы отличать осмотическое давление, которое существует по обе стороны клеточной мембраны, от осмотического давления, которое существует по обе стороны стенки капилляра, последнее стали называть коллоидно-осмотическим давлением, или онкотическим давлением.
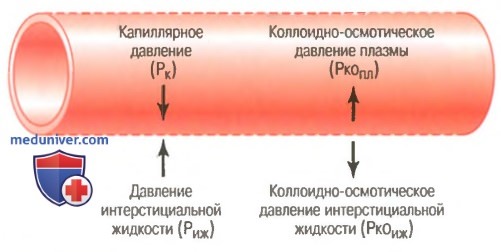
Капиллярное давление жидкости и коллоидно-осмотическое давление - силы, вызывающие движение жидкости через стенку капилляра в разных направлениях
б) Нормальная величина коллоидно-осмотического давления. Коллоидно-осмотическое (онкотическое) давление плазмы крови здорового человека в среднем равно 28 мм рт. ст. Из них 19 мм рт. ст. создается молекулами растворенных белков, а 9 мм рт. ст. — благодаря эффекту Доннана за счет осмотического давления натрия, калия и других катионов, связанных с белками плазмы.
в) Влияние различных белков плазмы на коллоидно-осмотическое давление. Белки плазмы представляют собой смесь, содержащую альбумины (молекулярная масса которых составляет в среднем 69000), глобулины (молекулярная масса 140000), фибриноген (молекулярная масса 400000). Таким образом, 1 г глобулина содержит только половину числа молекул, которые составляют 1 г альбумина, а 1 г фибриногена содержит всего 1/6 числа молекул, составляющих 1 г альбумина. Величина осмотического давления зависит от числа молекул, растворенных в жидкости, а не от их массы. Далее в таблице приведены как концентрации разных белков в плазме крови (г/дл), так и вклад белка каждого типа в общее коллоидно-осмотическое давление плазмы (Ркопл).

Из таблицы видно, что около 80% общего коллоидно-осмотического давления плазмы создается альбуминами, 20% — глобулинами и ничтожно малая часть — фибриногеном. Таким образом, для поддержания динамического равновесия между жидкостью в капиллярах и тканях наиболее важное значение имеют альбумины.
Коллоидно-осмотическое давление интерстициальной жидкости
Обычно размеры пор капиллярной стенки меньше, чем размеры белковых молекул, однако это справедливо не для всех пор, поэтому небольшое количество белков плазмы может проходить через стенку капилляра в интерстициальное пространство.
Общее содержание белков в 12 л интерстициальной жидкости организма немного больше, чем общее количество белков плазмы, но поскольку этот объем в 4 раза больше объема плазмы, концентрация белков интерстициальной жидкости составляет только 40% концентрации белков плазмы, т.е. примерно 3 г/дл. Легко рассчитать, что эта концентрация белков соответствует коллоидно-осмотическому (онкотическому) давлению 8 мм рт. ст.
Явление осмотического давления в воде было обнаружено и описано еще в 1748 году французским физиком-экспериментатором Жаном-Антуаном Нолле.
Проводя свой эксперимент, Нолле наполнил сосуд этанолом и, закрыв его плотной мембраной, опустил в емкость с чистой водой. Под действием физических сил вода поступала внутрь сосуда с концентрированной жидкостью и создавала там давление, под действием которого сосуд раздувался. В процессе его эксперимента хватало пяти часов, чтобы объем в сосуде увеличился, а мембрана раздулась. Тогда он решил провести обратный опыт и наполнил колбу водой, поместив ее в сосуд со спиртом. Объем в колбе стал уменьшаться, а мембрана начала прогибаться вниз.
Нолле объяснил это явление, как избирательный перенос молекул через мембрану: когда жидкость с меньшей плотностью легко проходила через стенки мембраны, вторая, концентрированная, не могла осуществить диффузию.
Позже было доказано, что если к концентрированному раствору будет приложено давление, то перенос молекул растворителя можно замедлить или остановить в зависимости от величины давления. Наименьшее давление, за исключением давления самого растворителя, которое нужно приложить к раствору, чтобы предотвратить перемещение молекул чистого вещества через мембрану, было названо"«соматическое", а сам процесс произвольного перехода молекул растворителя стали называть "осмос".
От чего зависит осмотическое давление воды
Важным условием осмоса является наличие полупроницаемой мембраны, то есть такого материала, поры которого будут достаточного размера, чтобы свободно пропускать молекулы растворителя и удерживать в растворе частицы растворенного вещества.
Осмотическое давление воды зависит от двух основных факторов:
Это объясняется уравнением Вант-Гоффа. Осмотическое давление воды равно: π = RCT,
где R - универсальная газовая постоянная,
С - концентрация вещества,
Ученый выявил, что осмотическое давление жидкостных растворов, подчиняется тем же законам, что и давление газовых систем. С помощью данного уравнения определяется величина давления.
Оно не зависит от состава растворенного вещества, поэтому осмотическое давление считается коллигативным свойством раствора, то есть обусловленным самопроизвольным движением молекул, их количеством, а не составом.
Для возникновения осмотического давления воды в системе необходимо два критерия:
- присутствие полупроницаемой мембраны;
- нахождение двух растворов с разной концентрацией по обе стороны от перегородки.
Как определить осмотическое давление воды
На практике величину осмотического давления воды определяют при помощи специального прибора - осмометра. Так измерения могут происходить статическим путем и динамическим.
При статическом методе измерение осуществляется только после установления равновесия в системе: раствор - мембрана - растворитель. Самым простым способом величина определяется по высоте столба жидкости в трубке осмометра. К его недостаткам можно отнести сложность определения момента равновесия и значительные временные затраты.
Динамический метод определение осмотического давления воды позволяет быстро и точно получить результат. Он основывается на определении объемной скорости пропускания и выдавливания молекул растворителя через мембраны с различным давлением в ячейке с последующим вычислением промежуточных значений среди полученных результатов.
Многие приборы позволяют проводить вычисления обоими методами. Единственным важным условиям проведения измерения является правильный подбор полупроницаемой мембраны. На практике чаще всего применяются:
- пленки из целлофана;
- природные и синтетические полимеры;
- пористые керамические и стеклянные перегородки;
- мембраны растительного и животного происхождения.
Роль осмотического давления воды для живых организмов
Осмос имеет большое значение в окружающей среде и деятельности человека. Например, он участвует в переносе жидкости в стволах высоких деревьев, в наполнении водой клеток и межклеточных структур живых организмов. Биологические жидкости человека - тканевые жидкости, кровь, лимфа тоже поддаются законам осмотического давления. В лабораторных условиях с его помощью исследуют характеристики вновь получаемых полимерных веществ, а в промышленности используют для очистки воды от минералов методом обратного осмоса.
Не менее важную роль осмос играет в экологии водоемов. При изменении концентрации солей в воде, обитатели могут погибнуть, так, например, если поместить пресноводное животное в морскую воду, то оно вскоре потеряет пятую часть своего веса, а если морского обитателя перенести в пресную воду, то из-за диффузии молекул повысится уровень внутриклеточной жидкости, клетки его органов разбухнут и лопнут.
Осмотическое давление морской воды
Осмотическое давление морской воды составляет примерно 25 бар, что существенно выше осмотического давления пресной воды. Поэтому процесс опреснения морской воды методом обратного осмоса проходит при существенно больших давлениях (40-60 бар). Естественно, для разных морей и океанов величина осмотического давления будут разниться за счет разной концентрации солей.
Где применяют осмотическое давление воды
Знание и правильное применение законов осмотического давления воды необходимо в медицине, биологии, энергетике и промышленности. На них основываются многие физико-биологические процессы, процессы получения веществ, а также способы очистки воды.
Читайте также:

