Нейроэндокринные и иммунные гипотезы кратко
Обновлено: 02.07.2024
Инновационный подход к диагностике лиц пожилого возраста позволил разработать общие рекомендации, персонифицированные программы эффективного лечения и реабилитации лиц пожилого возраста, которые могу служить основой повышения качества и продолжительности
Innovative approach to diagnostics of elderly people allowed to develop general recommendations, personified programs of effective treatment and rehabilitation of elderly people that can be a basis for improvement of life quality and increase of elderly people life expectancy.
Решение проблемы активного долголетия крайне актуально как для человечества в целом, так и для каждого человека в отдельности.
Иммунная теория старения
Показана несомненная связь процессов старения с состоянием иммунной системы:
Аутоиммунитет — пересмотр парадигмы
При старении увеличивается число аутоиммунных заболеваний за счет иммунорегуляторных нарушений, более активно работают патологические механизмы мимикрии, при этом на антигены микроорганизмов вырабатываются антитела (АТ), удаляющие патогены, однако при этом данные АТ повреждают и собственные клетки (органы) за счет наличия общих антигенов у патогенов и органов. С возрастом содержание в организме человека бактерий и вирусов существенно увеличивается, механизмы мимикрии начинают работать более активно. С возрастом значительно страдает иммунная система кишечника, где в норме находится более 70% иммунокомпетентных клеток. Это связано с дисбиотическими, секреторными, моторно-эвакуаторными, морфологическими нарушениями органов желудочно-кишечного тракта, неправильным питанием.
Общие механизмы патогенеза при хронических воспалительных процессах
В настоящее время сформулировано положение о том, что хронические воспалительные процессы, которые протекают более активно у лиц пожилого возраста, имеют ряд общих патогенетических механизмов [12–16], основой которых являются:
Таким образом, на основе современных представлений о важной физиологической роли естественного аутоиммунитета, учитывая выраженные изменения (нарушения) показателей данного звена иммунитета у лиц пожилого возраста, нами разработаны инновационные методы диагностики — диспансеризации, лечения и реабилитации лиц пожилого возраста.
Инновационная диагностика лиц пожилого возраста
Этот подход позволяет диагностировать:
Дополнительно (по показаниям) рекомендуется проводить диагностику инфекционных процессов и степень их активности, оценить состояние органов желудочно-кишечного тракта (ЖКТ), активно влияющих на течение основных хронических заболеваний (сделать посевы биологических сред или методом полимеразной цепной реакци (ПЦР) определить наличие вирусов, бактерий в биологических средах, определить титры антител к патогенам, использовать для диагностики инструментальные методы и др.).
- наличие и активность распространенного воспалительного (аутоиммунного) процесса по содержанию ААТ к двуспиральной ДНК, ААТ к бета-2-гликопротеину 1 (характеризующих наличие антифосфолипидного синдрома, связанного с нарушением свертывающей системы крови), ААТ к коллагену, по повышению уровня ревмофактора (АТ к Fc-фрагменту IgG);
- наличие и активность воспалительного (аутоиммунного) процесса в основных органах и системах по уровню ААТ к антигенам мышцы сердца, проводящей системы сердца, к эндотелию сосудов (ANCA), к антигенам легких, к антигенам органов ЖКТ — желудка, печени, кишечника, поджелудочной железы, к антигенам эндокринных органов (надпочечников, щитовидной железы, инсулину, рецепторам инсулина), к антигенам различных отделов нервной системы (антигенам нейронов, глии, периферических нервов — к основному белку миелина), к антигенам мочеполовой системы.
С учетом клинико-иммунологических исследований делаются клинико-иммунологические заключения для каждого пациента — индивидуально, даются рекомендации по коррекции лечения и реабилитации.
Проведение комплексной оценки аутоиммунитета у пожилых лиц позволило выявить общие закономерности изменений в аутоиммунном звене иммунитета, разработать индивидуальные клинические рекомендации для лечащих врачей по коррекции лечения и реабилитации.
Общие закономерности изменения аутоиммунитета у пожилых лиц
Диагностика распространенного активного воспалительного процесса
Клинически в данной группе пациентов имеются воспалительные заболевания с аутоиммунным компонентом (ревматоидный артрит), болезни суставов и позвоночника (артрозоартриты, распространенный остеохондроз).
Этим пациентам рекомендуется коррекция лечения: замена препаратов или проведение более интенсивной противовоспалительной терапии с последующей реабилитацией с включением фитотерапии — фитопрепаратов с противовоспалительным действием.
Через 2 месяца показано повторное обследование для определения уровня соответствующих ААТ.
Лабораторно-иммунологические признаки воспалительного процесса в эндотелии сосудов (повышено содержание ААТ к АNCA)
У части пациентов изменяется содержание ААТ к тромбоцитам, что может встречаться при коагулопатиях.
У другой части лиц отмечается изменение уровня ААТ к бета-2-гликопротеину 1, что характерно для антифосфолипидного синдрома.
Пациентам с измененным уровнем ААТ к эндотелию сосудов, с повышенным содержанием ААТ — к бета-2-ГП1, к антигенам тромбоцитов рекомендуется провести исследование состояния свертывающей системы крови, при нарушении — применять соответствующие препараты.
В период реабилитации таким пациентам рекомендуется проведение фитотерапии, включающей фитосборы с противоатеросклеротическим, сосудорасширяющим, разжижающим кровь действием.
Через 2 месяца показано проведение повторного определения уровня соответствующих ААТ.
Лабораторно-иммунологические признаки эндокринных изменений
При впервые обнаруженном повышенном уровне ААТ к тиреоглобулину, тиреоидной пероксидазе, рецепторам тиреотропного гормона проводится дополнительное обследование — УЗИ щитовидной железы, определение уровня гормонов. В зависимости от результатов назначается лечение или осуществляется наблюдение.
Нами обнаружено, что повышенный уровень ААТ к гормонам щитовидной железы в ряде случаев связан с наличием хронической бактериально-вирусной инфекции (часто — в носоглотке). При этом проводится соответствующее лечение, что благоприятно отражается на исходно повышенном уровне ААТ. В последующем рекомендуется реабилитация фитопрепаратами, оказывающими антимикробное и противовирусное действие (например, Cуперантитокс: по 1 капсуле (50 мг) 1 раз в день в течение 2 месяцев, Глицирам — глициризиновая кислота, оказывающая также противовоспалительный и противо-аллергический эффекты: по 1 таблетке 3 раза в день 2 месяца, эффективны растительные антимикробные средства: цетрария, Гипорамин и др.).
Лабораторно-иммунологические признаки наличия изменений в органах желудочно-кишечного тракта
У пациентов могут изменяться уровни ААТ к антигенам желудка, тонкого, толстого кишечника, печени, к инсулину, рецепторам инсулина.
С учетом выявленных нарушений лечащим врачом даются рекомендации по дополнительному обследованию пациентов, их лечению и реабилитации, назначается соответствующее питание, препараты, восстанавливающие микрофлору кишечника — про- и пребиотики, гепатопротекторы (с включением органотропной терапии — Гепатосан, Энтеросан), препараты, нормализующие моторную функцию кишечника, желчного пузыря (по показаниям).
Лабораторно-иммунологические признаки наличия изменений в нервной системе
Данным пациентам показан курс лечения с применением ноотропных препаратов. Нами отмечено, что использование фитопрепаратов с противовирусным действием также способствует нормализации уровня соответствующих ААТ (Глицирам, Суперантитокс, Гипорамин, Сангвиритрин и др.).
Лечение и реабилитация лиц пожилого возраста: общая концепция
Лечение лиц пожилого возраста должно быть основано на применении базисной терапии с учетом наличия хронических заболеваний и персонифицированного подхода.
Методы реабилитации необходимо разрабатывать персонифицированно с учетом следующих общих положений:
- Правильное питание является основой реабилитации, это один из доказанных способов увеличить на 15–25% продолжительность жизни (в 70% случаев причина смерти и в 40% — ведущая причина возникновения заболеваний связаны с неправильным питанием), основой функционального питания служит сбалансированный микро- и макроэлементный (цинк, селен, кальций, магний и др.) состав пищи, витаминный (витамины А, С, Е, D, группы В) и белковый состав потребляемых продуктов (например, водный экстракт бобовых оказывает комплексный лечебно-реабилитационный эффект, положительно воздействуя на гормональный фон и иммунитет, обладает антидепрессивным действием), уровень содержания антиоксидантов. Эти компоненты и определяют качество пищевых продуктов.
- Нормальное функционирование иммунной системы — важнейшая составляющая увеличения продолжительности жизни.
Состояние микробиоты, органов ЖКТ — один из главных факторов активного долголетия.
Заключение
Разработанный подход позволяет:
- улучшить клиническое течение основного заболевания, снизить выраженность и длительность клинических симптомов, улучшить ближайшие и отдаленные результаты лечения, провести профилактику осложнений, снизить частоту рецидивирования хронических заболеваний;
- повысить эффективность других методов лечения;
- осуществлять профилактику побочных эффектов фармакотерапии;
- повысить качество жизни пациентов.
Выводы
Литература
А. В. Афтеньев*
И. В. Архипов*, кандидат медицинских наук
И. Д. Баранова**, кандидат медицинских наук
И. С. Лебедева**
А. В. Симонова**, доктор медицинских наук, профессор
Л. Г. Кузьменко**, ***, доктор медицинских наук, профессор
На данный момент существует несколько десятков теорий старения. Многие из них представляют уже только исторический интерес, остальные же, отражая ряд существенных сторон процесса, могут быть уложены в логическую схему более универсального общего механизма старения. Общим для всех гипотез является одно – старение организма начинается сразу после начала деления оплодотворенной яйцеклетки. Рассмотрим некоторые из них.
Энергетическая теория старения
Данная теория относится к одной из самых первых теорий старения. Она была предложена Н. Рубнером в1908 г., который первым обратил внимание на то, что крупные млекопитающие живут дольше, чем мелкие. Например, мышь живет 3,5 года, собака – 20 лет, лошадь – 46 лет, слон – 70 лет. Являясь наиболее примитивной, энергетическая теория рассматривает старение как простое изнашивание клеток и тканей. Этот вывод сделан из того, что якобы существует обратная зависимость между интенсивностью обмена веществ, энергией и продолжительностью жизни.
По данным Н. Рубнера, на1 г массы тела всех животных приходится постоянное количество энергии (200 ккал/г), которое может быть израсходовано за жизнь. Исчерпав это количество энергии, животное погибает. Н. Рубнер ошибочно полагал, что интенсивность обмена и общее потребление кислорода определяются условиями теплового баланса и зависят от размеров и поверхности тела. Масса возрастает пропорционально линейным размерам, взятым в кубе, и площади взятой в квадрате. К примеру, собаке для поддержания стабильной температуры тела требуется меньше энергии, чем взятым такому же по весу количеству мышей. У мышей общая поверхность будет гораздо больше, чем у собаки. Следовательно, собака имеет более низкий уровень обмена веществ, чем мышь, а небольшая масса тела и высокий обмен веществ обусловливают крайне непродолжительную жизнь.
Интересным фактом является то, что срок жизни птиц, так же как и у млекопитающих, увеличивается с увеличением размера. Но по сравнению с млекопитающими птицы того же размера живут в 2 раза дольше. Происходит это потому, что у птиц гораздо интенсивнее основной обмен.
Человек имеет намного больший энергетический фонд (приблизительно в 4 раза). Отсюда был сделан вывод о том, что для продления своей жизни человек должен проявлять насколько можно минимальную активность. Это была грубая ошибка с точки зрения современной геронтологии. Напротив, активный образ жизни не только не сокращает, а продлевает продолжительность жизни.
Нейроэндокринные и иммунные гипотезы
Главным регулятором жизнедеятельности человека является нейроэндокринная система. Из-за этого геронтологи пытались выдвинуть теорию, которая могла бы связать основные механизмы старения с первичными нарушениями в нейроэндокринной системе, приводящими к развитию вторичных изменений в тканях.
К наиболее ранним теориям относятся гипотезы, рассматривающие процесс старения как результат дисфункции какой-либо конкретной железы – гипофиза, щитовидной или других, особенно половых, желез. Затем появились теории, объясняющие старение как нарушение функции всей нейроэндокринной системы организма.
Очень большую популярность имеют теории, которые связывают старение с первичными изменениями в гипоталамических структурах. Это объясняется тем, что гипоталамус является генератором биологических ритмов организма, являющихся основным звеном в регуляции функции, желез внутренней секреции. Данная регуляция реализуется через центральную эндокринную железу – гипофиз.
Молекулярно-генетическая теория старения
Молекулярно-генетическая теория является одной из наиболее признанных в современной геронтологии. Данная гипотеза видит причину старения в первичных изменениях генетического аппарата клетки.
Молекулярно-генетические теории подразделяются на две большие группы. Одни ученые рассматривают возрастные изменения генетического аппарата клеток как наследственно запрограммированные. Другие ученые считают, что подобные изменения происходят случайно. Отсюда следует, что процесс старения может являться или наследственно обусловленным, закономерным результатом роста и созревания, или следствием накопления случайных ошибок в системе хранения и передачи генетической информации.
Родоначальником первой группы молекулярно-генетических теорий является А. Вейсман, который выдвинул гипотезу о разделении функций между соматическими и половыми носителями генетического материала. По А. Вейсману, естественное старение отсутствует у одноклеточных организмов.
Эволюционное противоречие между необходимостью дифференциации клеток и обеспечением их бессмертия путем неограниченного деления привело к необходимости разделения клеток на соматические, которым было позволено дифференцироваться и стареть, и бессмертные зародышевые, или половые. В сущности, соматические клетки созданы для обеспечения жизнедеятельности половых клеток, обеспечивающих сохранение и передачу генетического материала в популяции. При выполнении функции размножения индивид становится бесполезным для популяции.
Также, по Вейсману, в результате естественного отбора преимуществом пользовались виды с наилучшим соотношением между плодовитостью и продолжительностью жизни. Отсюда был сделан вывод, что наибольшая продолжительность жизни обусловлена генетически в виде количества поколений соматических клеток многоклеточного организма.
Для подтверждения молекулярно-генетической теории проводился ряд научных исследований. Например, были выполнены опыты для обнаружения соотношения между ограничением питания в молодом возрасте и темпами роста животных. При ограничении питания у животных происходят замедление роста и задержка полового созревания, а следовательно старения. Происходит это потому, что организму требуется большее время для достижения окончательных размеров, т. е. старение, как и другие этапы онтогенеза, контролируется генами.
Последователем теории А. Вейсмана стал и Л. Хейфлик, который установил, что нормальные соматические клетки человека имеют лимитированный митотический потенциал и определенную продолжительность жизни. Для опыта брали из организма клетки соединительной ткани – фибробласты, которые затем помещали в питательную среду. Результатом этого явилось выявление числа Хейфлика – строго ограниченного количества делений, после которого культура погибала. Некоторые авторы утверждают, что в культурах фибробластов, полученных от молодых животных, количество делений превышает число делений в культуре клеток старых животных.
Позже был открыт молекулярный механизм, ограничивающий количество делений фибробластов в культуре. Оказалось, что в стареющих культурах снижается активность фермента теломеразы, который обеспечивает сохранение свойств ДНК в последовательных поколениях клеток. При встраивании гена этого фермента количество делений культивируемых фибробластов возросло.
Казалось, что молекулярно-генетическая теория получила свое подтверждение. Но тут имеются определенные особенности. Например, у фибробластов, используемых в эксперименте, некоторые свойства вообще отсутствовали, зато другие, напротив, обострялись. Если к культуре фибробластов добавляли какие-либо другие клетки, то количество их делений либо возрастало, либо снижалось.
Также фибробласты приобретали способность трансформироваться в другие типы клеток, продолжительность жизни которых не зависит от числа делений.
К молекулярно-генетическим гипотезам также относится гено-регуляторная теория. Эта теория старения была выдвинута В. Райтом совместно с сотрудниками. Сутью ее является представление о старении как об изменениях, происходящих в регуляторных генах. Эти гены являются наиболее активными и наименее защищенными структурами ДНК, способными определять темп и последовательность включения и выключения структурных генов. Вследствие нарушения скорости и последовательности включения структурных генов происходят возрастные изменения в структуре и функции клеток.
Прямых доказательств генорегуляторной теории не выявлено. Но современные исследования показали, что при старении организма в ДНК некоторые участки сокращаются в размерах.
Его последователь Л. Оргель считал, что главная причина старения организма – это накопление с возрастом генетических повреждений в результате мутаций. Мутации в генетическом аппарате клетки могут происходить по двум причинам. Они могут быть либо спонтанными, либо возникать в ответ на воздействие агрессивных факторов, как то ионизирующая радиация, ультрафиолетовые лучи, вирусы, накопление в организме токсических продуктов и т. д. В результате подобных мутаций гены утрачивают способность адекватно регулировать свою активность в связи с накоплением повреждений ДНК и РНК.
Наряду с этим в каждой клетки функционирует специальная система репарации для обеспечения стабильности структуры ДНК и константы в системе передачи генетической информации. В лабораторных экспериментах на некоторых видах животных была доказана взаимосвязь между активностью систем репарации ДНК и сроком жизни.
С течением времени система репарации ДНК изнашивается, в результате чего происходит старение организма. Доказательством этому служат случаи преждевременного старения и выраженного укорочения продолжительности жизни.
К таким случаям относятся наследственные болезни, при которых нарушается процесс репарации, такие как прогерии, синдром Тернера, некоторые формы болезни Дауна и др.
Свободнорадикальная теория старения
Среди всех теорий старения наиболее общепринята теория свободных радикалов, предложенная американским ученым Д. Харманом в середине 1950-х гг. Постоянно расширяя области своего приложения, свободнорадикальная теория старения включает многие из ранее выдвинутых гипотез и теорий старения. Свободнорадикальная теория относится к группе теорий старения в результате изнашивания организма.
Для того чтобы рассмотреть данную гипотезу, следует вспомнить, что ДНК и РНК представляют собой нестабильные, длинные цепи, которые состоят из тысяч молекул. Эти цепи могут очень легко распадаться на звенья. Они постоянно атакуются другими молекулами, представляющими собой либо банальные продукты клеточного метаболизма, либо вещества, загрязняющие окружающую среду (свинец). В результате этого внутри клетки в процессе обмена веществ все время синтезируются новые молекулы, которые заменяют поврежденные.
Большой группой атакующих молекул являются свободные радикалы, которые имеют выраженную способность соединяться с другими молекулами. Клетки время от времени, особенно при действии на организм ионизирующей радиации, самостоятельно синтезируют свободные радикалы.
Кроме того, свободные радикалы способны активизировать внутри клеток особые молекулы – факторы копирования.
Фактор копирования – это абсолютно безвредная молекула до тех пор, пока не подвергнется агрессивному воздействию свободных радикалов, которые способствуют ее миграции к центру клетки – ядру. Попав в ядро, факторы копирования встраиваются в ДНК, после этого она начинает синтезировать токсические вещества. Существует фактор копирования NFk-B, обладающий воспалительными свойствами.
В молодых организмах имеется особый обезвреживающий механизм, устраняющий повреждения, – ферментативная система антиокислительной защиты, которая со временем изнашивается. Накопление повреждений в клетках и скорость старения зависят от соотношения процессов образования активных форм кислорода и функцией этой системы.
В 1969 г. Э. Корд и М. Фридович открыли особый фермент – супероксиддисмутазу, после чего гипотеза Хармана получила новый импульс для своего развития. Активность этого фермента в гранулоцитах, тромбоцитах, эритроцитах и лимфоцитах человека связана со способностью этих клеток к образованию свободных радикалов. Это позволило проследить взаимосвязь наличия данных агрессивных факторов со сроком жизни клеток в крови, который варьирует от 12 ч до нескольких лет. Благодаря этому открытию были сформулированы убедительные доказательства образования в живых клетках свободных форм кислорода, объяснена функция сложной, многоуровневой системы антиоксидантной защиты.
В лабораторных условиях было выявлено, что наиболее высокая активность супероксиддисмутазы отмечается в тромбоцитах, которые часто синтезируют свободные радикалы. Это резко снижает продолжительность их жизни. Эритроциты также характеризуются высоким уровнем супероксиддисмутазы. Но эти клетки крайне редко синтезируют супероксидные радикалы. Срок их жизни больше, чем у тромбоцитов, но не очень высокий. Лимфоциты никогда не генерируют свободные радикалы и имеют довольно низкий уровень супероксиддисмутазы. Поэтому их срок жизни наиболее продолжителен.
Одной из вариаций свободнорадикальной теории является гипотеза старения в результате гликозилирования. Комплекс реакций гликозилирования – реакция Мэйяра – запускается после возникновения соединений глюкозы с аминогруппами аминокислот, пептидов, белков, нуклеиновых кислот. Продукты, образовавшиеся в результате реакции, способны повреждать белки или нуклеиновые кислоты. В результате этого дефектные молекулы оседают на стенки сосудов, тела нервных клеток. Подтверждением этой теории является то, что при развитии осложнений сахарного диабета появляются признаки, похожие на изменения в организме у людей пожилого возраста. Подобные симптомы возникают за счет более быстрого синтеза токсических продуктов реакции гликозилирования.
Также учеными было выявлено, что содержание специфических продуктов реакции Мэйяра в организме человека тесно взаимосвязано с его биологическим возрастом, который часто сильно варьируется у людей одного и того же календарного возраста.
Следует отметить, что проводились исследования, которые смогли доказать способность некоторых продуктов реакции гликозилирования синтезировать активные формы кислорода. Отсюда следует сделать вывод, что образование свободных радикалов и гликозилирование являются звеньями единой более сложной биохимической реакции, а также то, что многие связанные с процессом старения заболевания, такие как атеросклероз, почечная недостаточность, нейродегенеративные заболевания, связаны с реакцией гликозилирования и образованием свободных радикалов.
Один из способов борьбы со старением, в котором повинны свободные радикалы, – применение так называемых антиоксидантов.
Американским ученым Комфортом был проведен ряд научных экспериментов, в результате которых оказалось, что антиоксидант этоксихин способствует увеличению продолжительности жизни мышей примерно на 25%.
В1973 г. исследователь Ричард Хохшилд вводил мышам препарат центрофеноксин. Центрофеноксин используется в некоторых странах Европы и во всем мире (кроме США) для ликвидации признаков нарушений функции центральной нервной системы. Кроме того, его в течение продолжительного времени используют для лечения больных нейродегенеративными заболеваниями. Из этого следует то, что он нетоксичен для людей. В ходе эксперимента было установлено, что продолжительность жизни крыс увеличивается на 10%. Также Р. Хохшилд вводил лекарство старым мышам и показал, что оно увеличивает продолжительность остатка жизни подопытных животных на 11%.
Исследователь Д. Харман проводил опыты, доказывающие зависимость продолжительности жизни от особенностей рациона. Ученый считал, что ненасыщенные липиды, в избытке содержащиеся в маслах и растительных продуктах, принимают активное участие в свободнорадикальных реакциях, посредством этого способствуя ускоренному старению. В ходе эксперимента Харман увеличивал процентное содержание ненасыщенных липидов в пище мышей. Результатом этого – сокращение сроков жизни грызунов.
Этот витамин является синергистом витамина Е и способствует более эффективному удалению свободных радикалов.
Процесс старения на уровне целостного организма - не до конца изученный процесс, и поэтому не существует единой точки зрения на причины, обуславливающие возрастные изменения. Однако исследования механизмов старения имеют безусловную практическую ценность, позволяя определить наиболее эффективные методы его замедления.
Существует несколько различных подходов к классификации теорий, описывающих механизмы старения. Мы предлагаем выделить три ключевых группы теорий, опираясь на их определение основного аспекта процесса старения: метаболического, регуляторного либо генетического. Каждый из существующих сегодня подходов так или иначе можно отнести к одной из этих групп.
Метаболический аспект
Метаболическому аспекту уделяется основное внимание в теориях накопления повреждений. В этой группе теорий акцент делается на постепенное воздействие неизбежных внутренних изменений и внешней среды на все системы организма. Такое воздействие нарушает биохимические процессы. Можно выделить три основных теории: свободнорадикальную, теорию дефицита нутриентов и теорию поперечных сшивок (связей).
Свободнорадикальная теория старения
Теория была впервые предложена в 50-х годах XX века американским геронтологом Дэнхемом Хармэном. Согласно концепции Хармэна, именно свободные радикалы оказывают решающее воздействие на процессы биосинтеза. Свободные радикалы образуются в клетке в результате биохимических процессов и вызывают повреждения белков, липидов и других биологических молекул, таким образом запуская механизм старения.
С момента возникновения теории уже было доказано, что свободные радикалы могут являться причиной более чем 80 неинфекционных болезней, среди которых - рак, артрит и ряд сердечных заболеваний.
В рамках этой теории старения оказывается актуальным использование антиоксидантов натурального и синтетического происхождения, поскольку именно эти вещества нейтрализуют и предотвращают вредные последствия окисления. Наиболее известными антиоксидантами в антивозрастной медицине являются витамины C, E и бета-каротин (способствует выработке витамина A).
Таким образом, связывая механизм старения с негативным воздействием свободных радикалов, для эффективной диагностики и последующего замедления геронтологических процессов прежде всего необходимо определить степень активности ферментов антиоксидантной системы. Сделать это возможно с помощью генетического тестирования, определяющего индивидуальные особенности механизма защиты клеток от окислительного стресса.
Теория дефицита нутриентов
Данная теория связывает процесс старения с недостатком витаминов и минеральных веществ в потребляемых продуктах. Следует отметить, что способность к усвоению нутриентов снижается с возрастом, поэтому индивидуальная диета также подлежит регулярному пересмотру и корректировке. В противном случае дефицит витаминов и минералов приводит к необратимым изменениям в организме.
Исследование дефицита нутриентов производится посредством анализа их концентрации в крови и волосах. Генотипирование (генетический анализ) позволяет также выявить индивидуальные особенности обмена веществ и специфику усваиваемости витаминов и минеральных веществ. Восстановив необходимый уровень биологически значимых элементов, мы получаем возможность восстановить ряд функций организма и приостановить процесс старения.
Теория образования поперечных связей
Автором теории поперечных связей является биохимик и геронтолог Юхан Бьеркстен. Согласно его подходу, сцепление или склеивание белковых молекул (образование поперечных связей) происходит в связи с воздействием глюкозы. Этот процесс влечет за собой разрушение тканей организма и клеток.
Профилактикой раннего старения в таком случае может стать коррекция питания, направленная на снижение уровня сахара, а также активный образ жизни. Кроме того, замедлить процесс возникновения поперечных связей может прием некоторых препаратов.
Для предварительной диагностики используются маркеры гликозилирования, исследовать которые можно с помощью процедуры генотипирования.
Регуляторный аспект
Аутоиммунная теория
Запрограммированное снижение эффективности работы иммунной системы повышает риск инфекционных заболеваний. Кроме того, иммунная система начинает разрушать собственные клетки - поэтому идентифицировать этот механизм старения возможно посредством выявления аутоантител.
Снижение уровня аутоантител, таким образом, поможет скорректировать или даже приостановить процесс старения. Это становится возможным благодаря применению иммуномодуляторов.
Как и другие теории старения, основанные на регуляторном аспекте, аутоиммунная теория обращается к понятию наследственной предрасположенности. Сегодня выявление подобных программ, заложенных в генах, становится возможным благодаря полноценному исследованию ДНК человека (генетическому анализу).
Нейроэндокринная теория
Нейроэндокринная теория связывает процесс старения с концентрацией гормонов в организме. В молодости достаточный уровень гормонов обеспечивает нормальное функционирование организма, но его снижение с возрастом становится основной причиной быстрого старения.
Антивозрастная терапия довольно часто обращается к исследованию и коррекции различных гормональных нарушений. Продиагностировав уровень гормонов в крови и других биологических жидкостях, а также проведя генетическое тестирование, можно назначить индивидуальную гормономоделирующую терапию, которая простимулирует клетки к восстановлению метаболической активности до уровня молодого организма.
Генетический аспект
В теориях, относящихся к этой группе, старение также рассматривается как запрограммированный спад, однако решающая роль отводится именно наследственной предрасположенности.
Необратимые изменения ДНК, включение и выключение различных генов и сбои в генетических программах, проявляющиеся с годами, приводят к гибели клеток и влияют на функционирование всего организма. Получается, что своеобразные “биологические часы” определяют темпы роста и старения человека.
В наше время генетический анализ позволяет заранее определить предрасположенность организма к различным заболеваниям и существенно снизить риск их возникновения.
1. Годовалов А.П., Зенков А.Л. Характеристика клеточноопосредованного иммунного ответа, антителообразования, количественного состава и фагоцитарной активности перитониальных клеток крыс при экспериментальном тиреотоксикозе разной тяжести // Вестник Уральской медицинской академической науки. – 2014. – № 3 (49). – С. 22-23.
2. Черешнев В.А., Самоделкин Е.И., Косарева П.В., Сивакова Л.В., Шилов Е.Ю., Федык О.В., Хоринко В.П. Морфологические изменения в центральных и периферических органах иммуногенеза при моделировании токсической гемолитической анемии на фоне острого холодового стресса // Патологическая физиология и экспериментальная терапия. – 2017. – Т. 61, № 3. – С. 46-51.
3. Черешнев В.А., Шилов Ю.И., Черешнева М.В., Самоделкин Е.И., Гаврилова Т.В., Гусев Е.Ю., Гуляева И.Л. Экспериментальные модели в патологии. Пермь, 2014. 256 с.
4. Шилова Ю.А., Шилов Д.Ю., Шилов Ю.И. Влияние стресса на активность лейкоцитов периферической крови // Успехи современного естествознания. – 2010. – № 7. – С. 54-55.
5. Шилов Д.Ю., Годовалов А.П., Шилов Ю.И., Юркова Е.В. Влияние агониста бета-адренорецепторов гексопреналина сульфата на пролиферативный ответ лимфоцитов и продукцию иммуноглобулинов в присутствии тироксина и дексаметазона фосфата in vitro // Фундаментальные исследования. – 2011. – № 6. – С. 192-196.
6. Шилов Д.Ю., Шилов Ю.И. Иммуномодулирующее действие соталола гидрохлорида при остром стрессе // Acta Biomedica Scientifica. – 2012. – № 3-2 (85). – С. 337-342.
В настоящее время развитие такой науки как иммунология позволяет получить большое количество обширных данных о иммунитете и, в особенности, взаимосвязи между иммунной и иными системами человеческого организма 6. В настоящее время иммунология, как наука, является одной из ведущих, поскольку среди основных причин заболевания организма человека существенное место занимает подавление иммунитета, особенно при развитии заболеваний.
Цель работы – рассмотреть взаимосвязь между нервной, эндокринной и иммунной системами.
В организме человека существуют три тесно взаимосвязанных регулирующих системы: нервная, эндокринная и иммунная. Согласно современным представлениям, нервная, эндокринная и иммунная системы находятся в организме в тесной взаимосвязи и фактически образуют единую систему управления организмом и его самозащиты от многообразных внешних воздействий.
Объединение систем в единую регулирующую структуру базируется на следующих положениях.
- Связь между иммунной системой и ЦНС, эндокринной осуществляется через кровь с помощью цитокинов, тимопоэтина, лимфокинов.
- ЦНС воздействует на иммунную систему с помощью нейропептидов (нейротензин, вазоактивный нейропептид кишечника, пептид-дельта сна, энкефалины, эндорфины (эндогенные опиоиды)).
- ЦНС напрямую регулирует эндокринную систему, воздействуя на соответствующие железы, которые вырабатывают гормоны [2, 4].
- Эндокринная система воздействует на иммунную с помощью гормонов гипоталамо-гипофизарно-адреналовой оси [1, 8, 9].
- Иммунокомпетентные клетки способны продуцировать ряд гормонов, прежде всего кортикотропин, эндорфин, энкефалин.
- Нейроны способны напрямую продуцировать интерлейкины.
Самой первой из этих систем появилась эндокринная или гуморальная система. Гуморальная регуляция – один из эволюционно ранних механизмов контроля процессов жизнедеятельности в организме, осуществляемый через жидкие среды организма (кровь, лимфу, тканевую жидкость, слюну) с помощью гормонов, выделяемых клетками, органами, тканями. У высокоразвитых животных, включая человека, гуморальная система подчинена нервной регуляции и составляет, совместно с ней, единую нейрогуморальную сеть. Продукты обмена веществ действуют не только непосредственно на эффекторные органы, но и на окончания чувствительных нервов (хеморецепторы) и нервные центры, вызывая гуморальным или рефлекторным путём те или иные реакции. Гуморальная передача нервных импульсов химическими веществами, т. е. медиаторами, осуществляется в центральной и периферической нервной системе. Наряду с гормонами важную роль в гуморальной регуляции играют продукты промежуточного обмена. Одной из гуморальных систем, которая воздействует на иммунитет – это гипоталамо-гипофизарно-адреналовый комплекс, который активируется при стрессе. Воздействие, которое воспринимается корой головного мозга и передается в гипоталамус, где вырабатывается кортикотропин-высвобождающий гормон (CRH), стимулирующий гипофизарные рецепторы. Итогом этого процесса является секреция кортикотропина в плазму, стимуляция кортикотропиновых рецепторов в адреналовой области надпочечников и выброс кортизола в кровь. Воздействие на гипоталамические кортизоловые рецепторы по типу обратной связи приводит к снижению выработки CRH с целью поддержания гомеостаза. Иммунная система также вовлечена в развитие стресса, отвечая на действие стресс-реализующих гормонов. Иммунокомпетентные клетки (Т- и В-лимфоциты, макрофаги, нейтрофилы и эозинофилы, клетки тимуса) имеют рецепторы ко многим гормонам, в том числе к адреналину и кортизолу [3].
Помимо гипоталамо-гипофизарно-адреналовый комплекса, существует взаимосвязь гуморальной системы с иммунной и нервной системой через тимус. Вилочковая железа (тимус) производит большое количество гормонов, которые можно подразделить на: цитокины или лимфокины и тимические (или тимусные) гормоны. Тимопоэтины, регулирующие процессы роста, созревания и дифференцировки Т-клеток и функциональную активность зрелых клеток иммунной системы. К цитокинам, секретируемым иммунокомпетентными клетками, относятся: гамма-интерферон, интерлейкины (1-7 и 9-12), фактор некроза опухолей, гранулоцитарный колониестимулирующий фактор, гранулоцитомакрофагальный колониестимулирующий фактор, макрофагальный колониестимулирующий фактор, лейкемический ингибиторный фактор, онкостатин М, фактор стволовых клеток и другие. Секреция гормонов тимуса, регулируется с помощью глюкокортикоидов, секретируемые корой надпочечников, а секреция глюкокортикоидов, регулируется нервной системой (переднея доля гипофиза по принципу обратной связи). К примеру, при вирусном заболевание происходит выработка тимусом тимопоэтина, а это приводит к росту, созреванию и дифференцировке Т-лимфоцитов, а в дальнейшем активации адаптивного иммунитета [3].
В более позднем периоде эволюционного развития появилась нервная система. Нервная система (НС) – это целостная морфологическая и функциональная совокупность различных взаимосвязанных, нервных структур, которая совместно с эндокринной системой обеспечивает взаимосвязанную регуляцию деятельности всех систем организма и реакцию на изменение условий внутренней и внешней среды. Нервная система действует как интегративная система, связывая в одно целое чувствительность, двигательную активность и работу других регуляторных систем (эндокринной и иммунной).
НС состоит из: нервных клеток (нейронов) и глиальных клеток (нейроглии). Нейроны – это основные структурные и функциональные элементы как в центральной, так и периферической нервной системе. Они являются возбудимыми клетки, то есть, способны генерировать и передавать электрические импульсы (потенциалы действия). Нейроны имеют различную форму и размеры, формируют отростки двух типов: аксоны и дендриты.
Глиальные клетки более многочисленны, чем нейроны и составляют по крайней мере половину объёма ЦНС, но в отличие от нейронов они не могут генерировать потенциалов действия. Нейроглиальные клетки различны по строению и происхождению, они выполняют вспомогательные функции в нервной системе, обеспечивая опорную, трофическую, секреторную, разграничительную и защитную функции. Было отмечено, что нервная и иммунная системы имеют некоторые общие черты в принципах функционирования, а именно:
Помимо схожести с иммунной системой, нервная схожа с гуморальной системой, за счет помощи медиаторов, и гормонов, секреция которых, чаще всего реализуется за счет подачи импульсов НС. К примеру, увеличение выработки слюны в ротовой полости – это следствие ответа на внешний раздражитель нервной системой [3].
Самая поздняя из систем, в эволюционном ряде – это иммунная система. Иммунная система – это система, объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Адаптивный иммунитет – это способность организма обезвреживать чужеродные и потенциально опасные микроорганизмы (или молекулы токсинов), которые уже попадали в организм ранее. Представляет собой результат работы системы высокоспециализированных клеток (лимфоцитов), расположенных по всему организму. Считается, что система приобретённого иммунитета возникла у позвоночных животных. Он представлен T-лимфоцитами и антителами, продуцируемыми B-лимфоцитами.
Существует схема с помощью, которой можно рассмотреть единство нервной, эндокринной и иммунной систем – это схема реакции на патогенное воздействие.
Первая активируется нервная система. Она запускается за счет рецепторов боли, которые посылают импульс по сигнальному ганглию проходит до задних рогов спинного мозга, а дальше до таламуса, а там активируется потенциал действия и запуск иммунной и гуморальной систем. Иммунная система в первые секунды патогенеза болезни не особо активно себя проявляет, но постепенно увеличивает свой потенциал, так как происходит активация адаптивного или приобретенного и врожденного иммунитета. Если патогеном является микроорганизмом или это клетки, которые изменены, т.е. имеют на поверхности мембраны фосфатидилсерин, то тогда работают клетки врожденного иммунитета, а если это вирусы или аутоиммунные заболевания, то тут вступают клетки адаптивного иммунитета. В конце активируется гуморальная система, её участие это частичная коррекция или полное устранение дефектов заболевания.
Гуморальная, иммунная и нервная системы – это три взаимосвязанные системы, поскольку они взаимодополняют друг друга. Существуют примеры того как происходит данное взаимодействие 5. Основные наблюдаемые при иммунной патологии явления, связанные с данным взаимодействием:
- Введение с лечебной целью цитокинов сопровождается депрессией ЦНС и мышечной слабостью.
- Нервная депрессия или стресс приводят к выбросу кортикостерона и кортизола, которые вместе с половыми гормонами подавляют иммунную систему.
- Кратковременная стрессовая реакция приводит к выбросу адреналина и норадреналина, которые подавляют активность лимфоцитов. Было экспериментально доказано, что на пике стресса в крови спортсменов или студентов вообще пропадают иммуноглобулины всех классов, то есть человек временно испытывает тяжелую форму иммунодефицита.
На основании огромного количества фактического материала сегодня можно говорить о существовании единой регуляторной системы организма, объединяющей воедино нервную, иммунную и эндокринную системы.
Статья представляет собой краткий обзор, посвященный новой медико-биологический дисциплине – нейроиммуноэндокринологии. Взаимодействие нервной, эндокринной и иммунной систем рассматривается на примере гипоталамо-гипофизарно-адренокортикальной системы (ГГАС) в условиях острого и длительного воспаления. Статья главным образом базируется на собственных данных авторов, обнаруживших гипперреактивность ГГАС на новый иммунный стимул в условиях хронически текущего воспаления – аутоиммунного заболевания (артрит).

На рубеже двух столетий зародилась новая интегральная медико-биологическая дисциплина нейроиммуноэндокринология, которая объединяет и координирует исследования, направленные на изучение механизмов взаимодействия основных регулирующих систем нервной, эндокринной и иммунной [1,2]. Отправной точкой для выделения этой области знаний как самостоятельной дисциплины стали яркие открытия,
сделанные в начале и середине ХХ столетия, когда было показано, что нейроны гипоталамической области мозга способны, сохраняя присущую им организацию и импульсную активность, секретировать пептидные нейрогормоны [3,4]. Первоначально это относилось к способности крупноклеточных нейронов гипоталамуса синтезировать нонапептиды (окситоцин, вазопрессин и их гомологи), транспортировать их по аксонам в заднюю долю гипофиза и оттуда выделять в общий кровоток. Последнее роднило нервные клетки гипоталамуса с эндокринными, с секреторными клетками эндокринных желез, поэтому сам феномен был назван нейросекрецией [5].
Впоследствии выяснилось, что нейросекреция свойственна также тем популяциям мелкоклеточных нейронов гипоталамуса, которые регулируют гормональные функции передней доли гипофиза с помощью стимулирующих нейрогормонов (либеринов) и тормозящих нейрогормонов (статинов), транспортируемых в переднюю долю гипофиза гуморальным путём через кровоток портальной системы гипофиза [6].
Наконец, когда по аналогии с клетками гипофиза, на мембранах секреторных нейронов гипоталамуса были выявлены рецепторы к гормонам периферических эндокринных желез, стали понятны механизмы гипоталамической регуляции эндокринных функций. В их основе, как было установлено ранее для гипофиза, лежит принцип обратной связи, который определяет работу контролирующих механизмов [6].
Эти яркие открытия и вытекающие из них заключения стали краеугольным камнем, который лёг в основу новой для того времени области знаний - нейроэндокринологии. Родившись на стыке казалось бы различных дисциплин, нейробиологии и эндокринологии, нейроэндокринология дала новое измерение нашим знаниям о механизмах, лежащих в основе регуляции важнейших гомеостатических функций. Родившись на стыке различных дисциплин, нейроэндокринология оказалась важной ветвью нейронаук. Она раскрыла эндокринные функции мозга и подняла завесу над некоторыми его тайнами.
Между тем удивительные факты продолжали накапливаться, однако фокус новых открытий сместился в область иммунологии. Стало обнаруживаться большое сходство в организации и функционировании нервной и иммунной систем. Если выше при обсуждении общности нервной и эндокринной систем упоминалось о том, что нейроны, сохраняя специфическую организацию и функцию (генерирование и распространение нервных импульсов) могут одновременно
функционировать как эндокринные клетки, то оказалось, что аналогичное можно сказать и о клетках иммунной системы. Участвуя в регуляции гомеостаза с помощью специфических иммунных механизмов, эти клетки оказались способными экспрессировать рецепторы ко многим сигнальным молекулам, опосредующим воздействия нейроэндокринной системой [2,7], а также синтезировать некоторые эволюционно древние (консервативные) пептиды. В их ряду заслуживают упоминания нейропептиды, тахикинины, инсулиновые гормоны, проопиомеланокортин, дериватами которого являются АКТГ, β-эндорфин и меланоцит-стимулирующий гормон, и, наконец, гормон роста и пролактин, рецепторы которых относятся к большому семейству гемопоэтиновых - рецепторов к интерлейкинам, эритропоэтину, гранулоцитарно-макрофагальному колониеобразующему фактору 7.
При анализе сходства в организации нервной и иммунной систем привлекает внимание тот факт, что обе системы состоят из большого числа фенотипически различающихся клеток, организованных в сложные сети. В пределах такой сети клетки взаимосвязаны и функционируют по принципу обратной связи, когда пусковым сигналом служит адекватный раздражитель, а конечный ответ направлен на обеспечение полезного результата. Различие заключается в том, что в нервной системе клетки жестко фиксированы в пространстве, тогда как в иммунной они непрерывно перемещаются и лишь кратковременно взаимодействуют друг с другом.
Наиболее демонстративно взаимодействия нейроэндокринной и иммунной систем проявляются в реакции стресс. Известно, что эта защитная биологическая реакция развивается в ответ на действие широкого спектра агрессивных факторов внешней среды, таких как микробные, температурные, болевые агенты, факторы неподвижности, гравитации, психоэмоциональные воздействия и ряд других. При всех этих воздействиях активируется гипоталамо-гипофизарноадренокортикальная система (ГГАС).
Центральным звеном этой системы являются нейроэндокринные нейроны паравентрикулярного ядра (ПВЯ) гипоталамуса, синтезирующие кортикотропин-рилизинг гормон (КРГ). Их аксоны следуют к наружной зоне срединного возвышения, откуда КРГ поступает в портальный кровоток, достигая клеток аденогипофиза. КРГ через рецепторы 1 типа, активирующие цАМФ, стимулирует синтез проопиомеланокортина (ПОМК) и его деривата АКТГ. Последний вызывает выделение и синтез глюкокортикоидов, которые оказывают множество общеизвестных эффектов, в том числе ограничивают распространение воспаления. Важно подчеркнуть, что помимо КРГ, в мелкоклеточных нейронах гипоталамуса синтезируется еще один нейрогормон - вазопрессин (ВП), который через рецепторы 1б типа действует синергично с КРГ на АКТГ клетки гипофиза [10,11].
Ещё Ганс Селье, впервые описавший стресссиндром, отмечал, что иммунная система остаётся небезразличной к стрессу. Позднее были исследованы механизмы, с помощью которых иммунная система вовлекается в стрессовые реакции. Так, было показано, что в ответ на действие патогенных агентов макрофаги и лимфоциты выделяют широкий спектр регуляторных пептидов, объединенным общим названием цитокинов. Эти иммунные пептиды способен проникать в мозг через гемато-энцефалический барьер в тех его участках, где существуют "окна" для подобного рода веществ. К ним относятся система циркумвентрикулярных органов (срединное возвышение нейрогипофиза, субфорникальный орган, задняя крайняя область или area postrema), в которых существуют специфические механизмы транспорта для цитокинов. Пониженная барьерная активность в таких участках обусловлена особенностями организации, в первую очередь, наличием капилляров с фенестрированным эндотелием, облегчающим транспортировку цитокинов в нервную ткань из общего кровотока [12].
Попав в мозг, цитокины (и, в первую очередь, интерлейкин-1, ИЛ-1) стимулирует секрецию центрального нейрогормона стресса КРГ в нейросекреторных нейронах ПВЯ гипоталамуса. Причем, этот процесс зависит от присутствия простагландина Е2 и окиси азота. В свою очередь, КРГ стимулирует секрецию АКТГ в гипофизе, что приводит к стимуляции секреции глюкокортикоидных гормонов в коре надпочечников. Последние при повышенной секреции способны тормозить секрецию ИЛ-1 в макрофагах и тем самым угнетать иммунный ответ в случае его избыточности. Таким образом, здесь в чистом виде работают механизмы отрицательной обратной связи, в которых роль триггера выполняет иммунный пептид, а функцию исполнителя - нейрогормон гипоталамуса и гормоны эндокринной системы [1,12].
Изучение тонких механизмов взаимодействия нейроэндокринной и иммунной систем мы продолжили в исследованиях, которые проводили совместно с отделом физиологии эндокринной системы (G. Aguilera) одного из Национальных Институтов Здоровья США. В них мы исследовали влияние острого и хронического иммунного стресса на состояние ГГАС у крыс. Острый иммунный стресс воспроизводился введением эндотоксина липополисахарида (ЛПС) E. Coli в дозе 250мкг/100г внутрибрюшинно (в/б), а хронический - длительным введением этого антигена в нарастающих дозах от 25 до 250 мкг/100 г в течение 13-ти дней [13]. Об активности нейроэндокринной оси судили по динамике экспрессии соответствующей мРНК: в паравентрикулярном ядре - КРГ, в гипофизе - ПОМК, в коре надпочечников -11β-гидроксилазы с помощью метода гибридизации in situ. Дополнительно исследовали динамику экспрессии мРНК рецепторов к КРГ и глюкокортикоидам (кортикостерон). Помимо этого, радиоиммунным методом оценивали уровни АКТГ и кортикостерону в крови [13].
Полученные результаты оказались весьма любопытными. Так, было показано, что реакция ГГАС на острое воспаление, вызванное однократной инъекцией ЛПС, характеризуется активацией всех звеньев этой системы, включая синтез КРГ и ВП в мелкоклеточных ПВЯ гипоталамуса [13,14]. Напротив, при длительном введении ЛПС в нарастающих дозах, происходит парадоксальное подавление синтеза КРГ и нарастание синтеза ВП [13].
Подобная картина наблюдается и при ряде длительных воспалительных аутоиммунных заболеваний, таких как артрит, системная красная волчанка и аллергический энцефаломиелит и другие 17. Подавление синтеза КРГ в этих случаях может быть связано как с длительным угнетающим действием глюкокортикоидов, уровни которых повышены, так и с дисбалансом нейротрансмиттеров в гипоталамусе. В любом случае, при подавлении синтеза центрального нейрогормона ГГАС, отмечается парадоксальная активация ее гипофизарно-надпочечникового звена 15.
В качестве модели аутоиммунной патологии, демонстрирующей вовлечённость и взаимодействие трёх регулирующих систем в механизмах развития заболевания, может служить такое аутоиммунное заболевание как артрит, экспериментально вызываемый с помощью введения адьюванта культуры убитых нагреванием Micobacteium butyricum [15]. Как упоминалось ранее, при этой патологии отмечается парадоксальное подавление синтеза КРГ, сочетающееся с повышенной продукцией АКТГ и глюкокортикоидов. В этих условиях ответ на психоэмоциональный стресс заметно снижен.
Однако при изучении реакции этой оси на иммунный стресс (однократное в/б введение ЛПС в дозе 200 мкг животным с артритом) нами в сотрудничестве с Национальными Институтами Здоровья США (G. Aguilera), Университетом Бристоля, Англия (S. Lightman, M. Harbuz) и Свободным Университетом Амстердама, Голландия (F. Tilders) была обнаружена выраженная активация всех ее звеньев ГГАС [18]. Естественно, нас заинтересовали причины такой необычной реакции, в силу чего были исследован синтез и секреция наиболее значимых провоспалительных цитокинов - ИЛ-1 и ИЛ-6. Оказалось, что введение ЛПС на фоне артрита приводит к резкому нарастанию в крови уровней цитокинов в крови и их экспрессия в головном мозге и периферических органах [18].
Обобщенная схема нейроиммуноэндокринных взаимодействий в регуляции гипоталамогипофизарно-адреналовой системы при остром и хроническом воспалении представлена на рисунке (приводится по [19]). В то время как при остром воспалении происходит активация центральных звеньев ГГАС, то при хроническом выявляется подавление синтеза КРГ и нарастание синтеза ВП в мелкоклеточных нейронах гипоталамуса, что совпадает с активацией синтеза АКТГ и глюкокортикоидов. При сочетании острого и хронического воспаления обнаруживается цитокин-зависимая потенциация активности всех звеньев ГГАС. Подобная корреляция иммунной и нейроэндокринной систем была обозначена нами как феномен гиперчувствительности ГГАС к иммунному стрессу при хроническом (аутоиммунном) воспалении.
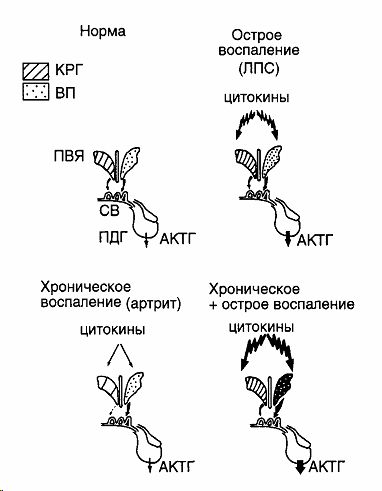
Рис 1. Гиперреактивность гипоталамо-гипофизарно-адренокортикальной системы при хроническом воспалении (артрит) в ответ на острое воспаление, вызванное новым антигеном (ЛПС). Стимуляция синтеза основных нейрогормонов стрессорной оси - кортикотропин-рилизинг гормона (КРГ) и вазопрессина (ВП) "мелкоклеточного происхождения", а также синтеза проопиомеланокортина в передней доле гипофиза и выделения в кровь АКТГ происходит за счет повышенной продукции цитокинов в головном мозге и периферических органах и их содержания в общем кровотоке. ПВЯ - паравентрикулярное ядро гипоталамуса, ПДГ - передняя доля гипофиза, СВ - срединное возвышение нейрогипофиза (по И.Г.Акмаеву и В.В.Гриневичу, 2001 [19]).
Читайте также:

