Недостатки теории бора кратко
Обновлено: 02.07.2024
Совпадение выводов теории Бора с опытными фактами для водорода не оставляло желать лучшего. Это был крупный шаг в теории атома. Он показал, что к атомам нельзя применять законы классической физики.
Однако, после первых успехов теории Бора пошли сплошные неудачи. Теория Бора не смогла объяснить характер спектров следующего за водородом атома гелия. Хотя он является самым простым после водорода атомом.
Самой слабой стороной теории Бора была её внутренняя логическая противоречивость: с одной стороны использовался классический закон Ньютона, с другой – квантовые постулаты, т.е. она не была ни последовательно классической, ни последовательно квантовой теорией.
В настоящее время, после открытия волновых свойств вещества, совершенно ясно, что теория Бора, опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
Люминесценция
Люминесценцией называется излучение света телами, избыточное над тепловым при той же температуре и имеющее длительность, значительно превышающую периоды излучений в оптическом диапазоне спектра. В отличие от равновесного теплового излучения, люминесцентное излучение не имеет равновесного характера.
При этом в зависимости от способов возбуждения различают несколько видов люминесценции: хемилюминесценция ‑ люминесценция, которая происходит за счет энергии химических реакций (например, свечение светлячков, фосфора, гнилых деревьев), электролюминесценция ‑ люминесценция, которая происходит за счет электрического поля, катодолюминесценция – происходит под действием электронов, рентгенолюминесценция – происходит под действием рентгеновского излучения, фотолюминесценция ‑ люминесценция, происходящая под действием света. При этом тело поглощает фотон какой-либо частоты, а затем испускает другой фотон, обычно большей длины волны. Люминесцирующие вещества называются люминофоры.
По длительности свечения условно различают два вида фотолюминесценции: флуоресценция, при которой свечение прекращается практически одновременно с прекращением освещения ( ), и фосфоресценция, при которой имеет место затухающее послесвечение в течение длительного промежутка времени.
При фотолюминесценции энергия поглощенного фотона расходуется частично на энергию излученного фотона и частично остается в веществе. Этот остаток обычно обозначают символом . Согласно закону сохранения энергии
Обычно , соответственно и .
Соотношение (25) называется правилом Стокса (установлено в 1852 г.): длина волны люминесцентного излучения всегда больше длины волны света, возбудившего его.
Однако, с повышением температуры вещества, может наблюдаться и обратное явление ‑ антистоксовое излучение, при котором и . Это означает, что при люминесценции часть люминесцирующего света проходя через толстые слои вещества, может поглощаться этим веществом.
Широкое и тщательное изучение люминесценции было предпринято С.И. Вавиловым и его сотрудниками.
Для характеристики явления люминесценции вводят понятие квантовый выход люминесценции ( ), т.е. отношение излучаемой энергии к энергии, поглощенной люминесцирующим веществом. Из экспериментальных данных следует, что величина вначале растет с увеличением длины волны возбуждающего света, далее, в некотором интервале длин волн остается постоянной, а затем резко падает.
Это общие закономерности люминесценции. Остановимся теперь несколько подробнее на флуоресценции и фосфоресценции.
При флуоресценции процесс поглощения и излучения света разыгрывается целиком внутри поглощающих молекул и поэтому мало зависит от внешних условий. Излучение возникает при переходе электрона из возбужденного состояния, вследствие поглощения фотона падающего света, в обычное, нормальное состояние. При этом длительность послесвечения определяется временем жизни атома или молекулы в возбужденном состоянии. При флуоресценции энергия поглощаемого фотона должна быть в точности равна разности энергетических уровней электрона.
Фотон поглощается, переводя молекулу в возбужденное состояние. Обратный переход осуществляется либо сразу, либо поэтапно.
Изучение спектров флуоресцирующих веществ позволяет разбираться в их свойствах и строении, как и изучение оптических спектров.
В фосфоресцирующих кристаллах – фосфорах ‑ энергия поглощаемого фотона достаточна, чтобы вовсе удалить электрон от оптических центров. Электрон может быть захвачен другим оптическим центром, перейти на низший энергетический уровень и излучить квант света ‑ фотон. Поскольку время жизни электрона в свободном состоянии велико, то и время послесвечения для фосфоров достаточно длительно. Необходимо заметить, что повышение температуры сильно сокращает это время.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это - неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени - порядка секунды. За это время атом должен полностью "коллапсировать" и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов - атом водорода.
Классическая физика хорошо описывает непрерывные процессы - движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально - в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния - это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон "соскакивает" с одной орбиты на другую, расположенную ближе к ядру.

Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае - для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ).

Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных "перечёркнутой" постоянной Планка:
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
Из правила квантования (2) выражаем :
и подставляем это в (4) :
Отсюда получаем формулу для допустимых радиусов орбит электрона:
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
Вместо подставим правую часть выражения (4) :
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода:
Основное состояние атома водорода - это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
То есть, диаметр атома оказывается равным как раз см - величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней .
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные - в ультрафиолетовом.

Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена.Длины волн этой серии описываются формулой (9) при :
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три "именованных" серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
-Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование - дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
-Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
-В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
-Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы - второй закон Ньютона и закон Кулона - используются для записи уравнения движения электрона по круговой орбите.
-Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
-Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже - в 1920-х годах.
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн.
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.

Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
Недостатки теории Бора: не смогла объяснить интенсивность спектральных линий; справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других); теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движенияэлектрона — классическое, другое — уравнение квантования орбит — квантовое; теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближённые соотношения: их точность часто бывает очень высокой.
Долгое время строение атома было дискуссионной темой среди физиков, пока не появилась созданная датским ученым Нильсом Бором модель. Он не был первым, кто попытался описать движение субатомных частиц, но именно его наработки позволили создать непротиворечивую теорию с возможностью прогнозирования местонахождения элементарный частицы в тот или иной момент времени.
Жизненный путь
Нильс Бор родился 7 октября 1885 года в Копенгагене и умер там же 18 ноября 1962 года. Он считается одним из величайших физиков и неудивительно: именно ему удалось построить непротиворечивую модель водородоподобных атомов. По легенде он увидел во сне, как вокруг некоего светящегося разреженного центра вращалось что-то вроде планет. Затем эта система резко уменьшилась до микроскопических размеров.
Вам будет интересно: Пожарно-строевая подготовка: нормативы, выполнение и методические рекомендации
С тех пор Бор упорно искал способ воплотить сон в формулах и таблицах. Тщательно изучая современную литературу по физике, экспериментируя в лаборатории и размышляя, он смог достичь своей цели. Обнародовать результаты ему не помешала даже врожденная застенчивость: он стеснялся выступать перед большой аудиторией, начинал путаться, и слушатели ничего не понимали из объяснений ученого.
Предшественники
Вам будет интересно: Современные регионы Германии - земли, вольные города и свободные государства
До Бора ученые пытались создать модель атома, основанную на постулатах классической физики. Наиболее успешная попытка принадлежала Эрнесту Резерфорду. В результате многочисленных опытов он пришел к выводу о существовании массивного атомного ядра, вокруг которого двигаются по орбитам электроны. Поскольку графически такая модель была похожа на строение Солнечной системы, за ней укрепилось название планетарной.

Но в ней имелся существенный недостаток: атом, отвечающий резерфордовским уравнениям, оказывался нестабильным. Рано или поздно электроны, двигавшиеся с ускорением по орбитам вокруг ядра, должны были упасть на ядро, а их энергия тратилась бы на электромагнитное излучение. Для Бора модель Резерфорда стала отправным пунктом в построении собственной теории.
Первый постулат Бора
Главным новшеством Бора стал отказ от использования классической ньютоновской физики в построении теории атома. Изучив полученные в лаборатории данные, он пришел к выводу, что в мире элементарных частиц не работает такой важный закон электродинамики, как равноускоренное движение без волнового излучения.

Итогом его размышлений стал закон, который звучит так: атомная система стабильна, только если она находится в одном из возможных стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. Смысл этого закона, иначе называемого постулатом квантовых состояний, состоит в признании отсутствия электромагнитного излучения, когда атом находится в таком состоянии. Также следствием первого постулата является признание наличия в атоме энергетических уровней.
Правило частот
Однако было очевидно, что атом не может все время находиться в одном и том же квантовом состоянии, поскольку стабильность отрицает любое взаимодействие, а значит, не было бы ни Вселенной, ни движения в ней. Кажущееся противоречие разрешил второй постулат модели строения атома Бора, известный как правило частот. Атом способен перейти из одного квантового состояния в другое с соответствующим изменением энергии, излучая или поглощая при этом квант, энергия которого равна разности энергий стационарных состояний.
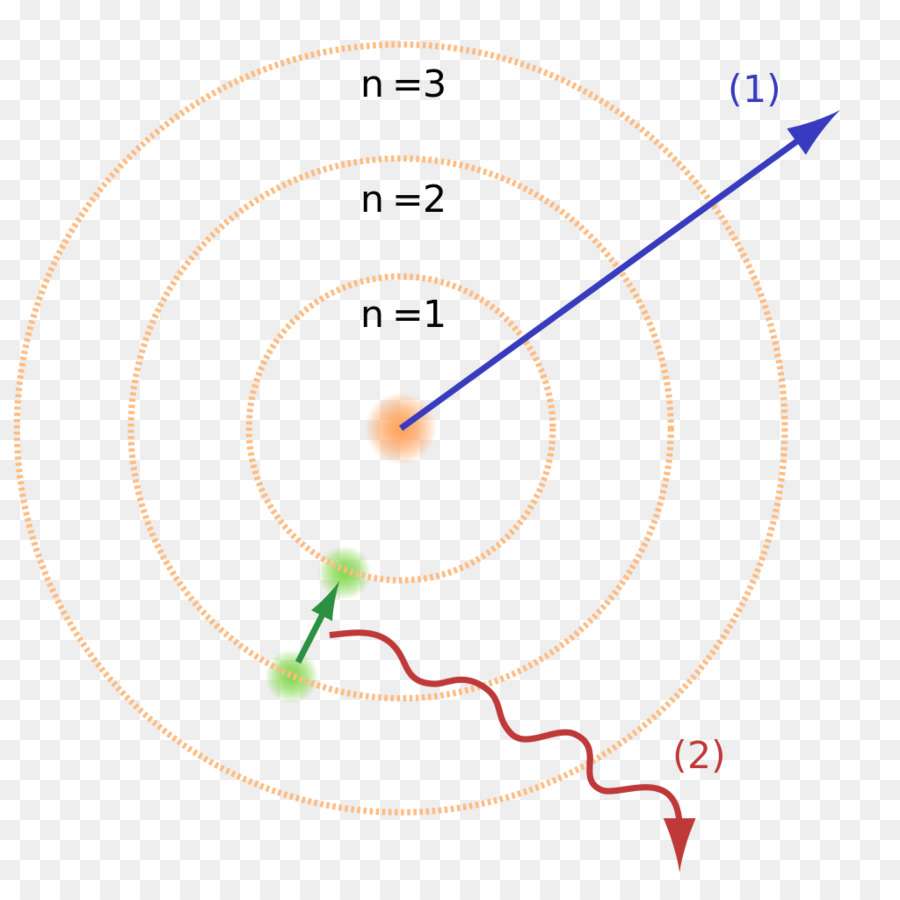
Второй постулат тоже противоречит классической электродинамике. Согласно теории Максвелла, характер движения электрона не может воздействовать на частоту его излучения.
Спектр атома
Квантовая модель Бора стала возможной благодаря тщательному изучению спектра атома. Долгое время ученых смущало, что вместо ожидаемой непрерывной цветовой области, получаемой при изучении спектров небесных светил, спектрограмма атома была прерывистой. Линии яркого цвета не переходили друг в друга, а разделялись внушительными темными участками.

Теория перехода электрона из одного квантового состояния в другое объясняла эту странность. Когда электрон переходил с одного энергетического уровня на другой, где от него требовалась меньшая энергия, он испускал квант, что отражалось на спектрограмме. Теория Бора сразу же продемонстрировала способность к прогнозированию дальнейших изменений в спектрах простых атомов вроде водорода.
Недостатки
Теория Бора не до конца порывала с классической физикой. Она по-прежнему сохраняла идею орбитального движения электронов в электромагнитном поле ядра. Идея о квантовании при переходе из одного стационарного состояния в другое удачно дополняла планетарную модель, но все же не разрешала всех противоречий.
Хотя в свете модели Бора электрон не мог перейти в движение по спирали и упасть на ядро, непрерывно излучая энергию, оставалось непонятным, почему он не мог последовательно подниматься на более высокие энергетические уровни. В этом случае все электроны рано или поздно оказались бы в наинизшем энергетическом состоянии, что привело бы разрушению атома. Другой проблемой стали аномалии в атомных спектрах, которые теория не объясняла. Еще в 1896 году Питер Зееман провел любопытный эксперимент. Он поместил атомный газ в магнитное поле и снял спектрограмму. Оказалось, что некоторые спектральные линии расщепились на несколько. Такой эффект в теории Бора объяснения не получал.
Построение модели атома водорода по Бору
Несмотря на все недостатки своей теории, Нильс Бор смог построить соответствующую действительности модель атома водорода. При этом он использовал правило частот и законы классической механики. Расчеты Бора по определению возможных радиусов орбит электрона и вычислению энергии квантовых состояний оказались достаточно точными и подтвердились экспериментально. Частоты излучений и поглощений электромагнитных волн соответствовали расположению темных промежутков на спектрограммах.

Таким образом, на примере атома водорода было доказано, что каждый атом представляет собой квантовую систему с дискретными энергетическими уровнями. Кроме того, ученый смог найти способ совместить классическую физику и свои постулаты с помощью принципа соответствия. Он гласит, что квантовая механика включает в себя законы ньютоновской физики. При определенных условиях (например, если квантовое число было достаточно большим), квантовая и классическая механика сближаются. Это доказывалось тем, что при увеличении квантового числа протяженность темных промежутков на спектре уменьшалась вплоть до полного исчезновения, как это и ожидалось в свете ньютоновских представлений.
Значение
Введение принципа соответствия стало важным промежуточным этапом на пути к признанию существования особой квантовой механики. Модель атома Бора стала для многих отправной точкой в конструировании более точных теорий движения субатомных частиц. Нильс Бор не смог подобрать точной физической интерпретации правилу квантования, но он и не мог этого сделать, поскольку лишь с течением времени были обнаружены волновые свойства элементарных частиц. Луи де Бройль, дополнив теорию Бора новыми открытиями, доказал, что каждая орбита, по которой движется электрон, представляет собой волну, распространяющуюся от ядра. С этой точки зрения стационарным состоянием атома стали считать такое, что образуется в случае, когда волна, сделав полный оборот вокруг ядра, повторялась.
Читайте также:

