Недостатки модели резерфорда кратко
Обновлено: 16.05.2024
Недостатки атома Резерфорда. Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента. К явлениям атомных масштабов законы классической физики неприменимы.
Создание Резерфордом планетарной, или ядерной, модели атома было крупным шагом вперед в познании строения атома. Но в некоторых случаях эта теория вступала в противоречие с твердо установленными фактами.
Так планетарная модель не могла объяснить устойчивости атома. Вращаясь вокруг ядра, электрон должен часть своей энергии испускать в виде электромагнитных колебаний, что должно привести к нарушению равновесия между электростатическим притяжением электрона к ядру и центробежной силой, обусловленной вращением электрона вокруг ядра.
Для восстановления равновесия электрон должен переместиться ближе к ядру. Следовательно, непрерывно излучая электромагнитную энергию, электрон должен постепенно приближаться к ядру и в конце концов упасть на него - существование атома должно прекратиться. В действительности атом очень устойчив и может существовать бесконечно долго.Модель Резерфорда не могла объяснить также характер атомного спектра. Известно, что солнечный свет, проходя через стеклянную призму, образует спектр - цветную полосу, содержащую все цвета радуги.Это явление объясняется тем, что солнечный свет состоит из электромагнитных волн различных частот. Волны различных частот неодинаково преломляются призмой, что приводит к образованию сплошного спектра.Аналогично ведет себя свет, излучаемый раскаленными жидкостями и твердыми телами. Спектр раскаленных газов и паров представляет собой отдельные цветные линии, разделенные темными промежутками, - линейчатый спектр. При этом атомы одного элемента дают вполне определенный спектр, отличающийся от спектра другого элемента.Линейчатый характер спектра водорода не согласуется с теорией Резерфорда, так как излучающий энергию электрон должен приближаться к ядру непрерывно, и его спектр должен быть непрерывным, сплошным.Следовательно, планетарная модель атома не могла объяснить ни устойчивости атомов, ни линейчатый характер спектра газов и паров.
Постулаты Бора
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам для которых момент импульса квантуется: , где n — натуральные числа, а — постоянная Планка. Пребывание электрона на орбите определяет энергию этих стационарных состояний.
При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии hν = En − Em, где En;Em — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома
22 Теория Бора для водородоподобных сил
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модельатома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка [1] : .
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rn и энергии En находящегося на этой орбите электрона:
Здесь me — масса электрона, Z — количество протонов в ядре, ε0 — диэлектрическая постоянная, e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.Радиус первой орбиты в атоме водорода R0=5,2917720859(36)×10 −11 м [2] , ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты E0 = − 13.6 эВ представляет собой энергию ионизации атома водорода.
23 Гипотеза де Бройля. Дифракция электронов.
В 1924г Луи де-Бройль высказал гипотезу, согласно которой дуализм (двойственность) св-в присущи не только оптическим явлениям, но и к материи вообще. В частности с потоком электронов связан волновой процесс, который влияет на поведение электрона как частицу, заряд и масса которой локализованы в малом объеме пространства так, что ведет себя как точечный заряд. Д-Бройль показал, как можно определить длинну электронной волны по аналогии с длинной волны фотона.
Pф=m(индекс ф)c=hνc/c (c.2)=hν/c=h/λ; λ(инд.c)=h/P(индекс е)=
=h/m(инд. с) v(инд.с) (1). Длина волны, определяемая (1) называется дебройлевой длиной волны. Д-Бройль попробовал объяснить 1-й постулат Бора – постулат квантования. Согласно д-Бройлю, стационарными являются такие орбиты электрона, у которых вдоль периметра укладывается целое число волн д-Бройля. Т.е. вдоль орбиты устанавливается стоячая волна. 2πr = nλ(индекс с), 2π r = nh/mv;
Джемер и Дэвисон впервые обнаружили дифракцию электронов при рассеянии их на монохроматические никеля. Электроны, ускоренные разностью потенциалов U, вылетали из эл. пушки в виде узкого пучка, и фокусировались на клисталлической пластинке. Рассеяные электроны улавливались ловушкой цилиндра Фарадея, соединенного с чувствительным гальванометром.
Электроны отдавали свой заряд ловушке и устанавливалась зависимость J от √U. Сила тока J является мерой отраженных от пластины электронов, а √U – мера их скорости.
mv 2 /2=eU; √U~v. Т.о. от кристалла отражаются лишь электроны определенных скоростей. Кристалл представляет собо пространственную дифракционную решетку, в которой источники вторичных волн, т.е. частицы в узлах кристаллической решетки, находятся на строго определенных расстояниях вдоль координатных осей. При прохождении через кристалл электро-магнитного излучения, частицы в узлах кристаллической решетки испускают вторичные волны, которые, налагаясь, образуют максимум и минимум дифракции. То, что от кристалла отражались лишь электроны определенных скоростей означало, что на кристалл падает излучение, представляющее собой волновой процесс, в его избирательное отражение есть результат дифракции.
24. Соотношение неопределенностей Гейзенберга.
Во всех макроскопических системах электрон ведет себя как частица, локализованная в малом объеме, обладающая определенной координатой и скоростью. При движении электрона в атоме проявляются его волновые свойства в большей степени, как и во всех микроскопических частицах, но волна не локализована в пространстве, а безгранична.
Пусть электроны движутся в направлении ОА со скоростью Vx и встречают узкую щель ВС с шириной а. DE – экран, на который будут попадать электроны. Т.к. электроны обладают волновыми свойствами, то при прохождении через узкую щель они дифрагируют, в результате чего электроны будут попадать не только в точки экрана DE, расположенные непосредственно за щелью, но распределяется по всему экрану. Представим, что электрон – классическая частица. Она характеризуется координатой и количеством движения. Можно охарактеризовать координату электрона в момент прохождения щели как координату щели. В таком определении координаты, однако, есть неточность, обусловленная шириной щели. Обозначим эту неопределенность через ∆x=a. После прохождения щели составляющая импульса Px≠0, т.к. вследствии дифракции изменяется скоростью. Составляющая импульса электрона не может быть определено точно, а лишь с некоторой погрешностью ∆Px≥Psinφ1=Pλ/a=hλ/λa=h/a; ∆Px*∆x≥h (1) – соотношение неопределенностей Гейзенберга.
25.Квантовое состояние. Уравнения Шредингера
В квантовой физике вводится комплекснозначная функция , описывающая чистое состояние объекта, которая называется волновой функцией. В наиболее распространенной копенгагенской интерпретации эта функция связана с вероятностью обнаружения объекта в одном из чистых состояний (квадрат модуля волновой функции представляет собой плотность вероятности). Поведение гамильтоновой системы в чистом состоянии полностью описывается с помощью волновой функции.
Отказавшись от описания движения частицы с помощью траекторий, получаемых из законов динамики, и определив вместо этого волновую функцию, необходимо ввести в рассмотрение уравнение, эквивалентное законам Ньютона и дающее рецепт для нахождения в частных физических задачах. Таким уравнением является уравнение Шрёдингера.
Пусть волновая функция задана в N-мерном пространстве, тогда в каждой точке с координатами , в определенный момент времени t она будет иметь вид . В таком случае уравнение Шрёдингера запишется в виде:
где , — постоянная Планка; — масса частицы, — внешняя по отношению к частице потенциальная энергия в точке , — оператор Лапласа (или лапласиан), эквивалентен квадрату оператора набла и в n-мерной системе координат имеет вид:
В трёхмерном случае пси-функция является функцией трёх координат и в декартовой системе координат заменяется выражением
тогда уравнение Шрёдингера примет вид:
где , — постоянная Планка; — масса частицы, — потенциальная энергия в точке
Форма уравнения Шрёдингера показывает, что относительно времени его решение должно быть простым, поскольку время входит в это уравнение лишь через первую производную в правой части. Действительно, частное решение для специального случая, когда не является функцией времени, можно записать в виде:
где функция должна удовлетворять уравнению:
которое получается из уравнения Шрёдингера (1) при подстановке в него указанной выше формулы для (2). Заметим, что это уравнение вообще не содержит времени; в связи с этим оно называется стационарным уравнением Шрёдингера (уравнение Шрёдингера, не содержащее времени).
Выражение (2) является лишь частным решением зависящего от времени уравнения Шрёдингера (1), общее решение представляет собой линейную комбинацию всех частных решений вида (2). Зависимость функции от времени проста, но зависимость её от координаты не всегда имеет элементарный вид, так как уравнение (3) при одном выборе вида потенциальной функции совершенно отличается от того же уравнения при другом выборе этой функции. В действительности, уравнение (3) может быть решено аналитически лишь для небольшого числа частных типов функции .
Важное значение имеет интерпретация величины в уравнении (2). Она производится следующим путём: временна́я зависимость функции в уравнении (2) имеет экспоненциальный характер, причём коэффициент при в показателе экспоненты выбран так, что правая часть уравнения (3) содержит просто постоянный множитель . В левой же части уравнения (3) функция умножаетсяна потенциальную энергию . Следовательно, из соображений размерности вытекает, что величина должна иметь размерность энергии. Единственной величиной с размерностью энергии, которая постоянна в механике, является полная (сохраняющаяся) энергия системы; таким образом, можно предполагать, что представляет собой полную энергию. Согласно физической интерпретации уравнения Шрёдингера, действительно является полной энергией частицы при движении, описываемом функцией .
26 Волновая функция и её статические свойства. Суперпозиция состояний
Волнова́я фу́нкция, или пси-функция — комплекснозначная функция, используемая вквантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
где — координатный базисный вектор, а — волновая функция в координатном представлении.
Для волновых функций справедлив принцип суперпозиции, заключающийся в том, что если система может пребывать в состояниях, описываемых волновыми функциями и , то она может пребывать и в состоянии, описываемом волновой функцией
при любых комплексных и .
Очевидно, что можно говорить и о суперпозиции (сложении) любого числа квантовых состояний, то есть о существовании квантового состояния системы, которое описывается волновой функцией .
В таком состоянии квадрат модуля коэффициента определяет вероятность того, что при измерении система будет обнаружена в состоянии, описываемом волновой функцией .
Поэтому для нормированных волновых функций .
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значенияволновой функции этого состояния в координатном представлении.
Нормированность волновой функции
Волновая функция по своему смыслу должна удовлетворять так называемому условию нормировки, например, в координатном представлении имеющее вид:
Это условие выражает тот факт, что вероятность обнаружить частицу с данной волновой функцией где-либо во всём пространстве равна единице. В общем случае интегрирование должно производиться по всем переменным, от которых зависит волновая функция в данном представлении.
В Резерфорд эксперимент, проводившаяся между 1908 и 1913 годами, заключалась в бомбардировке тонкой золотой фольги толщиной 0,0004 мм альфа-частицами и анализе картины дисперсии, которую эти частицы оставляли на флуоресцентном экране.
Фактически, Резерфорд провел множество экспериментов, все больше и больше уточняя детали. После тщательного анализа результатов были сделаны два очень важных вывода:
-Положительный заряд атома сосредоточен в области, называемой ядро.
-Это атомное ядро невероятно мало по сравнению с размером атома.
Эрнест Резерфорд (1871-1937), физик из Новой Зеландии, интересовался радиоактивностью и природой материи. Радиоактивность была недавним явлением, когда Резерфорд начал свои эксперименты, она была открыта Анри Беккерелем в 1896 году.
В 1907 году Резерфорд отправился в Манчестерский университет в Англии, чтобы изучить структуру атома, используя эти альфа-частицы в качестве зондов, чтобы заглянуть внутрь такой крошечной структуры. Его сопровождали физики Ханс Гейгер и Эрнест Марсден.
Они надеялись увидеть, как альфа-частица, которая представляет собой дважды ионизированный атом гелия, будет взаимодействовать с одним атомом золота, чтобы убедиться, что любое отклонение, которое она испытывает, вызвано исключительно электрической силой.
Однако большая часть альфа-частиц прошла через золотую фольгу с небольшим отклонением.
Этот факт полностью согласуется с атомной моделью Томсона, однако, к удивлению исследователей, небольшой процент альфа-частиц испытывает довольно заметное отклонение.
И еще меньший процент частиц вернется, полностью отскочив назад. Чем были вызваны эти неожиданные результаты?
Описание и выводы эксперимента
Фактически, альфа-частицы, которые Резерфорд использовал в качестве зонда, являются ядрами гелия, и в то время было известно только, что эти частицы заряжены положительно. Сегодня известно, что альфа-частицы состоят из двух протонов и двух нейтронов.
Альфа-частицы и бета-частицы были идентифицированы Резерфордом как два разных вида излучения урана. Альфа-частицы, намного более массивные, чем электрон, имеют положительный электрический заряд, а бета-частицы могут быть электронами или позитронами.
Упрощенная схема эксперимента представлена на рисунке 2. Луч альфа-частиц исходит от радиоактивного источника. Гейгер и Марсден использовали радон в качестве источника излучения.
Свинцовые блоки использовались для направления излучения на золотую фольгу и предотвращения его попадания непосредственно на флуоресцентный экран. Свинец - это материал, поглощающий радиацию.
Направленный таким образом луч падал на тонкую золотую фольгу, и большинство частиц продолжали свой путь к флуоресцентному экрану из сульфата цинка, где оставляли небольшой световой след. Гейгер отвечал за их подсчет по одному, хотя позже они разработали устройство, которое это делало.
Тот факт, что некоторые частицы претерпели небольшое отклонение, не удивил Резерфорда, Гейгера и Марсдена. В конце концов, на атоме есть положительные и отрицательные заряды, которые воздействуют на альфа-частицы, но поскольку атом нейтрален, что они уже знали, отклонения должны были быть небольшими.
Неожиданность эксперимента заключается в том, что несколько положительных частиц отскочили почти прямо назад.
Выводы
Примерно 1 из 8000 альфа-частиц отклоняется на углы более 90 °. Немного, но достаточно, чтобы поставить под вопрос некоторые вещи.
Модной моделью атома была модель пудинга с изюмом от Томсона, бывшего профессора Резерфорда в Кавендишской лаборатории, но Резерфорд задался вопросом, верна ли идея об атоме без ядра и с электронами, встроенными как изюм.
Потому что оказывается, что эти большие отклонения альфа-частиц и тот факт, что некоторые из них могут вернуться, могут быть объяснены только в том случае, если у атома есть маленькое тяжелое положительное ядро. Резерфорд предположил, что только электрические силы притяжения и отталкивания, как указано в законе Кулона, несут ответственность за любое отклонение.
Когда некоторые из альфа-частиц приближаются непосредственно к этому ядру и поскольку электрическая сила изменяется в зависимости от обратного квадрата расстояния, они чувствуют отталкивание, которое вызывает их рассеяние на большой угол или отклонение назад.
Безусловно, Гейгер и Марсден экспериментировали с бомбардировкой листов из разных металлов, а не только из золота, хотя этот металл был наиболее подходящим из-за его пластичности, чтобы создать очень тонкие листы.
Получив аналогичные результаты, Резерфорд был убежден, что положительный заряд в атоме должен располагаться в ядре, а не рассредоточиваться по его объему, как постулировал Томсон в своей модели.
С другой стороны, поскольку подавляющее большинство альфа-частиц проходило без отклонений, ядро должно было быть очень и очень маленьким по сравнению с размером атома. Однако в этом ядре должна была сосредоточиться большая часть массы атома.
Влияния на модель атома
Результаты очень удивили Резерфорда, который заявил на конференции в Кембридже: «… Это как когда вы стреляете 15-дюймовым пушечным ядром по листу папиросной бумаги, и снаряд отскакивает прямо на вас и попадает в вас.”.
Поскольку эти результаты не могли быть объяснены атомной моделью Томсона, Резерфорд предположил, что атом состоит из ядра, очень маленького, очень массивного и положительно заряженного. Электроны оставались на орбитах вокруг него, как миниатюрная солнечная система.
Это и есть ядерная модель атома, показанная на рисунке 3 слева. Поскольку электроны тоже очень и очень маленькие, оказывается, что атом - это почти все…. пусто! Таким образом, большинство альфа-частиц проходят сквозь лист практически без отклонений.
И аналогия с миниатюрной солнечной системой очень точна. Ядро атома играет роль Солнца, содержащего почти всю массу плюс положительный заряд. Электроны вращаются вокруг них, как планеты, и несут отрицательный заряд. Сборка электрически нейтральна.
Что касается распределения электронов в атоме, эксперимент Резерфорда ничего не показал. Вы могли подумать, что альфа-частицы будут взаимодействовать с ними, но масса электронов слишком мала, и они не могут значительно отклонять частицы.
Недостатки модели Резерфорда
Одной из проблем этой атомной модели было именно поведение электронов.
Если бы они не были статичными, а вращались бы вокруг ядра атома по круговой или эллиптической орбите, движимые электрическим притяжением, они в конечном итоге устремились бы к ядру.
Это происходит потому, что ускоренные электроны теряют энергию, и если это произойдет, произойдет коллапс атома и вещества.
К счастью, этого не происходит. Это своего рода динамическая устойчивость, предотвращающая коллапс. Следующей после модели Резерфорда атомной моделью была модель Бора, которая дала некоторые ответы на вопрос, почему не происходит атомного коллапса.
Протон и нейтрон
Резерфорд продолжал проводить эксперименты по рассеянию. Между 1917 и 1918 годами он и его помощник Уильям Кей предпочли бомбардировать газообразные атомы азота высокоэнергетическими альфа-частицами висмута-214.
Он снова был удивлен, когда обнаружил ядра водорода. Это уравнение реакции, первой в истории искусственной трансмутации ядер:
Ответ был: из того же азота. Резерфорд присвоил водороду атомный номер 1, потому что это самый простой элемент из всех: положительное ядро и отрицательный электрон.
Резерфорд нашел фундаментальную частицу, которую он назвал протон, название, производное от греческого слова для Первый. Таким образом, протон является важной составной частью каждого атомного ядра.
Позже, примерно в 1920 году, Резерфорд предположил, что должна существовать нейтральная частица с массой, очень похожей на массу протона. Он назвал эту частицу нейтрон и входит в состав почти всех известных атомов. Физик Джеймс Чедвик наконец идентифицировал его в 1932 году.
Как выглядит масштабная модель атома водорода?
Атом водорода, как мы уже сказали, самый простой из всех. Однако разработать модель этого атома было непросто.
Последовательные открытия породили квантовую физику и целую теорию, описывающую явления в атомном масштабе. В ходе этого процесса эволюционировала и атомная модель. Но давайте посмотрим на вопрос о размерах:
У атома водорода есть ядро, состоящее из одного протона (положительное) и одного электрона (отрицательное).
Радиус атома водорода оценивается как 2,1 x 10 -10 м, а протона 0,85 · 10 -15 м или 0,85 фемтометры. Название этого небольшого подразделения принадлежит Энрико Ферми, и оно часто используется при работе в таком масштабе.
Ну, отношение радиуса атома к радиусу ядра составляет порядка 10 5 м, то есть атом в 100000 раз больше ядра!
Однако следует учитывать, что в современной модели, основанной на квантовой механике, электрон окружает ядро в виде облака, называемого орбитальный (орбиталь - это не орбита), и электрон в атомном масштабе не пунктуален.
Если бы атом водорода увеличили - воображаемо - до размеров футбольного поля, то ядро, состоящее из положительного протона, было бы размером с муравья в центре поля, а отрицательный электрон был бы подобен призраку, разбросаны по полю и окружают положительное ядро.
Атомная модель сегодня
Современные атомные модели основаны на квантовой механике. Она указывает, что электрон в атоме не является отрицательно заряженной точкой, которая следует по точным орбитам, как предполагал Резерфорд.
Скорее электрон разбросанный в зонах вокруг положительного ядра, называемых атомные орбитали. От него мы можем узнать вероятность находиться в том или ином состоянии.
Несмотря на это, модель Резерфорда представляет собой огромный прогресс в познании внутренней структуры атома. И это открыло дорогу большему количеству исследователей, которые продолжили его совершенствовать.
Еще во времена Древней Греции философы догадывались о внутреннем строении вещества. А первые модели строения атомов появились уже в начале XX века. Гипотеза Дж. Томсона не была воспринята научным сообществом того времени критично – ведь до нее уже были выдвинуты различные теории о том, что же находится внутри мельчайших частиц материи.


Заслуги Дж. Томсона
Данная модель была разработана еще более детально Дж. Дж. Томсоном. В отличие от У. Томсона, он предполагал, что электроны в атоме располагаются строго на одной плоскости, представляющие собой концентрические кольца. Несмотря на одинаковую важность моделей атома Томсона и Резерфорда для науки того времени, стоит отметить, что Дж. Томсоном, помимо всего прочего, впервые был предложен способ определения количества электронов внутри атома. Его метод был основан на рассеивании рентгеновских лучей. Дж. Томсон предположил, что именно электроны являются теми частицами, которые должны быть в центре рассеивания лучей. Кроме того, именно Томсон был тем ученым, который открыл электроны. В современных школах именно с изучения его открытий начинается изучение курса квантовой механики.
Минусы теории Томсона
Однако по сравнению с моделью Резерфорда, модель атома Томсона имела один существенный недостаток. Она не могла объяснить дискретный характер излучения атома. Нельзя было с ее помощью и сказать что-либо о причинах устойчивости атома. Окончательно она была опровергнута, когда были произведены знаменитые опыты Резерфорда. Модель атома Томсона при этом имела не меньшую ценность для науки того времени, нежели другие гипотезы. Необходимо учитывать, что все эти модели, имевшиеся на тот момент, являлись сугубо гипотетическими.
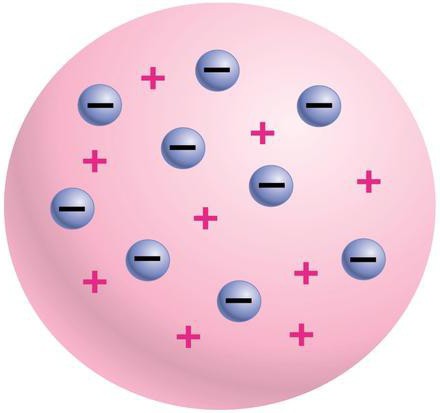
Особенности опыта Резерфорда
В 1906-1909 годах Г. Гейгером, Э. Мардсеном и Э. Резерфордом были проведены опыты, в ходе которых альфа-частицы подвергались рассеиванию на поверхности золотой фольги. Кратко модели атома Томсона и Резерфорда описываются следующим образом. В модели Томсона электроны распределены в атоме неравномерно, а в теории Резерфорда – вращаются в концентрических плоскостях. Отличительным фактором в опыте Резерфорда было использование именно альфа-частиц вместо электронов. Альфа-частицы, в отличие от электронов, обладали гораздо большей массой, и не претерпевали значительных отклонений, когда сталкивались с электронами. Поэтому у ученых была возможность регистрировать только те столкновения, которые происходили с положительно заряженной частью атома.

Роль открытия Резерфорда
Этот опыт имел решающее значение для науки. С его помощью ученые смогли получить ответы на те вопросы, которые оставались загадкой для авторов различных моделей атома. Томсон, Резерфорд и Бор, хотя и обладали одинаковой базой, все же внесли несколько различный вклад в науку – и результаты опытов Резерфорда в данном случае были поразительными. Их результаты оказались прямо противоположными тому, что ожидали увидеть ученые.
Большая часть альфа-частиц проходило через лист фольги по прямым (или практически прямым) траекториям. Однако траектории некоторых альфа-частиц отклонялись на значительные углы. А это было свидетельством того, что в атоме находилось образование с очень большой плотностью, и имевшее положительный заряд. В 1911 году на основе экспериментальных данных была выдвинута модель строения атома Резерфорда. Томсон, теория которого до этого считалась господствующей, в это время продолжал работать в лаборатории Кавендишского университета. До конца своей жизни ученый продолжал верить в существование механического эфира, несмотря на все успехи в научных исследованиях того времени.

Планетарная модель Резерфорда
Электроны вращаются в атоме с такой гигантской скоростью, что образуют вокруг поверхности атома нечто вроде облака. Согласно теории Резерфорда, атомы располагаются друг от друга на некотором расстоянии, что позволяет им не слипаться друг с другом. Ведь вокруг каждого из них существует отрицательно заряженная электронная оболочка.
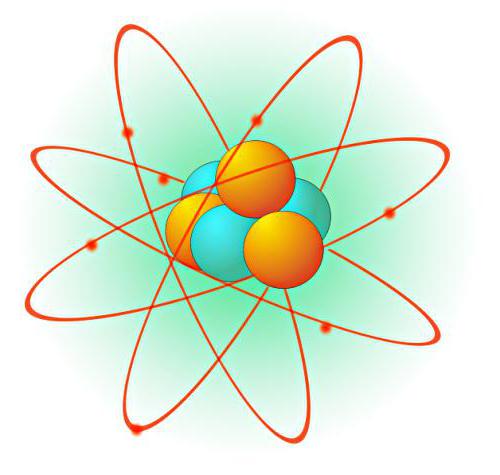
Модели атома Томсона и Резерфорда: основные отличия
Каковы же основные различия между двумя важнейшими теориями строения атома? Резерфорд предполагал, что в центре атома находится ядро, обладающее положительным электрическим зарядом, и объем которого, в сравнении с размерами атома, ничтожно мал. Томсон же предполагал, что весь атом представляет собой образование с большой плотностью. Вторым главным отличием было понимание положения электронов в атоме. Согласно Резерфорду, они вращаются вокруг ядра, и их число примерно равно ½ атомной массы химического элемента. В теории Томсона же электроны внутри атома распределены неравномерно.
Минусы теории Резерфорда
Однако, несмотря на все достоинства, на тот момент теория Резерфорда содержала в себе одно важное противоречие. По законам классической электродинамики, электрон, вращавшийся вокруг ядра, должен был постоянно испускать порции электрической энергии. Из-за этого радиус орбиты, по которой двигается электрон, должен был непрерывно испускать электромагнитное излучение. Согласно этим представлениям, время жизни атома должно быть ничтожно малым.

Модель Бора
Однако, помимо моделей атома Томсона и Резерфорда, существовала еще одна теория, объяснявшее внутреннее строение этих мельчайших частиц материи. Она принадлежит Нильсу Бору – датскому физику, предложившему свое объяснение в 1913 году. Согласно его модели, электрон в атоме не подчиняется стандартным физическим законам. Именно Бор был тем ученым, который ввел в науку понятие о соотношении между радиусом орбиты электрона и его скоростью.
В процессе создания своей теории Бор взял за основу модель Резерфорда, однако подверг ее значительной доработке. Модели атомов Бора, Резерфорда и Томсона сейчас могут показаться несколько простыми, однако именно они легли в основу современных представлений о внутреннем строении атома. Сегодня общепринятой является квантовая модель атома. Несмотря на то что квантовая механика не может описывать движение планет Солнечной системы, понятие орбиты до сих пор осталось в теориях, описывающих внутренне строение атома.
Читайте также:

